Valkude seedimine seedetraktis. Valkude seedimine seedetraktis
SISSEJUHATUS
Valkude metabolismil on teiste ainevahetuse tüüpide seas eriline koht. See on tingitud valkude spetsiifilistest funktsioonidest (plastilised, katalüütilised, immuunsed), mida ei suuda täita ei süsivesikud ega lipiidid.
Inimkehas laguneb iga päev umbes 400 g valke aminohapeteks (AMA) ja sama palju sünteesitakse. Toiduvalgud on inimeste jaoks peamine AUA allikas. Päevamäär valgu tarbimine on umbes 100 g Kõik 20 AMK-d, mis on osa keha valkudest, võib jagada ebaolulisteks (organism ise sünteesib) ja asendamatuteks (ei sünteesita ja tuleb varustada toiduga). Kõikide asendamatute aminohapete olemasolu toiduvalkudes määrab kasulikkuse valgu toitumine isik.
Kuna kõigi organismide valgud erinevad range liigi- ja koespetsiifilisuse poolest, kasutab inimkeha toiduvalke alles pärast nende täielikku hüdrolüüsi AMA-ks. seedetrakti mitmete proteolüütiliste ensüümide – peptidaaside – toimel. Kõik peptidaasid jagunevad olenevalt hüdrolüüsitava peptiidsideme asukohast (1) endopeptidaasid, hüdrolüüsimine peptiidsidemed, otstest eemal peptiidahelat(pepsiin, trüpsiin, kümotrüpsiin, elastaas) ja (2) eksopeptidaasid, moodustuvad hüdrolüüsivad peptiidsidemed N- ja C-terminaalsed aminohapped (aminopeptidaas, karboksüpeptidaas, dipeptidaas).
Mao- ja pankrease peptidaasid toodetakse inaktiivsel kujul, sekreteeritakse toimekohas, kus need aktiveeritakse osalise proteolüüsi teel. Selline aktiivsete ensüümide moodustumise mehhanism on vajalik mao ja kõhunäärme sekretoorsete rakkude kaitsmiseks iseseedimise eest.
Valkude seedimine maos toimub pepsiini toimel. Proensüümi pepsinogeeni toodavad maonäärmete peamised rakud ja see eritub toidu sissevõtmisel maoõõnde. Pepsinogeen aktiveeritakse kahel viisil:
1) vesinikkloriidhape (aeglaselt);
2) autokatalüütiliselt (kiiresti) olemasoleva pepsiiniga.
Maomahl sisaldab vesinikkloriidhapet, mida toodavad mao parietaalrakud ja mis täidab järgmisi funktsioone:
1) on bakteritsiidse toimega;
2) denatureerib toiduvalke;
3) loob pepsiini jaoks optimaalse pH;
4) aktiveerib pepsinogeeni osalise proteolüüsi teel. Valkude seedimine soolestikus toimub järgmistel juhtudel:
1) pankrease ensüümid (trüpsiin, kümotrüpsiin, elastaas, karboksüpeptidaasid);
2) peensoole ensüümid (aminopeptidaasid, dipeptidaasid, tripeptidaasid).
Trüpsiini aktiivne vorm moodustub soolestikus enteropeptidaasi osalusel, mis lõikab trüpsinogeeni N-otsast heksapeptiidi, mis viib molekuli konformatsiooni muutumiseni ja trüpsiini aktiivse tsentri moodustumiseni. Teisi pankrease mahla proteaase (kümotrüpsinogeen, prokarboksüpeptidaas, proelastaas) aktiveerib trüpsiin.
Pankrease peptidaaside aktiveerimine toimub kaskaadmehhanismi abil. Soole peptidaasid sünteesitakse enterotsüütides kohe aktiivsel kujul.
Valkude seedimise lõpptulemuseks on vabade aminohapete teke, mis sisenevad aktiivse transpordi teel soole limaskesta rakkudesse. Suurem osa moodustunud vabast AMK-st kasutatakse ära organismi enda valkude sünteesiks; ülejäänud AMA-d kasutatakse bioloogiliselt aktiivsete molekulide sünteesiks: hormoonid, biogeensed amiinid, aga ka nukleotiidid, heem, kreatiinfosfaat ja paljud teised ühendid, sealhulgas glükoosi sünteesiks glükoneogeneesi protsessis.
AMA transformatsioonide kõige olulisem tee organismis on transaminatsioonireaktsioonid α-ketohapetega koos uue (asendatava) AMA moodustumisega.
Teine AMA metabolismi viis on dekarboksüülimine bioloogiliselt aktiivsete molekulide - biogeensete amiinide - moodustumisega. AMK metabolismi peamine koensüüm on püridoksaalfosfaat (PP).
AMA lagunemine toimub nende deamineerimise teel: lämmastikuvabu jääke saab kasutada glükoosi sünteesiks (glükoneogenees) või, muutudes atsetüül-CoA-ks, oksüdeeritakse need süsinikdioksiidiks ja veeks koos energia moodustumisega (eristada glükogeenne ja ketogeenne AMK).
Selles jaotises esitatakse maomahla happesuse kvantitatiivse analüüsi laboritöö, mis võimaldab hinnata vaba, seotud, üldvesinikkloriidhappe sisaldust, aga ka maomahla üldhappesust.
Transamineerimisprotsessi esindavad kaks tööd:
1) aspartaataminotransferaasi (AST) ja alaniinaminotransferaasi (ALT) kvantitatiivne määramine vereseerumis, millel on diagnostiline väärtus südamekahjustuste korral ja maksahaiguste diferentsiaaldiagnostikaks;
2) ALT aktiivsuse kromatograafiline tõend. varajane diagnoosimine pärilik haigus- fenüülpüro-
viinamarjade oligofreenia (fenüülketonuuria) - töö on pühendatud fenüülalaniini kvantitatiivsele määramisele vereseerumis.
Valgu metabolismi lõpp-produktide kvantitatiivset määramist esindavad kaks laboratoorset tööd:
1) uurea kvantitatiivne määramine uriinis ensümaatilisel (ureaasi) meetodil;
2) kolorimeetriline meetod kreatiniini kvantitatiivseks määramiseks uriinis.
6.1. MAOMAHLA KVANTITATIIVNE ANALÜÜS. VABA, SIIDUNUD, KOGU VESINIKHAPE JA KOGU MAOHAPETE MÄÄRAMINE
Maomahl on tugevalt happelise reaktsiooniga (pH 1,5-2,0) värvitu vedelik. Päevas eritub inimesel umbes 1,5 liitrit maomahla; see sisaldab vett, mitteensümaatilisi valke, ensüüme (pepsiin, gastriksiin), mutsiini, Castle faktorit, vesinikkloriidhapet, hüdrofosfaate ja mõningaid muid ühendeid.
Maomahla happeline reaktsioon on tingitud vesinikkloriidhappe, hüdrofosfaatide olemasolust ja millal patoloogilised protsessid- piimhape ja rasvhapped. Kõik maomahla ained, mis võivad olla prootonidoonoriteks, on kõik üldine happesus. Valkude ja nende seedimisproduktidega seotud vesinikkloriidhapet nimetatakse seotud vesinikkloriidhape, ja sidumata kujul - vaba vesinikkloriidhape. Viimase sisaldus võib oluliselt kõikuda, samas kui seotud vesinikkloriidhappe hulk on üsna konstantne.
Maomahla sekretsiooni olemuses eristatakse järgmisi patoloogilisi muutusi: 1) hüperkloorhüdria - vaba vesinikkloriidhappe sisalduse ja üldhappesuse suurenemine. Seda seisundit täheldatakse peamiselt peptiline haavand kõht; 2) hüpokloorhüdria - vaba vesinikkloriidhappe koguse ja üldhappesuse vähenemine; 3) aklorhüdria - vesinikkloriidhappe täielik puudumine, samal ajal kui üldine happesus on oluliselt vähenenud; 4) ahiliya - maomahla sekretsiooni puudumine.
Võib täheldada vesinikkloriidhappe vähenemist või puudumist maos krooniline gastriit, maovähk, pahaloomuline aneemia.
Kliinik kasutab aga maomahla pH-meetriat kasulik informatsioon saab hankida lihtsal ja elegantsel viisil, mida soovitatakse allpool.
Eesmärk
Tiitrige järjestikku üks kolmest maomahla proovist NaOH lahusega kahe indikaatori juuresolekul ja tehke arvutuste põhjal järeldus maomahla happesuse kohta: normaalne, suurenenud või vähenenud. Võrrelge teiste proovidega ja märkige üles üldhappesuse, aga ka kogu, vaba ja seotud vesinikkloriidhappe muutuse olemus.
Meetodi põhimõte
Erinevate indikaatorite (dimetüülaminoasobenseen ja fenoolftaleiin) abil määratakse samast maomahla proovist nii üldhappesus kui ka üld-, vaba ja seotud vesinikkloriidhappe sisaldus.
Üldine happesus maomahla väljendatakse 0,1 M NaOH lahuse milliliitrite arvuna, mida kasutatakse tiitrimiseks 100 ml maomahlaga fenoolftaleiiniindikaatori juuresolekul (värvi ülemineku intervall pH 8,2-10). Tavaliselt on üldhappesus 40-60 tiiterühikut (ühikut).
vaba vesinikkloriidhape väljendatakse 0,1 M NaOH lahuse milliliitrite arvuna, mida kasutati tiitrimiseks 100 ml maomahlaga indikaatori dimetüülaminoasobenseeni juuresolekul (värvi ülemineku intervall pH 1,0-3,0). Tavaliselt on vaba vesinikkloriidhappe sisaldus 20-40 ühikut.
Üldine vesinikkloriidhape - see on vaba ja valkudega seotud vesinikkloriidhappe summa (viimane leitakse üld- ja vaba vesinikkloriidhappe erinevuse järgi).
Töö lõpetamine
Büretist viiakse tiitrimiskolbi 5 ml uuritavat maomahla. Lisage 1 tilk dimetüülaminoasobenseeni lahust ja 2 tilka fenoolftaleiini lahust. Ilmub roosa värv. Proovi tiitritakse 0,1 M NaOH lahusega, kuni see muutub oranžiks ja märgitakse vaba vesinikkloriidhappe tiitrimiseks kasutatud leelise milliliitrite arv (I tiitrimispunkt).
Edasi jätkatakse tiitrimist, kuni ilmub sidrunkollane värvus ja märgitakse üles tiitrimiseks kasutatud NaOH milliliitrite koguarv üldise tiitrimise algusest (tiitrimispunkt II). Seejärel jätkatakse tiitrimist, kuni ilmub karmiinpunane värvus ja märgitakse uuesti tiitrimisele läinud leelise milliliitrite arv üldise tiitrimise algusest (tiitrimise punkt III).
Arvutused
Oletame, et 5 ml maomahla tiitriti punktini I 0 kuni 1,5 ml 0,1 M NaOH lahust, punktini II - 0 kuni 2 ml ja punktini III - 0 kuni 3 ml. Siis on koguhappesus 3? 100/5 \u003d 60 ühikut, vaba vesinikkloriidhappe kogus - 1,5 * 100/5 \u003d 30 ühikut, üldvesinikkloriidhappe kogus (aritmeetiline keskmine tiitrimispunktide II ja III vahel) - (2 + 3) / 2? 100/5 \u003d 50 ühikut ja seotud vesinikkloriidhappe kogus leitakse üld- ja vaba vesinikkloriidhappe sisalduse erinevuse järgi: 50–30 \u003d 20 ühikut.
Tiitrimis- ja arvutusandmed kantakse tabelisse (vt allpool).
Testiülesanded teemal "Valkude transformatsioon ja aminohapete deamineerimine"
1. Proteinaasid, amülaasid ja lipaasid kuuluvad hüdrolaaside klassi.
2. Tauriin on tsüsteiini muundumise saadus.
3. Skatool ja indool tekivad soolestikus aminohappest türosiinist.
4. Vesinikkloriidhape maos soodustab pepsinogeeni aktiveerumist.
5. Aminohapete deamineerimisel tekivad organismis biogeensed amiinid.
6. Pepsiin kuulub endopeptidaaside hulka.
7. Glutamaadi dehüdrogenaasi koensüümina saab NAD+ asendada FAD-ga.
8. Inimestel toimub tsüsteiini mitteoksüdatiivne deaminatsioon.
9. Trüpsiin osaleb kümotrüpsinogeeni aktiveerimises.
10. Pepsiini ise seedimine maos on võimalik.
11. Karboksü- ja aminopeptidaasid klassifitseeritakse endopeptidaasideks.
12. Uridiindifosfoglükuroonhape osaleb indooli neutraliseerimises.
Deaminatsiooni koensüüm Mitteassendamatud aminohapped
aminohapped ei saa inimese jaoks olla on
1) NAD+ 1) fenüülalaniin
2) FAD 2) türosiin
3) FMN 3) trüptofaan
4) TPP 4) treoniin
5) PF 5) metioniin
3. Loo vastavus proensüümi ja vastava katalüsaatori vahel.
6.2. ASPARTAMINOTRANSFERAASI JA ALANIINI AMINOTRANSFERAASI KVANTITATIIVNE MÄÄRAMINE
SEERUMIS
Aspartaataminotransferaas (AsAT, EC: 2.6.1.1) ja alaniinaminotransferaas (AlAT, EC: 2.6.1.2) on püridoksaalfosfaati sisaldavad ensüümid.
AST katalüüsib aminorühma pöörduvat ülekannet aspartaadist α-ketoglutaraadiks glutamaadi ja oksaloatsetaadi moodustumisega.
ALT katalüüsib aminorühma alaniinilt α-ketoglutaraadile ülemineku pöörduvat reaktsiooni glutamaadi ja püruvaadi (PVC) moodustumisega.
ALT leidub tsütosoolis, samas kui AST eksisteerib teadaolevalt kahel kujul: tsütoplasmaatiline ja mitokondriaalne.
Kudede kahjustamisel "pestakse" kahjustatud rakkudest välja aminotransferaasid vereringesse, mistõttu on aminotransferaaside aktiivsuse määramine vereseerumis oluline, eriti südamekahjustuste ja diferentsiaaldiagnostika maksahaigused. Nii et tüsistusteta müokardiinfarkti korral hakkab AST tase vereseerumis tõusma juba 4-6 tundi pärast infarkti algust, maksimaalne aktiivsus saabub teisel päeval ja alles 5.-8. ensüümi aktiivsus väheneb normaalseks. Seerumi ALT aktiivsuse muutus on sel juhul ebaoluline.
Nakkusliku hepatiidi (Botkini tõbi) ja kroonilise hepatiidi ägenemise korral suureneb mõlema aminotransferaasi aktiivsus seerumis
vere tase tõuseb (AlAT aktiivsus tõuseb tugevamini). Maksatsirroosiga ei kaasne olulist hüperensüümi.
Eesmärk
Määrata kolorimeetrilise meetodiga mõlema aminotransferaasi aktiivsus vereseerumis ja võrrelda tulemusi normiga.
Meetodi põhimõte
Mõlema aminotransferaasi aktiivsuse määramine põhineb 1-tunnise inkubeerimise ajal moodustunud püruvaadi kolorimeetrilisel tuvastamisel värvusreaktsiooniga 2,4-dinitrofenüülhüdrasiiniga aluselises keskkonnas (vt töö 4.3B). ALT puhul tekib püruvaat otse alaniinist ja AST puhul püruvaat oksaloatsetaadist pärast viimase dekarboksüülimist leeliselises keskkonnas:
Mõlema ensüümi aktiivsus määratakse kalibreerimisgraafikuga.
Töö lõpetamine* (Vt lisa 9.2)
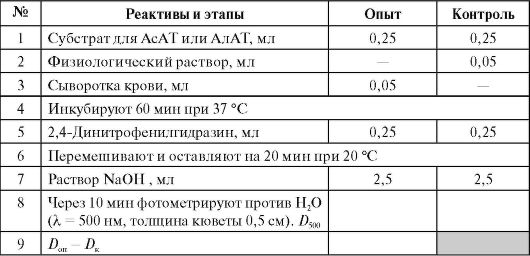
* Üks pool õpilasrühmast määrab AlAT aktiivsuse, teine - AsAT aktiivsuse, seejärel vahetavad rühmad tulemusi.
Arvutused
Aktiivsus arvutatakse kalibreerimiskõvera järgi μkat/l (andmed selle ehitamiseks on toodud tabelis).

Norm:ALT \u003d 0,05-0,12 μkat / l; ASAT \u003d 0,06-0,14 μkat / l. Ülemine piir on 0,42 mikrokat / l.
Järelduste iseseisev sõnastamine
Testiülesanded teemal
"Valkude seedimine ja aminohapete ainevahetus"
1. Tehke kindlaks, kas väide on tõene.
1. Türosiin on inimesele asendamatu aminohape.
2. Aminohapete oksüdatiivses deaminatsioonis võivad osaleda erinevad koensüümid.
3. Aminohapete transamiinimise reaktsioonid on pöördumatud.
4. α-ketoglutaarhape osaleb aminohapete transdeaminatsiooni ja transreamiinimise protsessides.
5. FAD toimib aminotransferaaside kofaktorina.
6. Transamineerimise käigus eraldub ammoniaak.
7. Inimese organismis on võimalik püroviinamarihappe muundamine alaniiniks.
8. Fenüülalaniin on serotoniini eelkäija.
9. Müokardiinfarkti diagnoosimisel kasutatakse aspartaataminotransferaasi aktiivsuse määramist inimese vereseerumis.
10. Vitamiin B 1 on vajalik transaminatsioonireaktsioonide jaoks.
11. Suhkurtõve korral suureneb glükoneogenees.
12. Lüsiin ja treoniin osalevad transaminatsioonireaktsioonides.
2. Valige õige vastus.
TCA metaboliit, mis on seotud glükogeeni aminohappega
transaminatsioonireaktsioonid on ei ole 1) tsitraat 1) arginiin
2) isotsitraat 2) glutamiin
3) suktsinaat 3) histidiin
4) fumaraat 4) leutsiin
5) oksaloatsetaat 5) metioniin
3. Loo vastavus aine ja selle eelkäija vahel.
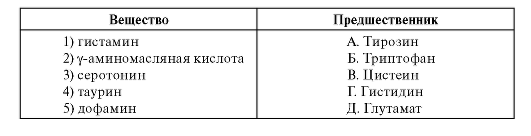
6.3. ALANIINI AMINOTRANFERAASI AKTIIVSUSE TUVASTAMINE PABERKROMATOGRAAFIAGA
Alaniinaminotransferaas (AlAT), nagu ka teised aminotransferaasid, osaleb raku tsütosoolis α-aminohapete ja α-ketohapete vastastikuses muundamises:
Alaniin + α-ketoglutaraat ↔ püruvaat + glutamaat.
Seetõttu saab ALT aktiivsust kvalitatiivselt määrata uue aminohappe ilmumisega reaktsioonisegusse, mis on tekkinud aminorühma üleminekul alaniinist või glutamaadist vastavalt α-ketoglutaraadile või püruvaadile (olenevalt reaktsioon).
Eesmärk
Kasutage paberkromatograafiat, et näidata ALT aktiivsust ja määrata, milline aminohape (alaniin või glutamaat) oli algses substraadisegus, st mis suunas ensümaatiline reaktsioon toimus.
Meetodi põhimõte
Kuna ensümaatilise reaktsiooni tulemusena moodustub uus aminohape, siis algse aminohappe ja ALT toimel tekkinud aminohappe identifitseerimine toimub radiaalmeetodil.
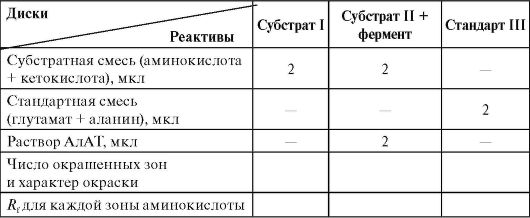
paberkromatograafia (vt paber 1.4B "Aminohapete paberkromatograafia"). Identifitseerimine toimub pärast ninhüdriiniga värvimist, võrreldes uuritud AMK Rf väärtusi standardsete väärtustega, mis eraldatakse samaaegselt samadel tingimustel. Probleemi lahendamiseks on vaja läbi viia kolm sõltumatut kromatograafilist eraldamist: 1) substraadi segu (üks aminohape); 2) substraadi segu + ALT (tekib teine aminohape); 3) "tunnistajate" alaniini ja glutamaadi standardlahus identifitseerimiseks.
Töö lõpetamine
Võtke kolm kromatograafilise paberi ketast läbimõõduga 12 cm. Lihtsa pliiatsiga peal märkige õpilase perekonnanimi ja ketta number. Iga ketta keskele tehakse ring läbimõõduga 0,3-0,4 cm Ketaste keskele kantakse reaktiivid mikropipetiga, nagu on näidatud tabelis.
10 minutit pärast viimase reagendi pealekandmist (inkubatsiooniaeg) kuivatatakse kõik kolm ketast õhu käes. Igale kettale tehakse kääridega kaks paralleelset lõiget servast keskkohani (lõike laius võrdub ketta keskel oleva ringi läbimõõduga). Lõigatud riba volditakse kettaga risti nii, et voltimisjoon läbib lahuse pealekandmise tsooni keskosa. "Jalg" lühendatakse 2-3 cm ja Petri tassi alumise ja ülemise poole vahele asetatakse ketas, mis sisaldab butanooli + äädikhape+ H 2 O vahekorras 5:1:4. Veetke kromatograafilist eraldamist tõmbe all umbes 1 tund. Kettad eemaldatakse kromatograafilisest kambrist ja joonistatakse lihtsa pliiatsiga lahusti esikülg.
Kuivatage* ahjus 100°C juures, niisutage ninhüdriini lahusega* ja kuivatage uuesti*.
Arvutage iga värvilise tsooni jaoks Rf väärtus ja tehke aminohapete identifitseerimine. Tehakse järeldus, milline aminohape oli substraadisegus. Seejärel lõigatakse igalt kettalt segmendid välja ja pannakse kõrvuti kokku, joondades aine kesksed kasutusalad.
![]()
Järelduste iseseisev sõnastamine
6.4. EXPRESS MEETOD VEREPLASMAS SUURENDATUD FENÜÜLALANIINI SISALDUSE MÄÄRAMISEKS
muutumine asendamatu aminohape fenüülalaniin asenduseks – türosiin inimkehas toimub hüdroksüülimisreaktsiooniga, mida katalüüsib ensüüm fenüülalaniin-4-monooksügenaas (tetrahüdrobiopteriin toimib kosubstraadina).
Kliiniline ja diagnostiline väärtus
Fenüülalaniin-4-monooksügenaasi kaasasündinud puudumine põhjustab raske päriliku haiguse - fenüülpüroviidse oligofreenia (fenüülketonuuria) - arengu. Samal ajal suureneb kudede fenüülalaniini tarbimise vähenemise tõttu järsult selle kontsentratsioon vereplasmas (normaalne sisaldus on 0,1 mmol/l, mis vastab 0,015 g/l). Samas tugevnemise tulemusena
* Tärniga tähistatud toiminguid teostavad laboritehnikud veojõul.
fenüülalaniini transaminatsioonireaktsioonid, fenüülpüruvaadi, püruvaadi metabolismis osalevate ensüümide konkureeriva inhibiitori kontsentratsioon kudedes suureneb. Laps aeglustub vaimne areng ja areneb fenüülpüroviin oligofreenia. Sellega seoses on äärmiselt oluline selle patoloogia võimalikult varane diagnoosimine (lapse 1-3. sünnipäeval) ja tutvustamine. range dieet fenüülalaniini dieedist väljajätmine. Fenüülalaniin-4-monooksügenaasi puudumise varajaseks tuvastamiseks määratakse plasma fenüülalaniinisisalduse tõus, mida on üsna lihtne läbi viia paberkromatograafia abil.
Eesmärk
Hinnake fenüülalaniini sisaldust uuritava lapse vereplasmas, kasutades paberkromatograafiat, võrreldes selle sisaldust ilmselgelt terve laps.
Meetodi põhimõte
Uuritava lapse vereplasma proovide kromatograafiline eraldamine ja ilmselgelt terve, võrreldes maksimaalset lubatud fenüülalaniini kogust sisaldava standardiga (poolkvantitatiivne määramine).
Töö lõpetamine
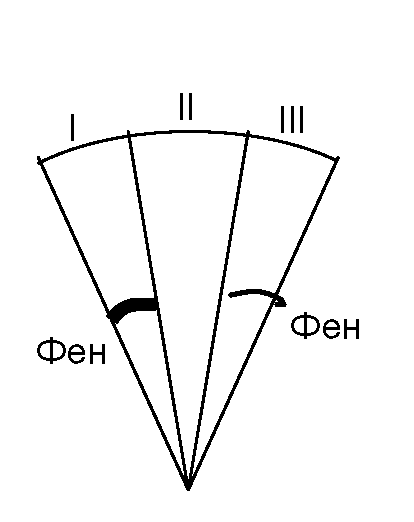
Võetakse kolm ketast kromatograafilist paberit läbimõõduga 12 cm. 2 μl uuritava lapse vereplasmast kantakse kettale I, 2 μl teadaoleva terve lapse vereplasmat (fenüülalaniini kontsentratsioon 0,015 g / l) rakendatakse II kettale. III kettale kantakse 2 μl fenüülalaniini standardlahust (kontsentratsioon 0,06 g/l) ja 2 μl terve lapse vereplasma. Fenüülalaniini üldkontsentratsioon on 0,075 g/l.
Lahuste pealekandmine kromatograafilistele ketastele, kromatograafia ja kromatogrammide väljatöötamine toimub samamoodi nagu eelmises töös.
Saadud kromatogramme võrreldakse fenüülalaniini värvuse intensiivsusega kõigil kolmel kettal ja tehakse järeldus fenüülalaniini sisalduse kohta uuritava lapse vereplasmas.
Järelduste iseseisev sõnastamine
Testiülesanded teemal "Aminohapete vahetus"
I. Tehke kindlaks, kas väide on tõene.
1. Maksa histidiin on võimeline desamiinituma vastavalt molekulisisesele tüübile.
2. Aminohapete oksüdaaside redutseeritud koensüüme saab vahetult oksüdeerida molekulaarse hapnikuga.
3. Glutamiinhappe deamineerimisega kaasneb vahepealne iminohappe moodustumine.
4. Monoamiini oksüdaaside (MAO) koensüüm on FAD.
6. Ammoniaak tekib mis tahes tüüpi aminohapete deamineerimisel.
7. Histamiinil on vasokonstriktiivne toime.
8. Dopamiin on norepinefriini eelkäija.
9. Inimorganismis on võimalik 5-hüdroksütrüptofaani dekarboksüülimine.
10. Kõik looduslikud aminohapped võivad TCA-s "ära põleda".
II. Inimkehas saab alaniinist moodustada glükoosi. 12. Leutsiin on klassifitseeritud ketogeenseks aminohappeks.
2. Valige õige vastus.
Koensüümi enamuse dekarboksüülimine
aminohappe aminohappe dekarboksülaasi pliid
on haridusele
1) FAD 1) alkohol
2) FMN 2) aldehüüd
3) PF 3) amiin
4) TPP 4) amiid
5) NADP+ 5) ketoon
3. Looge vastavus AUA vahetuses osaleva ensüümi ja selle koensüümi vahel.

6.5. UREAASI KVANTITATIIVNE MÄÄRAMINE URIINIS ENSÜMAATILISE UREAASI/FENOOL-HÜPOKLORIIDI MEETODIL
Karbamiid on inimkehas valkude metabolismi peamine lõpp-produkt. Uurea moodustab 80–90% uriiniga eritatavast lämmastikust.
Karbamiidi sünteesi bioloogiline roll maksas (ornitiinuurea tsükkel) on siduda aminohapete deamineerimisel tekkiv ammoniaak suhteliselt vähetoksiliseks uurea molekuliks, mis seejärel uriiniga eritub.
Teades ööpäevas eritunud karbamiidi kogust ja toiduga tarnitava lämmastiku kogust, on võimalik välja arvutada lämmastiku bilanss, mis on oluline näitaja valkude ja aminohapete metabolismi seisund. Lämmastiku tasakaal võib olla:
1) positiivne - raskest haigusest taastuvatel lastel;
2) negatiivne - raskete haiguste, sealhulgas vähi korral, nälgimise ajal ja vanemas eas;
3) võrdne nulliga (lämmastiku tasakaal) - tervetel täiskasvanutel (tavalise toitumisega).
Igasuguse valkude metabolismi suurenemisega, intensiivse valkude lagunemise protsessidega (kasvajad, hüpertüreoidism, diabeet) kaasneb karbamiidi moodustumise suurenemine ja koputamiseks uriiniga erituva uurea koguse suurenemine. Maksa patoloogiliste muutustega, mis põhjustavad selle funktsionaalset puudulikkust ja sellest tulenevalt uurea sünteesi rikkumist, kaasneb uurea sisalduse vähenemine veres ja uriinis. Neerude funktsionaalne rike põhjustab uurea koguse vähenemist uriinis ja samaaegselt selle sisalduse suurenemist veres (ureemia). Mõned diabeedi vormid, mida iseloomustavad suurenenud söögiisu ja patsiendi progresseeruv kõhnumine, millega kaasneb uurea eritumise suurenemine uriiniga valgu suurenenud lagunemise tõttu.
Eesmärk
Määrake uurea sisaldus igapäevases uriinis ja võrrelge tulemust normiga.
Meetodi põhimõte
See meetod on ensümaatiline, see põhineb uurea molekuli lõhustumise reaktsioonil väga spetsiifilise ensüümi (ureaasi) toimel ammoniaagi ja süsinikdioksiidiga, mis moodustavad vesilahuses ammooniumkarbonaadi:
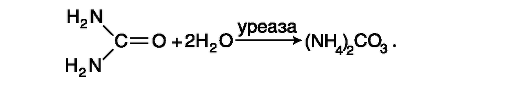
Ammooniumioonid reageerivad naatriumnitroprussiidi juuresolekul fenooli ja naatriumhüpokloritiga. Reaktsiooni käigus tekib indofenool ( sinist värvi), mille värvi intensiivsus on võrdeline ammooniumiioonide (ja vastavalt uurea) kontsentratsiooniga.
Töö lõpetamine (Vt lisa 9.2)
Uuringu jaoks võetakse järgmised proovid (kolm märgistatud katseklaasi): kogemus (lahjendatud uriin), standard (karbamiidi standardlahus 0,03 g/l) ja kontroll (vesi). Kõik reaktiivid lisatakse tabelis kirjeldatud viisil.
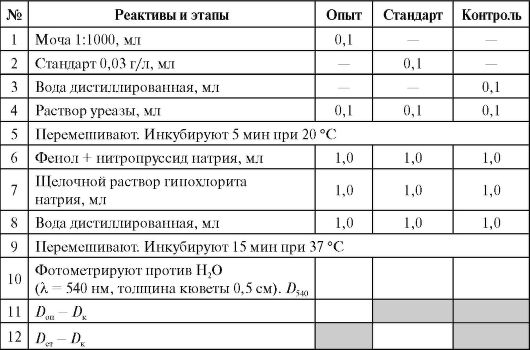
Õpilasrühmale pannakse kaks kontrolli ja kaks standardit. Ülejäänud õpilased teevad katseteste.
Arvutused
Karbamiidi mass arvutatakse uureastandardi* abil:

Järelduste iseseisev sõnastamine.
Testiülesanded teemal "Ammoniaagi neutraliseerimise viisid inimese ja looma organismis"
1. Tehke kindlaks, kas väide on tõene.
1. Glutamiini süntetaas on klassifitseeritud ligaasiks.
2. Karbamiidi eritumine uriiniga 20-35 mg / päevas on norm.
3. Karbamoüülfosfaadi moodustumine uurea sünteesil nõuab kahe ATP molekuli tarbimist.
4. Kreatiin eritub tavaliselt uriiniga.
5. Arginaas katalüüsib lämmastikoksiidi moodustumist (11).
6. Aspartaadi aminorühm on üks lämmastikuallikatest uurea molekulis.
7. Aminohapped on ainus ammoniaagi allikas organismis.
8. Glutamiini amiidrühma lämmastik võib sisalduda karbamiidi molekulis.
9. ATP-d kulutatakse glutamiini süntetaasi reaktsioonis. * Arvestades päevast uriinikogust 1,5 liitrit.
10. Inimese jaoks on 1 g kreatiniini vabanemine päevas norm.
11. Metioniin osaleb kreatiini sünteesis.
12. Ammooniumiioon eritub uriiniga.
2. Valige õige vastus.
Ammoniaak ajurakkudes Karbamiiditsükkel
juhtumisega kahjutuks tehtud
1) uurea süntees 1) neerudes
2) ammooniumisoolade moodustumine 2) maksas
3) glutamaadi muundamine glutamiiniks 3) neerupealistes
4) kreatiini süntees 4) põies
5) kõik ülaltoodud meetodid 5) kõhunäärmes
3. Määrake X ja Y vaheline vastavus reaktsioonis:

6.6. KVANTITEERIMINE
URINE kreatiniin
Kreatiniin on üks lämmastiku metabolismi lõppprodukte (5% uriini kogulämmastikust). See moodustub aastal lihaskoe kreatiinfosfaadist:
Kreatiinfosfaat → Kreatiniin + Fn.
Kreatiinfosfaat sünteesitakse omakorda kreatiinist reaktsioonis, mida katalüüsib kreatiinkinaas (kreatiinfosfokinaas, CPK) ATP osalusel:
Kreatiin + ATP ↔ Kreatiin~P + ADP.
See reaktsioon on pöörduv ja ATP moodustumine pöördreaktsioonis on hädaolukorra mehhanism lihaste kokkutõmbumiseks energia saamiseks.
Tavaliselt eritub uriiniga ainult kreatiniin. Kreatiini esinemine uriinis (kreatinuuria) viitab maksa-, neeru-, suhkurtõve, endokriinsete häirete (hüpertüreoidism, Addisoni tõbi, akromegaalia jne) haigustele. nakkushaigused. Erandiks on kreatiini ilmumine noorukite ja rasedate naiste uriinis.
Patoloogias esineb hüperkreatininuuria samaaegse kreatinuuriaga vöötlihased: müosiit, myasthenia gravis, düstroofia. Hüpokreatininuuriat täheldatakse kroonilise nefriidi korral, lihaste atroofia pärast infektsioone, vanemas eas.
Eesmärk
Määrake kreatiniini sisaldus päevases uriinis ja võrrelge tulemust normiga.
Meetodi põhimõte
Uriini kreatiniini kvantitatiivse määramise meetod (vastavalt Folinile) põhineb värvireaktsioonil pikriinhappega. Kreatiniini pikraadi oranži värvuse intensiivsus, mõõdetuna fotoelektrilisel kolorimeetril koos rohelise valgusfiltriga (540 nm), on otseselt võrdeline kreatiniini kontsentratsiooniga, mis määratakse kalibreerimisgraafiku abil.
Töö lõpetamine
Reaktiivid asetatakse 2 50 ml mõõtekolbi, nagu on näidatud tabelis.

Kalibreerimisgraafiku koostamiseks kasutatakse kaaliumdikromaadi (K 2 Cr 2 O 7) standardlahust.
Empiiriliselt leiti, et K 2Cr 2 O 7 0,17 M lahuse optiline tihedus vastab kreatiniini (kontsentratsioon 2 mg/ml) ja pikriinhappe interaktsiooni tulemusena leeliselises aines tekkinud toote optilisele tihedusele. keskmine. Seetõttu saab odava ja kergesti kättesaadava kaaliumdikromaadi abil hõlpsasti konstrueerida kalibreerimiskõvera.
0,17 M kaaliumdikromaadi alglahusest valmistatakse rida lahjendusi: 1, 2, 3 ja 5 ml alglahust võetakse vastavalt 4 mõõtetorusse ning kõik proovid reguleeritakse veega lõppmahuni. 5 ml. Määrata saadud lahuste optiline tihedus lainepikkusel 540 nm 1 cm paksuses küvetis vee suhtes. Kalibreerimislahuste optilise tiheduse saadud väärtustest lahutatakse eelmises töös määratud Dc ja saadud tulemuste põhjal joonistatakse graafik optilise tiheduse sõltuvusest kreatiniini kontsentratsioonist. Selleks kantakse abstsissteljele kreatiniini kontsentratsioonile vastav kaaliumdikromaadi milliliitrite arv (vastavalt 0,4; 0,8; 1,2 ja 2 mg / ml) ning optilise tiheduse väärtus (D 540 - D kuni ) on joonistatud ordinaatteljel. Töös saadud väärtus (D op - D k) kantakse graafikule ja leitakse kreatiniini kontsentratsioon uriinis (C, mg / ml). Seejärel arvutage kreatiniini mass päevases uriinis:
Norm:mehed: 1-2 g / päevas (8,8-17,6 mmol / päevas);
naised: 0,6-1,5 g / päevas (5,3-13,2 mmol / päevas).
Järelduste iseseisev sõnastamine Testiülesanded teemal
"Üksikute aminohapete vahetuse omadused"
1. Tehke kindlaks, kas väide on tõene.
1. Glütsiin osaleb puriini aluste sünteesis.
2. CoA sisaldab β-alaniini.
3. Arginiini guanidiini rühma lämmastik toimib lämmastikoksiidi moodustumise allikana.
4. Monooksügenaasid osalevad katehhoolamiinide moodustumisel.
5. Trüptofaan võib olla nikotiinhappe ribonukleotiidi (PP-vitamiin) moodustumise eelkäija.
6. Seriinist moodustub serotoniin.
7. Glutamiinhape on osa glutatioonist.
8. Homogentisiinhape on fenüülalaniini muundamise vaheprodukt.
9. Histidiini on võimalik muuta glutamiinhappeks.
10. Kreatiinfosfaat on makroergiline ühend.
11. Tsüsteiin läbib dekarboksüülimisprotsessi.
12. Glütsiini saab muuta seriiniks ja treoniiniks.
2. Valige õige vastus.
glütsiini molekul ei osale Seos, mis
sünteesis ei moodustunud türosiinist on
1) heem 1) homogentisiin
2) puriinalused happed
3) pürimidiini alused 2) adrenaliin
4) paarunud sapphapped 3) norepinefriin
5) kreatiin 4) dopamiin
5) fenüülalaniin
3. Määrake X ja Y vaheline vastavus reaktsioonis

Testiülesanded teemal
"Aminohapete metabolismi regulatsioon ja patoloogia"
1. Tehke kindlaks, kas väide on tõene.
1. Fenüülketonuuria tekib fenüülalaniin-4-monooksügenaasi sünteesi kaasasündinud häire tagajärjel.
2. Lõhnaga uriin Vahtra siirup ilmneb hargnenud ahelaga aminohapete vahetuse rikkumisega.
3. Kwashiorkori on täheldatud lastel, kelle toidus on valgupuudus.
4. Alkaptonuuria on trüptofaani metabolismi kaasasündinud defekt.
5. Fenüülketonuuriat saab tuvastada fenüülalaniini suurenenud sisalduse järgi vereseerumis.
6. Kwashiorkoriga kaasneb organismi vastupanuvõime langus infektsioonidele.
7. Aminohapete kontsentratsiooni suurenemisega veres kaasneb atsideemia.
8. Fenüülketonuuria korral annab türosiini toidust väljajätmine positiivse efekti.
9. Depressiooni ravis kasutatakse monoamiini oksüdaasi inhibiitoreid.
10. Hartnupi tõbe seostatakse trüptofaani malabsorptsiooniga.
11. Vitamiin B 6 puudumine põhjustab üksikute aminohapete metabolismi rikkumist.
12. Metioniini puudus võib põhjustada maksa rasvade degeneratsiooni.
2. Valige õige vastus.
Fenüülpüroviidne oligofreenia Seotud albinismiga
areneb kaasasündinud ainevahetushäirete tagajärjel
ensüümi klass 1) metioniini puudumine
1) oksidoreduktaas 2) seriin
2) transferaas 3) tsüsteiin
3) hüdrolaas 4) türosiin
4) lüaas 5) trüptofaan
5) isomeraas
3. Looge vastavus patoloogia ja AUA vahel, mille metabolismi või imendumise rikkumine soolestikus esineb selle patoloogia korral.

6.7. KOLLOKVIUM VALGUDE SEEDIMISE JA AMINOHAPETE AINEVAHETUSE KOHTA
Küsimused iseõppimiseks
1. Valkude bioloogilise väärtuse mõiste. Valkude roll toitumises. Asendatavad ja asendamatud aminohapped.
2. Levinud teed aminohapete transformatsiooniks kudedes.
3. Aminohapete deamineerimine. Oksüdatiivse deaminatsiooni mehhanismid.
4. Aminohapete lämmastikuvaba jäägi muundamise viisid. Glükogeensed ja ketogeensed aminohapped.
5. Aminohapete transamineerimine. Transamiinimise ensüümid ja koensüümid. Transdeaminatsioon ja transreaminatsioon. Aminotransferaaside määramise diagnostiline väärtus vereseerumis.
6. Aromaatsete aminohapete hüdroksüülimise ja dekarboksüülimise reaktsioonid.
7. Aminohapete dekarboksüleerimine. Biogeensete amiinide ja nende teke bioloogiline roll. Biogeensete amiinide lagunemine. Monoamiini oksüdaas.
8. Ammoniaagi moodustumise viisid organismis. uurea biosüntees.
9. Valkude lagunemise toksiliste produktide teke soolestikus ja nende neutraliseerimise mehhanism maksas.
10. Glütsiini ja seriini vahetuse tunnused.
11. Väävlit sisaldavate aminohapete vahetuse tunnused.
12. Arginiini metabolismi tunnused.
13. Dikarboksüülaminohapete vahetuse tunnused.
14. Fenüülalaniini ja türosiini vahetuse tunnused. Fenüülpüroviiniline oligofreenia. Alkaptonuuria. Ekspressmeetod fenüülalaniini kõrgenenud taseme määramiseks vereseerumis.
15. Kreatiini süntees. Kreatiinfosfaat. Kreatiniini kvantitatiivne määramine uriinis.
16. Valkude, rasvade ja süsivesikute ainevahetuse seos.
Kollokviumi kirjaliku osa variandid
1. Määrake aktiveerimismehhanism
1) pepsinogeen
2) trüpsinogeen
3) kümotrüpsinogeen
4) proelastaas
2. Kirjutage detoksikatsiooni reaktsioonid maksas
1) fenoolid
2) indool
3) bensoehape
4) ammoniaak
3. Mõelge reaktsioonide mehhanismile ja koensüümide osalemisele protsessides
1) hüdroksüülimine
2) transdeaminatsioon
3) transreamineerimine
4) metüülimine
4. Täpsustage farmakoloogilised toimed nii põhjalikult kui võimalik.
1) dopamiin
2) histamiin
3) serotoniin
4) norepinefriin
5. Analüüsige ainevahetushäirete juhtumeid
1) trüptofaan
2) türosiin
3) väävlit sisaldavad aminohapped
4) hargnenud ahelaga aminohapped
6. Märkige, milliste ühendite biosüntees osaleb
1) metioniin
2) arginiin
3) glutamiin
4) glütsiin
Arvuti testimisülesannete valikud
1. Aminohapped osalevad ammoniaagi neutraliseerimises
1) histidiin
2) asparagiinhape
3) alaniin
4) glutamiinhape
5) trüptofaan
2. Glutamaatdehüdrogenaasi koensüüm moodustumise reaktsioonis α- ketoglutaarhape
1) ÜLE+
2) PF
3) FAD
4) FMN
5) CoQ (ubikinoon)
3. Patsientidel, kelle ammoniaagisisaldus veres on pidevalt suurenenud, võib aminohappe võtmine olla kasulik.
1) histidiin
2) asparagiin
3) glutamiin
4) glutamiinhape
5) lüsiin
4. Homogentisinaat-1,2-dioksigenaasi ensüümi sünteesi kaasasündinud defekt põhjustab
1) fenüülketonuuria
2) Parkinsoni tõbi
3) alkaptonuuria
4) albinism
5) homotsüstinuuria
5. Osaleb kreatiini sünteesis
1) arginiin
2) leutsiin
3) metioniin
4) seriin
5) glütsiin
6. Igapäevane kreatiniini eritumine uriiniga on
1) 0,1-0,2 g päevas
2) 1,0-2,0 g/päevas
3) 10-20 g/päevas
4) 1,0-2,0 mg/päevas
5) 10-20 mg päevas
7. aminohapete transamiinimise protsess
1) tagab biogeensete amiinide sünteesi
2) esineb püridoksaalfosfaadi osalusel
3) tagab mitteasendatavate aminohapete moodustumise
4) millega kaasneb ammoniaagi teke
5) viib aminohapete üldarvu suurenemiseni
8. Osaleb ornitiini tsüklis
1) tsitrulliin
2) lüsiin
3) alaniin
4) arginiin
5) asparagiin
9. Segaaminohapped (glükogeensed ja ketogeensed) hõlmavad
1) trüptofaan
2) türosiin
3) fenüülalaniin
4) seriin
5) leutsiin
10. THPA osaleb sünteesis
1) seriin glütsiinist
2) tsüsteiin metioniinist
3) türosiin fenüülalaniinist
4) glutamiinhape histidiinist
5) glutamiin glutamaadist
11. Transamineerimise protsess ei allu
1) glutamiin ja asparagiin
2) lüsiin ja treoniin
3) isoleutsiin ja aspartaat
4) fenüülalaniin ja türosiin
5) alaniin ja valiin
12. Ajurakkudes sisalduv ammoniaak detoksifitseeritakse
1) uurea süntees
2) ammooniumisoolade moodustumine
3) glutamaadi muundamine glutamiiniks
4) alaniini moodustumine
5) kreatiini süntees
13. Enamiku aminohapete dekarboksülaaside koensüüm on
1) FAD
2) FMN
3) PF
4) TPP
5) biotiin
14. Histidaas kuulub klassi
1) oksidoreduktaas
2) transferaas
3) hüdrolaas
4) lyaz
5) isomeraas
15. Skatool ja indool detoksifitseeritakse maksas
1) glütsiin
2) glutamaat
3) α-ketoglutaraat
4) uridiindifosfoglükuroonhape
5) proliin
16. Püridoksaalfosfaat (PP) - koensüüm
1) alaniini aminotransferaas
2) amülaas
3) aspartaataminotransferaas
4) monoamiini oksüdaas
5) glutamaatdehüdrogenaas
17. Transaminatsioonireaktsioonides osalev TCA metaboliit on
1) tsitraat
2) α-ketoglutaraat
3) suktsinaat
4) fumaraat
5) malaat
18. Tekib γ-aminovõihape
1) histidiinist
2) asparagiinhappest
3) glutamiinhappest
4) glutamiinist
5) asparagiinist
19. Normaalne igapäevane uurea eritumine uriiniga on
1) 25-35 mg
2) 0,25-0,35 g
3) 2,5-3,5 g
4) 25-35g
5) 250-350g
20. Glütsiin võib tekkida
1) metioniinist
2) lüsiinist
3) valiinist
4) türosiinist
5) seriinist
21. Albinism on seotud ainevahetushäiretega
1) metioniin
2) seriin
3) tsüsteiin
4) türosiin
5) trüptofaan
22. Lämmastikoksiid(11) NO tekib lämmastikust
1) arginiin
2) tsüsteiin
3) valiin
4) histidiin
5) seriin
23. L-aminohappe oksüdaaside koensüüm võib olla
1) FMN
2) PF
3) ÜLE +
4) NADP +
5) CoA
24. Aspartaataminotransferaasi aktiivsus vereseerumis suureneb järsult
1) neeruhaigusega
2) pankreatiidiga
3) prostatiidiga
4) neerupõletikuga
5) müokardiinfarktiga
25. vesinikkloriidhape maos
1) denatureerib valke
2) on bakteritsiidse toimega
3) aktiveerib pepsinogeeni
4) loob pepsiini jaoks optimaalse pH
5) inhibeerib pepsinogeeni
26. Koensüüm monoamiini oksüdaas (MAO) on
1) ÜLE+
2) FAD
3) NADH (H+)
4) TPP
5) PF
27. Kwashiorkori täheldatakse toidupuudusega lastel
1) süsivesikud
2) lipiidid
3) valgud
4) vitamiinid
5) mineraalid
28. Tauriini moodustumise allikas on
1) metioniin
2) tsüsteiin
3) glütsiin
4) seriin
5) treoniin
29.
1) leutsiin
2) alaniin
3) seriin
4) glutamiin
5) lüsiin
30. Fenüülalaniini mädanemise korral soolestikus
1) fenool
2) skatool
3) indool
4) kresool
5) leutsiin
31. Alkaptonuuria on kaasasündinud metaboolne defekt
1) trüptofaan
2) histidiin
3) metioniin
4) türosiin
5) glütsiin
32. Toimub uurea biosüntees
1) ajus
2) põies
3) kõhunäärmes
4) neerupealistes
5) maksas
33. igapäevane vajadus inimeste valkudes on ligikaudu
1) 100 g
2) 100 mg
3) 10 g
4) 1000 mg
5) 1000 g
34. Aminohapete deaminatsiooni koensüümid võivad olla
1) ÜLE+
2) FAD
3) FMN
4) TPP
5) CoA
35. α-ketoglutaarhappe redutseeriva amiinimise protsessis,
1) NADP +
2) NADPH(H+)
3) FADH 2
4) FMNN 2
5) ÜLE+
36. Serotoniin on dekarboksüülimise saadus
1) histidiin
2) türosiin
3) proliin
4) fenüülalaniin
5) 5-hüdroksütrüptofaan
37. Rangelt ketogeenne aminohape on
1) alaniin
2) valiin
3) trüptofaan
4) leutsiin
5) metioniin
38. Arginaas osaleb sünteesis
1) lämmastikoksiid (11)
2) kreatiin
3) uurea
4) seriin
5) orav
39. Moodustamises osalevad monooksügenaasid
1) türosiin
2) dihüdroksüfenüülalaniin
3) norepinefriin
4) asparagiin
5) glutamiin
40. Inimkehas toimub intramolekulaarne deaminatsioon
1) glütsiin
2) glutamiin
3) histidiin
4) türosiin
5) trüptofaan
41. Türosiinist moodustunud ühendid on
1) γ-aminovõihape
2) adrenaliin
3) norepinefriin
4) dopamiin
5) fenüülalaniin
42. Aminohapete metabolismi peamine koensüüm on
1) CoA
2) TPF
3) ÜLE +
4) biotsütiin
5) PF
43. Fenüülpüroviin oligofreenia areneb selle klassi ensüümi kaasasündinud puudumise tagajärjel
1) lüaz
2) ligaas
3) hüdrolaas
4) isomeraas
5) oksidoreduktaas
44. Need moodustuvad aminohappest türosiinist
1) serotoniin
2) dihüdroksüfenüülalaniin
3) dopamiin
4) norepinefriin
5) indool
45. Pepsinogeeni aktiveerimine pepsiiniks viiakse läbi
1) trüpsiin
2) kümotrüpsiin
3) pepsiin
4) enterokinaas
5) amülaas
46. Skatool ja indool tekivad soolestikus mädanemise käigus.
1) türosiin
2) fenüülalaniin
3) trüptofaan
4) histidiin
5) proliin
47. Ensüümi fenüülalaniin-4-monooksügenaasi (fenüülalaniinhüdroksülaasi) kaasasündinud puudulikkus põhjustab
1) fenüülpürovikoloogiline oligofreenia
2) Parkinsoni tõbi
3) alkaptonuuria
4) albinism
5) homotsüstinuuria
48. pankrease sekretsiooni ensüüm ei näita proteolüütiline aktiivsus on
1) trüpsiin
2) kümotrüpsiin
3) amülaas
4) karboksüpeptidaas
5) aminopeptidaas
49. Dihüdroksüfenüületüülamiin (dopamiin) on
1) biogeenne amiin
2) norepinefriini sünteesi eelkäija
3) vasodilataator
4) trüptofaani derivaat
5) γ-aminovõihappe (GABA) eelkäija
50. bioloogiline väärtus määratud valk
1) aminohapete koostis
2) laengu olemasolu
3) lõhenemisvõimalus seedetraktis
5) molekulmass
51. Karbamiidi tsüklis osalevad ensüümid on
1) arginaas
2) kreatiinkinaas
3) karbamoüülfosfaadi süntetaas
4) ureaas
5) fumaraas
52. Patsiendi uriinist leiti märkimisväärne kogus homogentisiinhapet. Võimalik patoloogia- see on
1) albinism
2) Parkinsoni tõbi
3) tsüstinuuria
4) alkaptonuuria
5) fenüülketonuuria
53. läbib maksas kõige intensiivsema deaminatsiooni
1) ser
2 Gis
3) cis
4) asp
5) glu
54. Karbamiidi sünteesi ja TCA protsesside tavaline metaboliit on
1) suktsinüül-CoA
2) suktsinaat
3) aspartaat
4) fumaraat
5) malaat
55. Histidaas (histidiini ammoniaaklüaas) katalüüsib reaktsiooni
2) oksüdatiivne deamineerimine
3) karboksüülimine
4) molekulisisene deaminatsioon
5) metüülimine
56. Metioniin osaleb sünteesis
1) adrenaliin
2) tsüsteiin
3) uurea
4) fosfatidüülkoliin
5) norepinefriin
Õiged vastused
1. 2, 4
2. 1
3. 4
4. 3
5. 1, 3, 5
6. 2
7. 2, 3
8. 1, 4
9. 1, 2, 3
10. 1
11. 2
12. 3
13. 3
14. 4
15. 4
16. 1, 3
17. 2
18. 3
19. 4
20. 5
21. 4
22. 1
23. 1
24. 5
25. 1, 2, 3, 4
26. 2
27. 3
28. 2
29. 1
30. 1, 4
31. 4
32. 5
33. 1
34. 1, 2, 3
35. 2
36. 5
37. 4
38. 3
39. 1, 2, 3
40. 3
41. 2, 3, 4
42. 5
43. 5
44. 2, 3, 4
45. 3
46. 3
47. 1
48. 3
49. 1, 2
50. 1, 3, 4
51. 1, 3
52. 4
53. 5
54. 4
55. 4
56. 1, 2, 4
Toitumine on keeruline protsess, mille tulemusena nad sisenevad, seedivad ja imenduvad organismile vajalik ained. Viimase kümne aasta jooksul on aktiivselt arenenud spetsiaalne toitumisele pühendatud teadus - nutritsioloogia. Selles artiklis käsitleme seedimise protsessi inimkehas, kui kaua see kestab ja kuidas ilma sapipõieta hakkama saada.
Seedesüsteemi struktuur
Seedesüsteemi esindab seeduvust tagavate organite kogum toitaineid keha, mis on talle energiaallikas, vajalik rakkude uuenemiseks ja kasvuks.
Seedesüsteem koosneb: suuõõnest, neelust, peensoolest, jämesoolest ja pärasoolest.
Seedimine inimese suus
Seedimise protsess suus on toidu jahvatamine. Selles protsessis toimub toidu energeetiline töötlemine süljega, mikroorganismide ja ensüümide vastasmõju. Pärast süljega töötlemist osa aineid lahustub ja nende maitse ilmneb. füsioloogiline protsess Seedimine suuõõnes seisneb tärklise lagunemises suhkruteks süljes sisalduva amülaasi ensüümi toimel.
Jälgime amülaasi toimet näitel: minuti jooksul leiba närides on tunda magusat maitset. Valkude ja rasvade lagunemist suus ei toimu. Keskmiselt võtab seedimise protsess inimkehas aega umbes 15-20 sekundit.
Seedimise osakond - magu
Magu on kõige laiem osa seedetrakt, millel on võime suurendada suurust ja mis mahutab tohutul hulgal toitu. Selle seinte lihaste rütmilise kokkutõmbumise tulemusena algab seedimisprotsess inimkehas toidu põhjaliku segamisega happelise maomahlaga. 
Makku sattunud toidutükk jääb sinna 3-5 tunniks, läbides selle aja jooksul mehaanilise ja keemilise töötlemise. Seedimine maos algab toidu kokkupuutel maomahla ja selles sisalduva vesinikkloriidhappe ning pepsiini toimega.
Inimese maos seedimise tulemusena seeditakse valgud ensüümide abil madala molekulmassiga peptiidideks ja aminohapeteks. Suus alanud süsivesikute seedimine maos peatub, mis on seletatav nende amülaaside aktiivsuse kadumisega happelises keskkonnas.
Seedimine maoõõnes
Seedimisprotsess inimkehas toimub maomahla toimel, mis sisaldab lipaasi, mis on võimeline rasvu lagundama. Kus suur tähtsus antakse maomahla soolhappele. Vesinikkloriidhappe mõjul suureneb ensüümide aktiivsus, tekib valkude denaturatsioon ja turse ning avaldub bakteritsiidne toime.
Maos seedimise füsioloogia seisneb selles, et süsivesikutega rikastatud toidul, mis on maos umbes kaks tundi, on evakuatsiooniprotsess kiirem kui valke või rasvu sisaldaval toidul, mis jääb maos püsima 8-10 tundi.
Peensooles läbib maomahlaga segatud ja osaliselt seeditud toit, mis on vedela või poolvedela konsistentsiga, samaaegselt väikeste portsjonitena. Millises osakonnas seedimisprotsess inimorganismis ikkagi toimub? 
Seedimine - peensool
Ainete imendumise biokeemia seisukohalt on tähtsaimal kohal seedimine peensooles, kuhu siseneb maost toiduboolus.
Selles jaotises koosneb soolemahl leeliselisest keskkonnast, mis on tingitud sapi, pankrease mahla ja sooleseina sekreedi jõudmisest peensoolde. Seedimisprotsess peensooles ei ole kõigil kiire. Seda soodustab kohalolek mitte piisavalt ensüüm laktaas, mis hüdrolüüsib täispiima seedimatusega seotud piimasuhkrut. Seedimisprotsessi käigus see osakond inimene tarbib rohkem kui 20 ensüümi, näiteks peptidaase, nukleaase, amülaasi, laktaasi, sahharoosi jne.
Selle protsessi aktiivsus peensooles sõltub kolmest teineteisesse sisenevast osakonnast, millest see koosneb - kaksteistsõrmiksoolest, tühisoolest ja niudesoolest. Maksas moodustunud sapp siseneb kaksteistsõrmiksoole. Siin seeditakse toit tänu pankrease mahlale ja sapile, mis sellele mõjuvad. Pankrease mahl, mis on värvitu vedelik, sisaldab ensüüme, mis soodustavad valkude ja polüpeptiidide lagunemist: trüpsiin, kümotrüpsiin, elastaas, karboksüpeptidaas ja aminopeptidaas. 
Maksa roll
Inimkehas seedimise protsessis (nimetame seda lühidalt) on oluline roll maksale, milles moodustub sapp. Peensoole seedimisprotsessi eripära on tingitud sapi kaasabil rasvade emulgeerimisel, triglütseriidide imendumisest, lipaasi aktiveerimisest, samuti stimuleerib peristaltikat, inaktiveerib pepsiini kaksteistsõrmiksooles, on bakteritsiidse ja bakteriostaatilise toimega. , suurendab valkude ja süsivesikute hüdrolüüsi ja imendumist.
Sapp ei koosne seedeensüümidest, vaid on oluline rasvade ja rasvlahustuvate vitamiinide lahustumisel ja imendumisel. Kui sappi ei toodeta piisavalt või see eritub soolestikku, rikutakse seedimise ja rasvade imendumise protsesse, samuti suureneb nende eritumine algsel kujul väljaheitega.
Mis juhtub sapipõie puudumisel?
Inimene jääb ilma nn väikese kotita, millesse sapp oli varem “reservi” ladestunud.
Sapp on kaksteistsõrmiksooles vajalik ainult siis, kui selles on toitu. Ja see ei ole püsiv protsess, vaid perioodil pärast söömist. Mõne aja pärast tühjeneb kaksteistsõrmiksool. Sellest lähtuvalt kaob vajadus sapi järele.
Maksa töö sellega aga ei piirdu, see jätkab sapi tootmist. Sellepärast loodi loodus sapipõie et toidukordade vahel eritatav sapp ei rikneks ja säiliks kuni vajaduse ilmnemiseni. 
Ja siin tekib küsimus selle "sapi hoidmise" puudumise kohta. Nagu selgub, saab inimene ilma sapipõieta hakkama. Kui operatsioon tehakse õigeaegselt ja teisi seedeelunditega seotud haigusi ei provotseerita, siis on sapipõie puudumine organismis kergesti talutav. Seedimisprotsessi aeg inimkehas pakub huvi paljudele.
Pärast operatsiooni saab sapi säilitada ainult sapiteedes. Pärast sapi tootmist maksarakkude poolt vabaneb see kanalitesse, kust see kergesti ja pidevalt saadetakse kaksteistsõrmiksoole. Ja see ei sõltu sellest, kas toitu võetakse või mitte. Sellest järeldub, et pärast sapipõie eemaldamist tuleb kõigepealt süüa sageli ja väikeste portsjonitena. See on tingitud asjaolust, et suurte sapikoguste töötlemiseks pole piisavalt sappi. Lõppude lõpuks pole selle kogunemiseks enam kohta, vaid see siseneb soolestikku pidevalt, kuigi väikestes kogustes.
Sageli kulub kehal aega, et õppida, kuidas ilma sapipõieta toimida, et leida vajalik ruum sapi säilitamiseks. Siit saate teada, kuidas toimub seedimise protsess inimese kehas ilma sapipõieta.
Seedimise osakond - jämesool
Seedimata toidu jäänused liiguvad jämesoolde ja jäävad sinna umbes 10–15 tunniks. Siin toimuvad soolestikus järgmised seedimisprotsessid: vee imendumine ja toitainete mikroobne metabolism. 
Jämesooles toimuvas seedimises mängivad tohutut rolli toidu ballastained, mille hulka kuuluvad seedimatud biokeemilised komponendid: kiudained, hemitselluloos, ligniin, kummid, vaigud, vahad.
Toidu struktuur mõjutab imendumise kiirust peensooles ja seedetraktis liikumise aega.
osa kiudaine, mida ei lagunda seedetrakti kuuluvad ensüümid, hävitab mikrofloora.
Jämesool on fekaalse massi moodustumise koht, mille hulka kuuluvad: seedimata toidujäägid, lima, limaskesta surnud rakud ja soolestikus pidevalt paljunevad mikroobid, mis põhjustavad käärimis- ja gaasitekke protsesse. Kui kaua seedimise protsess inimkehas kestab? See on tavaline küsimus.
Ainete lagunemine ja imendumine
Toitainete imendumise protsess toimub kogu seedekulglas, mis on kaetud karvadega. Limaskesta 1 ruutmillimeetril on umbes 30-40 villi. 
Rasvu, õigemini rasvlahustuvate vitamiinide lahustavate ainete imendumisprotsessi toimumiseks peavad soolestikus olema rasvad ja sapp.
Vees lahustuvate toodete, nagu aminohapped, monosahhariidid, mineraalioonid, imendumine toimub vere kapillaaride osalusel.
Kell terve inimene Kogu seedimisprotsess kestab 24–36 tundi.
Just nii kaua kestab seedimisprotsess inimkehas.
Mis ei ole võimelised verre ja lümfi imenduma, kuna suured suurused nende molekulid. Toidu keemiline töötlemine seedetraktis on suurte molekulaarsete valkude, süsivesikute ja lipiidide järjestikune ensümaatiline hüdrolüütiline lõhustamine lihtsateks aineteks, mis on võimelised imenduma. Ensüüme, mis neid hüdrolüüsireaktsioone katalüüsivad, nimetatakse hüdrolaasideks. Kõik seedeensüümid sünteesitakse, reserveeritakse ja sekreteeritakse inaktiivsel kujul, proensüümide kujul ning aktiveeruvad vahetult enne hüdrolüüsi algust.
Toiduvalkude seedimine on ette nähtud nende denatureerimiseks, liigi- ja koespetsiifilisuse kaotamiseks ning jagamiseks lihtsateks komponentideks, mis on võimelised peensooles verre imenduma. Peaaegu kõik toiduvalgud (~95 ÷ 97%) imenduvad vabade aminohapetena. Toiduvalkude lagunemine on hüdrolüüs katalüsaatorite osalusel - proteolüütilised ensüümid (proteaasid, proteinaasid, peptidaasid). Iga proteinaasi ensüüm lõhub valkude täpselt määratletud peptiidsidemeid. Toime spetsiifilisus sõltub polüpeptiidi suurusest, selle struktuurist, peptiidsidemete moodustumisel osalevate aminohapete tüübist. Peamised proteinaasid, mis katalüüsivad toiduvalkude ja peptiidide hüdrolüüsi, on toodud tabelis.
Tabel 1. Seedetrakti proteolüütilised ensüümid. Modifikatsioon: Berezov T. T., Korovkin B. F. Bioloogiline keemia. 3. väljaanne, |
||
| Saladus | Ensüümid | Tegevusfunktsioonid |
| Maomahl | Pepsiin | Proteinaas |
| renniin | Piima kalgendamine | |
| Gatriksiin | Sarnaselt pepsiiniga | |
| pankrease mahl | trüpsiin | Proteinaas |
| Kümotrüpsiin | Proteinaas | |
| kollagenaas | Proteinaas | |
| Karboksüpeptidaas | Peptidaas | |
| Elastaasi | Peptidaas | |
| soole mahl | Aminopeptidaas | Peptidaas |
| Leutsiini aminopeptidaas | Peptidaas | |
| Alaniinaminopeptidaas | Peptidaas | |
| Enteropeptidaas | Glükoproteiin | |
| Tripeptidaas | Peptidaasid | |
| Dipeptidaasid | Peptidaasid | |
| Prolüüldipeptidaas | Peptidaas | |
| Proliini dipeptidaas | Peptidaas | |
|
|
Loomse valguga toidu seedimise protsess erineb täiesti tärkliserikka toidu seedimisest. Kui vaatate, kuidas röövloomad toitu söövad, märkate, et nad rebivad rümbast välja lihatükke ja närimata neelavad need alla. Nad vajavad oma hambaid ainult lihatüki maharebimiseks, kuid mitte närimiseks. Nii et seedimist ei toimu suuõõne nad seda ei tee ja loomsete valkude seedimine algab maost. Selleks lastakse maoõõnde soolhape ja ensüüm pepsiin ning seal tekib teravalt happeline keskkond - parim loomsete valkude seedimiseks.
Kas tead, mida teeb soolhape lihaga ja miks on vaja teravalt happelist keskkonda? Akadeemik A. M. Ugolev leidis selle eksperimentaalselt. Selgub, et maomahla vesinikkloriidhape tungib lihatüki rakkudesse ja põhjustab lüsosoomide (spetsiaalsete rakuorganite) hävimise. Raku lüsosoomides on ensüümid - hüdrolaasid, mis selles loodud pH keskkonnaga 3,5–5,5 (väga happeline) hävitavad kõik rakustruktuurid. Seetõttu kutsub maomahl esile (aktiveerib) eneseseedimist loomset toitu oma ensüümid. See mehhanism eksisteerib nii lihasööjatel kui ka taimtoidulistel. Põhimõtteliselt saab seda teha ka inimesel, kuid selleks on vaja süüa toores liha.
Indutseeritud autolüüs paraneb temperatuuril 37-40 °C. Happelise maomahla mõjul suureneb esiteks membraani läbilaskvus; teiseks proteolüütiliste ja teiste ensüümide aktiivsuse muutus; kolmandaks muutub valgurakkude ja kudede seisund, eelkõige nende tundlikkus ensüümide toime suhtes.
Erinevalt seedemahlade pinnamõjust toiduobjektile toimub indutseeritud autolüüsi korral söödud lihatüki kudede seestpoolt "seedeplahvatus", kuna autolüüs indutseeritakse kogu liha paksuse ulatuses. toiduobjekt. Sel juhul toimub kõigi rakustruktuuride hüdrolüütiline lõhustamine.
Induktor, see tähendab maomahla vesinikkloriidhape, tungib toortoidu rakkudesse ja hävitab selle lüsosoomid-organellid, mis sisaldavad palju hüdrolüütilisi ensüüme. Tsütoplasmasse (rakuõõnde) vabanevad ensüümid lõhustavad (hüdrolüüsivad) rakustruktuure ja selle membraani. Seetõttu seeditakse toortoitu (loomset ja taimset) selle enda ensüümide abil ja seejärel imendub see kehasse.
Selgus, et umbes 50% hüdrolüüsist (lõhustumisest) ei määra mitte maomahla ensüümid, vaid autolüüsitud kude ise!
Kõik loomad kasutavad autolüütilist seedimist, tarbides elusobjekte (loomi või taimi), ja ainult inimesed soojendavad oma toitu, et seda "parandada".
Seedemahlade enda ensüümid on eriti olulised lüsosoomideta struktuuride (näiteks valkude) kasutamiseks. sidekoe), Koos suur kiirus. Selleks on vaja pepsiini.
Biokeemik A. Pargetti leidis, et kui küpsetada tulel temperatuuril üle 54 °C mis tahes aja jooksul, kaob ensüümide aktiivsus ja autolüüs muutub võimatuks.
Ülaltoodud protsess kehtib ainult valkude seedimise kohta. Töödeldud valgu mass portsjonitena satub see kaksteistsõrmiksoole ja sealt edasi peensoolde, kus toimuvad seedimise lõppprotsessid ja valguproduktide verre imendumine.
Selgub, et happeline sisaldus tuleks neutraliseerida ja omandada neutraalne või kergelt aluseline reaktsioon. See on vajalik selleks, et pankrease ensüümid saaksid alustada maos valmistatud valgustruktuuride lõplikku lagunemist.
Seega selgub, et kui loom valgurikas toit tapetakse kuumtöötlemisel, siis muutuvad autolüüsiprotsessid võimatuks kas maos või peensooles ning kogu seedimiskoormus langeb organismile (mao ja kõhunääre, mis toodavad loomset valku lagundavaid ensüüme).
Pavlov näitas oma katsetega, et erinevate valgutooted loomset päritolu (liha ja juust, munad ja liha, piim ja kala jne) on mao aktiivsus soolhappe, pepsiini tootmisel ja nende aktiivsus täiesti erinev (mõne toote puhul algab see varem, teistel hiljem, ka mahlade tugevus on erinev). Seega tekivad valgu ja valgu ebamugavad kombinatsioonid.
Veelgi erinevad on normaalse seedimise tingimused kell samaaegne vastuvõtt valgurikkad toidud (liha, kala), tärkliserikkad toidud (nt kartul, teravili, leib). Seedimine ei saa normaalselt kulgeda. Mõlemad ensüümid (amülaas ja pepsiin) segavad üksteist, sest nad vajavad erinev keskkond: amülaas on kergelt aluseline ja pepsiin on teravalt happeline. Seega on tärklise- ja valguliste toitude üheaegne seedimise töö organismile ülemäära raske (see annab ka välise efekti - väsimustunde). Ja pealegi ei saa neid mõlemaid tooteid normaalselt seedida ja keha toitmise asemel kahjustavad seda, sillutades teed paljude arenguks. kroonilised haigused kõige mitmekesisema iseloomuga. Seetõttu on valgu- ja tärkliserikaste toitude eraldi kasutamine aluseks eraldi ja meditsiiniline toitumine.
Lisaks ülaltoodud põhjustele on valgurikkad toidud organismile äärmiselt koormavad. Ja punase tegevuse keskmes on mõiste "toidu spetsiifiline dünaamiline toime".
Toidu spetsiifilise dünaamilise toime (SDAP) all mõeldakse ainevahetuse suurenemist pärast sööki võrreldes põhiainevahetuse tasemega. Umbes 15-30 minutit pärast sööki toimub energia metabolismi kiirenemine, mis saavutab maksimumi 3-6 tunni pärast ja püsib 10-12 tundi. Ja erinevat tüüpi toidud mõjutavad seda kasvu erineval viisil. Rasvad kiirendavad veidi ainevahetust ja mõnikord aeglustavad seda. Süsivesikute sisaldus suureneb 10-20% ja valgurikas toit veelgi - kuni 40%.
Mis põhjustas nii tugeva energiavahetuse tõusu pärast valgurikka toidu söömist? Selleks peate teadma, kui palju täiskasvanud inimene kulutab toiduvalk kulunud kehakudede ehitamiseks ja asendamiseks ning kui palju energiakuluks.
Kaua aega tagasi näitas Rubner empiiriliselt, et ainult 4% üldine vahetus energia läheb valkude ehitamiseks või kasvatamiseks. Keskmiselt on see 30 g valku päevas inimese kohta (ja 100 g lihas on see 20 g). Enne kui vastame küsimusele, kuhu kaob lisavalk, anname vastuse teisele: mida kasutame põhilise "kütusena"?
Meie peamine energiaallikas on süsivesikud. Hapnikuga oksüdeerides saame vaba energiat, mida kasutame, samuti süsinikdioksiid ja vesi, mis erituvad organismist kergesti.
Kui energiamaterjalina kasutatakse valku, siis sellest tuleb kõigepealt eraldada lämmastik ja seejärel kütusena kasutada süsivesikuid.
Erinevalt süsivesikutest ja rasvadest ei saa lämmastikku organismis varuda ning see eritub organismist tugevalt (ja selleks on vaja vaba vett ja energiat). Jah, pärast valgurikas hommikusöök toiduga tarnitavast lämmastikust väljub kuni 50% ja koos sellega ka vesi, milles see asub! Sel juhul saavutab energiakulu sellised proportsioonid, et kuni 30-40% toidu kalorisisaldusest kulub lämmastiku lagundamiseks ja selle organismist eemaldamiseks. Nagu me teame, on peamine organ, mis lämmastikku kehast eemaldab, neerud. Seetõttu kulutab "üleplaneeritud" töö need kiiresti ära.
SDDP reaktsioonide tulemusena ei toimu mitte ainult energia metabolismi intensiivistumine ja aminohapete (valkude) lagunemine, vaid ka vere glükoosisisalduse muutus, nihked. vee-soola tasakaal, muutused veresoonte toonuses, kaasatud on hormonaalsed süsteemid.
Biokeemik A. E. Braunshtein juhtis tähelepanu asjaolule, et aminohapete (valkude) assimilatsioon ja metabolism nõuab märkimisväärsel hulgal vaba energiat. Oma teel läbi keha põhjustab iga lämmastikuaatom paljude ATP ja anorgaanilise fosfaadi molekulide lagunemise.
Kui võrrelda valkude sünteesi ja lagunemise kiirust, samuti lämmastikuringet madala ja kõrge sisaldus valku, leiti, et madala valgusisaldusega dieediga väheneb lämmastiku ringluse intensiivsus 18%. See näitab SDDP rolli ehitamisel ratsionaalsed dieedid ravi, enesetervendamise juhtudel ja samas anti vastus armastajatele lihatoit, mis peab seda peamiseks energiatarnijaks.
Oluline on mõista, et valguvaesele dieedile üleminekul keha säästetud energia läheb teie keha tugevdamiseks ja tervendamiseks.
Happe-aluse tasakaalu pidev säilitamine organismis.
Eluprotsessid, mille väliseks ilminguks on tervis või haigus, kulgevad bioloogiliste reaktsioonidena. Bioloogilised reaktsioonid kulgevad kõige paremini ühes või teises veekeskkonnas ja teatud temperatuuril. Optimaalne veekeskkond mida iseloomustab happeliste ja aluseliste elementide suhe, mis on pH väärtus.
Inimkeha kulutab palju pingutusi parima pH väärtuse säilitamiseks, omades teatud mehhanisme, mis seda reguleerivad ja toetavad. Keha sisekeskkonna kõrvalekaldumine optimaalsetest pH väärtustest põhjustab vaevusi ja seejärel haigusi. Sel põhjusel paranemisprotsessi läbiviimiseks ja edaspidi hooldamiseks hea tervis oluline on seda indikaatorit reguleerida ja taastada.
Inimese organismis tekivad happed ja leelised iseenesest, ainevahetuse teel, samuti viiakse sisse toiduga, mis võib olla ülekaalus hapete või leeliste sisaldusega või neutraalne (mõlemad sisalduvad selles võrdses koguses). Seega tekivad osade toodete seedimisel organismis valdavalt happed ja seetõttu nimetatakse neid hapet moodustavateks toodeteks, teisi aga seeditavateks, leelisteks ja seetõttu nimetatakse neid leelist moodustavateks toodeteks.
Toodete happeliste ja aluseliste omaduste kohta suur mõju pakub kuumtöötlust. Enamik värskeid toiduaineid põhjustab tarbimisel organismi sisekeskkonna pH nihke leeliselisele poolele. Kuid samad tooted, mis on läbinud kuumtöötluse (keetmine, küpsetamine jne), küllastavad juba sisekeskkonda hapetega, nihutades selle happelisele poolele. Pealegi võivad mõned tooted sisekeskkonda oluliselt mõjutada, teised aga mitte nii palju. Siit sai alguse toiduainete jagunemine tugevalt hapet ja nõrgalt hapet moodustavaks, samuti nõrgalt ja tugevalt aluselist moodustavaks.
Tugevalt hapet moodustav toodete hulka kuuluvad: liha ja lihatooted (vorst, sink, keedetud sealiha jne), kala, munad, juust, maiustused, valgest jahust tooted, alkohol ja kohv.
Nõrgalt hapet moodustava toodete hulka kuuluvad: kodujuust, hapukoor, pähklid, täisteratooted ja täisterajahutooted.
Nõrgalt aluseline toodete hulka kuuluvad mitmesugused kuivatatud puuviljad, pastöriseerimata piim ja seened.
Tugevalt leeliseline Toitude hulka kuuluvad: köögiviljad (juurviljad ja eriti lehtköögiviljad), värsked puuviljad, kartul ja salat.
Üldjuhul põhjustavad loomsed saadused organismi sisekeskkonna nihkumist happelisele poolele ja taimsed saadused aluselise poole.
Värske taimse toidu aluselist moodustavat toimet selgitab selles sisalduvate mineraalide kõrge sisaldus: kaalium, kaltsium, magneesium ja naatrium.
Oluline on mõista, mis juhtub kehas toodetavate hapetega ja kuidas need võivad tervist mõjutada.
Süsivesikuterikaste toitude seedimise käigus koguneb palju süsihapet (H2COZ). Süsihape on iseenesest ebastabiilne ja eksisteerib ainult lahustes, lagunedes kergesti veeks ja süsinikdioksiidiks. Sellest selgub, et rakusisesest süsivesikute toidust tekib vesi (elukeskkond) ning süsihape ja süsihappegaas on keskkonna pH regulaatorid, millest sõltub rakusiseste ensüümide aktiivsus. Loomulikult annavad süsivesikuid sisaldavad toidud kehale energiat.
Süsivesikute toitude omaduste osas tuleks erilist tähelepanu pöörata mineraalid sisaldub selle koostises. Niisiis, kaalium, mida leidub süsivesikute sisaldavates toiduainetes, soodustab vee eemaldamist kehast ja naatrium, vastupidi, aeglustab seda. Puu- ja juurviljad on peamiselt kaaliumisisaldusega toiduained ning teraviljad naatriumtoidud. Seetõttu tuleks ülaltoodud toodete kasutamisel säilitada tasakaal: 50% köögiviljade puhul puuviljadega ja teraviljade puhul kaunviljadega.
Mis puudutab seedimist valgurikas toit, mida peate teadma, et valk on süsivesikute ja lämmastiku kombinatsioon. Seedimise käigus jaguneb valk süsivesikute ja lämmastiku osadeks. Süsivesikute osa seeditakse edasi süsivesikuna ja lämmastikku sisaldavat osa kasutatakse kudede ehitamiseks. Keha suudab aga oma vajadusteks omastada vaid väikese osa toidust saadavast lämmastikust ning eemaldada piiratud koguses lämmastikku sisaldavaid aineid karbamiidi ja kusihappe kujul. Seega karbamiid ja kusihappe, jäädes kehasse kuni neerude kaudu eritumiseni, nihutavad happe-aluse tasakaalu happe poole. Kui inimene tarbib palju valgurikkaid toite, siis kogunevad tema kehasse uurea ja kusihape, põhjustades hapestumist.
Loomset päritolu valguproduktid sisaldavad ka palju väävlit ja fosforit, mis moodustavad teise eritatavate hapete rühma.
Selle tulemusena selgub, et peamiselt hapet moodustavate toiduainete tarbimisel muutub organism liigselt happeliseks. Keha sisekeskkond, selle pH nihkub normaalsetest, õigetest näitajatest ega suuda enam normaalselt läbi viia bioloogilisi reaktsioone – eluprotsessid on häiritud. Loodusarstide sõnul on see paljude haiguste peamine põhjus.
Niisiis, oleme välja selgitanud, mis on tervendav väärtus eraldi toiteallikas.
1. Toiduainete eraldamine ühel toidukorral võimaldab neid kergemini ja paremini seedida ja omastada. See säästab elujõudu organismi ja suunab need isetervenemisele. Ja haigus ise jätab toidust ilma, kõrvaldades selle esinemise ja kulgemise eeldused.
2. Valgusisaldusega toidu kvantitatiivse tarbimise vähendamine füsioloogiliselt vajalikud normid eemaldab kehalt tarbetu koormuse SDDP reaktsioonide näol, vähendab eritusorganite, eriti neerude koormust.
3. Leeliseliste omadustega toitude ülekaal toidus võimaldab ühtlustada ja normaliseerida organismi sisekeskkonda ning seeläbi luua õiged tingimused tervenemise ja jätkusuutliku tervise eest.
4. Kõrge energiapotentsiaaliga toitude söömine (Bircher-Benner soovitab 1. järku patareideks) ja tarbitava toidu üldkoguse vähendamine loob head eeldused energia suurendamiseks organismis ja selle puudumisega kaasnevatest haigustest edukalt vabanemiseks.
Kliinilised tõendid eraldi toitumise süsteemi tõhususe kohta.
Pärast seda, kui õige toitumise rajajad M. Bircher-Benner, G. Hay, M. Gerzon ja N. Walker said empiiriliselt teada, kuidas toitumise abil inimeste tervist ravida ja parandada, tekkis hulgaliselt järgijaid, kes oma tööd edukalt jätkasid. Dr Herbert Shelton levitas seda dieeti Ameerikas ja ravis edukalt, tuginedes sellele ja teistele loodusravi meetoditele. Euroopas tegi sama dr Ludwig Walb. Tema ja paljud teised arstid viidi läbi kliinilised uuringud mis kinnitas terapeutilise eraldi toitumise tõhusust.
1935. aastal lubati dr Walbi juurde ravile 11-aastane laps, kellel diagnoositi kortsus neer. Enne seda ravis teda tollal väga kuulus neeruhaiguste spetsialist, professor Wolgard. Kõik ravikatsed, sealhulgas kliimaravi Egiptuses, olid ebaõnnestunud ja professor hülgas patsiendi, arvestades sel juhul lootusetu.
Dr Walb viis poisi üle eraldi dieedile, millest ta täielikult taastus ja sai hiljem spordipiloodiks!
Kokku pöördus Valbi poole 120 "ravimatu" neeruhaigusega inimest. Pärast ravi õige toitumine 80% neist parandas oma seisundit ja mõned paranesid täielikult.
Kuidas seletada eraldi toitumise meetodi efektiivsust neerude ravis? Rakendus teatud tooted toitumine toob kaasa asjaolu, et tarbetu vesi ja sool erituvad kehast. Need kaks tegurit mõjutavad oluliselt südame ja neerude tööd. Koormuse vähendamine võimaldab neil alustada enesetervendamise protsessi. Seetõttu inimestele, kellel on krooniline neerupuudulikkus muudetakse eraldi toitumise süsteemi nii, et nad söövad peamiselt soola- ja valguvaest toitu. Lisaks on terapeutilise toitumise esimeses etapis liigse vee ja soola eemaldamiseks ette nähtud tooted, millel on looduslik diureetiline toime (kaaliumirikas).
Sellise toitumise tagajärjel veres väheneb ainete hulk, mis peaksid uriiniga erituma. Urineerimine suureneb. Valgu eritumine uriiniga toimub vastupidises suunas; kõrgendatud vererõhk neeruhaiguse tõttu väheneb. Südame töö paraneb, neerud taastuvad. Oluline on mitte alustada haigust siis, kui keha kaotab võime end ise ravida.
Südamehaigustega patsientide peamine ravi on eraldi toitumine. Leiti, et kõigi tõsiste südamehaigustega, sealhulgas infarkti ja insultiga, kaasneb organismi varjatud hapestumine. Eraldi toitumise kasutamine vähendab vere hüübimist, mõõdetuna "elavhõbeda väärtuse" väärtusega.
Dr Walb leidis, et kõigi vereringe- ja südamehaiguste puhul tuleks eelistada väikesed trikid toitu, vältige denatureeritud toite, kuna need küllastavad inimest vähem ja aeglasemalt ning seetõttu süüakse ka sisse suurel hulgal mis kahjustab vereringet ja südant.
Eraldi toitumise kasutamine enam kui 90% patsientidest suurenenud tase kolesterool veres põhjustab selle taseme langust ja sellele järgnevat normaliseerumist. Seega väheneb oluliselt ateroskleroosi ja selle tüsistuste, näiteks südame pärgarterite lupjumise risk.
Diabeeti põdev 54-aastane mees pidi töötamise lõpetama. Haiguse tõttu oli ta ühest silmast pime, teine silm nägi 50%. Peamise ravina kasutati eraldi toitumist. Nägemine paranes 6 nädala pärast. Insuliini annust vähendati poole võrra. Mõne aja pärast sai ta tööle asuda.
Dr Walb rääkis 55-aastasest mehest, kes kannatas 6 aastat diabeet. Laboratoorses uuringus leiti suurenenud summa suhkrut uriinis, oli selle patsiendi veresuhkru tase umbes 350 mg (norm on 110 mg). Tema päevane uriinieritus oli üle 6 liitri ja iga päev pidi ta süstima 50 ühikut. insuliini. Pärast eraldi dieedile üleminekut vähenes 4 kuu insuliinivajadus nulli ja uriini kogus oli 1,6 liitrit päevas (normaalne). Veresuhkru tase oli keskmiselt 150 mg ja seda uriinis ei tuvastatud.
Diabeediga patsiendid peaksid kasutama eraldi toitumise süsteemi modifitseeritud kujul. Need, kes vajavad insuliini, peaksid sööma rikas süsivesikute poolest(teravili, kartul), pärast hommikust ja õhtust insuliinisüsti. Vahepeal on soovitatav võtta väikesed portsjonid toit, mis koosneb värsketest köögiviljadest, puuviljadest, ürtidest. Selline toit leelistab keha.
Dr Walb näitas, et 200 diabeetikul, keda raviti tema kliinikus eraldi toidukordadega, vähenes umbes 4-6 nädala pärast suhkru tase uriinis 98% ja veresuhkru tase 90%. Insuliini tarbimine vähenes keskmiselt 37%. Lisaks taandusid vereringe halvenemisega seotud vaevused. Samas märgiti, et diabeetikud süstivad kõrgemalt standardühikud insuliini, võib saavutada käegakatsutavamaid tulemusi kui teised diabeetikud.
Suhkurtõvega patsientide jaoks eraldi toitumise kasutamine võib ravida veresoonkonna diabeetilisi kahjustusi. Selleks kõrvaldage keha hapestumine, süües aluselist toitu (värske, taimne). Sellele järgneb veresuhkru taseme langus normaalväärtuseni. Eraldi toitumisega ballastainete rohkus toob kaasa asjaolu, et mõned süsivesikute (glükoos) komponendid sisenevad verre aeglasemalt. Veresuhkur on madalam ja muutub sujuvalt, selle asemel, et kõikuda üles-alla, nagu see on rafineeritud süsivesikute toiduga (kooritud teraviljad, kartulid, küpsetised, suhkrust rääkimata).
1978. aastal uuris dr Walb 82 naist ja 51 meest, kelle keskmine vanus oli 53 aastat. Patsiendid põdesid erinevaid haigusi: kasvajad, allergiad, neeruhaigused, reuma, diabeet, vereringeelundite haigused ja seedeorganid. Vereanalüüs nelja nädala jooksul, kasutades eraldi dieeti, näitas, et tema andmed normaliseerusid keskmiselt 80%! Ja seda kõigest nelja nädala pärast!
Eraldi toitumise praktika.
Kui keha vabaneb mürkainetest, millega ta varem oli täidetud, siis tuju tõuseb ja inimesele avaneb uus rõõmus maailm.
Howard Hay
Eraldi toiteallika puhul tuleb järgida kolme olulist tingimust.
1. Õige valik toit.
Siin on vaja järgida dr Bircher-Benneri soovitusi - kasutada rohkem tooteid, mis on 1. järku akud. See on peamiselt värske taimne toit: köögiviljad (leht- ja juurviljad), puuviljad, pähklid. Erilist tähelepanu on vaja pöörata tähelepanu värskete mahlade kasutamisele, eriti esimesel etapil, et toksiinid kehast kiiresti välja uhtuda.
2. Keha leelistamine päeva jooksul.
Leelist moodustavad toidud on toidud, milles domineerivad mineraalid nagu naatrium, kaalium, kaltsium ja magneesium. Peamiselt on need värsked juur- ja puuviljad ning nendest valmistatud värsked mahlad.
Happemoodustajad on tooted, milles on ülekaalus fosfor, kloor ja väävel. See on enamasti teravili lihatooted, samuti tooteid, mis on läbinud kuumtöötluse (isegi samad köögiviljad, kuumtöödeldud, muutuvad hapet moodustavaks).
Keha usaldusväärseks leelistamiseks, mis on eriti väärtuslik paljude haiguste puhul, on vaja umbes 80%. päevane ratsioon süüa toorelt (värsked mahlad, köögiviljad, puuviljad, salatid, kergelt hautatud köögiviljad). Ja ainult 20% eraldatakse loomse päritoluga valgutoodetele (liha, kala, juust) ja teraviljale (teravili, leib). Praktika on näidanud, et suhe 70:30 on väga hea näitaja.
Millised toidud on “aluselisemad” ja millised “happelised”, saab näha allolevast tabelist.
Et säilitada organismis aluselist ülejääki ja seeläbi luua ravieeldusi, tuleks süüa suur kogus tabeli vasakus servas loetletud tooted. Happe liialduse korral sobivad tabeli paremal küljel märgitud tooted.
Tabel 1
3. Toidu eraldi tarbimise põhimõtte järgimine.
Juba varem on välja toodud, miks tuleb mõnda toitu teistest eraldi võtta. Kordan lühidalt, et see reegel aitab kaasa parem kursus seedimisprotsess, seeditud toidu assimilatsioon, säästmine elutähtsat energiat keha, mida kasutatakse tervendamisprotsessideks või keha tugevdamiseks.
Eraldi toitumise peamine saladus on teada, milline toiduained saab kombineerida ühe toidukorraga ja mida mitte.
Keelatud on segada leelis-liigseid tooteid happeliigsete toodetega ühes etapis.
Java skript keelatud – otsing pole saadaval...
Valkude seedimine seedetraktis
Valkude seedimine algab maos maoensüümide toimel. Seda eritub ööpäevas kuni 2,5 liitrit ja see erineb teistest seedemahladest tugevalt happelise reaktsiooni poolest, mis tuleneb mao limaskesta parietaalrakkude poolt eritatava vaba vesinikkloriidhappe olemasolust.
Vesinikkloriidhappe sekretsioon on aktiivne transport, mida viib läbi prootoni ATPaas koos ATP tarbimisega.
Vesinikkloriidhappe roll:
1. denatureerib valke;
2. steriliseerib toitu;
3. põhjustab vähelahustuvate valkude turset;
4. aktiveerib pepsinogeeni;
5. loob pepsiini toimeks pH-optimumi;
6. Soodustab raua imendumist;
7. põhjustab sekretiini eritumist kaksteistsõrmiksooles.
Maomahl sisaldab proteolüütilisi ensüüme pepsiini, gastriksiini ja renniini. Peamine neist on pepsiin. Seda toodavad mao limaskesta peamised rakud proensüümina pepsinogeeni. See aktiveeritakse vesinikkloriidhappega (aeglane) ja autokatalüütiliselt pepsiiniga (kiire), eraldades polüpeptiidahela fragmendi N-otsast (osaline proteolüüs). Sel juhul muutub molekuli konformatsioon ja moodustub aktiivne kese. Pepsiin toimib pH väärtustel 1,5–2,5 ja on suhteliselt spetsiifilise toimega endopeptidaas, mis lõhustab peptiidsidemeid valgumolekulis.
Lisaks pepsiinile sisaldab maomahl ensüümi gastriksiini, millel on pH 3,0–4,0 juures proteolüütiline aktiivsus. Ilmselt alustab just tema valkude seedimist.
Väikelaste maomahl sisaldab ensüümi renniini, millel on suur tähtsus imikute valkude seedimisel, sest. katalüüsib piima kalgendamist (lahustuva kaseinogeeni muutumist lahustumatuks kaseiiniks), mille tulemusena aeglustub lahustumatu kaseiini edasiliikumine kaksteistsõrmiksoole ja see puutub kauem kokku proteaasidega.
Maos pepsiini toimel tekkinud polüpeptiidid sisenevad kaksteistsõrmiksoole, kus eritub pankrease mahl. Pankrease mahlal on leeliseline reaktsioon (pH 7,5-8,2), mis on tingitud suurest bikarbonaatide sisaldusest. Maost tulev happeline sisu neutraliseeritakse ja pepsiin kaotab oma aktiivsuse.
Pankrease mahl sisaldab proteolüütilisi ensüüme trüpsiini, kümotrüpsiini, karboksüpeptidaasi ja elastaasi, mida toodetakse samuti proensüümide kujul. Trüpsinogeeni aktiveerib enterokinaas (mida toodavad limaskestarakud kaksteistsõrmiksool), läheb üle aktiivseks trüpsiiniks, mis aktiveerib kõik teised kõhunäärme ja soolemahla ensüümid. Pankrease rakke kaitseb proteaaside toime eest asjaolu, et maomahla ensüümid moodustuvad mitteaktiivsete lähteainetena ning kõhunäärmes sünteesitakse spetsiaalne trüpsiini inhibiitorvalk. Seedetrakti õõnsuses ei puutu proteaasid rakuvalkudega kokku, kuna limaskest on kaetud limakihiga ja iga rakk sisaldab välispind plasmamembraani polüsahhariidid, mida proteaasid ei lõhusta. Rakuvalkude hävitamine mao- või soolemahla ensüümide toimel toimub peptilise haavandiga.
Toiduvalkude proteolüüsi saaduste seedimine peensooles toimub amino-, di- ja tripeptidaaside abil, mis toimivad peamiselt parietaalses piirkonnas.
Seega on valgu seedimise lõpp-produktideks seedetraktis vabad aminohapped, mis imenduvad.