Биологическая роль сложных белков. Структура и функции сложных белков. Строение и функции миоглобина и гемоглобина
1. Особенности структуры простых и сложных белков
По составу белки делят на простые , состоящие только из аминокислотных остатков (протеины), и сложные (протеиды). Сложные могут включать ионы металла (металлопротеиды) или пигмент (хромопротеиды), образовывать прочные комплексы с липидами (липопротеины), нуклеиновыми кислотами (нуклеопротеиды), а также ковалентно связывать остаток фосфорной кислоты (фосфопротеиды), углевода (гликопротеины) или нуклеиновой кислоты (геномы некоторых вирусов).
1.1 Простые белки (протеины)
По ряду характерных свойств протеины разделяют на несколько групп.
Альбумины . Они растворимы в воде, свёртываются при нагревании, нейтральны, сравнительно трудно осаждаются растворами солей. Примерами их могут служить: альбумин белка куриного яйца, альбумин кровяной сыворотки, альбумин мускульной ткани, молочный альбумин.
Глобулины. Они нерастворимы в воде, но растворяются в очень слабых растворах солей. Примерами глобулинов могут служить: фибриноген, глобулин кровяной сыворотки, глобулин мускульной ткани, глобулин белка куриного яйца.
Гистоны. Белки основного характера. Находятся в виде нуклеопротеидов в лейкоцитах и красных кровяных шариках.
Протамины. Не содержат серы, обладают сравнительно сильными основными свойствами, дают кристаллические соли; содержатся (в виде нуклеопротеинов) в сперматозоидах рыб.
Проламины. Находятся в зернах различных хлебных злаков. Замечательной их особенностью является растворимость в 80% -ном спирте. Представителем этих бел- ов может служить глиадин, составляющий главную часть клейковины.
Склеропротеины. Нерастворимые белки, которые составляют наружный покров тела животного и находятся в скелете и в соединительной ткани. К ним относятся кератин, коллагены, эластин, фиброин.
Кератин является главной составной частью волос, рогов, копыт, ногтей, перьев и верхнего слоя кожи. По химическому составу кератин богат серой
Коллагены. Чрезвычайно распространены в живых организмах. Из коллагенов состоит соединительная ткань; они находятся в хрящах. Кости позвоночных животных состоят из неорганических веществ (фосфорнокислого и углекислого кальция), жира и коллагенов.
Эластин входит в состав жил и других эластичных веществ соединительной ткани.
1.2 Сложные белки (протеиды)
Протеиды являются сложными белками, состоящими из белковой и небелковой частей. Название протеида определяется названием его простетической группы). Так, нуклеиновые кислоты являются небелковой частью нуклеопротеидов, фосфорная к-та входит в состав фосфопротеидов, углеводы – гликопротеидов, а липиды – липопротеидов. Протеиды также можно подразделить на несколько групп.
Нуклеопротеиды. Имеют важное значение, т.к. их небелковая часть представлена ДНК и РНК. Простетическая группа представлена в основном гистонами и протаминами. Такие комплексы ДНК с гистонами обнаружены в сперматозоидах, а с гистонами – в соматических клетках, где молекула ДНК “намотана” вокруг молекул гистонов. Нуклепротеидами по своей природе являются вне клетки вирусы – это комплексы вирусной нуклеиновой к-ты и белковой оболочки – капсида.
Хромопротеиды. Являются сложными белками, простетическая группа которых представлена окрашенными соединениями. К хромопротеидам относятся гемоглобин, миоглобин (бело мышц), ряд ферментов (каталаза, пероксидаза, цитохромы), а также хлорофилл.
Гемоглобин (Hb) состоит из белка глобина и небелковой части гема, включающего атом Fe(II), соединенный с протопорфирином. Молекула гемоглобина состоит из 4-х субъединиц: двух a и двух b и соответственно содержит четыре полипептидные цепочки двух сортов. Каждая a-цепочка содержит 141, а b-цепочка – 146 аминокислотных остатков.
Атом железа может образовать шесть координационных связей. Четыре связи направлены к атомам азота пиррольных колец, оставшееся две связи – перпендикулярно к плоскости порфиринового кольца по обе его стороны. Гемы расположены вблизи поверхности белковой глобулы в специальных карманах, образованных складками полипептидных цепочек глобина. Гемоглобин при нормальном функционировании может находиться в одной из трех форм: феррогемоглобин (обычно называемый дезоксигемоглобином или просто гемоглобином), оксигемоглобин и ферригемоглобин (метгемоглобин). В ферригемоглобине железо находится в закисной форме Fe(II), одна из двух связей, перпендикулярных к плоскости порфиринового кольца, направлена к атому азота гистидинового остатка, называемого проксимальным (соседним), по другую сторону порфиринового кольца и на большем расстоянии от него находится другой гистидиновый остаток – дистальный гистидин, не связанный непосредственно с атомом железа. Взаимодействие молекулярного кислорода со свободным гемом приводит к необратимому окислению атома железа гема . Поэтому в дезоксигемоглобине глобин предохраняет железо от окисления.


При взаимодействии молекулярного кислорода с гемоглобином существует небольшая, но конечная вероятность окисления последнего: молекула O 2 не присоединяется, но окислит железо: Fe 2+ + O 2 Þ Fe 3+ + O 2 – . Поэтому при дыхании в эритроцитах непрерывно образуется метгемоглобин. Для его восстановления в эритроците существует специальная ферментативная система, восстанавливающая метгемоглобин и превращающая его в нормальный дезоксигемоглобин. При нарушении этой системы возникает тяжелое заболевание – метгемоглобинемия, при которой гемоглобин перестает быть переносчиком кислорода.
Присоединение кислорода меняет кислотно-основные свойства гемоглобина. Оксигемоглоин является более сильной кислотой, чем дезоксигемоглобин. Поэтому в тканях, где значительная часть гемоглобина теряет кислород и становится более сильным основанием, гемоглобин связывает образующуюся в ходе метаболических внутриклеточных процессов углекислоту. В альвеолах легких дезоксигемоглобин снова превращается в оксигемоглобин, становится более сильной кислотой и способствует отщеплению CO 2 . Углекислота, освобождаемая тканями, недостаточно хорошо растворима для эффективного переноса. С помощью фермента карбоангидразы, ускоряющего прямую и обратную реакцию:
CO 2 + H 2 O Û HCO 3 – + H + ,
Двуокись углерода превращается в хорошо растворимый бикарбонат-анион. В капиллярах тканей отщепление кислорода повышает содержание дезоксигемоглобина, связывающего протоны и смещающего равновесие реакции вправо. Легко растворимый ион бикарбоната переносится кровью. В альвеолах легких гемоглобин оксигенируется, протоны освобождаются и равновесие смещается влево. Образуется плохо растворимая двуокись углерода CO 2 , которая удаляется из водной фазы и выдыхается. Таким образом, гемоглобин работает как буфер с переменным значением pH. Функция гемоглобина как переносчика углекислоты не менее важна, чем его функция переноса кислорода.
Миоглобин. Хромопротеид, содержащийся в мышцах. Он состоит только из одной цепи, аналогичной субъединице гемоглобина. Миоглобин является дыхательным пигментом мышечной ткани. Он значительно легче гемоглобина связывается с кислородом, но труднее отдает его. Миоглобин создает запасы кислорода в мышцах, где его количество может достичь 14% всего кислорода организма. Это имеет важное значение, особенно для работы мышц сердца. Высокое содержание миоглобина обнаружено у морских млекопитающих (тюленя, моржа), что позволяет им длительное время находиться под водой.
Гликопротеиды. Представляют собой сложные белки простетическая группа которых образована производными углеводов (аминосахарами, гексуроновыми кислотами). Гликопротеиды входят в состав клеточных мембран. Так, легочные стенки бактерий построены из пептидогликанов, являющихся производными линейных полисахаридов, несущих ковалентно связанные с ними пептидные фрагменты. Эти фрагменты осуществляют сшивание полисахаридных цепей с образованием механически прочной сетчатой структуры. Например, клеточная стенка E . coli построена из полисахаридных цепей, образованных остатками N-ацетилглюкозамина, связанными b-(1®4)связями, причем каждый второй остаток несет присоединенный к нему по атому С3 фрагмент, образованный связанными амидными связями остатками молочной кислоты, L-аланина, D-глутамата (через g-карбоксил), мезодиаминонимелината и D-аланина:

Каждая С-концевая группа этого пептида, принадлежащая остатку D-аланина, образует амидную связь с аминогруппой остатка диаминонимиелиновой кислоты, принадлежащей соседней полисахаридной цепи.
Кроме вышеприведенной функции гликопротеиды участвуют в транспорте различных веществ, в процессах свертывания крови, иммунитета, являются составными частями слизи и секретов желудочно-кишечного тракта. У арктических рыб гликопротеиды играют роль антифризов – веществ, препятствующих образованию кристаллов льда внутри их организма.
Фосфопротеиды. Имеют в качестве небелкового компонента фосфорную к-ту. Представителями данных белков являются казеиноген молока, вителлин (белок желтков яиц), ихтулин (белок икры рыб). Такая локализация фосфопротеидов свидетельствует о важном их значении для развивающегося организма. У взрослых форм эти белки присутствуют в костной и нервной тканях.
Липопротеиды. Сложные белки, простетическая группа которых образована липидами. По строению это небольшого размера (150-200 нм) сферические частицы, наружная оболочка которых образована белками (что позволяет им передвигаться по крови), а внутренняя часть – липидами и их производными. Основная функция липопротеидов – транспорт по крови липидов. В зависимости от количества белка и липидов, липопротеиды подразделяются на хиломикроны, липопротеиды низкой плотности (ЛПНП) и высокой плотности (ЛПВП), которые иногда обозначаются как a- и b-липопротеиды.
Хиломикроны являются наиболее крупными из липопротеидов и содержат до 98-99% липидов и только 1-2% белка. Они образуются в слизистой оболочки кишечника и обеспечивают транспорт липидов из кишечника в лимфу, а затем в кровь.
В ЛПНП количество белка составляет 9-20% , а среди липидов преобладают холестерин и триацилглицерины (до 40%). Белковая часть ЛПВП колеблется в пределах 35-50%, а белковая представлена фосфолипидами и холестерином. Таким образом, холестерин транспортируется по крови в составе липопротеидов, особенно ЛПНП.
2. Химические основы домашнего приготовления пищи
Белки . При температуре 70 0 С происходит коагуляция (свертывание) белков. Они теряют способность удерживать воду (набухать), т.е. из гидрофильных становятся гидрофобными, при этом уменьшается масса мяса, рыбы и птицы. Частично разрушается третичная и вторичная структура белковых молекул, часть белков превращается в полипептидные цепочки, что способствует лучшему их расщеплению протеазами желудочно-кишечного тракта.
Белки, находящиеся в продуктах в виде раствора, при варке свертываются хлопьями и образуют пену на поверхности бульона. Коллаген и эластин соединительной ткани превращаются в глютин (желатин). Общие потери белка при тепловой обработке составляют от 2 до 7%.
Превышение температуры и времени обработки способствует уплотнению мышечных волокон и ухудшению консистенции изделий, особенно приготовленных из печени, сердца и морепродуктов. При сильном нагреве на поверхности продукта происходит деструкция крахмала, и идут реакции между сахарами и аминокислотами с образованием меланоидов, которые придают корочке темный цвет, специфический аромат и вкус.
Мясопродукты при варке и жаренье в результате уплотнения белков, плавления жира и перехода в окружающую среду влаги и растворимых веществ теряют до 30-40% массы. Наименьшие потери свойственны панированным изделиям из котлетной массы, так как выпрессованная белками влага удерживается наполнителем (хлебом), а слой панировки препятствует ее испарению с обжариваемой поверхности.
Жиры . При нагреве жир из продуктов вытапливается. Пищевая ценность его снижается из-за распада жирных кислот. Так, потери линолевой и арахидоновой кислот составляют 20-40%. При варке до 40% жира переходит в бульон, часть его эмульгирует и окисляется. Под действием содержащихся в бульоне кислот и солей эмульгированный жир легко разлагается на глицерин и жирные кислоты, которые делают бульон мутным, придают ему неприятный вкус и запах. В связи с этим варить бульон следует при умеренном кипении, а скапливающийся на поверхности жир надо периодически удалять.
Глубокие изменения жира происходят при жаренье. Если температура сковороды превышает 180 0 С, то жир распадается с образованием дыма, при этом резко ухудшаются вкусовые качества продуктов. Жарить продукты следует при температуре на 5-10 0 С ниже температуры дымообразования.
При жаренье основным способом жир теряется за счет его разбрызгивания. Это связано с бурным испарением воды при нагревании жира более 100 0 С. Потери жира при разбрызгивании называются угаром, и они значительные у жиров, в состав которых входит много воды (маргарин), а также при жаренье увлажненных продуктов (сырой картофель, мясо и др.). Общие потери жира меньше у панировочных изделий.
Самые значительные химические изменения жиров наблюдаются при жаренье во фритюре. В результате гидролиза, окисления и полимеризации накапливаются вредные соединения, придающие жиру неприятный запах и прогорклый вкус. Токсические продукты термического окисления жиров (альдегиды и кетоны) адсорбируются на поверхности обжариваемых изделий. Кроме того, жир загрязняется частицами попадающего в него продукта.
Для предупреждения нежелательных изменений жира используют фритюрницы, в нижней части которых имеется так называемая холодная зона, где температура жира значительно ниже, и попадающие туда частицы продукта не сгорают. Для предохранения фритюра от порчи используют ряд технологических приемов: фритюр периодически процеживают, руки и инвентарь смазывают растительным маслом, предназначенные для жаренья во фритюре изделия не панируют в сухарях.
Углеводы . При нагревании крахмала с небольшим количеством воды происходит его клейстеризация, которая начинается при температуре 55-60 0 С и ускоряется с повышением температуры до 100 0 С. При тепловой обработке картофеля клейстеризация крахмала происходит за счет влаги, содержащейся в самом картофеле.
При выпечке изделий из теста крахмал клейстеризуется за счет влаги, выделяемой свернувшимися белками клейковины. Аналогичный процесс происходит при варке предварительно набухших в воде бобовых. Крахмал, содержащийся в сухих продуктах (крупах, макаронных изделиях), клейстеризуется при варке за счет поглощения влаги окружающей среды, при этом масса продуктов увеличивается.
Сырой крахмал не усваивается в организме человека, поэтому все крахмалосодержащие продукты употребляют в пищу после тепловой обработке. При нагревании крахмала свыше 110 0 С без воды крахмал расщепляется до декстринов, которые растворимы в воде. Декстринизация происходит на поверхности выпекаемых изделий при образовании корочки, при пассеровании муки, поджаривании крупы, запекании макаронных изделий.
Тепловая обработка способствует переходу протопектина, скрепляющего растительные клетки между собой, в пектин. При этом продукты приобретают нежную консистенцию и лучше усваиваются. На скорость превращения протопектина в пектин влияют следующие факторы:
· свойства продуктов: у одних протопектин менее устойчив (картофель, фрукты), у других более устойчив (бобовые, свекла, крупы);
· температура варки: чем она выше, тем быстрее идет превращение протопектина в пектин;
· реакция среды: кислая среда замедляет этот процесс, поэтому при варке супов картофель нельзя закладывать после квашеной капусты или других кислых продуктов, а при замачивании бобовых нельзя допускать их закисания.
Клетчатка – основной структурный компонент стенок растительных клеток – при тепловой обработке она набухает и становится пористее.
Витамины . Жирорастворимые витамины (А, D, E, K) при тепловой обработке сохраняются хорошо. Так, пассерование моркови не снижает ее витаминной ценности, наоборот, растворенный в жирах каротин легче превращается в витамин А. Такая устойчивость каротина позволяет длительное время хранить пассерованные овощи в жирах, хотя при длительном хранении витамины частично разрушаются за счет воздействия на них кислорода воздуха.
Водорастворимые витамины группы В устойчивы при нагревании в кислой среде, а в щелочной и нейтральной среде разрушаются на 20-30%, частично они переходят в отвар. Самые большие потери тиамина и пиридоксина имеют место при комбинированном нагреве (тушении и др.). Высокая сохранность с кратковременной тепловой обработкой и незначительным количеством вытекающего сока. Наиболее устойчив к нагреванию витамин РР.
Сильнее всего при тепловой обработке разрушается витамин С за счет окисления его кислородом воздуха, этому способствуют следующие факторы:
· варка продуктов при открытой крышке;
· закладка продуктов в холодную воду;
· увеличение сроков тепловой обработки и длительное хранение пищи в горячем состоянии на мармите;
· увеличение поверхности контакта продукта с кислородом (измельчение, протирание).
Кислая среда способствует сохранению витамина С. При варке он частично переходит в отвар. При жаренье картофеля во фритюре витамин С разрушается меньше, чем при жаренье основным способом.
Минеральные вещества . Максимальные потери (25-60%) минеральных веществ (калия, натрия, фосфора, железа, меди, цинка и др.) происходят при варке в большом количестве воды за счет перехода их в отвар. Вот почему отвары из экологически чистых овощей используют для приготовления первых блюд и соусов.
Обобщенные величины потерь пищевых веществ при тепловой кулинарной обработке продуктов, %
| Продукты |
Углеводы |
Минеральные вещества |
Витамины |
Энергети-ческая ценность |
||||||||||
| B-каротин |
||||||||||||||
| Растительные |
||||||||||||||
| Животные |
||||||||||||||
| В среднем |
||||||||||||||
Красящие вещества . Хлорофилл зеленых овощей при варке под действием кислот разрушается с образованием буроокрашенных веществ. Антоцианы сливы, вишни, черной смородины, а также каротин моркови и томатов устойчивы к тепловой обработке. Пигменты свеклы приобретают бурый цвет, поэтому для сохранения ее яркого цвета создают, кислую среду и повышенную концентрацию отвара. Мясо меняет окраску с ярко-розовой на серую вследствие изменения гемоглобина.
Максимальные потери пищевых веществ наблюдается при варке основным способом по сравнению с другими видами тепловой обработки продуктов. Усложнение технологии (измельчение, протирание сырых и отварных продуктов, тушение) также способствует потери питательных веществ.
Наиболее рациональными с точки зрения сохранения ценных пищевых веществ тепловыми обработками являются: для растительных продуктов - варка без слива отвара и варка в кожуре; для животных - тушение, запекание, использование мяса в виде котлет, особенно паровых.
Список использованных источников и литературы
1. Гуськова, Е.В. Биохимия в товароведении [Текст]: учеб. метод. комплекс / Е.В. Гуськова; Челяб. ин-т (фил) ГОУ ВПО «РГТЭУ».- Челябинск: [б.и.], 2008. – 52 с.
2. Марри, Р., Греннер, Д., Мейес, П., Родуэлл, В. Биохимия человека. В 2-х томах. Том 1. Перевод с англ.: - М.: Мир, 1993. – 384 с.
3. Митякина, Ю.А. Биохимия [Текст]: учеб. пособие / Ю.А. Митякина – М.: РИОР, 2005. – 113 с.
4. Нечаев, А.П. Пищевая химия [Текст] / А.П. Нечаев, С.Е. Траубенберг и др. – СПб.: ГИОРД, 2003. – 640 с.
ВОЕННО-МЕДИЦИНСКАЯ АКАДЕМИЯ
Экз №__
Кафедра клинической биохимии и лабораторной диагностики
«УТВЕРЖДАЮ»
ИО начальника кафедры
клинической биохимии и
лабораторной диагностики
полковник медицинской службы
В.ПАСТУШЕНКОВ
«___» _____________ 2008 г.
доцент кафедры клинической биохимии и лабораторной диагностики
доктор медицинских наук В.АНТОНОВ
_____________________________________________________________________
должность, ученая степень, ученое звание, воинское звание, инициал имени, фамилия автора (авторов)
ЛЕКЦИЯ № 4
по дисциплине: «Биохимия»
___________________________________________________________
(наименование учебной дисциплины)
на тему: «Биохимия простых и сложных белков. Структура и функция нуклеиновых кислот. Молекулярная биология гена. Генная инженерия »
________________________________________________
(наименование темы занятий по тематическому плану изучения дисциплины)
с курсантами и студентами 2 курса факультетов подготовки врачей
(военно-медицинских специалистов иностранных армий)
Обсуждена и одобрена на заседании кафедры
«____» ____________ 200___ г.
Протокол №______
Уточнено (дополнено):
«____» ____________ 200___ г.
_____________________________________
(воинское звание, подпись, инициал имени, фамилия)
Лекция на тему : «Биохимия простых и сложных белков. Структура и функция нуклеиновых кислот. Молекулярная биология гена. Генная инженерия»
Учебные групп : курсанты и слушатели II курса ФПВ
Цель лекции : Рассмотреть вопросы строения, функции, классификации простых и сложных белков, структуру и функцию нуклеиновых кислот. Молекулярные аспекты биологии гена. Дать представление о генной инженерии
Время лекции : 2 часа
План лекции.
Введение.
Классификация сложных белков, общая характеристика структуры и функции.
Нуклеиновые кислоты
Генная инженерия
Заключение
Введение
Простые белки построены только из аминокислот. Сложные белки построены из двух компонентов - простой белок и небелковое вещество, называемое простетической группой. Простетические группы прочно связаны с белковой частью молекулы.
Классификация сложных белков
Классификация сложных белков зависит от строения простетической группы.
Гликопротеины (содержат углеводы).
Липопротеины (содержат липиды).
Фосфопротеины (содержат фосфорную кислоту).
Хромопротеины (содержат окрашенную простетическую группу).
Металлопротеины (содержат ионы различных металлов).
Нуклеопротеины (содержат нуклеиновые кислоты).
Гликопротеины. Простетические группы этих белков представлены углеводами и их производными.
Гликопротеины содержат от 1 до 30 % углеводов, которые прочно связаны с белковой частью молекулы. Они представлены различными моносахаридами, их ацетил-амино-производными, дезоксисахаридами, нейраминовыми и сиаловыми кислотами. Они могут быть также представлены линейными или разветвленными олигосахаридами.
Функции гликопротеинов:
большинство белков на внешней поверхности животных клеток (рецепторы);
большая часть синтезируемых клеточных белков (интерфероны);
большая часть белков плазмы крови (кроме альбуминов):
иммуноглобулины;
групповые вещества крови;
фибриноген, протромбин;
гаптоглобин, трансферин;
церулоплазмин;
мембранные ферменты;
гормоны (гонадотропин, кортикотропин).
Связь между углеводными компонентами и белковой частью в гликопротеинах ковалентно-гликозидная, через ОН группы серина, треонина, или NH группу лизина, аспарагина, глутамина.
Липопротеины - сложные белки. Их простетическая группа представлена разнообразными липидами. Существует несколько классов липидов. Каждый из них выполняет специфическую биологическую функцию:
Структурную (например в составе цитоскелета);
Транспортную (например транспортные и плазменные липопротеины).
Фосфопротеины - сложные белки. Их простетическая группа представлена фосфорной кислотой. Остатки фосфата соединяются с белковой частью молекулы сложноэфирными связями через гидрокси-группы аминокислот серина и треонина.
К фосфопротеинам относятся казеины - белки молока, вителлины - яичного желтка, овальбумин - белок куриного яйца. Большое количество их содержится в ЦНС. Многие важные ферменты клетки активны только в фосфорилированной форме. Фосфопротеины являются источником энергетического и пластического материала.
Металлопротеины кроме белка содержат ионы одного или нескольких металлов. Ионы металлов соединены координационными связями с функциональными группами белка.
Пример металлопротеинов:
ферритин, трансферрин - Fe;
алкогольдегидрогеназа - Zn;
цитохромоксидаза - Cu;
протеиназы - Mg, К;
АТФ-аза - Na, К, Са, Мg.
Как правило, металлопротеины - ферменты. Ионы металлов выполняют следующие функции:
являются активным центром фермента;
служат мостиком между активным центром фермента и субстратом, сближают их;
служат акцепторами электронов на определенной стадии ферментативной реакции.
Нуклеопротеины - это сложные белки, небелковым компонентом которых являются нуклеиновые кислоты - ДНК (дезоксирибонуклеиновая кислота) или РНК (рибонуклеиновая кислота).
Нуклеиновые кислоты
Молекулы нуклеиновых кислот заряжены отрицательно, поэтому они образуют с положительно заряженными белковыми компонентами ионные связи.
Нуклеиновые кислоты - линейные (реже - циклические) гетерополимеры, их мономерами являются мононуклеотиды. Мононуклеотид состоит из трех частей:
азотистого основания (у всех нуклеиновых кислот);
пентозы (рибозы у РНК или дезоксирибозы у ДНК) - вместе они составляют нуклеозид;
остатка фосфорной кислоты. Номенклатура различных мононуклеотидов представлена в таблице.
Номенклатура нуклеотидов.
Мономеры, из которых потом строятся нуклеиновые кислоты, состоят из азотистого основания, остатка сахара (дезоксирибоза или рибоза) и фосфата. Сахара вместе с азотистым основанием называются нуклеозидами (аденозин, гуанозин, тимидин, цитидин). Если к ним присоединены 1-, 2-, или 3-фосфорных остатка, то вся эта структура называется Соответственно, нуклеотизид монофосфатом, дифосфатом или трифосфатом или нуклеотидом (аденин, гуанин, тимин, цитозин).
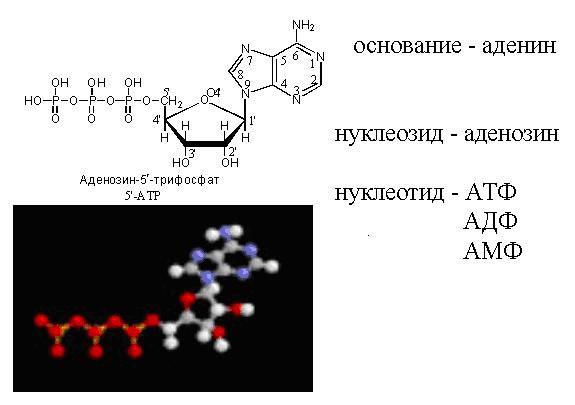
Модель АТФ в плоскости и пространстве.
ТМФ встречается только в ДНК, а УМФ - только в РНК. Если в составе мононуклеотида имеется дезоксирибоза, то в начало его названия добавляется приставка "дезокси".

В составе нуклеиновых кислот мононуклеотиды связаны 3, 5-фосфодиэфирными связями между рибозами (дезоксирибозами) соседних мононуклеотидов через остаток фосфорной кислоты. Поэтому, если молекула нуклеиновой кислоты не является циклической, концы ее различны.
Один из них обозначается как 3-конец, а другой - 5-конец. Начальным считается 5-конец.

Первичная структура ДНК
Как любой полимер, молекула ДНК обладает первичной структурой, образованной уникальной последовательностью чередования 4 видов мономеров: азотистых оснований, 2 из которых являются пуринами, а 2 - пиримидинами, соединенными гомополимерной сахарофосфатной цепью. Фосфоэфирные связи последовательно соединяют З"-атом углерода остатка дезоксирибозы каждого предыдущего нуклеотида с 5"-атомом углерода последующего, создавая непрерывный ковалентно-связанный остов молекулы. Последовательность азотистых оснований и является собственно генетической матрицей, на которой при помощи триплетного кода записана вся наследственная информация организма. Весьма условно можно провести аналогию между такого типа кодировкой и буквами алфавита, в определенной очередности образующих слова и фразы. Хотя в генетическом словаре всего четыре буквы, но их оказывается достаточно для шифрования последовательности 20 различных аминокислот, из которых состоят все будущие белковые молекулы - конечные продукты функционирующих генов. Таким же образом закодированы регуляторные участки генома -промоторы и энхансеры, старт- и стоп-кодоны и др.
Стабильность первичной структуры молекулы ДНК позволяет клеткам из поколения в поколение сохранять уникальную для каждого организма наследственную информацию (генотип). Изменения в последовательности чередующихся азотистых оснований (мутации) могут приводить к возникновению ошибок в наследственной информации, различные возможные последствия которых описаны ниже.
Строго говоря, первичная структура ДНК, обладая значительным консерватизмом, все же не является постоянной. Открытие мобильных диспергированных генов, транспозонов показало, что отдельные участки молекулы способны перемещаться вдоль цепи в процессе нормального функционирования и дифференци-ровки клеток, меняя при этом первичную структуру молекулы. Особенно такие перестройки характерны для клеток лимфоидной ткани: с ними связана терминальная дифференцировка наивных лимфоцитов, приводящая к появлению клонов узко специализированных иммунокомпетентных клеток. Неслучайность таких участков и дискретность генетической информации позволяют в ходе подобных перемещений сохранить целостность генома.
С другой стороны, некоторые вирусы (ретро-, аденовирусы и др.) способны встраивать в ДНК-клетки хозяина дополнительные элементы, а также перетаскивать участки генов или целые гены из одного локу-са молекулы ДНК в другие. Действие ионизирующей радиации, химических канцерогенов и мутагенов, ошибки в процессе репликации ДНК также приводят к изменениям в первичной структуре молекулы. Такие изменения носят, как правило, случайный характер и потому изменяют целостность генома и представляют собой соматические мутации. Последствия таких изменений не однозначны.
Если мутация возникла в «бессмысленном» участке ДНК, она, как правило, носит безразличный характер. Такой же характер имеют мутации, возникающие в конститутивно репрессированных генах. Понятие конститутивной репрессии тканеспецифично и связано с особенностями клеточной дифференцировки, в связи с чем ген, репрессированный в клетках определенного типа, может оказаться функционально значимым в клетках другого гистогенеза. К примеру, терминальная (унаследованная, т. е. присутствующая во всех клетках данного организма) мутация генов BRCA 1/2 обусловливает чрезвычайно высокий риск раннего развития рака молочной железы или яичника, но никак не проявляется в клетках прочих тканей.
Если мутация затронула функционирующий ген, то ее последствия не могут носить безразличного характера, однако они и в этом случае не однозначны: при изменении последовательности оснований в регуляторных участках гена может наблюдаться как ослабление его экспрессии вплоть до полного отключения (нокаут гена), так и аномальная активация (гипер- или, оверэкспрессия) вплоть до приобретения постоянной нерегулируемой активности. Наконец, мутация в «смысловой» части гена, кодирующей определенный белковый продукт (миссенс-мутация), может вызвать появление измененного белка. В свою очередь, измененный белковый продукт по функциональным свойствам может полностью соответствовать белку «дикого» типа: либо иметь сниженную специфическую ак-| тивность; либо, напротив, гиперактивность; либо, наконец, приобретать иной, не свойственный белку «дикого» типа, вид активности. Таким образом, в зависимости от совокупности многих факторов соматические мутации могут приво-I дить как к снижению жизнеспособности клетки, оста-I новке ее деления и гибели, так и, напротив, к ее усиленному росту и делению вплоть до опухолевой транс формации.
Вторичная структура ДНК
Вторичная структура ДНК представлена двойной спиралью, модель которой была открыта более полувека назад будущими Нобелевскими лауреатами (премия присуждена именно за это открытие) Джеймсом Уотсоном и Френсисом Криком. Согласно этой модели молекула нативной ДНК представляет собой две зеркально отраженные (в отношении комплементарных друг другу пуриновых и пиримидиновых азотистых оснований) антипараллельные (5"-конец одной цепи соседствует с 3"-концом другой) цепи, соединенные друг с другом силами комплементарного взаимодействия. Важнейшее свойство ДНК - избирательность в образовании связей (комплементарность). Размеры оснований и двойной спирали подобраны в природе таким образом, что тимин (Т) образует водородные связи только с аденином (А), а цитозин (С) - только с гуанином (G) .

Водородные связи не являются ковалентными, а потому могут быть относительно легко разрушены, что приводит к расхождению обеих нитей - денатурации в молекулы.ДНК. Этот процесс (локальная денатурация) абсолютно необходим для выполнения молекулой ДНК матричных функций, а также репликации самой молекулы.
В составе 2-нитевой (2-цепочечной) молекулы обе нити ДНК являются правозакрученными спиралями с общей осью: азотистые основания обращены внутрь молекулы, образуя гидрофобную зону, а обе сахаро-фосфатные цепи расположены периферически (плектонемическая спираль). Хорошо известны несколько канонических форм двойной спирали, различающихся геометрическими размерами. Классическая В-форма, модель которой предложена Уотсоном и Криком в 1953 г., имеет следующие характеристики: один виток правозакрученной молекулы содержит 10 пар нук-леотидов, длина его проекции на ось составляет 34 А (ангстрем), диаметр (по атомам фосфора) - 18 А; молекула имеет большую и малую боковые бороздки с поперечником 17 и 11 А соответственно.

Три представления двунитевой молекулы ДНК:
а и б - классические изображения двуспиральной ДНК;
в - ДНК как двухцепочечная структура с неопределенными физическими параметрами, но с цепями, комплементарными друг другу;
А, С, G, Т - мономерные звенья полимерной молекулы ДНК;
C-G, Т-А - комплементарные пары оснований, связывающие две цепи
Такая форма молекулы существует в препаратах, уровень влажности которых близок к физиологическому. При частичном обезвоживании ДНК переходит в А-форму, в которой один виток содержит уже 11 пар оснований, проекция витка на ось составляет 28 А, диаметр уменьшается на 1 А, а ширина обеих бороздок сравнивается. С-форма, образующаяся в присутствии солей лития, напротив, является более рыхлой, чем В-форма: виток содержит 9 нуклеотидньгх пар. Абсолютно уникальна открытая относительно недавно левоза- крученная Z-форма ДНК, содержащая 12 нуклеотидов на 1 виток. В пределах канонических форм возможно существование определенных промежуточных вариантов, переходы между которыми осуществляются не кооперативно, в отличие от кооперативных переходов от одной канонической формы к другой.
Конформационные переходы на отдельных участках гигантской молекулы ДНК важны для высших уровней организации и функционирования хроматина и будут обсуждаться в соответствующем раз-деле. Здесь же следует отметить, что наличие двойной спирали в любой из канонических форм возможно не только при участии 2 нитей, но и на отдельном участке 1-нитевой молекулы, однако при условии, что этот участок будет нести палиндромную последовательность, т. е. симметрично отраженную последовательность комплементарных оснований, например «...ATCAG...CTGAT...». В таком участке 2-нитевой молекулы ДНК может образовываться «шпилька» или «крест», представляющие собой симметричный дуплексный отросток, ось которого перпендикулярна основной оси молекулы. Обратимое образование «шпилек», «креста» и конформационные переходы молекулы, играет определенную роль в регулировании активности отдельных генов.
Структуры ДНК высших порядков организации
В предыдущих разделах кратко описана структура собственно молекулы ДНК вне ее связи с другими компонентами хроматина. Все последующие уровни организации этого биополимера охватывают структуру супрамолекулярного комплекса ДНК.
В составе хроматина молекула ДНК находится во взаимодействии с большим количеством белков (массовое соотношение ДНК:белок в ядрах разных клеток различается, но в среднем близок к соотношению 1:1 - 1:2), которые делят на 2 неодинаковые группы гистоны и негистоновые белки хроматина. Гистоны (белки основного характера, растворимые в кислотах) составляют большую часть (до 80 %) суммарных ядерных белков, негистоновые белки (кислые, нейтральные и некоторые слабо основные) составляют количественно меньшую часть ядерных белков, но объединяют в своей группе значительно большее разнообразие структурных, ферментативных и регуляторных белковых компонентов хроматина.
Структура нуклеогистонового комплекса хорошо изучена и определяется 2 уровнями его организации: нуклеосомным и нуклеомерным. Нуклеосомы представляют собой нуклеопротеидные частицы диаметром 10 нм, состоящие из центральной (коровой) белковой частицы с соленоидоподобной укладкой дву-нитевой молекулы ДНК на ее поверхности. Коровая частица является октамером 4 гистонов (у человека - гистоны Н2а, Н2Ь, НЗ и Н4), по 2 молекулы каждого на 1 частицу. Длина участка ДНК, непосредственно контактирующая с коровой частицей, составляет 140 пар нуклеотидов (п.н.), что соответствует молекулярной массе (ММ) ок. 100 кДа. ДНК, контактирующая с ко-ровыми частицами, стерически защищена от действия эндонуклеаз. Молекула ДНК образует на поверхности коровой частицы 2 витка, после чего, не обрываясь, переходит на следующую коровую частицу. Длина свободного участка ДНК между соседними коровыми частицами (линкер) оценивается в 30-60 п.н. (10-20 нм). Морфологически нуклеосомный уровень организации хроматина выглядит, как «бусинки на нитке».

Схема организации хроматина и N-i гистона НЗ человека (а), возможные сайты посттрансляционных модификаций гистонов НЗ и Н4 (б).
На поверхности нуклеосомы N-конец гистона Н и концы других гистонов, представлены в виде коне тивного домена; на схеме гистона НЗ отмечены мес: иболее распространенных посттрансляционных мо; каций: ацетилирование (флажок), фосфорилирован (кружок) и метилирование (шестиугольник), вполне можны и некоторые модификации в глобулярном до: Обращает на себя внимание пространственная per ность мест модификаций, звездочка указывает на тс Lys-9 может быть как ацетилирован, так и метилирован.
С линкером ассоциирован гистон HI, защающий свободный вненуклеосомный участок ДН действия эндонуклеаз и имеющий значение для фо рования следующего уровня организации хромати нуклеомеров, которые являются олигоме нуклеосом, образующими супербидную (от англ. i beads - большие шары) спираль. Нуклеомерная организация свойственна транскрипционно неактивному хроматину и обеспечивает его высокий уровень пактизации и защиты от нуклеазного расщепления.
Присутствие нуклеосом в промоторных участках генов препятствует образованию инициаторного комплекса транскрипции, в состав которого входят РНК-полимераза и факторы транскрипции, и для инициации транскрипции необходимо локальное разрушение нуклеосомной структуры хроматина в окрестностях промотора и регуляторных элементов. При этом конститутивно транскрибируемые гены вовсе не имеют нуклеосомной структуры в промоторной области.
Не вполне ясен механизм, посредством которого поддерживается непрерывное существование участка в виде свободной от нуклеосом последовательности ДНК: либо факторы транскрипции успевают провза-имодействовать с промоторным участком еще до сборки нуклеосом, либо эти факторы связываются с соответствующими участками ДНК, содержащими нуклеосомы, и дестабилизируют последние. В пользу такого предположения свидетельствует способность коровых гистонов к многочисленным обратимым модификациям: фосфорилированию, ацетилированию, метилированию - которые вызывают конформационные изменения молекул и соответственно изменение белок-белковых взаимодействий. В частности, химическая модификация консервативных доменов гистонов НЗ и Н4 вызывает дестабилизацию корового октамера, который диссоциирует с освобождением 2 димеров Н2а/Н2Ь; димеры же НЗ/Н4 сохраняют связь с ДНК, но структурно не препятствуют прохождению репли-кативного или транскрипционного комплексов.
Таким образом, обратимая сборка-разборка нуклеосом является регуляторным элементом функциональной активации генов, а хранение транскрипцион-но неактивного хроматина в форме супербидной спирали хромомеров предотвращает риск нуклеазного переваривания генетического материала.
; Значительно менее изучены взаимоотношения ДНК с негистоновыми белками хроматина. В первую очередь, это связано с огромным количеством негистоновых белков, часть которых обладает видовой и тканевой специфичностью. По данным двухмерного электрофореза, число негистоновых белков ядра превышает 450, включая модифицированные формы, однако это количество учитывает только мажорные фракции, доступные визуализации при существующих методах неспецифического окрашивания электрофореграмм. учетом минорных белковых компонентов клеточно го ядра реальное количество негистоновых белков хроматина может измеряться тысячами.
До сих пор отсутствует единая классификация негистоновых белков, для их классификации используют прочность их связи с хроматином (экстрагируемость), физико-химические (растворимость, изоэлектричес-кая точка, молекулярная масса, подвижность при электрофорезе и др.), функциональные свойства, ферментативную активность.
Часто негистоновые белки классифицируют на основании способа их выделения из препаратов тотального хроматина в растворах различной ионной силы и с содержанием разных диссоциирующих агентов. Так, до 10 % негистоновых белков может быть извлечено из хроматина экстракцией 0,35 М NaCl (глобули-новая фракция хроматина); до 90 % негистоновых белков удаляются обработкой ядер 2,0 М NaCl с 5 М мочевины или 37 %-ным раствором гуанидин-хлорида. Большая часть остаточных после такой экстракции белков может быть отделена додецилсульфатом натрия (SDS), 2-меркаптоэтанолом и щелочью. Однако и после такой обработки с ДНК остается связанной небольшое количество белка, который не удаляется даже при депротеинизации ДНК фенолом или хлороформом. Следовательно, взаимоотношения ДНК с разными негистоновыми белками неравнозначны, и говорить о нативной структуре супрамолекулярного комплекса хроматина можно только с позиции сохранения интактности тех или иных взаимодействий в конкретных препаратах изолированного хроматина.
Из всего многообразия негистоновых белков хроматина следует выделить компоненты ядерного матрикса (скелетной фибриллярно-гранулярной структуры ядра) и- небольшую группу обычно сопутствующих им белков (компоненты подмембранного фиброзного слоя ядра - ламины, белки ядерных пор и некоторые другие). Именно эти компоненты клеточного ядра образуют пространственную матрицу, на которой происходит регулируемое функционирование молекулы ДНК.
Ген - материальный носитель наследственной информации, совокупность которых родители передают потомкам. В настоящее время, в молекулярной биологии установлено, что гены - это участки ДНК , несущие какую-либо целостную информацию - о строении одной молекулы белка или одной молекулы РНК . Эти и другие функциональные молекулы определяют рост и функционирование организма .
В то же время, каждый ген характеризуется рядом специфических регуляторных последовательностей ДНК , таких как промоторы , которые принимают непосредственное участие в регулировании проявлением гена. Регуляторные последовательности могут находиться как в непосредственной близости от открытой рамки считывания , кодирующей белок, или начала последовательности РНК, как в случае с промоторами (так называемые cis-регуляторные элементы , англ. cis-regulatory elements), так и на расстоянии многих миллионов пар оснований (нуклеотидов ), как в случае с энхансерами и супрессорами (иногда классифицируемые как trans-регуляторные элементы , англ. trans-regulatory elements). Таким образом, понятие гена не ограничено только кодирующим участком ДНК, а представляет собой более широкую концепцию, включающую в себя и регуляторные последовательности.
Изначально термин ген появился как теоретическая единица передачи дискретной наследственной информации. История биологии помнит споры о том, какие молекулы могут являться носителями наследственной информации. Большинство исследователей считали, что такими носителями могут быть только белки , так как их строение (20 аминокислот ) позволяет создать больше вариантов, чем строение ДНК, которое составлено всего из четырёх видов нуклеотидов . Позже было экспериментально доказано, что именно ДНК включает в себя наследственную информацию, что было выражено в виде центральной догмы молекулярной биологии .
В организме человека содержится свыше 50 000 индивидуальных белков, отличающихся первичной структурой, конформацией, строением активного центра и функциями. Однако до настоящего времени нет единой и стройной классификации, учитывающей различные особенности белков. В основе имеющихся классификаций лежат разные признаки. Так белки можно классифицировать:
по форме белковых молекул (глобулярные – округлые или фибриллярные – нитевидные)
по молекулярной массе (низкомолекулярные, высокомолекулярные)
по выполняемым функциям (транспортные, структурные, защитные, регуляторные и др.)
по локализации в клетке (ядерные, цитоплазматические, лизосомальные и др.)
по структурным признакам и химическому составу белки делятся на две группы: простые и сложные. Простые белки представлены только полипептидной цепью, состоящей из аминокислот. Сложные белки имеют в своем составе белковую часть и небелковый компонент (простетическую группу). Однако и эта классификация не является идеальной, поскольку в чистом виде простые белки встречаются в организме редко.
Характеристика простых белков.
К простым белкам относят гистоны, протамины, альбумины и глобулины, проламины и глютелины, протеиноиды.
Гистоны - тканевые белки многочисленных организмов, связаны с ДНК хроматина. Это белки небольшой молекулярной массы (11-24 тыс.Да). По электрохимическим свойствам относятся к белкам с резко выраженными основными свойствами (поликатионные белки), ИЭТ у гистонов колеблется от 9 до 12. Гистоны имеют только третичную структуру, сосредоточены в основном в ядрах клеток. Гистоны связаны с ДНК в составе дезоксирибонуклеопротеинов. Связь гистон-ДНК электростатическая, так как гистоны имеют большой положительный заряд, а цепь ДНК-отрицательный. В составе гистонов преобладают диаминомонокарбоновые аминокислоты аргинин, лизин.
Выделяют 5 типов гистонов. Деление основано на ряде признаков, главным из которых является соотношение лизина и аргинина во фракциях, четыре гистона Н2А, Н2В, Н3 и Н4 образуют октамерный белковый комплекс, который называют «нуклеосомный кор». Молекула ДНК «накручивается» на поверхность гистонового октамера, совершая 1,75 оборота (около 146 пар нуклеотидов). Такой комплекс гистоновых белков с ДНК служит основной структурной единицей хроматина, ее называют «нуклеосома» .
Основная функция гистонов - структурная и регуляторная. Структурная функция состоит в том, что гистоны участвуют в стабилизации пространственной структуры ДНК, а следовательно, хроматина и хромосом. Регуляторная функция заключается в способности блокировать передачу генетической информации от ДНК к РНК.
Протамины - своеобразные биологические заменители гистонов, но отличаются от них составом и структурой. Это самые низкомолекулярные белки (М - 4-12 тыс. Да), обладают резко выраженными основными свойствам из-за большого содержания в них аргинина (80%).
Как и гистоны, протамины - поликатионные белки. Они связываются с ДНК в хроматине спермиев и находятся в молоках рыб.
Сальмин - протамин из молоки лосося.
Скумбрин - из молоки скумбрии.
Протамины делают компактной ДНК сперматозоидов, т.е. выполняют как и гистоны, структурную функцию, однако не выполняют регуляторную.
Альбумины и глобулины.
Альбумины (А) и глобулины (Г).
А и Г белки, которые есть во всех тканях. Сыворотка крови наиболее богата этими белками. Содержание альбуминов в ней составляет 40-45 г/л, глобулинов 20-30 г/л, т.е на долю альбуминов приходится более половины белков плазмы крови.
Альбумины -белки относительно небольшой молекулярной массы (15-70 тыс. Да); они имеют отрицательный заряд и кислые свойства, ИЭТ - 4,7, содержат много глутаминовой аминокислоты. Это сильно гидратированые белки, поэтому они осаждаются только при большой концентрации водоотнимающих веществ.
Благодаря высокой гидрофильности, небольшим размерам молекул, значительной концентрации альбумины играют важную роль в поддержании осмотического давления крови. Если концентрация альбуминов ниже 30 г/л, изменяется осмотическое давление крови, что приводит к возникновению отеков. Около 75-80 % осмотического давления крови приходится на долю альбуминов.
Характерным свойством альбуминов является их высокая адсорбционная способность. Они адсорбируют полярные и неполярные молекулы, выполняя транспортную роль. Это неспецифические переносчики они транспортируют гормоны, холестерол, билирубин, лекарственные вещества, ионы кальция. Связывание и перенос длинноцепочных жирных кислот - основная физиологическая функция сывороточных альбуминов. Альбумины синтезируются преимущественно в печени и быстро обновляются, период их полураспада 7 дней.
Глобулины - белки с большей, чем альбумины молекулярной массой. Глобулины слабокислые или нейтральные белки (ИЭТ = 6 – 7,3). Некоторые из глобулинов обладают способностью к специфическому связыванию веществ (специфические переносчики).
Возможно фракционирование белков сыворотки крови на альбумины и глобулины методом высаливания с помощью (NH 4) 2 SO 4 . В насыщенном растворе осаждаются альбумины как более легкая фракция, в полунасыщенном – глобулины.
В клинике широкое распространение получил метод фракционирования белков сыворотки крови путем электрофореза. При электрофоретическом разделении белков сыворотки крови можно выделить 5–7 фракций: Характер и степень изменения белковых фракций сыворотки крови при различных патологических состояниях представляет большой интерес для диагностических целей. Уменьшение альбуминов наблюдается в результате нарушения их синтеза, при дефиците пластического материала, нарушении синтетической функции печени, поражении почек. Содержание глобулинов увеличивается при хронических инфекционных процессах.
Электрофорез белков сыворотки крови.
Проламины и глютелины.
Это группа растительных белков, которые содержатся исключительно в клейковине семян злаковых растений, где выполняют роль запасных белков. Характерной особенностью проламинов является то, что они не растворимы в воде, солевых растворах, щелочах, но растворимы в 70% растворе этанола, в то время как все другие белки выпадают в осадок. Наиболее изучены белки глиадин (пшеница) и зеин (кукуруза). Установлено, что проламины содержат 20-25% глутаминовой кислоты и 10-15 % пролина. Эти белки, например, глиадин, в норме у человека расщепляются, но иногда при рождении фермент, расщепляющий этот белок, отсутствует. Тогда этот белок превращается в продукты распада, обладающие токсическим действием. Развивается заболевание целиакия - непереносимость растительных белков.
Глютелины – тоже растительные белки, не растворимые в воде, в растворах солей, этаноле. Они растворимы в слабых щелочах.
Протеиноиды.
Белки опорных тканей (костей, хрящей, сухожилий, связок), кератины - белки волос, рогов, копыт, коллагены - белки соединительной ткани, эластин - белок эластических волокон.
Все эти белки относятся к фибриллярным, не гидролизуются в желудочно - кишечном тракте. Коллаген составляет 25-33 % от общего количества белка организма взрослого человека или 6 % от массы тела. Пептидная цепь коллагена содержит около 1000 аминокислотных остатков, из которых каждая 3-я аминокислота – глицин, 20% составляют пролин и гидроксипролин, 10% аланин. При формировании вторичной и третичной структур этот белок не может давать типичных a-спиралей, поскольку аминокислоты пролин и оксипролин могут давать только одну водородную связь. Поэтому полипептидная цепь на участке, где находятся эти аминокислоты, легко изгибается, так как не удерживается, как обычно, второй водородной связью.
Эластин – это основной структурный компонент эластических волокон, которые содержатся в тканях обладающих значительной эластичностью (кровеносные сосуды, связки, легкие). Свойства эластичности проявляются высокой растяжимостью этих тканей и быстрым восстановлением исходной формы и размера после снятия нагрузки. В составе эластина содержится много гидрофобных аминокислот (глицина, валина, аланина, лейцина, пролина).
СЛОЖНЫЕ БЕЛКИ
Сложные белки кроме полипептидных цепей содержат в своем составе небелковую (простетическую) часть, представленную различными веществами. В зависимости от химической природы небелковой части выделяют следующие группы сложных белков:
хромопротеины
углевод – белковые комплексы
липид – белковые комплексы
нуклеопротеины
фосфопротеины
3.4.2. К гемопротеинам относятся: гемоглобин, миоглобин, цитохромы, пероксидаза, каталаза. Эти белки содержат в качестве простетической группой гем .
По своему химическому строению гем представляет собой протопорфирин IX , связанный с двухвалентным железом. Протопорфирин IX - органическое соединение, относящееся к классу порфиринов. Протопорфирин IX содержит четыре замещённых пиррольных кольца, соединённых метиновыми мостиками =СН— . Заместителями в пиррольных кольцах являются: четыре метильные группы СН3 — , две винильные группы СН2 =СН— и два остатка пропионовой кислоты — СН2 —СН2 —СООН . Гем соединяется с белковой частью следующим образом. Неполярные группы. протопорфирина IX взаимодействуют с гидрофобными участками аминокислот при помощи гидрофобных связей. Кроме того, имеется координационная связь между атомом железа и имидазольным радикалом гистидина в белковой цепи. Ещё одна координационная связь атома железа может использоваться для связывания кислорода и других лигандов.
Присутствие в биологическом материале гемсодержащих белков обнаруживается при помощи бензидиновой пробы (при добавлении бензидина и пероксида водорода исследуемый раствор окрашивается в сине-зелёный цвет).
3.4.3. Сравните структуру и функцию миоглобина и гемоглобина, запомните характерные особенности каждого из этих белков.
Миоглобин - хромопротеин, присутствующий в мышечной ткани и обладающий большим сродством к кислороду. Молекулярная масса этого белка около 16000 Да, Молекула миоглобина имеет третичную структуру и представляет собой одну полипептидную цепь, соединённую с гемом. Миоглобин не обладает аллостерическими свойствами (см. 2.4.), кривая насыщения его кислородом имеет вид гиперболы (рисунок 4). Функция миоглобина заключается в создании в мышцах кислородного резерва, который расходуется по мере необходимости, восполняя временную нехватку кислорода.
Гемоглобин (Hb) - хромопротеин, присутствующий в эритроцитах и участвующий в транспорте кислорода к тканям. Гемоглобин взрослых людей называется гемоглобином А (Hb A). Молекулярная масса его составляет около 65000 Да. Молекула Hb А имеет четвертичную структуру и включает четыре субъединицы - полипептидные цепи (обозначаемые α1 , α2 , β1 и β2 , каждая из которых связана с гемом.
Запомните, что гемоглобин относится к аллостерическим белкам, его молекулы могут обратимо переходить из одной конформации в другую. При этом изменяется сродство белка к лигандам. Конформация, обладающая наименьшим сродством к лиганду, называется напряжённой, или Т-конформацией. Конформация, обладающая наибольшим сродством к лиганду, называется релаксированной, или R-конформацией.
R- и Т-конформации молекулы гемоглобина находятся в состоянии динамического равновесия:
Различные факторы среды могут сдвигать это равновесие в ту или иную сторону. Аллостерическими регуляторами, влияющими на сродство Hb к O2 , являются: 1) кислород; 2) концентрация Н+ (рН среды); 3) углекислота (СO2 ) ; 4) 2,3-дифосфоглицерат (ДФГ) . Присоединение молекулы кислорода к одной из субъединиц гемоглобина способствует переходу напряжённой конформации в релаксированную и повышает сродство к кислороду других субъединиц той же молекулы гемоглобина. Это явление получило название кооперативного эффекта. Сложный характер связывания гемоглобина с кислородом отражает кривая насыщения гемоглобина O2 , имеющая S-образную форму (рисунок 3.1).






