Що таке пептидний зв'язок у біології визначення. Пептиди. Електронна та просторова будова пептидного зв'язку
У певних умовах (наприклад, при дії певних ферментів) амінокислоти здатні реагувати один з одним. Внаслідок взаємодії α-аміногрупи (-NH 2) однієї амінокислоти з α-карбоксильноїгрупою ( -СООН) інший амінокислоти виникає пептидна зв'язок.
Освіта пептидного зв'язкуможна уявити собі, як відщеплення молекули води від карбоксильної і аміногруп, що приєднуються до один одного ( Мал. 1.9):
Мал. 1.9 Освіта пептидної з в'язі
Пептидна зв'язок, характерна для первинної структурибілків, не є повністю одинарний. Її довжина становить 0.132 нм, що є середнім значенням між істинним одинарним зв'язком C-N (0.149 нм) і справжнім подвійним зв'язком C = N (0,127 нм). За деякими даними, пептидний зв'язок є частково подвійним і частково одинарним:
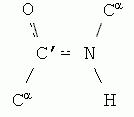
Рис. 1.10. Пептидна зв'язок
Пептидна зв'язок має плоску структуру(планарний зв'язок), тобто всі чотири атоми (C, N, O, H) лежать у однієї площини, і характеризується певною жорсткістю, Тобто.
Ці властивості пептидного зв'язку забезпечуються так званою sp 2 -гібридизацією електронів N і С" атомів, відсутністю обертання навколо C'-N зв'язку
Давайте детальніше зупинимося на тонкій (електронній) структурі пептидного зв'язку.
Електронні формули C, N та O:
Вуглець, азоті кисеньставляться до 2-му періоду, тобто мають два енергетичні рівні. На другому ( зовнішньому) енергетичному рівні локалізовані два енергетичні підрівні: sі p.Електронні формули цих елементів мають наступний вигляд:
Вуглець C 1s 2 2s 2 2p 2
Азот N 1s 2 2s 2 2p 3
Кисень O 1s 2 2s 2 2p 4
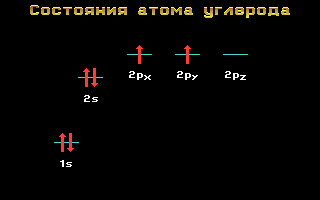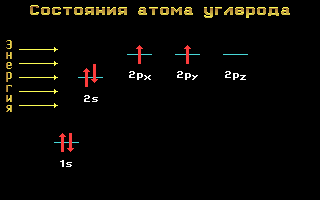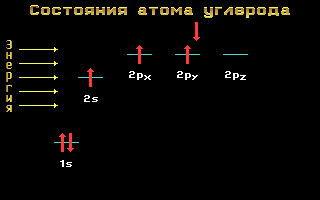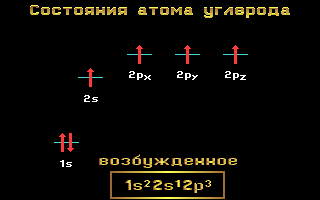
Мал. 1.11 Енергетичні рівніатома вуглецю
Утворенню ковалентного пептидного зв'язку передує sp 2 -гібридизація атомних орбіт атомів вуглецю та азоту.
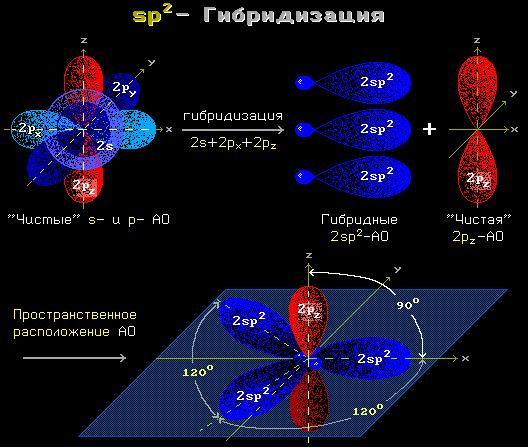
Мал. 1.12 sp 2 гібридизація
sp 2-гібридизаціяперетворює одну сферичну s-і дві витягнуті p-орбітиелектронів атома в три sp 2 -орбіти. Ці три орбіти залучають атом до трьох ковалентних зв'язків, що лежать в одній площині..
Залучені в sp 2 -гібридизацію електрони ковалентнопов'язаних C" і N атомів створюють "делокалізоване"електронна хмара, що охоплює обидва ці атоми, і поширюються також через зв'язок С-О - на атом Про (саме тому зв'язки C"=N і C=O малюються як рівноправні "полуторні").
![]()
Мал. 1.13 Делокалізація ковалентного зв'язку під час утворення пептидного зв'язку
Ковалентний зв'язок вважається локалізованоюякщо її електронна пара знаходиться в полі двох ядер і пов'язує тільки дваатома.
Делокалізований зв'язок– зв'язок, електронна пара якого розосереджена між декількома (більше 2) ядрами атомів. Така справакалізація(Розосередження) електронів характерна для пов'язаних π-зв'язків, тобто. кратних зв'язків, що чергуються з одинарними.
Розподіл електронів – енергетично вигідний процес, т.к. призводить до зниження енергії молекули. Необхідною умовою ділалізації р-електронів є π-перекривання р-атомних орбіталей сусідніх sp 2 -атомів.
Однак у C і N атомів є ще p-електроникрім тих, що вже задіяні в sp 2 орбітах. І оскільки ці p-орбітимають форму "вісімок", перпендикулярних всім трьом sp 2 -орбітам, то додатковий зв'язок цих p-електронів - зв'язок, що вимагає зближення "вісімкових" орбіт і "усуспільнення" (тобто переходів з атома на атом) електронів, що знаходяться на них, - це узагальнення p-електронів перешкоджає обертанню навколо С-N зв'язку.
Атом кисню карбоксильної групи і атом водню аміногрупи можуть бути в цис- або транс-положенніщодо зв'язку -C-N-.
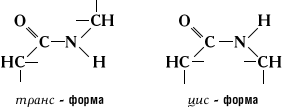
Мал. 1.14 Ціс- І транс-форма пептидного зв'язку
Експериментально доведено велику стійкість транс-Форми.
ПЕПТИДИ, природні або синтетичні. соед., яких брало побудовані з залишків a-амінокислот, з'єднаних між собою пептидними (амідними) зв'язками C(O) NH. Можуть містити також неамінокислотну компоненту (напр., залишок ). За кількістю амінокислотних залишків, що входять до пептидів, розрізняють діпепетиди, трипептиди, тетрапептиди і т.д. Пептиди, що містять до 10 амінокислотних залишків, зв. олігопептидами, що містять більше 10 амінокислотних залишків поліпептидами Прір з мол. м. понад 6 тис. зв.
Історична довідка.Вперше пептиди були виділені із ферментативних гідролізатів. Термін "пептиди" запропонований Е. Фішером. Перший синтетичний пептид отримав T. Курціус в 1881 Е. Фішер до 1905 р. розробив перший загальний методсинтезу пептидів та синтезував ряд олігопептидів разл. будови. Істот. Внесок у розвиток пептидів зробили учні Е. Фішера Е. Абдергальден, Г. Лейке та M. Бергман. В 1932 Бергман і Л. Зервас використовували в синтезі пептидів бензилоксикарбонільну групу (карбобензоксигрупу) для захисту a-аміногруп, що ознаменувало новий етапу розвитку синтезу пептидів. Отримані N-захищені (N-карбобензоксиамінокислоти) широко використовували для отримання різних пептидів, які успішно застосовували для вивчення ряду ключових проблем і цих B-B, напр, для дослідження субстратної протеолитич. . Із застосуванням N-карбобензоксиамінокислот були вперше синтезовані ( , та ін). Важливе досягненняу цій галузі розроблений на поч. 50-х pp. P. Воганом та ін синтез пептидів методом змішаних (докладно методи синтезу пептидів розглянуті нижче). У 1953 В. Дю Віньо синтезував перший пептидний окситоцин. На основі розробленої P. Мерріфілдом в 1963 концепції твердофазного пептидного синтезу були створені автоматичні. синтезатори пептидів Набули інтенсивного розвитку методи контрольованого ферментативного синтезу пептидів. Використання нових методів дозволило здійснити синтез та ін.
Успіхи синтетич. пептидів були підготовлені досягненнями в галузі розробки таких , очищення та аналізу пептидів, як , на разл. , гель-фільтрація, високоефективна (ВЕРХ), імуно-хім. аналіз та ін. великий розвитоктакож методи аналізу кінцевих груп та методи ступінчастого розщеплення пептидів. Були, зокрема, створені автоматичні. амінокислотні аналізатори та автоматичні. прилади визначення первинної структури пептидов-т.зв. секвенатори.
Номенклатура пептидів.Амінокислотний залишок пептидів, що несе вільн. a-аміногрупу, зв. N-кінцевим, а несучий вільн. a-карбоксильну групу - С-кінцевим. Назва пептиду образується із назв. амінокислотних залишків, що входять до його складу, перераховуються послідовно, починаючи з N-кінцевого. При цьому використовують тривіальні назви. , в яких брало закінчення "ін" замінюється на "мул"; виняток C-кінцевий залишок, назв. до-рого збігається із назв. відповідної. Усі амінокислотні залишки, що входять до пептидів, нумеруються, починаючи з N-кінця. Для запису первинної структури пептидів () широко використовують трилітерні та однолітерні позначення амінокислотних залишків (напр., Ala Ser-Asp Phe-GIy аланіл-серил-аспарагіл-фенілаланіл-глі-цин).
Будова.має св-ва частково. Це проявляється у зменшенні довжини зв'язку (0,132 нм) порівняно з довжиною C N (0,147 нм). Частково двозв'язковий характер унеможливлює своб. обертання заступників навколо неї. тому пептидна угруповання є плоскою і зазвичай має транс-конфігурацію (ф-ла I). T. обр., кістяк пептидного ланцюга є ряд жорстких площин з рухомим ("шарнірним") зчленуванням у місці, де розташовані асиметрич. З (у ф-лі I позначені зірочкою).
У розчинах пептидів спостерігається переважне утворення певних конформерів. З подовженням ланцюга більш виражену стійкість набувають (аналогічно) упорядковані елементи вторинної структури(a-спіраль і b-струк-тура). Освіта вторинної структури особливо притаманно регулярних пептидів, зокрема поліамінокислот.
Властивості. Олігопептиди по св-вам близькі до подібні. Олігопептиди є, як правило, кристалічними. в-ва, що розкладаються при нагр. до 200 300 0 C. Вони добре розтв. в, розб. к-тах і , майже розтв. в орг. р-телегля. Виняток Олігопептиди, побудовані із залишків гідрофобних.
Олігопептиди мають амфотерні св-вами і, залежно від кислотності середовища, можуть існувати у формі , або . основ. смуги поглинання в ІЧ спектрі для групи NH 3300 і 3080 см -1 для групи C = O 1660 см -1 . В СФ спектрі смуга поглинання пептидної групи знаходиться в області 180-230 нм. Ізоелектрич. точка (рI) пептидів коливається в широких межах і залежить від складу амінокислотних залишків . Величини рК а пептидів становлять для а-СООН бл. 3 для a -N H 2 ок. 8.
Хім. св-ва олигопептидов визначаються які у них функц. групами, і навіть особливостями . Їхній хімічний. перетворення на значить. мірою аналогічні відповідним р-ціям. Вони пропонують покласти. та . Дипептиди та їх похідні (особливо ефіри) легко циклізуються, перетворюючись на . Під впливом 5,7 зв.
соляної к-ти пептиди гідролізуються протягом 24год при 105 0 C.
Синтез.Хім. синтез пептидів полягає у створенні між групою COOH однієї та NH 2 ін. або пептиду. Відповідно до цього розрізняють карбоксильну та амінну компоненти р-ції пептидного синтезу. Для проведення цілеспрямованого контрольованого синтезу пептидів необхідна попередня. тимчасова захист всіх (або деяких) функцій. груп, які не беруть участь в освіті, а також попереджає. активація одного з компонентів пептидного синтезу. Після закінчення синтезу видаляють. При отриманні біологічно активних пептидів необхідна умова- запобігання усім етапах пептидного синтезу.
наиб. важливі способиосвіти при здійсненні р-ції у р-ре-методи активір. ефірів, кар-бодіімідний, змішаних та азидний метод.
Метод активованих ефірів заснований на попередньому. утворенні складноефірного похідного карбоксильної компоненти шляхом введення в неї спиртового залишку, що містить сильний електроноакцепторний замісник. В результаті утворюється високореакційноспо-собний ефір, що легко піддається під дією амінокомпоненти пептидного синтезу. Як активір. ефірів при синтезі пептидів широко використовують пента-фтор-, пентахлор-, трихлор-і n-нітрофенілові та ряд ін. ефірів захищених та пептидів.
Карбодіімідний метод освіти передбачає використання як конденсуючих разл. заміщених. Особливо широке застосування при синтезі пептидів отримав дициклогексил-карбодіїмід:
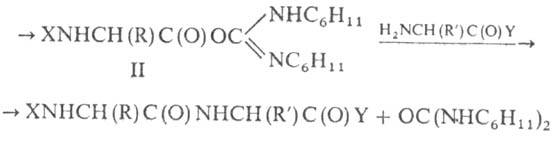
X та Y-соотв. N- і С-захисні групи З цим конденсуючим можна здійснювати синтез пептидів і водних середовищах, т. К. Швидкості р-цій і проміжно утворюється О-ацилізомо-чевини (II) істотно різняться. При синтезі пептидів знаходять також застосування разл. водорозчинні карбодіімі-ди (напр., N-диметиламінопропіл-N"-етилкарбодіімід).
Метод змішаних заснований на попередньому. активації карбоксильної компоненти пептидного синтезу шляхом утворення змішаного з карбоновою або неорг. до того. наиб. часто використовують алкілові ефіри хлормурашиної (хлоркутної) к-ти, особливо етиловий та ізобутиловий ефіри, напр.:
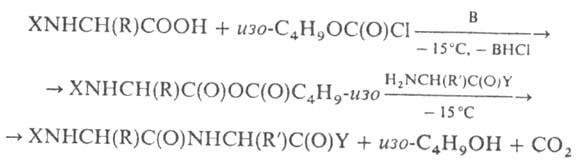
В - третинний
При синтезі пептидів за цим методом дуже ефективні змішані N-ациламінокислот та півалінової (триметилоцтової) к-ти. Завдяки сильному покладе. трет-бутил'ної групи електро-фільність карбоксильного С в залишку півалінової к-ти істотно знижена, і це, поряд зі стерич. перешкодами, пригнічує небажано. побічну р-цію освіти та вільн. N-ациламінокислоти, к-раю здійснюється за схемою:
В одному з варіантів методу змішаних застосовують як конденсуючий агент 1-етоксикар-боніл-2-етокси-1,2-дигідрохінолін. Це єднання. легко утворює з карбоксильною компонентою пептидного синтезу проміж. змішаний, що швидко вступає в р-цію, причому повністю виключається небажають. побічна р-ція.
Окремий випадок способу змішаних - спосіб симетрич. , в якому використовують 2 O. Їх застосування виключає можливість або неправильного .
Азидний метод синтезу передбачає активацію карбоксильної компоненти перед, перетворенням її в N-заміщеною або пептиду:
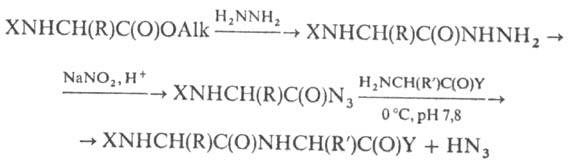
Зважаючи на нестійкість їх у своб. вигляді з розчину, як правило, не виділяють. Якщо замість р-ції з гідразидом використовувати алкілові ефіри азотистої к-ти (напр., трет-бутилнітрит), то азид-ную можна проводити в орг. р-рітелі; утворюється HN 3 пов'язують третинними. Нерідко азидна ускладнюється небажано. побічними р-ціями (перетвор. гідразиду не в , а в амід; р-ціягідразиду з , що веде до утворення 1,2-діацил-гідразину; проміж. освіта, який в результаті перегрупування Курціуса може призводити до похідного або відповідного та ін). Переваги азидного методу - мала ступінь, можливість застосування і без захисту.
Для перетвор. захищених пептидів у вільні використовують спец. методи деблокування, які засновані на р-ціях, що забезпечують відщеплення разл. , що гарантують збереження всіх . Приклади деблокування: видалення оксикарбонільної групи каталітич. при атм. та кімнатній т-рі, відщеплення трет-бутилоксикарбонільної групи м'яким, а також гідролітич. відщеплення трифторацетильної групи під впливом розб. р-рів .
При синтезі біологічно активних пептидів важливо, щоб не відбувалася , яка може здійснюватися в результаті оборотного відщеплення H + від a -атома С N-ациламінокислоти або пептиду. сприяють і до-ти, висока т-рата полярні розчинники. Вирішальну роль грає , що каталізується , яка може протікати по т. зв. азлактонового механізму або через енолізацію за схемою:
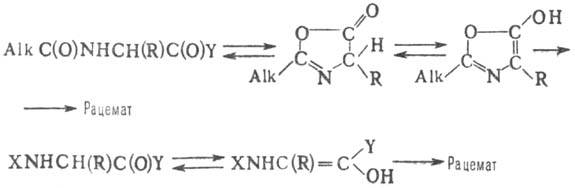
наиб. важливі способи виключення: 1) нарощування пептидного ланцюга у напрямку від С-кінця до N-кінцяіз застосуванням N-захисних груп типу ROC(O). 2) Активація N-захищених пептидних фрагментів з С-кінцевими залишками або . 3) Використання азидного методу (за відсутності надлишку третинного та підтримки низьких т-ру реакц. середовищі). 4) Застосування актив. ефірів, яких брало протікає через перехідний стан, стабілізір. водневими містками (напр., ефірів, утворених з N-гідроксипіпери-дином та 8-гідроксихіноліном). 5) Використання карбоді-імідного методу з N-гідроксоїд. або к-т Льюїса.
Поряд із синтезом пептидів у розчинах, важливе значення має синтез пептидів із застосуванням нерозчинних . Він включає пептидів (р-ція, або метод, Мер-ріфілд) і синтез пептидів з використанням полімерних .
Стратегія твердофазного пептидного синтезу передбачає тимчасове закріплення пептидного ланцюга, що синтезується, на нерозчинному полімерному і здійснюється за схемою:
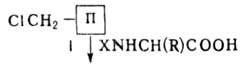
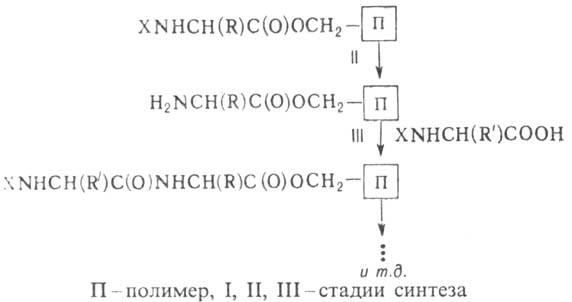
Завдяки цьому способу вдалося замінити дуже складні та трудомісткі процедури поділу та очищення проміж. пептидів простими операціями промивання і , а також звести процес пептидного синтезу до стандартної послідовності процедур, що періодично повторюються, легко піддаються автоматизації. Метод Мерріфілда дозволив суттєво прискорити процес синтезу пептидів. На основі цієї методології створено разл. типи автоматич. синтезаторів пептидів
З'єднання високо виробляє. пептидів з роздільними здібностями препаративної ВЕРХ забезпечує вихід на якісно новий рівеньхім. синтезу пептидів, що, своєю чергою, благотворно впливає в розвитку разл. областей , мовляв. біології, фармакології та медицини.
Стратегія синтезу пептидів із застосуванням полімерних передбачає тимчасове зв'язування із високомол. активір. карбоксильні компоненти або конденсуючого агента пептидного синтезу. Перевага цього методу: закріплені можуть вводитися в надлишку, а відділення синтезованих пептидів від нерозчинних не становить труднощів.
Приклад такого синтезу-пропускання амінокомпоненти в заданій послідовності через дек. колонок, в кожній з яких брало знаходиться пов'язаний з полімерним активір. ефір певної
Пептиди. Електронне та просторова будовапептидного зв'язку.
ЗАНЯТТЯ 14
ПЕПТИДИ І БІЛКИ: СТРУКТУРА, КЛАСИФІКАЦІЯ ТА ФІЗИКО-ХІМІЧНІ ВЛАСТИВОСТІ. РОЗЧИНИ ВМС
Пептиди. Електронна та просторова будова пептидного зв'язку.
У пептидній (амідній) групі -СО-NH- атом вуглецю знаходиться в стані sp 2 -гібридизації. Неподілена пара електронів атома азоту вступає в пару з π-електронами подвійного зв'язку С=О. З позицій електронної будови пептидна група є трицентровою p,π-сполученою системою, електронна щільність в якій зміщена в бік більш негативного атома кисню. Атоми З, Про N, що утворюють сполучену систему, знаходяться в одній площині. Розподіл електронної густини в амідній групі можна подати за допомогою граничних структур (I) і (II) або зміщення електронної густини в результаті +M- і - M-ефектів груп NH і C=O відповідно (III).
Внаслідок сполучення відбувається деяке вирівнювання довжин зв'язків. Подвійний зв'язок С=Про подовжується до 0,124 нм проти звичайної довжини 0,121 нм, а зв'язок С-N стає коротшим - 0,132 нм порівняно з 0,147 нм у звичайному випадку (рис. 1). Плоска сполучена система в пептидній групі спричиняє утруднення обертання навколо зв'язку С-N (бар'єр обертання становить 63-84 кДж/моль). Таким чином, електронна будова визначає досить жорстку плоску структуру пептидної групи.
Як видно із рис. 1, α-атоми вуглецю амінокислотних залишків розташовуються в площині пептидної групи різні сторонивід зв'язку С-N, тобто в більш вигідному транспортному положенні: бічні радикали R амінокислотних залишків у цьому випадку будуть найбільш віддалені один від одного в просторі.
Поліпептидна ланцюг має напрочуд однотипну будову і може бути представлена у вигляді ряду розташованих під кутом один до одного площин пептидних
![]()
Мал. 1. Площинне розташування пептидної групи -CO-NH- та α-атомів вуглецю амінокислотних залишків
груп, з'єднаних між собою через α-атоми вуглецю зв'язками Сα-N та Сα-Сsp 2 (рис. 2). Обертання навколо цих одинарних зв'язків дуже обмежене внаслідок труднощів у просторовому розміщенні бічних радикалів амінокислотних залишків. Таким чином, електронна та просторова будова пептидної групи багато в чому визначає структуру поліпептидного ланцюга в цілому.