Что такое пептидная связь в биологии определение. Пептиды. Электронное и пространственное строение пептидной связи
В определенных условиях (например, при воздействии определенных ферментов), аминокислоты способны реагировать друг с другом. В результате взаимодействия α-аминогруппы (-NH 2 ) одной аминокислоты с α-карбоксильной группой (-СООН ) другой аминокислотывозникаетпептидная связь.
Образование пептидной связи можно представить себе, как отщепление молекулы воды от присоединяющихся к друг другу карбоксильной и аминогрупп (Рис. 1.9 ):
Рис. 1.9 Образование пептидной с вязи
Пептидная связь, характерная для первичной структуры белков, не является полностью одинарной . Её длина составляет 0.132 нм, что является средним значением между истинной одинарной связью C-N (0.149 нм) и истинной двойной связью C= N (0,127 нм). По некоторым данным, пептидная связь является частично двойной и частично одинарной :
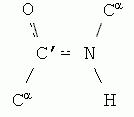
Рис 1.10. Пептидная связь
Пептидная связь имеет плоскую структуру (планарная связь ), т. е. все четыре атома (C, N, O, H) лежат в одной плоскости , и характеризуется определённой жёсткостью , т. е..
Эти свойства пептидной связи обеспечиваются так называемой sp 2 -гибридизацией электронов N и С" атомов,отсутствием вращения вокруг C´-N связи
Давайте более подробно остановимся на тонкой (электронной) структуре пептидной связи.
Электронные формулы C, N и O:
Углерод , азот и кислород относятся ко 2-му периоду , т. е. имеют два энергетических уровня . На втором (внешнем ) энергетическом уровне локализованы два энергетических подуровня : s и p. Электронные формулы этих элементов имеют следующий вид:
Углерод C 1s 2 2s 2 2p 2
Азот N 1s 2 2s 2 2p 3
Кислород O 1s 2 2s 2 2p 4
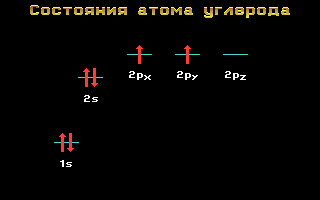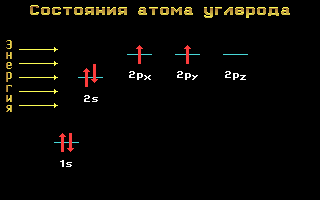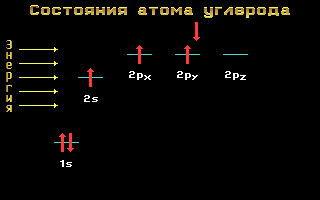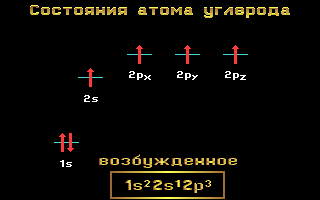
Рис. 1.11 Энергетические уровни атома углерода
Образованию ковалентной пептидной связи предшествует sp 2 -гибридизация атомных орбит атомов углерода и азота.
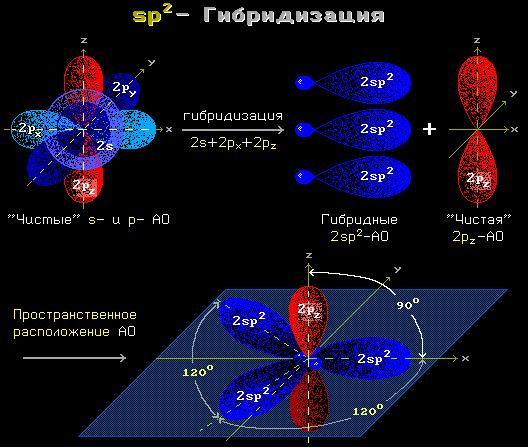
Рис. 1.12 sp 2 гибридизация
sp 2- гибридизация преобразует одну сферическую s- и две вытянутые p-орбиты электронов атома в три sp 2 -орбиты . Эти три орбиты вовлекают атом в три ковалентные связи, лежащие в одной плоскости .
Вовлеченные в sp 2 -гибридизацию электроны ковалентно связанных C" и N атомов создают "делокализованное" электронное облако, охватывающее оба эти атома, и распространяющиеся также - через связь С-О - на атом О (именно поэтому связи C"=N и C=O рисуются как равноправные "полуторные").
![]()
Рис. 1.13 Делокализация ковалентной связи при образовании пептидной связи
Ковалентная связь считается локализованной , если ее электронная пара находится в поле двух ядер и связывает только два атома.
Делокализованная связь – связь, электронная пара которой рассредоточена между несколькими (более 2) ядрами атомов. Такая делокализация (рассредоточение) электронов характерна для сопряженных π-связей , т.е. кратных связей, чередующихся с одинарными.
Рассредоточение электронов – энергетически выгодный процесс, т.к. приводит к снижению энергии молекулы. Необходимым условием делокализации р-электронов является π-перекрывание р-атомных орбиталей соседних sp 2 -атомов.
Однако у C и N атомов есть еще p-электроны кроме тех, что уже задействованных в sp 2 орбитах. И так как эти p-орбиты имеют форму "восьмерок", перпендикулярных всем трем sp 2 -орбитам, то дополнительная связь этих p-электронов - связь, требующая сближения "восьмерочных" орбит и "обобществления" (т.е. переходов с атома на атом) находящихся на них электронов, - это обобществление p-электронов препятствует вращению вокруг С"-N связи.
Атом кислорода карбоксильной группы и атом водорода аминогруппы могут находятся в цис - или транс -положении относительно связи –C-N-.
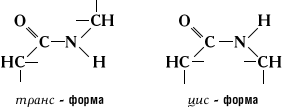
Рис. 1.14 Цис - и транс -форма пептидной связи
Экспериментально доказана большая устойчивость транс -формы.
ПЕПТИДЫ
, природные
или синтетич. соед., к-рых построены из остатков a
-аминокислот,
соединенных между собой пептидными (амидными) связями C(O) NH. Могут содержать
в также неаминокислотную компоненту (напр., остаток ). По числу
аминокислотных остатков, входящих в пептидов, различают ди-пептиды, трипептиды,
тетрапептиды и т.д. Пептиды, содержащие до 10 аминокислотных остатков, наз. олигопептидами,
содержащие более 10 аминокислотных остатков полипепти-дами Прир
с мол. м. более 6 тыс. наз.
Историческая справка.
Впервые пептиды были выделены из ферментативных гидролизатов . Термин "пептиды"
предложен Э. Фишером. Первый синтетический пептид получил T. Курциус в 1881 Э.
Фишер к 1905 разработал первый общий метод синтеза пептидов и синтезировал ряд олигопептидов
разл. строения. Существ. вклад в развитие пептидов внесли ученики Э. Фишера
Э. Абдергальден, Г. Лейке и M. Бергман. В 1932 M Бергман и Л. Зервас использовали
в синтезе пептидов бензилоксикарбонильную группу (карбобензоксигруппу) для защиты
a
-аминогрупп , что ознаменовало новый этап в развитии синтеза
пептидов. Полученные N-защищенные (N-карбобензоксиаминокислоты) широко
использовали для получения различных пептидов, к-рые успешно применяли для изучения
ряда ключевых проблем и этих B-B, напр, для исследования субстратной
протеолитич. . С применением N-карбобензоксиаминокислот
были впервые синтезированы ( , и др.).
Важное достижение в этой области разработанный в нач. 50-х гг. P. Воганом и
др. синтез пептидов методом смешанных (подробно методы синтеза пептидов рассмотрены
ниже). В 1953 В. Дю Виньо синтезировал первый пептидный -окситоцин.
На основе разработанной P. Меррифилдом в 1963 концепции твердофазного пептидного
синтеза были созданы автоматич. синтезаторы пептидов. Получили интенсивное развитие
методы контролируемого ферментативного синтеза пептидов. Использование новых методов
позволило осуществить синтез и др.
Успехи синтетич.
пептидов были подготовлены достижениями в области разработки таких ,
очистки и анализа пептидов, как , на разл.
, гель-фильтрация, высокоэффективная (ВЭЖХ),
иммуно-хим. анализ и др. Получили большое развитие также методы анализа концевых
групп и методы ступенчатого расщепления пептидов. Были, в частности, созданы автоматич.
аминокислотные анализаторы и автоматич. приборы для определения первичной структуры
пептидов-т.наз. секвенаторы.
Номенклатура пептидов.
Аминокислотный
остаток пептидов, несущий своб. a
-аминогруппу, наз. N-концевым, а несущий своб.
a
-карбоксильную группу - С-концевым. Название пептида образу
ется
из назв. входящих в его состав аминокислотных остатков, перечисляемых последовательно,
начиная с N-концево-го. При этом используют тривиальные назв. , в
к-рых окончание "ин" заменяется на "ил"; исключение
C-концевой остаток, назв. к-рого совпадает с назв. соответствующей .
Все аминокислотные остатки, входящие в пептиды, нумеруются, начиная с N-конца. Для
записи первичной структуры пептидов () широко используют
трехбуквенные и однобуквенные обозначения аминокислотных остатков (напр., Ala
Ser -Asp Phe -GIy аланил-серил-аспарагил-фенилаланил-гли-цин).
Строение.
имеет св-ва частично . Это проявляется в уменьшении длины
этой связи (0,132 нм)по сравнению с длиной C N (0,147 нм). Частично
двоесвязный характер делает невозможным своб. вращение заместителей
вокруг нее. поэтому пептидная группировка является плоской и имеет обычно транс-конфигурацию
(ф-ла I). T. обр., остов пептидной цепи представляет собой ряд жестких плоскостей
с подвижным ("шарнирным") сочленением в месте, где расположены асимметрич.
С (в ф-ле I обозначены звездочкой).
В р-рах пептидов наблюдается
предпочтительное образование определенных конформе-ров. С удлинением цепи более
выраженную устойчивость приобретают (аналогично ) упорядоченные элементы
вторичной структуры (a
-спираль и b
-струк-тура). Образование вторичной
структуры особенно характерно для регулярных пептидов, в частности для полиаминокислот.
Свойства. Олигопептиды
по св-вам близки к , подобны . Олигопептиды представляют
собой, как правило, кристаллич. в-ва, разлагающиеся при нагр. до 200 300 0 C.
Они хорошо раств. в , разб. к-тах и , почти не раств. в орг. р-рителях.
Исключение Олигопептиды, построенные из остатков гидрофобных .
Олигопептиды обладают амфотерными
св-вами и, в зависимости от кислотности среды, могут существовать в форме ,
или . Осн. полосы поглощения в ИК спектре для группы NH
3300 и 3080 см -1 , для группы C=O 1660 см -1 . В УФ спектре
полоса поглощения пептидной группы находится в области 180-230 нм. Изоэлектрич.
точка (рI) пептидов колеблется в широких пределах и зависит от состава аминокислотных
остатков в . Величины рК а пептидов составляют для а-СООН
ок. 3, для a
-N
H 2 ок. 8.
Хим. св-ва олигопептидов определяются содержащимися в них функц. группами, а также особенностями . Их хим. превращения в значит. мере аналогичны соответствующим р-циям . Они дают положит. и . Дипептиды и их производные (особенно эфиры) легко циклизуются, превращаясь в . Под действием 5,7 н.
соляной к-ты пептиды гидролизуются
до в течение 24ч при 105 0 C.
Синтез.
Хим. синтез
пептидов заключается в создании между группой COOH одной
и NH 2 др. или пептида. В соответствии с этим различают
карбоксильную и аминную компоненты р-ции пептидного синтеза. Для проведения
целенаправленного контролируемого синтеза пептидов необходима предварит. временная
защита всех (или нек-рых) функц. групп, к-рые не участвуют в образовании , а также предварит. активация одной из компонент пептидного синтеза. После
окончания синтеза удаляют. При получении биологически активных
пептидов необходимое условие - предотвращение на всех этапах
пептидного синтеза.
Наиб. важные способы образования
при осуществлении р-ции в р-ре-методы активир. эфиров, кар-бодиимидный,
смешанных и азидный метод.
Метод активированных эфиров
основан на предварит. образовании сложноэфирного производного карбоксильной
компоненты путем введения в нее спиртового остатка, содержащего сильный электроноакцепторный
заместитель. В результате образуется высокореакционноспо-собный эфир, легко
подвергающийся под действием аминокомпоненты пептидного синтеза. В
качестве активир. эфиров при синтезе пептидов широко используют пента-фтор-, пентахлор-,
трихлор- и n-нитрофениловые и ряд др. эфиров защищенных и
пептидов.
Карбодиимидный метод образования
предусматривает использование в качестве конденсирующих
разл. замещенных . Особенно широкое применение при синтезе пептидов получил
дициклогексил-карбодиимид:
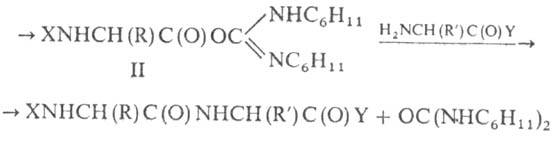
X и Y-соотв. N- и
С-защитные группы С этим конденсирующим можно осуществлять синтез
пептидов и в водных средах, т. к. скорости р-ций и промежуточно
образующейся О-ацилизомо-чевины (II) существенно различаются. При синтезе пептидов
находят также применение разл. водорастворимые карбодиими-ды (напр., N-диметиламинопропил-N"-этилкарбодиимид).
Метод смешанных
основан на предварит. активации карбоксильной компоненты пептидного синтеза
путем образования смешанного с карбоновой или неорг. к-той. Наиб.
часто используют алкиловые эфиры хлормуравьиной (хлоругольной) к-ты, особенно
этиловый и изобутиловый эфиры, напр.:
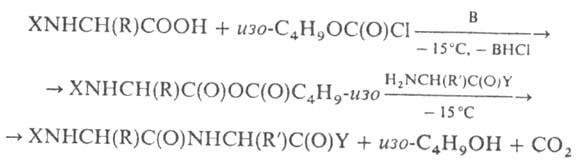
В - третичный
При синтезе пептидов по этому
методу весьма эффективны смешанные N-ациламинокислот и пивалиновой
(триметилуксусной) к-ты. Благодаря сильному положит. трет-бутилъной
группы электро-фильность карбоксильного С в остатке пивалиновой к-ты
существенно снижена, и это, наряду со стерич. препятствиями, подавляет нежелат.
побочную р-цию образования и своб. N-ациламинокислоты, к-рая осуществляется
по схеме:
В одном из вариантов метода
смешанных применяют в качестве конденсирующего агента 1-этоксикар-бонил-2-этокси-1,2-дигидрохинолин.
Это соед. легко образует с карбоксильной компонентой пептидного синтеза про-межут.
смешанный , быстро вступающий в р-цию , причем полностью
исключается нежелат. побочная р-ция.
Частный случай метода смешанных
- метод симметрич. , в к-ром используют
2 O. Их применение исключает возможность
или неправильного .
Азидный метод синтеза предусматривает
активацию карбоксильной компоненты предварит, превращением ее в N-замещенной
или пептида:
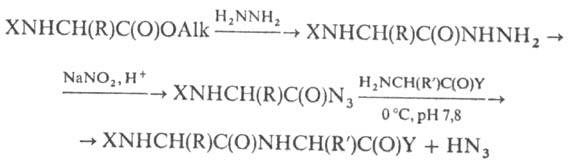
Ввиду нестойкости
их в своб. виде из р-ра, как правило, не выделяют. Если вместо для р-ции с гидразидом использовать алкиловые эфиры азотистой к-ты
(напр., трет-бутилнитрит), то азид-ную можно проводить
в орг. р-рителе; образующуюся HN 3 связывают третичными . Нередко
азидная осложняется нежелат. побочными р-циями (превращ. гидразида
не в , а в амид; р-ция
гидразида
с , ведущая к образованию 1,2-диацил-гидразина; промежут. образование
, к-рый в результате перегруппировки Курциуса может приводить к производному
или соответствующему и др.). Преимущества азидного метода-малая
степень , возможность применения и без защиты .
Для превращ. защищенных
пептидов в свободные используют спец. методы деблокирования, к-рые основаны на р-циях,
обеспечивающих отщепление разл. , гарантирующих сохранение всех
в . Примеры деблокирования: удаление оксикарбониль-ной
группы каталитич. при атм. и комнатной т-ре, отщепление
трет-бутилоксикарбонильной группы мягким , а также гидролитич.
отщепление трифторацетильной группы под действием разб. р-ров .
При синтезе биологически
активных пептидов важно, чтобы не происходила , к-рая может осуществляться
в результате обратимого отщепления H + от a
-атома С N-ациламинокислоты
или пептида. способствуют и к-ты, высокая т-ра и полярные
р-рители. Решающую роль играет , катализируемая , к-рая
может протекать по т. наз. азлактоновому механизму или через енолизацию по схеме:
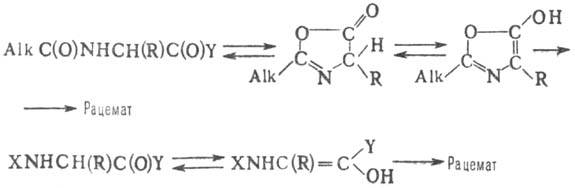
Наиб. важные способы исключения
: 1) наращивание пептидной цепи в направлении от С-конца к N-концу
с применением N-защитных
групп типа ROC(O). 2) Активация N-защищенных пептидных фрагментов с С-концевы-ми
остатками или . 3) Использование азид-ного метода (при отсутствии
избытка третичного и поддержании низких т-р в реакц. среде). 4) Применение
активир. эфиров , к-рых протекает через переходное состояние,
стабилизир. водородными мостиками (напр., эфиров, образованных с N-гидроксипипери-дином
и 8-гидроксихинолином). 5) Использование карбоди-имидного метода с
N-гидроксисоед. или к-т Льюиса.
Наряду с синтезом пептидов в
р-рах, важное значение имеет синтез пептидов с применением нерастворимых .
Он включает пептидов (р-ция, или метод, Мэр-рифилда) и синтез
пептидов с использованием полимерных .
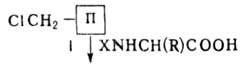
Стратегия твердофазного
пептидного синтеза предусматривает временное закрепление синтезируемой пептидной
цепи на нерастворимом полимерном и осуществляется по схеме:
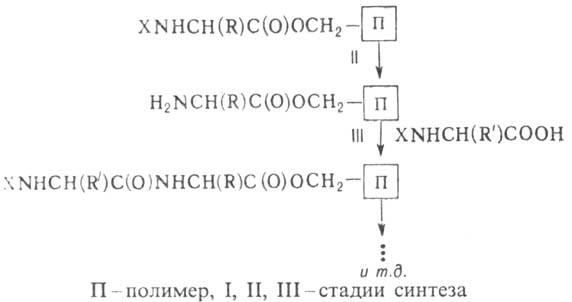
Благодаря этому способу
удалось заменить весьма сложные и трудоемкие процедуры разделения и очистки
промежут. пептидов простыми операциями промывки и , а также свести
процесс пептидного синтеза к стандартной последовательности периодически повторяющихся
процедур, легко поддающихся автоматизации. Метод Меррифилда позволил существенно
ускорить процесс синтеза пептидов. На основе этой методологии созданы разл. типы автоматич.
синтезаторов пептидов.
Соединение высокопроизводит.
пептидов с разделяющими способностями препаративной ВЭЖХ обеспечивает
выход на качественно новый уровень хим. синтеза пептидов, что, в свою очередь, благотворно
влияет на развитие разл. областей , мол. биологии, фармакологии и медицины.
Стратегия синтеза пептидов с
применением полимерных предусматривает временное связывание с высокомол.
активир. карбоксильной компоненты или конденсирующего агента пептидного
синтеза. Преимущество этого метода: закрепленные на могут
вводиться в избытке, а отделение синтезированных пептидов от нерастворимых
не представляет затруднений.
Пример такого синтеза-пропускание аминокомпоненты в заданной последовательности через неск. колонок, в каждой из к-рых находится связанный с полимерным активир. эфир определенной
Пептиды. Электронное и пространственное строение пептидной связи.
ЗАНЯТИЕ 14
ПЕПТИДЫ И БЕЛКИ: СТРУКТУРА, КЛАССИФИКАЦИЯ И ФИЗИКО-ХИМИЧЕСКИЕ СВОЙСТВА. РАСТВОРЫ ВМС
Пептиды. Электронное и пространственное строение пептидной связи.
В пептидной (амидной) группе -СО-NH- атом углерода находится в состоянии sp 2 -гибридизации. Неподеленная пара электронов атома азота вступает в сопряжение с π-электронами двойной связи С=О. С позиций электронного строения пептидная группа представляет собой трехцентровую p,π-сопряженную систему, электронная плотность в которой смещена в сторону более электроотрицательного атома кислорода. Атомы С, О и N, образующие сопряженную систему, находятся в одной плоскости. Распределение электронной плотности в амидной группе можно представить с помощью граничных структур (I) и (II) или смещения электронной плотности в результате +M- и - M-эффектов групп NH и C=O соответственно (III).
В результате сопряжения происходит некоторое выравнивание длин связей. Двойная связь С=О удлиняется до 0,124 нм против обычной длины 0,121 нм, а связь С-N становится короче - 0,132 нм по сравнению с 0,147 нм в обычном случае (рис. 1). Плоская сопряженная система в пептидной группе служит причиной затруднения вращения вокруг связи С-N (барьер вращения составляет 63-84 кДж/моль). Таким образом, электронное строение предопределяет достаточно жесткую плоскую структуру пептидной группы.
Как видно из рис. 1, α-атомы углерода аминокислотных остатков располагаются в плоскости пептидной группы по разные стороны от связи С-N, т. е. в более выгодном тpанс-положении: боковые радикалы R аминокислотных остатков в этом случае будут наиболее удалены друг от друга в пространстве.
Полипептидная цепь имеет удивительно однотипное строение и может быть представлена в виде ряда расположенных под углом друг к другу плоскостей пептидных
![]()
Рис. 1. Плоскостное расположение пептидной группы -CO-NH- и α-атомов углерода аминокислотных остатков
групп, соединенных между собой через α-атомы углерода связями Сα-N и Сα-Сsp 2 (рис. 2). Вращение вокруг этих одинарных связей весьма ограничено вследствие затруднений в пространственном размещении боковых радикалов аминокислотных остатков. Таким образом, электронное и пространственное строение пептидной группы во многом предопределяет структуру полипептидной цепи в целом.