Как из кислоты получить аминокислоту. Методы получения аминокислот
План:
1. Общая характеристика аминокислот: определение, классификация, номенклатура, изомерия.
2. Способы получения, физические и химические свойства, области применения аминокислот.
3. Общая характеристика белков: определение, классификация, образование пептидной связи, структура.
4. Способы получения, физические и химические свойства, функции белков.
Аминокислоты – это органические соединения, молекулы которых содержат одновременно аминогруппу (– NH 2 ) и карбоксильную группу (–СООН).
В состав аминокислот может входить несколько амино- и карбоксильных групп. Например:
α, ε-диаминокапроновая кислота
(лизин)

α -аминоглутаровая кислота
(глутаминовая кислота)
Названия аминокислот производят от названия соответствующих карбоновых кислот, в которых один или несколько атомов водорода в углеводородном радикале замещены аминогруппами. Например:
СН 3 –СООН  H 2 N–СН 2 –СООН
H 2 N–СН 2 –СООН
Уксусная кислота аминоуксусная кислота
И зомерия аминокислот определяется расположением аминогруппы и строением углеводородного радикала. Различают α
-аминокислоты (аминогруппа находится у первого атома углерода, считая от карбоксильной группы), (β
-аминокислоты (аминогруппа находится у второго атома углерода), γ-аминокислоты (аминогруппа находится у третьего атома углерода).
зомерия аминокислот определяется расположением аминогруппы и строением углеводородного радикала. Различают α
-аминокислоты (аминогруппа находится у первого атома углерода, считая от карбоксильной группы), (β
-аминокислоты (аминогруппа находится у второго атома углерода), γ-аминокислоты (аминогруппа находится у третьего атома углерода).
Например: СН 3 –СН 2 –СООН
пропионовая кислота
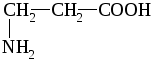
α-аминопропионовая кислота
(аланин)
β-аминопропионовая кислота
Изомерию аминокислот, обусловленную положением группы –NH 2 и разветвлением углеводородного радикала, покажем на примере аминокислоты состава C 3 H 6 (NH 2)COOH:

α -аминомасляная кислота

β -аминомасляная кислота

γ -аминомасляная кислота

α -аминоизомасляная кислота

β -аминоизомасляная кислота
Наиболее важное значение имеют α -аминокислоты, которые широко распространены в природе и из которых построены белки.
В молекуле белка остатки α -аминокислот соединены между собой пептидными (амидными) связями:

Группировки атомов называются остатками аминокислот, а

Группировки атомов – пептидными группами (не путать с пептидными связями).
Важнейшие α -аминокислоты представлены в таблице 1.
Таблица 1 - Важнейшие α -аминокислоты
| Формула аминокислоты | Название |
| CH 2 (NH 2)–COOH | Глицин (гликокол) |
| CH 3 –CH(NH 2)–СООН | Аланин |
| СН 3 –СН(СН 3)–CH(NH 2)–COOH | Валин |
| CH 3 –CH(CH 3)–CH 2 –CH(NH 2)–COOH | Лейцин |
| CH 3 –CH 2 –CH(CH 3)–CH(NH 2)–COOH | Изолейцин |
| CH 2 (OH)–CH(NH 2)–СООН | Серин |
| CH 3 –CH(OH)–CH(NH 2)–СООН | Треонин |
| CH 2 (SH)–CH(NH 2)–COOH | Цистеин |
| HOOC–CH(NH 2)–CH 2 –S HOOC–CH(NH 2)–CH 2 –S | Цистин |
| CH 2 (SCH 3)–CH 2 –CH(NH 2)–COOH | Метионин |
| HOOC–CH 2 –CH(NH 2)–COOH | Аспарагиновая кислота |
| H 2 N(O)C–CH 2 –CH(NH 2)–COOH | Аспарагин |
| HOOC–(CH 2) 2 –CH(NH 2)–COOH | Глутаминовая кислота |
| H 2 N(O)C–(CH 2) 2 –CH(NH 2)–COOH | Глутамин |
| H 2 N–(CH 2) 4 –CH(NH 2)–COOH | Лизин |
| H 2 N–C(=NH)–NH–(CH 2) 3 –CH(NH 2)–COOH | Аргинин |
| C 6 H 5 –CH 2 –CH(NH 2)–COOH | Фенилаланин |
| n -HO–C 6 H 4 –CH 2 –CH(NH 2)–COOH | Тирозин |
  | Пролин |
| Гидроксипролин |
|
 | Триптофан |
 | Гистидин |
Способы получения аминокислот:
1. Действие аммиака на галогензамещенные карбоновые кислоты:
А )
)
2NH 3  + NH 4 Cl
+ NH 4 Cl
α-хлорпропионовая кислота аланин

Б) СН 3 СООН +Сl 2  + НСl
+ НСl
хлоруксусная кислота

2NH 3 + NH 4 Сl
глицин
2. Гидролитический метод, заключающийся в гидролизе белков и пептидов, например:

 +
+
глицилаланин (дипептид) глицин аланин
3. Ферментативный метод – образование аминокислот в процессе жизнедеятельности организма под воздействием ферментов.
4
 . Взаимодействие фталимида калия с галогензамещенными карбоновыми кислотами:
. Взаимодействие фталимида калия с галогензамещенными карбоновыми кислотами:

+ 



5. Циангидринный метод:


R–CHO 


6. Присоединение аммиака к непредельным кислотам:

R–СН=СН–СООН
Физические свойства аминокислот
Аминокислоты – твердые кристаллические вещества, хорошо растворимые в воде и спирте и нерастворимые в эфире. Температура плавления аминокислот выше 250 0 С. В природе найдено несколько сотен аминокислот. Они входят в состав белков, пептидов и других физиологически активных соединений. Такие аминокислоты, как аспарагиновая кислота, валин, гистидин, глицин, глутамин, серин, не растворяются в спирте и эфире. Изолейцин, лейцин, лизин, метионин, тирозин не растворяются в спирте. Триптофан растворяется в воде, горячем спирте, не растворяется в хлороформе (СНСl 3). Ограниченно растворим в этаноле и метаноле, а цистеин растворяется в эфире, ацетоне и бензоле.
Химические свойства аминокислот
1. Аминокислоты можно отнести к своеобразным амфотерным соединениям, амфотерные свойства которых объясняются взаимодействием аминной и карбоксильной групп в молекуле аминокислоты. Это взаимодействие заключается в следующем: карбоксильная группа аминокислоты отщепляет ион водорода, который присоединяется к аминогруппе той же молекулы по месту неподеленной пары электронов азота:
Внутренняя соль
В результате такого взаимодействия функциональных групп образуется так называемая внутренняя соль, а в растворе нет избытка ионов Н + или ОН ─ ; такой раствор не действует на индикатор (например, фенолфталеин или лакмус).


глутаминовая кислота лизин
Амфотерный характер аминокислот подтверждается взаимодействием их с кислотами и щелочами с образованием солей: при повышении концентрации ионов ОН - в растворе аминокислоты она реагирует как кислота (в форме аниона), а при повышении концентрации ионов Н + – как основание (в форме катиона):
H 2 N–CH 2 –COO - H 3 N + –CH 2 –COO - H 3 N + –CH 2 –COOH
анион биполярный ион катион
(в щелочной среде) (в нейтральной среде) (в кислой среде)
2. Реакции с участием карбоксильной группы:
А) реакции с основаниями:

NaOH + Н 2 О
натриевая соль
аминоуксусной кислоты
Б ) реакции со спиртами:
) реакции со спиртами:
СН 3 ОН  + Н 2 О
+ Н 2 О
метиловый эфир
аминоуксусной кислоты
3. Реакции с участием аминогруппы:
А) реакции с минеральными кислотами:

хлорид аммониевой соли
аминоуксусной кислоты
б) реакции с галогеналканами:


СН 3 Сl +НСl
N -метил-α-аминопропионовая кислота
4. Реакции с участием амино- и карбоксильных групп:
А) образование дипептидов:


+


дипептид
б) внутримолекулярная циклизация:


 + Н 2 О
+ Н 2 О
ε –аминокапроновая ε -капролактам
кислота
5. Реакции с металлами и их оксидами:
2H 2 N–CH 2 –COOH + 2Na 2H 2 N–CH 2 –COONa + Н 2
2H 2 N–СН 2 –СООН + Na 2 O 2H 2 N–CH 2 –COONa + H 2 O
Области применения аминокислот
Мировое производство аминокислот превышает 450 тыс. т в год.
1. Как исходный продукт для получения полиамидов, красителей и лекарственных препаратов.
2. Аминокислоты, полученные искусственным путем, используются в животноводстве в качестве пищевых добавок.
3. Получение синтетических волокон (ε-аминокапроновая кислота) для производства капронового волокна.
4. В фармакологии, для получения средств защиты растений; в синтезе физиологически активных пептидов.
5. В медицине:
п -аминобензойная кислота – для получения анестезина и новокаина, глутаминовая кислота – для лечения заболеваний нервной системы; цистеин – для лечения глазных болезней; гистидин – для лечения заболеваний печени.
Белки – это органические соединения (биополимеры), которые состоят из остатков α -аминокислот, связанных пептидными связями (CO – NH ).
В качестве основных химических элементов белки содержат углерод, водород, кислород, азот и серу. Белки более сложного состава – протеиды – содержат фосфор (липопротеиды, нуклеопротеиды, фосфопротеиды) и железо (гемоглобин). Белки являются основой всего живого, они входят в состав клеток и тканей живых организмов, являются составной частью пищи человека и играют главную роль в реализации генетической информации и катализе почти всех химических реакций, идущих в живых организмах; на долю белков приходится большая часть массы живых организмов.
Различают простые белки , молекулы которых построены только из остатков аминокислот, и сложные , представляющие собой биологически активные комплексы белков с небелковыми веществами (протеиды).
В белках аминокислоты соединены между собой пептидными связями (СО–NH), образование которых происходит в результате взаимодействия карбоксила одной аминокислоты с аминогруппой другой. Например:

глицин аланин

глицилаланин (дипептид)
У образовавшегося дипептида на концах молекулы находятся те же функциональные группы, что и в каждой аминокислоте, и поэтому дипептид может одним из его концов вступать в реакцию с третьей аминокислотой:



глицилаланилцистеин (трипептид)
Структура макромолекул белков показана на рисунке 1.
 |
Рисунок 1 - Структура белков
Первичная структура молекулы белка представлена соединением аминокислотных звеньев в определенной последовательности; R 1 , R 2 , R 3 , R 4 – аминокислотные остатки.
В торичная (спиралевидная) структура
молекулы белка характеризуется образованием спирали за счет водородных связей (полипептидная цепь со спиральной структурой).
торичная (спиралевидная) структура
молекулы белка характеризуется образованием спирали за счет водородных связей (полипептидная цепь со спиральной структурой).
Третичная структура
возникает в процессе укладки в пространстве вторичной структуры и поддерживается взаимодействием между функциональными группами радикалов полипептидной цепи. Например, за счет образования дисульфидных мостиков (
В человеческом организме содержится несколько десятков тысяч различных белков, синтезируемых из соответствующих аминокислот.
Наличие в белках разнообразных функциональных групп не позволяет отнести их к какому-либо одному из известных классов органических соединений. По этой причине в белках объединяются признаки разных классов, определяющие в своем сочетании особое новое качество белков, позволяющее считать их высшей формой развития органических веществ.
Физические свойства белков
По агрегатному состоянию различают жидкие (студнеобразные белки), растворимые в воде, и твердые белки, нерастворимые в воде.
Структурно различают фибриллярные белки (длинные нитевидные молекулы), нерастворимые в воде, и глобулярные (компактные структуры сферической формы), растворимые в воде.
При растворении белков в воде образуется молекулярно-дисперсная система (раствор высокомолекулярного вещества). Белки содержатся в мясе, молоке, в зерновых и бобовых культурах, в рыбе и других продуктах моря.
Химические свойства белков
Качественные реакции на белки.
По составу белки делятся на две группы:
1) простые белки (протеины), распадающиеся при гидролизе на аминокислоты,
2) сложные белки (протеиды), образующие при гидролизе аминокислоты и вещества небелковой природы.
1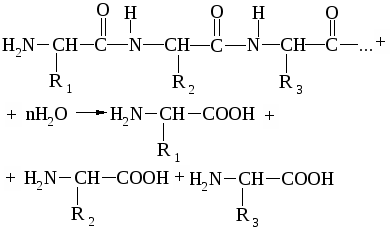 . Реакции гидролиза белков при нагревании со щелочами или кислотами:
. Реакции гидролиза белков при нагревании со щелочами или кислотами:
Такие реакции идут и под действием ферментов.
2. Качественные реакции на белки:
А) Биуретовая реакция:
Белок комплексное соединение
комплексное соединение
(ярко-фиолетовое окрашивание)
б) Ксантопротеиновая реакция:

(желтое окрашивание)
Это цветная реакция на концевые ароматические группы аминокислотных остатков тирозина (приведенный пример) и триптофана.
в) Цистиновая реакция – образование черного осадка PbS при кипячении белка, содержащего серу, со щелочью и ацетатом свинца.
г) Миллонова реакция – образование красного осадка при кипячении белка с раствором нитрата ртути (II ), содержащим азотистую кислоту.
3. Денатурация белков – дезориентация конфигурации белковой молекулы (α-спираль превращается в разупорядоченную белковую цепь при воздействии сильных кислот и щелочей, нагревании, действии радиации, сильном встряхивании и т. п.).
Функции белков
Белки – основа кожи, шерсти, шелка и других натуральных материалов; они являются важнейшими компонентами пищи человека и корма животных. В организме человека белки могут выполнять различные функции:
каталитическую (ферменты),
регуляторную (гормоны),
строительную (структурообразующие белки),
двигательную (сократительные белки),
транспортную (транспортные белки),
защитную (антитела),
энергетическую (белки, участвующие в энергетическом обмене).
Суточная потребность взрослого человека в белках – 70-80 г. Ресурсы пищевого и кормового белка можно увеличить путем добавления в них лизина, метионина и др.
Отправить свою хорошую работу в базу знаний просто. Используйте форму, расположенную ниже
Студенты, аспиранты, молодые ученые, использующие базу знаний в своей учебе и работе, будут вам очень благодарны.
Размещено на http://www.allbest.ru/
А минокислоты
Любое соединение, которое содержит одновременно карбоксильную и аминогруппу, является аминокислотой . Однако, чаще этот термин применяется для обозначения карбоновых кислот, аминогруппа которых находится в ? -положении к карбоксильной группе.
аминокислота свойство получение
Аминокислоты, как правило, входят в состав полимеров - белков . В природе встречается свыше 70 аминокислот, но только 20 играют важную роль в живых организмах. Незаменимыми называются аминокислоты, которые не могут быть синтезированы организмом из веществ, поступающих с пищей, в количествах, достаточных для того, чтобы удовлетворить физиологические потребности организма. Незаменимые аминокислоты приводятся в табл. 1. Для больных фенилкетонурией незаменимой аминокислотой является также тирозин (см. табл. 1).
Таблица 1. Незаменимые аминокислоты R-CHNH2COOH
|
Название (сокращение) |
||
|
изолейцин (ile, ileu) |
CH 3 CH 2 CH(CH) 3 - |
|
|
лейцин (leu) |
(CH 3 ) 2 CHCH 2 - |
|
|
лизин (lys) |
NH 2 CH 2 CH 2 CH 2 CH 2 - |
|
|
метионин (met) |
CH 3 SCH 2 CH 2 - |
|
|
фенилаланин (phe) |
C 6 H 5 CH 2 - |
|
|
треонин (thr) |
CH 3 CH(OH)- |
|
|
триптофан (try) |
||
|
валин (val) |
(CH 3 ) 2 CH- |
|
|
тирозин (tyr) |
Аминокислоты называют обычно как замещенные соответствующих карбоновых кислот, обозначая положение аминогруппы буквами греческого алфавита. Для простейших аминокислот обычно применяются тривиальные названия (глицин, аланин, изолейцин и т.д.). Изомерия аминокислот связана с расположением функциональных групп и со строением углеводородного скелета. Молекула аминокислоты моет содержать одну или несколько карбоксильных групп и в соответствии с этим аминокислоты различаются по основности. Также в молекуле аминокислоты может находиться разное количество аминогрупп.
С пособы получения аминокислот
1. Гидролизом белков можно получить около 25 аминокислот, но полученную смесь трудно разделить. Обычно одна или две кислоты получаются в значительно больших количествах, чем остальные, и эти кислоты удается выделить довольно легко - с помощью ионообменных смол.
2. Из галогензамещенных кислот. Один из наиболее распространенных методов синтеза ? -аминокислот заключается в аммонолизе ? -галогензамещенной кислоты, которую обычно получают по реакции Геля-Фольгарда-Зелинского:
Этот метод можно модифицировать, получая?-бромзамещенную кислоту через малоновый эфир:
Ввести аминогруппу в эфир?-галогензамещенной кислоты можно с помощью фталимида калия (синтез Габриэля ):
3. Из карбонильных соединений (синтез Штреккера ). Синтез?-аминокислот по Штреккеру состоит в реакции карбонильного соединения со смесью хлорида аммония и цианистого натрия (это усовершенствование метода предложено Н.Д. Зелинским и Г.Л. Стадниковым).
Реакции присоединения - отщепления с участием аммиака и карбонильного соединения дают имин, который реагирует с цианистым водородом, образуя?-аминонитрил. В результате его гидролиза образуется?-аминокислота.
Х имические свойства аминокислот
Все?-аминокислоты, кроме глицина, содержат хиральный?-углеродный атом и могут встречаться в виде энантиомеров :
Было доказано, что почти все природные?-аминокислоты обладают одной и той же относительной конфигурацией при?-углеродном атоме. ?-Углеродному атому (-)-серина была условно приписана L -конфигурация, а?-углеродному атому (+)-серина - D -конфигурация. При этом, если проекция?-аминокислоты по Фишеру написана так, что карбоксильная группа расположена сверху, а R - внизу, у L -аминокислоты аминогруппа будет находиться слева, а у D -аминокислоты - справа. Схема Фишера для определения конфигурации аминокислоты применима ко всем?-аминокислотам, обладающим хиральным?-углеродным атомом.
Из рисунка видно, что L -аминокислота может быть правовращающей (+) или левовращающей (-) в зависимости от природы радикала. Подавляющее большинство?-аминокислот, встречающихся в природе, относится к L -ряду. Их энантиоморфы , т.е. D -аминокислоты, синтезируются только микроорганизмами и называются «неприродными» аминокислотами .
Согласно номенклатуре (R,S), большинство «природных» или L-аминокислот имеет S-конфигурацию.
L-Изолейцин и L-треонин, содержащие по два хиральных центра в молекуле, могут быть любыми членами пары диастереомеров в зависимости от конфигурации при Я-углеродном атоме. Ниже приводятся правильные абсолютные конфигурации этих аминокислот.
К ислотно-основные свойства аминокислот
Аминокислоты - амфотерные вещества, которые могут существовать в виде катионов или анионов. Это свойство объясняется наличием как кислотной (-СООН ), так и основной (- NH 2 ) группы в одной и той же молекуле. В очень кислых растворах NH 2 -группа кислоты протонируется и кислота становится катионом. В сильнощелочных растворах карбоксильная группа аминокислоты депротонируется и кислота превращается в анион.
В твердом состоянии аминокислоты существуют в виде цвиттер-ионов (биполярных ионов, внутренних солей ). В цвиттер-ионах протон переносится от карбоксильной группы к аминогруппе:
Если поместить аминокислоту в среду, обладающую проводимостью, и опустить туда пару электродов, то в кислых растворах аминокислота будет мигрировать к катоду, а в щелочных растворах - к аноду. При некотором значении рН, характерном для данной аминокислоты, она не будет передвигаться ни к аноду, ни к катоду, так как каждая молекула находится в виде цвиттер-иона (несет и положительный, и отрицательный заряд). Это значение рН называется изоэлектрической точкой (pI) данной аминокислоты.
Р еакции аминокислот
Большинство реакций, в которые аминокислоты вступают в лабораторных условиях (in vitro ), свойственны всем аминам или карбоновым кислотам.
1. образование амидов по карбоксильной группе. При реакции карбонильной группы аминокислоты с аминогруппой амина параллельно протекает реакция поликонденсации аминокислоты, приводящей к образованию амидов. Чтобы предотвратить полимеризацию, аминогруппу кислоты блокируют с тем, чтобы в реакцию вступала только аминогруппа амина. С этой целью используют карбобензоксихлорид (карбобензилоксихлорид, бензилхлорформиат), трет -бутоксикарбоксазид и др. Для реакции с амином карбоксильную группу активируют, воздействуя на нее этилхлорформиатом. Защитную группу затем удаляют путем каталитического гидрогенолиза или действием холодного раствора бромистого водорода в уксусной кислоте.
2. образование амидов по аминогруппе. При ацилировании аминогруппы?-аминокислоты образуется амид.
Реакция лучше идет в основной среде, так как при этом обеспечивается высокая концентрация свободного амина.
3. образование сложных эфиров. Карбоксильная группа аминокислоты легко этерифицируется обычными методами. Например, метиловые эфиры получают, пропуская сухой газообразный хлористый водород через раствор аминокислоты в метаноле:
Аминокислоты способны к поликонденсации, в результате которой образуется полиамид. Полиамиды, состоящие из?-аминокислот, называются пептидами или полипептидами . Амидная связь в таких полимерах называется пептидной связью . Полипептиды с молекулярной массой не меньше 5000 называют белками . В состав белков входит около 25 различных аминокислот. При гидролизе данного белка могут образовываться все эти аминокислоты или некоторые из них в определенных пропорциях, характерных для отдельного белка.
Уникальная последовательность аминокислотных остатков в цепи, присущая данному белку, называется первичной структурой белка . Особенности скручивания цепей белковых молекул (взаимное расположение фрагментов в пространстве) называются вторичной структурой белков . Полипептидные цепи белков могут соединяться между собой с образованием амидных, дисульфидных, водородных и иных связей за счет боковых цепей аминокислот. В результате этого происходит закручивание спирали в клубок. Эта особенность строения называется третичной структурой белка . Для проявления биологической активности некоторые белки должны сначала образовать макрокомплекс (олигопротеин ), состоящий из нескольких полноценных белковых субъединиц. Четвертичная структура определяет степень ассоциации таких мономеров в биологически активном материале.
Белки делятся на две большие группы - фибриллярные (отношение длины молекулы к ширине больше 10) и глобулярные (отношение меньше 10). К фибриллярным белкам относится коллаген , наиболее распространенный белок позвоночных; на его долю приходится почти 50% сухого веса хрящей и около 30% твердого вещества кости. В большинстве регуляторных систем растений и животных катализ осуществляется глобулярными белками, которые носят название ферментов .
Размещено на Allbest.ru
Подобные документы
Определение класса аминокислот как гетерофункциональных соединений, которые содержат две функциональные группы (карбоксильную и аминогруппу), связанные с углеводородным радикалом. Классификация, изомерия, свойства, получение и применение аминокислот.
презентация , добавлен 10.04.2013
Физико-химические свойства аминокислот. Получение аминокислот в ходе гидролиза белков или как результат химических реакций. Ряд веществ, способных выполнять некоторые биологические функции аминокислот. Способность аминокислоты к поликонденсации.
презентация , добавлен 22.05.2012
Аминокислота - любое соединение, которое содержит одновременно карбоксильную и аминогруппу. Способы ее получения. Химические и кислотно-основные свойства. Реакции аминокислот: образование сложных эфиров и амидов по карбоксильной группе и по аминогруппе.
реферат , добавлен 21.02.2009
Общая формула и характеристика аминокислот как производных кислот. Протеиногенные кислоты, входящие в состав белков. Классификация аминокислот по взаимному расположению и количеству функциональных групп. Физические и химические свойства аминокислот.
презентация , добавлен 22.01.2012
Химические свойства и характеристика аминокислот, изомерия. Классификация стандартных a-аминокислот по R-группам и по функциональным группам. Кислотно-основное равновесие в растворе a-аминокислот. Использование нингидриновой реакции для их обнаружения.
реферат , добавлен 22.03.2012
Биохимические свойства аминокислот - органических соединений, в молекулах которых один или несколько атомов водорода углеродной цепи замещены на группу -NH2. Аминокислоты как пищевая добавка. Аминокислотные препараты. Биологическая роль аминокислот.
презентация , добавлен 27.02.2017
Номенклатура аминов, их физические и химические свойства. Промышленные и лабораторные способы получения аминов. Классификация аминокислот и белковых веществ. Строение белковых молекул. Катализ биохимических реакций с участием ферментов (энзимов).
реферат , добавлен 01.05.2011
Классификация аминокислот и виды их изомерии. Химические свойства аминокислот, зависящие от наличия карбоксила, аминогруппы, совместного наличия карбоксильной и аминогруппы. Окислительно-восстановительные процессы, протекающие с участием кислот.
реферат , добавлен 22.06.2010
Понятие и общая характеристика представителей алифатических аминокислот. Ароматические аминокислоты: сущность, применение, методика получение. Реакции по карбоксильной группе. Анализ белковых молекул. Пространственное строение данных соединений.
контрольная работа , добавлен 05.08.2013
Белки – высокомолекулярные азотсодержащие органические вещества, молекулы которых построены из остатков аминокислот. Наследственная информация сосредоточена в молекуле ДНК. С помощью белков реализуется генетическая информация. Классификация аминокислот.
Производство аминокислот
Среди соединений, получаемых биотехнологическими методами, аминокислоты занимают первое место по объему производства и второе место по стоимости, уступая по последнему параметру антибиотикам. Объем мирового производства аминокислот составляет более 500 тыс. т в год. Однако указанный объем – лишь небольшая доля от требуемого количества аминокислот. По данным ВОЗ, потребность человечества всего лишь в четырех незаменимых аминокислотах составляет, млн т: для лизина – 5, метионина – 4, треонина – 3,7 и триптофана – 2.
В промышленных масштабах белковые аминокислоты получают:
· гидролизом природного белоксодержащего сырья;
· химическим синтезом;
· микробиологическим синтезом;
· биотрансформацией предшественников аминокислот с помощью микроорганизмов или выделенных из них ферментов (химико-микробиологический метод).
Гидролиз природного белоксодержащего сырья. При гидролизе белоксодержащее сырье (отходы пищевой и молочной промышленности) нагревают с растворами кислот или щелочей при температуре 100 – 105 °С в течение 20 – 48 ч. Чаще всего используют 20 %-й раствор соляной кислоты, обеспечивающий глубокий гидролиз белка. В ходе кислотного гидролиза белков происходят рацемизация и разрушение некоторых составляющих их аминокислот. При кислотном гидролизе полностью разрушается триптофан и достаточно значительны потери цистеина, метионина и тирозина (10 – 30 %). Кроме того, для ускорения реакции гидролиза белков используют иммобилизованные протеолитические ферменты и ионообменные смолы. Аминокислоты, полученные методом гидролиза, используют, в медицине, животноводстве, пищевой и микробиологической промышленности.
Химический синтез. Используя метод химического синтеза аминокислот целевой продукт получают в виде рацемической смеси D- и L-стереоизомерных форм. Подавляющее большинство природных аминокислот относится к L-ряду. D-α-аминокислоты обнаружены лишь в составе гликопротеинов клеточных стенок бактерий, антибиотиков и некоторых токсинов. Проницаемость L-аминокислот в клетке в 500 раз превышает таковую ее антипода. Стереоспецифичны также транспорт и метаболизм аминокислот. Разделение рацематов других аминокислот – дорогая и чрезвычайно трудоемкая процедура.
Исключением в этом отношении является лишь метионин, метаболизм которого нестереоизбирателен, благодаря чему данная аминокислота получается преимущественно путем химического синтеза, что экономически более выгодно в сравнении с микробиологическим способом.
Микробиологический синтез. Наиболее перспективен и экономически выгоден микробиологический синтез аминокислот. Более 60 % всех производимых в настоящее время промышленностью высокоочищенных препаратов белковых аминокислот получают именно этим способом, главное преимущество которого в сравнении с методами химического синтеза состоит в возможности получения L-аминокислот на основе возобновляемого сырья.
Большинство диких штаммов микроорганизмов способны продуцировать аминокислоты во внешнюю среду в очень незначительных количествах. Среди возможных продуцентов глутаминовой кислоты отмечены организмы, из которых 30 % – дрожжи, 30 % – стрептомицеты, 20 % – бактерии и 10 % – микроскопические грибы.
Перспективные штаммы продуцентов постоянно улучшают посредством селекции мутантов с измененной генетической программой и регуляторными свойствами. Распространенные объекты селекции продуцентов – микроорганизмы, относящиеся к родам Brevibacterium, Micrococcus, Corynebacterium, Arthrobacter (табл. 8.1).
Таблица 8.1.
Микроорганизмы – продуценты аминокислот
Разработка технологической схемы получения отдельной аминокислоты базируется на знании путей и механизмов регуляции биосинтеза конкретной аминокислоты. Необходимого дисбаланса метаболизма, обеспечивающего сверхсинтез целевого продукта, добиваются путем строго контролируемых изменений состава и условий среды.
Производство лизина. В клетках микроорганизмов лизин синтезируется из аспарагиновой кислоты и служит конечным продуктом разветвленного метаболического пути биосинтеза, общего для трех аминокислот – лизина, метионина и треонина (рис.8.2). В процессе образования аминокислот из общего предшественника одновременно с лизином возникают две другие аминокислоты – метионин и треонин. В этом случае эффекта накопления в среде всего одной целевой аминокислоты добиваются путем блокирования процессов, ведущих к синтезу побочных аминокислот, возникающих в связи с разветвлением метаболического пути.
При накоплении треонина и лизина в избыточной концентрации инги-бируется аспартаткиназа и их синтез останавливается, при пониженной концентрации любой из двух аминокислот процесс активизируется.
Чтобы добиться о бразования лизина в больших количествах, получают мутанты двух типов. У мутантов первого типа не синтезируется или не функционирует гомосериндегидрогеназа, в результате чего блокируется синтез метионина и треонина. Такие мутанты являются ауксотрофами по гомосерину или треонину (метионину); внутриклеточная концентрация треонина у них существенно снижена, что снимает блокаду с аспартаткиназы.
Мутанты второго типа дефектны по структурному гену, детерминирующему конформацию аспартаткиназы. В итоге фермент теряет чувствительность к концентрациям аллостерического ингибитора – лизина.
Технология получения. В качестве источников углерода для культивирования продуцентов лизина используют вторичное сырье: свекловичную мелассу, молочную сыворотку, гидролизаты крахмала, сульфитные щелока. Источниками азота являются мочевина и соли аммония. Кроме того, в питательную среду добавляют необходимые для жизнедеятельности макро- и микроэлементы (Р, Са, Mg, Mn, Fe и др.); стимуляторы роста, в качестве которых выступают экстракты кукурузы, дрожжей и солодовых ростков, гидролизаты отрубей и дрожжей, витамины группы В. Степень аэрации индивидуальна для производства каждого конкретной продуцента.
Лизин появляется в культуральной среде начиная с середины экспоненциальной фазы роста культуры и достигает максимума к ее концу. Поэтому на первой стадии технологического процесса формируют биомассу продуцента, которую выращивают в специальных посевных аппаратах в течение суток (рН 7,0 – 7,2; температура 28 – 30 °С), а затем подают в производственный ферментер, заполненный питательной средой. Лизин начинает поступать в культуральную жидкость через 25 – 30 ч после начала ферментации. Важный фактор, обеспечивающий в культуральной среде высокие концентрации аминокислоты, синтезированной внутри клетки, – проницаемость клеточных мембран. Проницаемость клеточной мембраны увеличивают либо с помощью мутаций, либо путем изменения состава питательной среды. В последнем случае в культуральной среде создают дефицит биотина (1 – 5 мкл/л), добавляют пенициллин (2 – 4 мкг/л), детергенты (твин-40 и твин-60) или производные высших жирных кислот (пальмитаты, стеараты). Биотин контролирует содержание в клеточной мембране фосфолипидов, а пенициллин нарушает биосинтез клеточных стенок бактерий, что повышает выделение аминокислот в среду.
По завершении процесса ферментации (через 55 – 72 ч) жидкую фазу отделяют от культуры клеток микроорганизма фильтрованием и используют для выделения из нее лизина.
Высокоочищенные препараты лизина получают после фракционирования фильтрата культуральной жидкости методом ионообменной хроматографии на катионите. С этой целью лизин переводят в форму катиона:
H 3 N-СН-СООН
Для данного процесса фильтрат обрабатывают соляной кислотой до рН 1,6 – 2,0. Обладая двумя положительно заряженными ионогенными группировками, лизин прочно сорбируется на смоле и элюируется с нее в виде индивидуального соединения 0,5 – 5 %-м раствором гидроксида аммония после выхода всех других катионов. Элюат концентрируют в вакууме при температуре 60 о С, переводят в форму монохлоргидрата, после чего высушивают и дополнительно чистят с помощью перекристаллизации. В результате получают препараты кристаллического лизина 97 – 98 %-й чистоты, которые используют для повышения питательной ценности пищевых продуктов и в медицинской промышленности.
Кроме высокоочищенных препаратов лизина получают иные виды его товарной формы: жидкий концентрат лизина (ЖКЛ), сухой кормовой концентрат лизина (ККЛ) и высококонцентрированные кормовые препараты, характеризующиеся относительно меньшей степенью очистки в сравнении с первым препаратом.
Производство триптофана. Метаболический путь и характеристика продуцентов. Подобно лизину триптофан образуется в ходе разветвленного метаболического пути (рис.8.3).

Рис.8.3. Метаболический путь синтеза триптофана
Однако при использовании ауксотрофных мутантов, у которых блокированы реакции, ведущие к синтезу фенилаланина и тирозина в среде, избыточное накопление триптофана в среде не наблюдается, что объясняется особенностью регуляции биосинтеза триптофана у микроорганизмов. Метаболическим предшественником триптофана служит антраниловая кислота, которая возникает из хоризмовой кислоты под действием антранилатсинтетазы. Триптофан оказывает ингибирующее действие на антранилатсинтетазу, поэтому для обхода метаболического контроля синтез фермента индуцируют ступенчатым введением предшественника – антраниловой кислоты.
В связи с этой особенностью промышленное производство триптофана организовано преимущественно по двухступенчатой схеме.
Технология получения. На первом этапе химическим способом синтезируют антраниловую кислоту, которую с помощью энзиматической системы мутантных штаммов дрожжей Candida utilis переводят в триптофан.
Биомассу дрожжей выращивают при температуре 30 °С в среде, содержащей свекловичную мелассу, мочевину и минеральные компоненты. Через сутки в ферментер вводят 5 %-й спиртовой раствор антраниловой кислоты и 50 %-й раствор мочевины, а через 3 – 4 ч после введения предшественника дополнительно добавляют источник углерода (25 %-й раствор мелассы). Антраниловую кислоту и мочевину подают через каждые 6 ч, а мелассу – через каждые 12 ч. Процесс двухступенчатой ферментации завершается через 144 ч и обеспечивает содержание триптофана в культуральной среде до 6 г/л.
После сушки культуральной жидкости получают кормовой концентрат триптофана (ККТ), который включает белки, свободный триптофан, витамины В 1 В 2 и PP. Высокоочищенные кристаллические препараты триптофана образуются после дополнительной очистки культуральной жидкости методом ионообменной хроматографии на колонке, заполненной катионитом (сорбция при рН 1,0; элюция 5%-м раствором гидроксида аммония в смеси с пропанолом-2). Элюаты кристаллизуют; кристаллы отмывают и высушивают. Кристаллический препарат содержит до 99 % триптофана.
Кроме триптофана микробиологическим способом с использованием предшественников получают гистидин, изолейцин, метионин, серии и треонин.
Химико-микробиологический метод. В последние годы при производстве аминокислот все шире используют биотрансформацию предшественников аминокислот, с помощью иммобилизованных ферментов или клеток микроорганизмов, предварительно получаемых химическим путем.
Применение ферментов в производстве аминокислот обеспечивает стереоспецифичность процессов их синтеза, что выгодно отличает биотехнологические производства от химических.
Получение L-лизина.
Процесс получения лизина основан на стереоспецифическом ферментативном гидролизе (конверсии) D-,L-α-амино-ε-капролактама, который сначала получают химическим путем из циклогексена: 
Рацемат используют в качестве субстрата, который под действием фермента L- α-амино-ε-капролактамгидролазы (лактамаза) превращается в L-лизин, а оставшаяся непрореагировавшая его часть (D-форма) переводится при воздействии рацемазы в смесь антиподов:
Лактамаза найдена у некоторых видов дрожжей и бактерий, в частности у Candida laurentii . При производстве лизина в водный раствор D-,L-α-амино-ε-капролактама одновременно вводят источники лактамазы и рацемазы, содержащиеся в дрожжевых и бактериальных клетках. Процесс осуществляется при температуре 30 – 50 °С, рН 8,0 – 8,5 и оптимальном режиме аэрации. На выходе из реактора образуется преимущественно один продукт – лизин, который выделяют из смеси, очищают и сушат. Описанная технология получения лизина обеспечивает содержание аминокислоты в реакционной среде свыше 150 г/л. Кроме того, созданы мутанты, у которых целевой продукт – лизин далее не вовлекается в обмен веществ, что увеличивает выход искомого продукта.
Получение триптофана. Химико-ферментативный способ получения триптофана состоит в прямой конденсации индола, аммиака и пировиноградной кислоты:
 |  |
Реакцию катализирует пиридоксальзависимая триптофаназа. Фермент найден у бактерий Е. coli, Bacillus albei , Proteus rettgeri и характеризуется широкой субстратной специфичностью. Добавление триптофана индуцирует образование фермента, а добавление индола ингибирует его синтез у бактерий, поэтому процесс получения триптофана ведут при избытке аммиака и пирувата. Выход аминокислоты при реализации химико-энзиматического способа получения триптофана составляет 63 г/л.
Перечень целевых аминокислот, производимых химико-ферментативным способом разнообразен (L-аспарагиновая кислота, L-аланин, L-глутамин, L-лизин, L-тирозин, L-триптофан, L-цистеин, L-фенилаланин, L-метионин). Химико-энзиматический способ в сравнении с микробиологическим более специфичен, не требует процедуры очистки аминокислот от побочных продуктов и сточных потоков. Однако по стоимости сырья и ферментативных препаратов он еще уступает микробиологическому способу.
Применение аминокислот. Помимо применения в качестве пищевых добавок, приправ и усилителей вкуса аминокислоты используют как сырье в химической, парфюмерной и фармацевтической промышленности и при производстве ряда других веществ.
Оптически активные аминокислоты получают из белкового гидролизата, микробиологическим и ферментативным методами. При химических способах получения образуются рацематы, которые используют, либо как таковые, либо разделяют.
1. Аммонолиз галогенкарбоновых кислот
2. Синтез по Штекеру – Зелинскому (модификация циангидринного синтеза оксикислот)

Реакционная способность
Аминокислоты, имея кислотную (карбоксильную) и основную (аминную) группу, являются амфотерными соединениями. Аминокислоты реагируют с кислотами и основаниями, при этом образуются соли.
Наличие кислотной и осно́вной групп в одной молекуле приводит к внутримолекулярному протонированию аминогруппы, поэтому аминокислоты существуют в виде внутренних солей – диполярных ионов, называемых цвиттер-ионами (от нем. cлова zwei - два).

Диполярный ион (цвиттер-ион)
За счет ионного строения аминокислоты являются кристаллическими веществами с высокими температурами плавления, хорошо растворимы в воде и плохо растворимы в органических растворителях.
Амфотерность аминокислот

Значение рН, при котором аминокислота является электрически нейтральной (существует только в виде цвиттер-ионов), называется изоэлектрической точкой, рI.

В большинстве случаев водные растворы аминокислот имеют слабокислую реакцию, т.к. кислотность NH 3 + выше основности группы СОО -
В воде аминогруппу протонируют молекулы воды.
Аминокислоты более сильные кислоты, чем карбоновые, но более слабые основания, чем первичные амины.
Реакции по амино- и карбоксильной группам
1. Образование хелатов с ионами тяжелых металлов, реакция относится к качественным.

2. Реакция с NaNO 2 /HCl (HNO 2)

По объему выделившегося азота определяют количество аминокислот в растворе.
Алкилирование
Исчерпывающее метилирование – первая стадия синтеза бетаинов, специфических производных a-аминокислот, имеющих цвиттер-ионное строение. Бетаины имеют сладкий вкус и содержатся в некоторых растениях, например в свекле.

Ацилирование


Реакция с формальдегидом

Нингидринная реакция (качественная)


Пролин и гидроксипролин, у которых нет a - аминогрупп, в реакции с нингидрином образуют производное желтого цвета. Реакцию используют для колориметрического количественного определения аминокислот, в том числе в автоматических аминокислотных анализаторах.
Этерификация
Этерификация аминокислот идет в два этапа. Сначала в присутствии хлористого водорода в качестве катализатора получают соль сложного эфира, а затем действием более сильного основания, например триэтиламина, выделяют сложный эфир аминокислоты.


Термическое поведение аминокислот






