Основные характеристики аминокислот входящих в состав белков. Аминокислоты, входящие в состав белков, их строение, свойства
Белки - полимерные молекулы, в которых мономерами служат аминокислоты. В составе белков в организме человека встречают только 20 альфа-аминокислот. Одни и те же аминокислоты присутствуют в различных по структуре и функциям белках. Индивидуальность белковых молекул определяется порядком чередования аминокислот в белке.
Аминокислотами называются органические кислоты, содержащие одну или несколько аминогрупп.
Все α- аминокислоты, кроме аминоуксусной (глицина), имеют асимметрический α-углеродный атом и существуют в виде двух энантиомеров.Практически все белки построены из 20 α -аминокислот, принадлежащих за исключением глицина к L- ряду.
||По физическим и ряду химических свойств аминокислоты резко отличаются от соответствующих кислот и оснований. Они
· лучше растворяются в воде, чем в органических растворителях;
· хорошо кристаллизуются;
· имеют высокую плотность
· высокие температуры плавления.
Эти свойства указывают на взаимодействие аминных и кислотных групп, вследствие чего аминокислоты в твёрдом состоянии и в растворе (в широком интервале рН) находятся в цвиттер-ионной форме (т.е. как внутренние соли).
Все аминокислоты отличаются характером радикала, который может быть ациклическим или циклическим. В состав радикала может входить дополнительно вторая карбоксильная группа (такие аминокислоты называются моноаминодикарбоновые МАДК) или две аминные группы (диаминомонокарбоновые ДАМК). В составе отдельных аминокислот могут находиться гидроксильные группы (серин, треонин),сульфгидрильная (цистеин), метильная (метионин).
Таблица 1. Важнейшие аминокислоты.
Большинство аминокислот, участвующих в обменных процессах и входящих в состав белков, могут поступать с пищей или синтезироваться в организме в процессе обмена (из других аминокислот, поступающих в избытке). Они называются заменимыми. Некоторые аминокислоты не могут синтезироваться в организме и должны поступать с пищей - незаменимые аминокислоты. Таких аминокислот девять(гистидин, триптофан, фенилаланин, лизин, метионин, треонин, изолейцин, лейцин, валин).
4.Молекулярная масса белков. Размеры и форма белковых молекул.
Первичная структура белков в значительной степени определяет вторичную, третичную структуры и особенности четвертичной структуры. В свою очередь, первичная и пространственная структуры белков, их молекулярная масса, форма и размеры обусловливают их физико-химические свойства.
Размер белка может измеряться в числе аминокислотных остатков или в дальтонах (молекулярная масса), но из-за относительно большой величины молекулы масса белка выражается в производных единицах - килодальтонах (кДа). Молекулярная масса белков достаточно большая, поэтому они относятся к высокомолекулярным соединениям. Молекулярная масса белков колеблется от 6 000 до 1 000 000 Дальтон и выше, она зависит от количества аминокислотных остатков в полипептидной цепи, а для олигомерных белков имеющих четвертичную структуру – от количества входящих в них протомеров (субъединиц).
Молекулярная масса некоторых белков составляет:
· инсулин - 5700Д,
· Пепсин- 35 000Д,
· гемоглобин – 65 000Д.
Молекулярную массу белка можно определить по скорости седиментации при ультрацентрифугировании, т.е. при ускорении 100000-500000 G . На основании этого определяют коэффициент седиментации, который обозначают S (в честь шведского ученого СВЕДБЕРГА). Молекулярная масса большинства белков колеблется в пределах 1-20S.Для вычисления молекулярной массы (М), помимо константы седиментации, необходимы дополнительные сведения о плотности растворителяи белка и другие согласно уравнению Сведберга:
![]()
Другим методом определения молекулярной массы является метод гельфильтрации (молекулярное просеивание). Используется искусственно созданные гранулы, имеющие поры (гранулы СЕФАДЕКСА). Внутрь гранулы могут проникать только соединения определённого размера: молекулы небольшого размера входят в гранулы, а большие быстрее вымываются. Молекулярная масса рассчитывается ориентировочно. Буфер не задерживается, а белок движется тем медленнее, чем меньше молекулярная масса.
Белки имеют различную форму, но выделяют две основных группы:
· глобулярные (шарообразные) .Более компактны, в этих белках гидрофильные группы расположены преимущественно снаружи, а гидрофобные – внутри, образуя ядро, водорастворимысвёртываются при нагревании, нейтральны, сравнительно трудно осаждаются растворами солей. (Глобулин, Альбумин)
· фибриллярные (веретенообразные). Образуют полимеры, их структура обычно высокорегулярна и поддерживается, в основном, взаимодействиями между разными цепями. Они образуют микрофиламенты, микротрубочки, фибриллы, поддерживают структуру клеток и тканей. (Актин, Миозин)
На основе различий белков в молекулярной массе, размеров и форме их можно разделить с помощью ультрацентрифугирования (по скорости седиментации), методом гель – фильтрации (молекулярного просеивания в сефадексе).
Приветствую вас, друзья мои! Сегодня я хотела бы поговорить с вами вот на тему сколько всего аминокислот существует. И какие нужны для нашего организма? Дело в том, что многие мои подруги стали поклонницами монодиет. Я хотела бы доказать, что не от всего можно отказаться. Исключение некоторой части продуктов негативно влияет на нашу красоту.
Белки являются незаменимыми питательными веществами в любой здоровой диете. Все белки состоят из строительных блоков, называемых аминокислотами. Это вроде кирпичиков для строительства дома. Но не все белки в своем рационе содержат аминокислоты, которые нам необходимы.
Если вы посмотрите на белок под микроскопом, он будет выглядеть в виде цепочки из аминокислот, соединенных пептидной связью. В организме человека органические кислоты играют роль кирпичиков, из которых создается и ремонтируется мышечная ткань, волосы и кожа.
Еще десятки лет назад ученые знали только три-четыре вещества. Сейчас известно, что существует более 200 органических кислот. В последние годы находят еще большее применение для аминокислотных функций. Например, кератин, содержащийся в наших волосах и ногтях помогает разработать соединение, используемое в виде биоразлагаемого пластика.
Однако для стабильной жизнедеятельности организма нужно 22 протеиногенные аминокислоты, которые разделяются по категориям:
- заменимые – самостоятельно синтезируются в нашем организме;
- незаменимые – поступают извне (продукты, пищевые добавки).
Эта классификация не лишена недостатков. Например, аргинин может создаваться в нашем организме, считаясь заменимой кислотой. Только с некоторыми особенностями метаболизма и в некоторых физиологических состояниях приравнивается к незаменимым.
Также и гистидин, который синтезируется, только в не больших количествах. Поэтому его необходимо употреблять с едой.
Незаменимые
Этот вид веществ не может синтезироваться в теле человека самостоятельно. Поэтому необходимо получать их из еды. Больше всего их содержат белки животного происхождения. Если организм чувствует нехватку какого-либо элемента, то начинает потреблять из других источников. Например, из мышечной ткани. Основной упор делается на функционирование двух органов – мозга и сердца. Чаще всего - в ущерб остальным. Более подробно вы можете прочесть в моей статье про . Сейчас же я сделаю беглый обзор.

Только три аминокислоты (изолейцин + лейцин + валин) составляют почти 70% всех органических кислот в организме. Поэтому их значение в организме человека настолько высоко. В спортпитании есть даже специальный BCAA комплекс, содержащий эти три компонента.
Лейцин участвует в защите и восстановлении мышц, костей, кожных покровов. Благодаря ему выделяется гормон роста. Управляет уровнем сахара и помогает сжиганию жира. Содержится в бобовых, мясе, орехах, рисе (нешлифованном) и зернах пшеницы. Благодаря своей способности стимулировать синтез белка, лейцин помогает стимулировать наращивание мышечной массы и способствует жиросжиганию. Лучшие пищевые источники лейцина, включают любой белок из животных, которые, естественно, содержат все незаменимые аминокислоты.
Изолейцин существует в белках и ускоряет выработку энергии. Его очень «любят» спортсмены. После изнурительных тренировок помогает быстрой регенерации мышечной ткани. Снимает неприятный болевой синдром. Участвует в образовании гемоглобина, регулирует количество глюкозы. Источники: мясные и рыбные продукты, яйца, орехи, горох, соя. В спортивном питании содержится в BCAA концентратах.
PS: думаю, вам будет интересно в каких продуктах питания содержатся аминокислоты и сколько?
Белки – то высокомолекулярные азотсодержащие органические соединения, состоящие из остатков аминокислот, соединенных пептидными связями. Иными словами белки – это полимеры, мономерами которых являются аминокислоты.
Белки построены из сотен или тысяч аминокислотных остатков, соединенных пептидными связями. Разнообразие существующих в природе белков зависит от особенностей аминокислотного состава, количества аминокислотных остатков и порядка их сочетания.
Общая характеристика аминокислот.
Всего в природе обнаружено около 300 аминокислот. По способности входить в состав белков аминокислоты бывают:
1) Протеиногенные (протеин – белок; генезис – дающий, рождающий). Количество белковых, или протеиногенных аминокислот, составляет относительно невелико: в живых организмах имеется 20 основных протеиногенных аминокислот. Помимо стандартных 20 аминокислот, в белках встречаются и модифицированные аминокислоты, которые являются производными обычных аминокислот.
2) Непротеиногенные (в состав белков не входят); бывают α, β и γ.
Все белковые аминокислоты являются α-аминокислотами с характерной общей структурной особенностью: наличием карбоксильной и аминной групп, связанных с атомом углерода в α-положении.
Помимо карбоксильной и аминогрупп, каждая аминокислота имеет радикал, который у разных аминокислот неодинаков по структуре, электрическому заряду и растворимости.
Классификация протеиногенных аминокислот.
Существует несколько классификаций протеиногенных аминокислот, в ос-нову которых положены разные критерии. Рассмотрим лишь некоторые из них:
1) Классификация по электрохимической природе радикала (R):
а) неполярные аминокислоты (их 8) – гидрофобные (нерастворимые в воде): аланин (ала); валин (вал); лейцин (лей); изолейцин (иле); пролин (про); фенилала-нин (фен); триптофан (три); метионин (мет);
б) полярные аминокислоты (их 12) – растворяются в воде; в свою очередь они делятся на:
– незаряженные (их 7): глицин (гли); серин (сер); треонин (тре); цис-теин (цис); тирозин (тир); аспарагин (асп); глутамин (глн);
– заряженные отрицательно (их 2): аспарагиновая кислота (асп); глу-таминовая кислота (глу);
– заряженные положительно (их 3): лизин (лиз); гистидин (гис); арги-нин (арг).
2) Классификация по способности синтезироваться в организме человека и животных:
а) незаменимые (не синтезируются в организме, поэтому должны поступать с пищей, их 8): валин, лейцин, изолейцин, триптофан, фенилаланин, метионин, треонин, лизин);
б) заменимые (синтезируются в организме) – их 12.
Биологическая роль аминокислот.
Помимо того, что аминокислоты являются структурными блоками белков, они используются в живых организмах для синтеза разнообразных веществ. Разные аминокислоты (как протеиногенные, так и непротеиногенные) являются предшественниками пептидов, азотистых оснований, гормонов, витаминов, ней-ромедиаторов, алкалоидов и других важнейших соединений. Так, например, из триптофана синтезируются витамин РР (никотиновая кислота) и серотонин, из тирозина – такие важные гормоны, как адреналин, норадреналин, тироксин. Из аминокислоты валин образуется витамин В3 (пантотеновая кислота). Аминокислота пролин является соединением, защищающим живые клетки от многих стрессов (в том числе, окислительного).
Уровни организации белковых молекул (структура белков).
Существует 4 основных уровня организации белковых молекул:
- Первичная структура
Первичная структура белка представляет собой полипептидную цепь, состоящую из аминокислотных остатков, соединенных пептидными связями:
Пептидная связь характеризуется следующими свойствами:
1) атомы О и Н пептидной связи имеют трансориентацию;
2) четыре атома пептидной связи лежат в одной плоскости, т.е. для пептидной связи характерна компланарность;
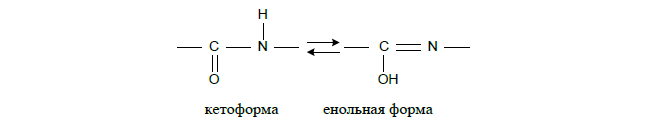
3) пептидная связь в молекуле белка проявляет кето-енольную таутомеризацию;
4) длина C-N-связи, равная 0,13 нм, имеет промежуточное значение между длиной двойной ковалентной связи (0,12 нм) и одинарной ковалентной связи (0,15 нм), из чего следует, что вращение вокруг оси C-N затруднено;
5) пептидная связь прочнее обычной ковалентной, т.к. она является полуторной (из-за перераспределения электронной плотности).
Для каждого индивидуального белка последовательность аминокислот в полипептидной цепи является уникальной. Она определяется генетически и в свою очередь определяет более высокие уровни организации данного белка.
- Вторичная структура
Вторичная структура белка представляет собой способ укладки полипептидной цепи в упорядоченную форму за счет системы водородных связей. Полипептидная цепь самопроизвольно скручивается и приобретает более энергетически выгодную форму. Вторичная структура белков имеет две основные разновидности:
1) α–спираль (как правило, правозакрученная); стабилизируется между кислородом карбонильной группой и водородом аминогруппы.
Между Н и О образуется водородная связь. Она слабая, но поскольку этих связей много, то эта структура устойчивая. Каждая пептидная группа участвует в образовании 2-х водородных связей.
Гидрофильные радикалы R оказываются наружу, а гидрофобные радикалы R1 находятся внутри спирали (прячутся внутрь от растворителя).
2) β – складчатый слой . При образовании этой структуры несколько полипептидных цепей, не сворачиваясь в α-спираль, связываются межцепочечными водородными связями. Например, такой структурой обладают β-кератины (входят в состав шелка). β-складчатая структура возникает между смежными полипептидными цепями. При взаимодействии между собой вторичных структур может образовываться сверхвторичная структура (суперспираль). Например, суперспирализованная α-спираль встречается в фибриллярных белках.
- Третичная структура
Третичная структура белков представляет собой глобулу и характерна для глобулярных белков. На третичном уровне организации возникает активный центр и белок приобретает функциональную активность.
Связи, стабилизирующие третичную структуру:
1) дисульфидная (возникает между радикалами цистеина; эта связь прочная, но способна легко восстанавливаться);
2) ионная (образуется между заряженными радикалами аминокислот);
3) водородная (возникает между радикалами полярных аминокислот);
4) изопептидная (образуется между карбоксильной и аминогруппой радикала);
5) гидрофобное взаимодействие (между гидрофобными аминокислотами).
У глобулы полярные радикалы в гидратированном состоянии находятся снаружи, гидрофобные радикалы внутри.
В пределах глобулы часто выделяют домены – участки полипептидной цепи, которые самостоятельно от других участков той же цепи образуют структуру, во многом напоминающую глобулярный белок.
- Четвертичная структура
Четвертичная структура характерна только для олигомерных белков (олигомерные белки – белки, состоящие из нескольких полипептидных цепей).
Протомер – полипептидная цепь в составе олигомерного белка. Четвертичная структура – характерный способ расположения протомеров олигомерного белка. Активный центр возникает при объединении протомеров. К примеру, четвертичной структурой обладает гемоглобин – белок крови, содержащийся в эритроцитах (переносит кислород).
Аминокислоты.
Аминокислоты – мономеры белков. Названия аминокислот производят от названий соответствующих карбоновых кислот с приставкой амино-. -. Все аминокислоты, входящие в состав белков имеют тривиальное название. Все a – аминокислоты имеют общую формулу: Общая формула аминокислот В зависимости от строения радикала аминокислоты разбивают на группы, например: серосодержащие аминокислоты (цистеин, метионин), ароматические аминокислоты (триптофан, тирозин) и т.д. Для аминокислот характерна изомерия: углеродного скелета, положения функциональной группы, оптическая изомерия.Аминокислоты, входящие в состав белков.
| Аминокислота. | - R |
| Глицин | - H |
| Аланин | - СH 3 |
| Валин | - CH(CH 3) 2 |
| Лейцин | - CH 2 – CH(CH 3) 2 |
| Изолейцин | - CH 2 – CH(CH 3) – С 2 H 5 |
| Цистеин | - CH 2 - SH |
| Метионин | - CH 2 – CH 2 - S – СH 3 |
| Серин | - CH 2 - OH |
| Треонин | - CH(OH) – CH 3 |
| Фенилаланин | - CH 2 – C 6 H 5 |
| Тирозин | 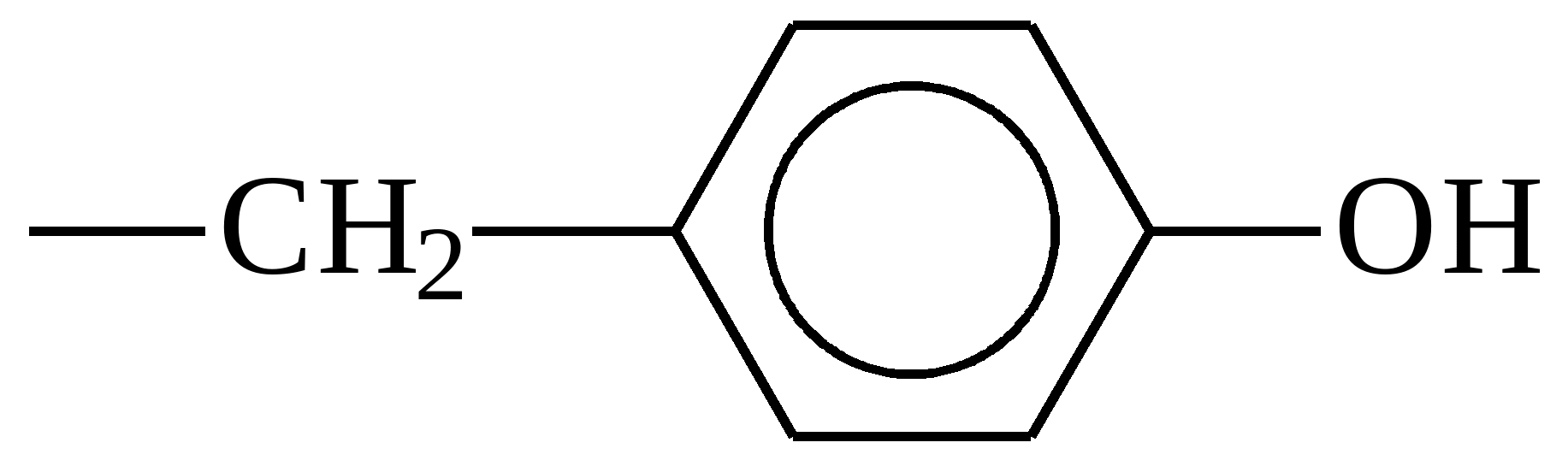 |
| Триптофан | 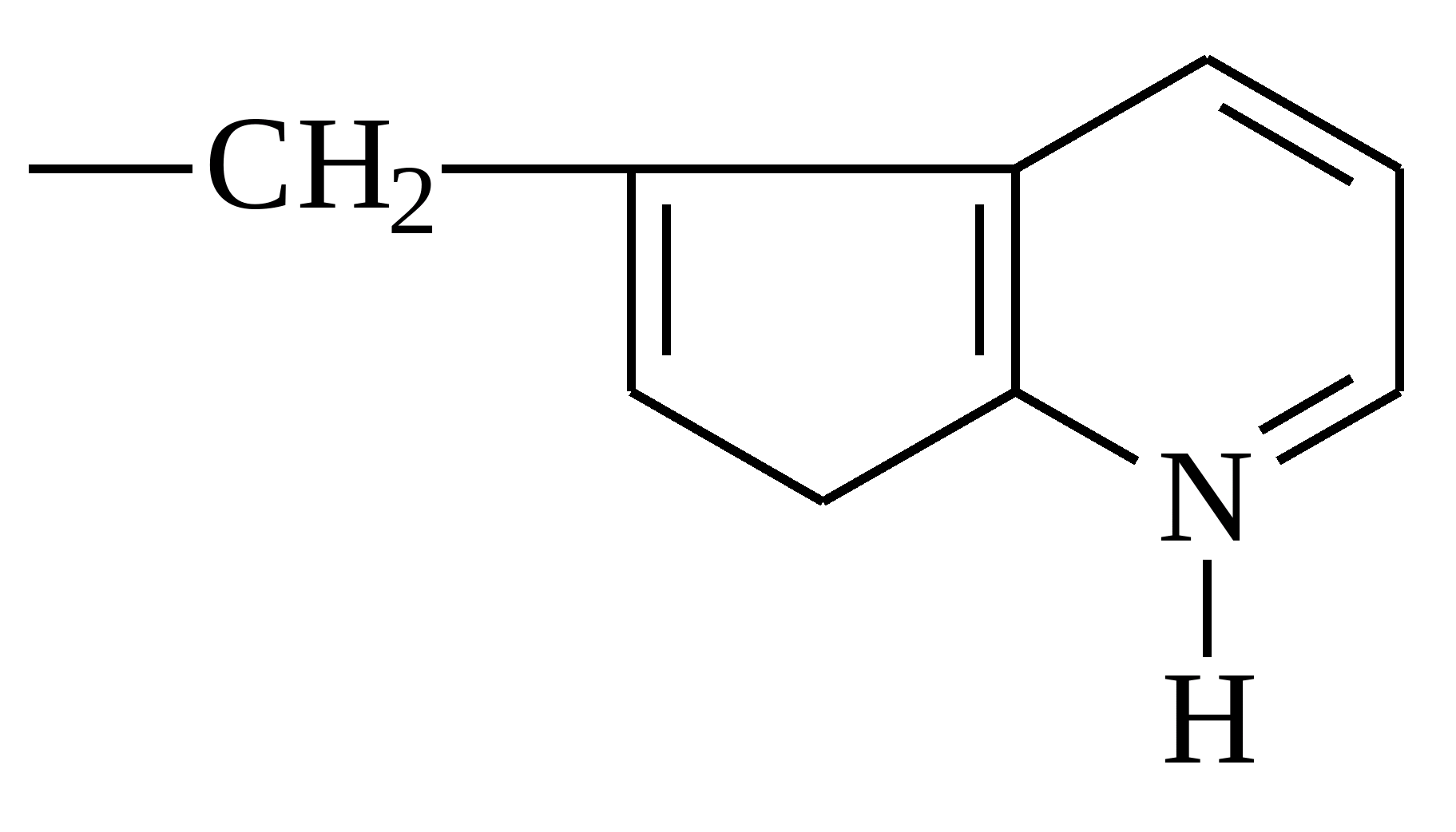 |
| Аспарагиновая кислота | - CH 2 - COOH |
| Глутаминовая кислота | - CH 2 – CH 2 - COOH |
| Аспарагин | - CH 2 – CO –NH 2 |
| Глутамин | - CH 2 – CH 2 - CO –NH 2 |
| Гистидин | 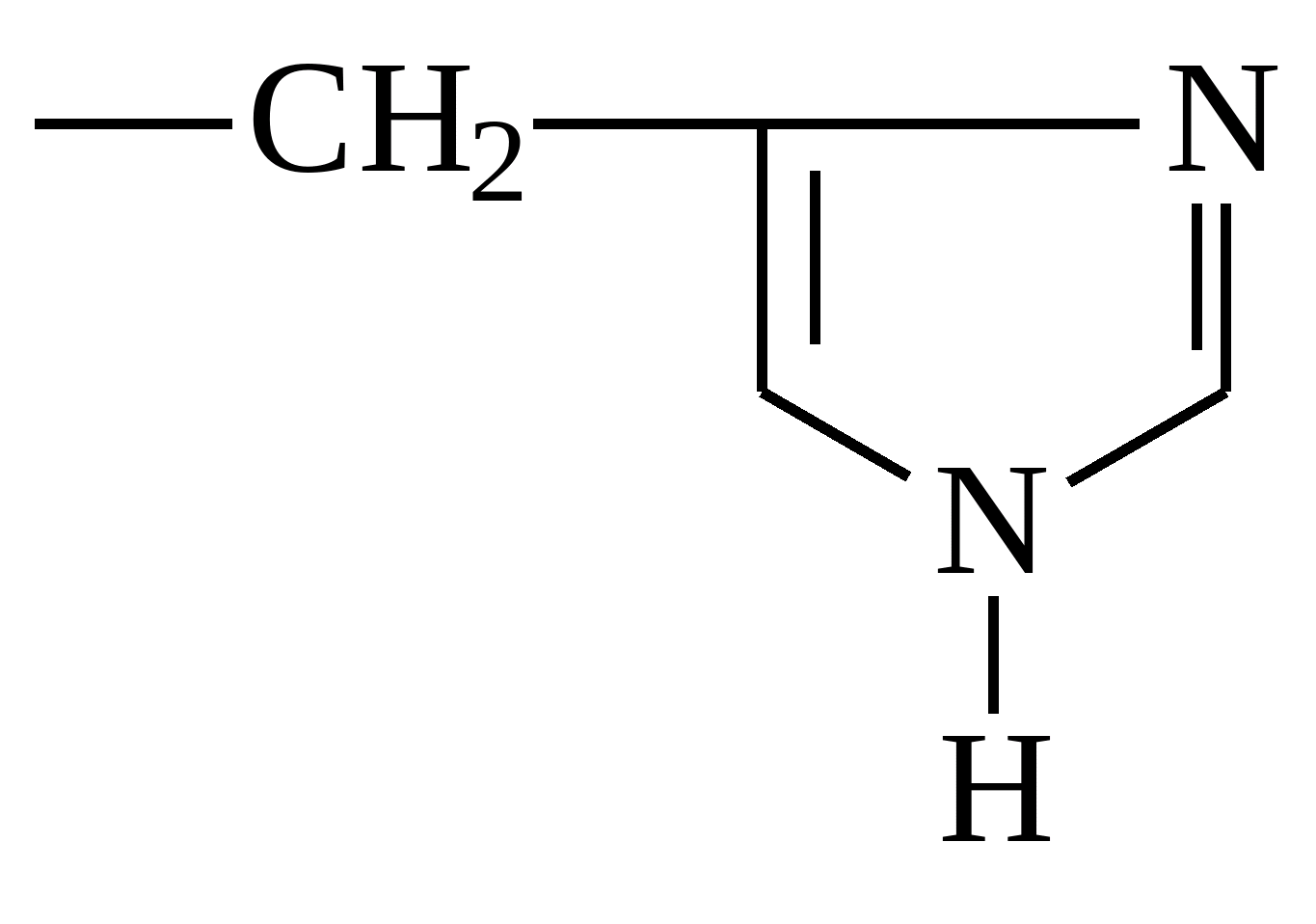 |
| Лизин | - (CH 2) 4 – NH 2 |
| Аргинин |  |
| Пролин | 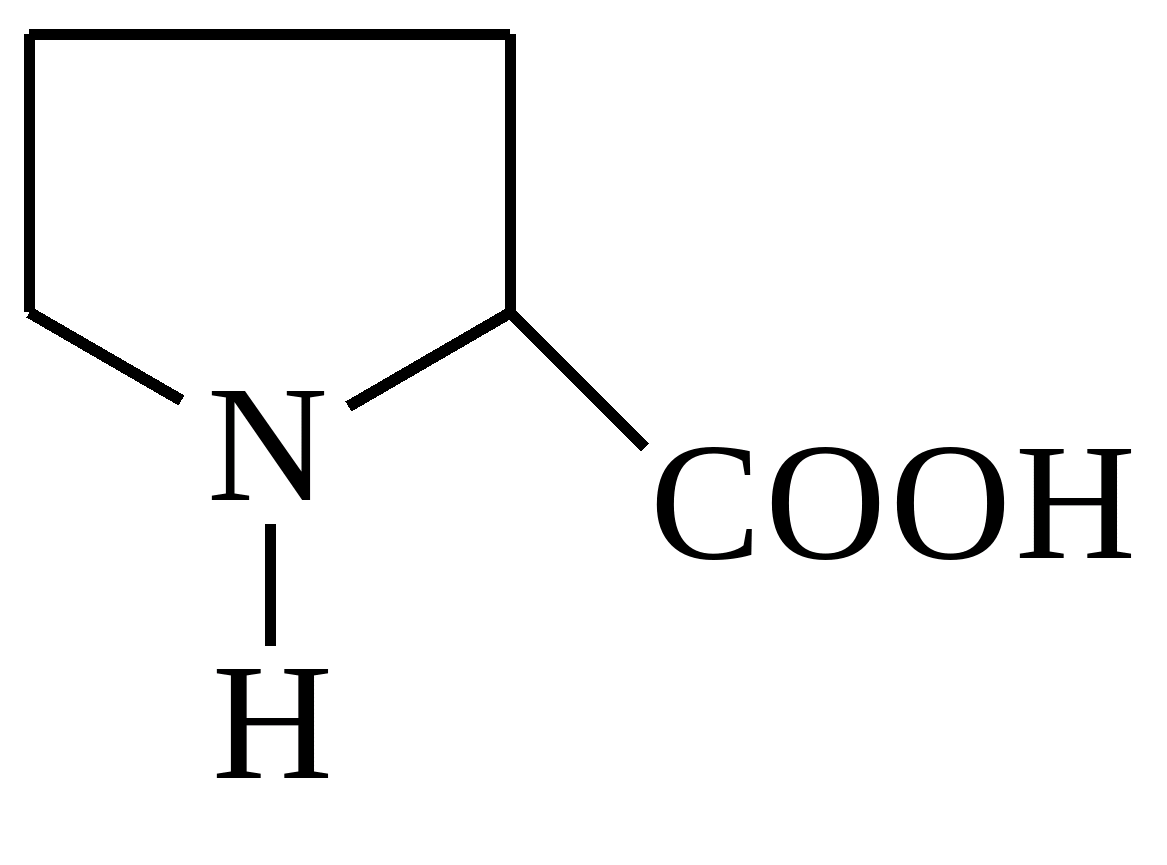 |
Получение аминокислот.
Аминокислоты получают как синтезом, так и из природных объектов. Данный метод основан на замещении галогена в молекуле галогензамещенной карбоновой кислоты на аминогруппу под действием аммиака:
Химические свойства.
Химические свойства аминокислот определяются наличием в их структуре нескольких функциональных групп, в общем случае аминогруппы (свойства оснований), и карбоксильной группы (свойство кислот). Поэтому в реакциях аминокислоты способны проявлять как основные, так и кислотные свойства – это амфотерные соединения, реагирующие и с кислотами, и с основаниями. В результате образуются соответствующие соли: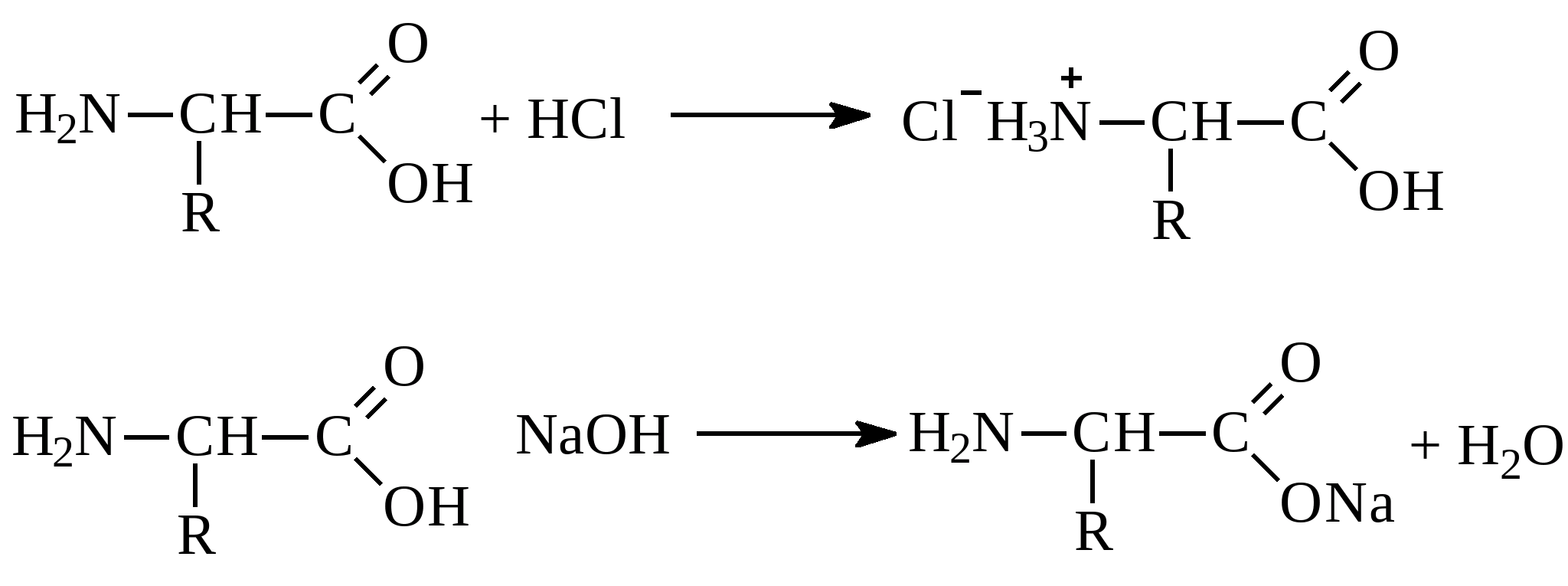 В зависимости от кислотности среды аминокислоты в растворе существуют в одной из форм: в щелочной среде
в нейтральной среде в кислой среде
Если в аминокислоте преобладают кислотные группы, то раствор аминокислоты имеет кислую реакцию. Растворы кислот с основными радикалами имеют щелочную реакцию. Аминокислоты способны в ступать в реакции как с участием аминогруппы, так и с участием карбоксильной группы., характерные для соответствующих классов соединений. Реакция по аминогруппе (взаимодействие с азотистой кислотой
):
В зависимости от кислотности среды аминокислоты в растворе существуют в одной из форм: в щелочной среде
в нейтральной среде в кислой среде
Если в аминокислоте преобладают кислотные группы, то раствор аминокислоты имеет кислую реакцию. Растворы кислот с основными радикалами имеют щелочную реакцию. Аминокислоты способны в ступать в реакции как с участием аминогруппы, так и с участием карбоксильной группы., характерные для соответствующих классов соединений. Реакция по аминогруппе (взаимодействие с азотистой кислотой
): 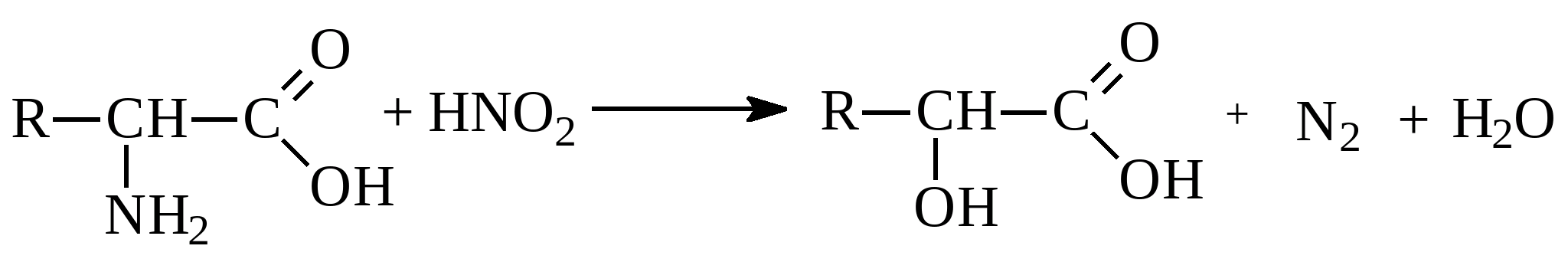 Оксикислота
Взаимодействие со спиртами (реакция по карбоксильной группе
) приводит к образованию сложных эфиров:
Оксикислота
Взаимодействие со спиртами (реакция по карбоксильной группе
) приводит к образованию сложных эфиров: 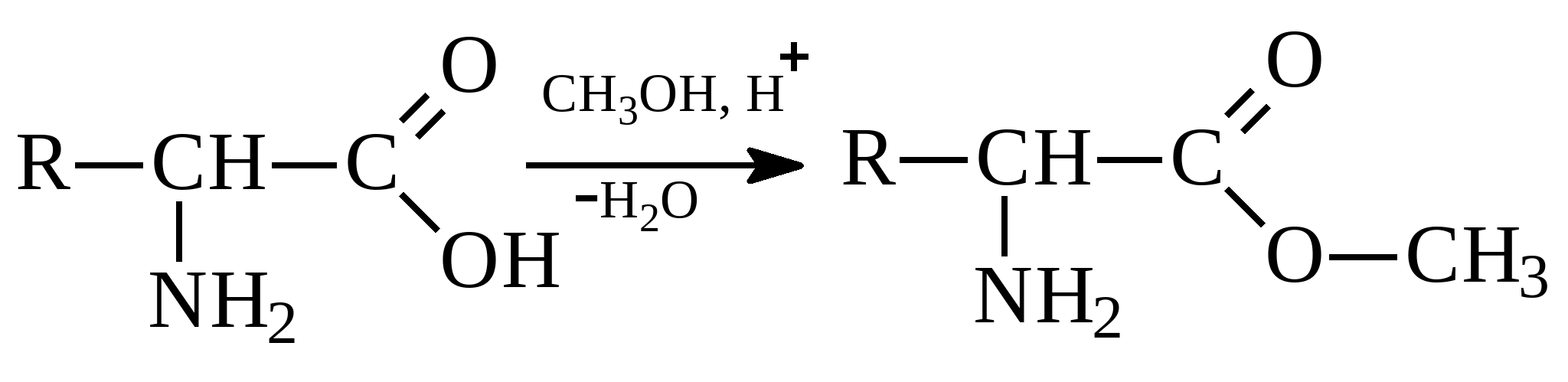 Взаимодействие аминокислот друг с другом с отщеплением воды и образованием продукта, в котором фрагменты связаны пептидной связью: Пептидная связь
Подобные соединения – продукты конденсации двух и более продуктов аминокислот – называют пептидами. Они относятся к классу амидов. Качественной реакцией на аминокислоты является образование окрашенных в сине – фиолетовый цвет продуктов с нингидрином
(аминокислоты им окисляются):
Взаимодействие аминокислот друг с другом с отщеплением воды и образованием продукта, в котором фрагменты связаны пептидной связью: Пептидная связь
Подобные соединения – продукты конденсации двух и более продуктов аминокислот – называют пептидами. Они относятся к классу амидов. Качественной реакцией на аминокислоты является образование окрашенных в сине – фиолетовый цвет продуктов с нингидрином
(аминокислоты им окисляются): 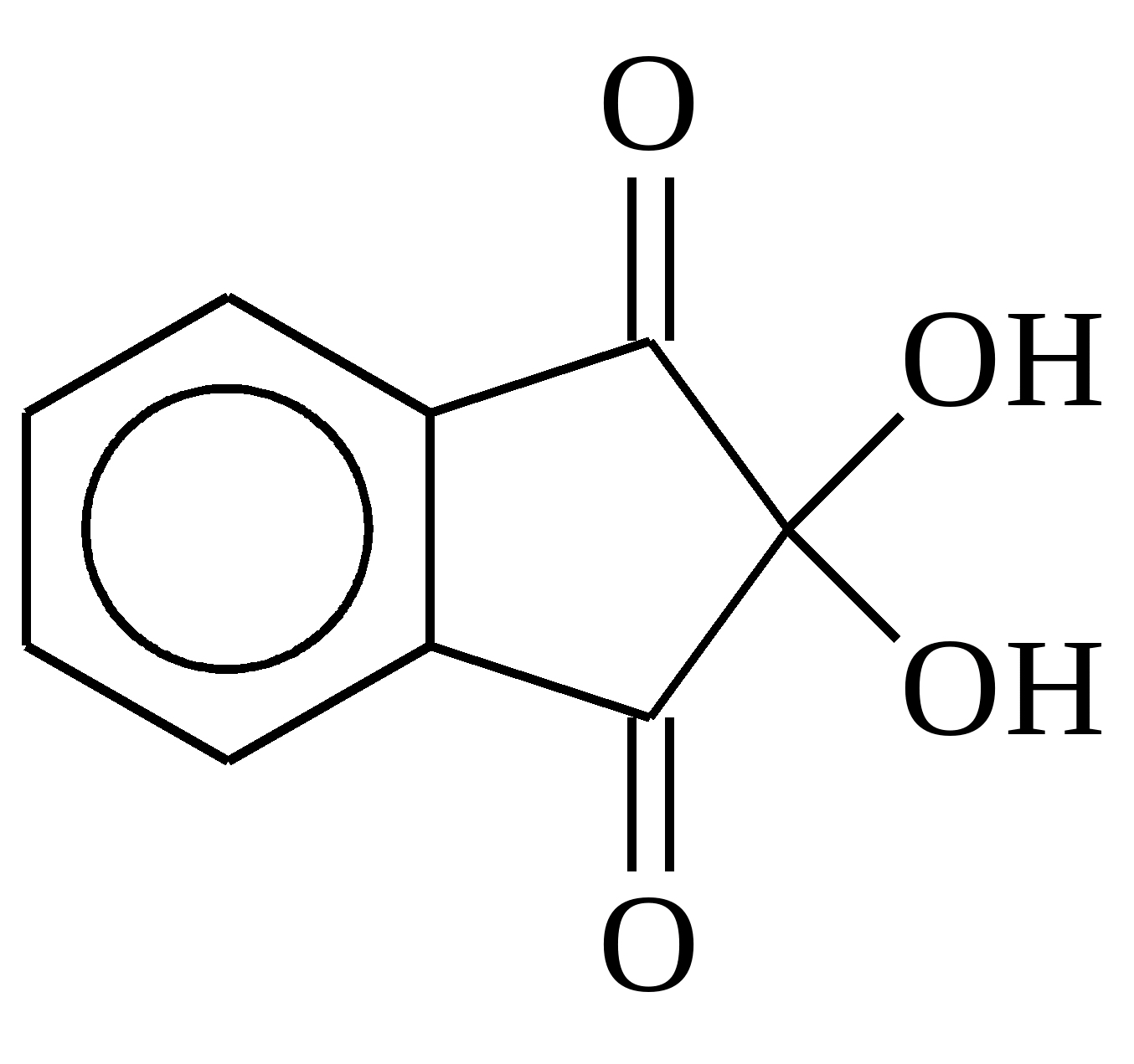 Нингидрин
Нингидрин
Ароматические аминокислоты при нагревании взаимодействуют с концентрированной HNO 3 (нитрируется бензольное кольцо), продукты окрашены в желтый цвет (ксантопротеиновая реакция).
Нингидрин
Нингидрин
Ароматические аминокислоты при нагревании взаимодействуют с концентрированной HNO 3 (нитрируется бензольное кольцо), продукты окрашены в желтый цвет (ксантопротеиновая реакция). Липиды. 5
Под термином липиды объединяют жиры и жироподобные вещества. Липиды – органические соединения с различной структурой, но общими свойствами. Они нерастворимы в воде, но хорошо растворяются в органических растворителях, таких как; бензин, эфиры и т.д. По химической структуре жиры представляют собой сложные соединения трехатомного спирта глицерина и высокомолекулярных жирных кислот. Например, стеарин получается в результате реакции между глицерином и стеариновой кислотой: жирная кислота
Глицерин стеариновая кислота Стеарин
Стеариновая и пальмитиновая (С 15 H 31 COOH) кислоты являются насыщенными (предельными), а олеиновая (С 17 H 33 COOH) и некоторые другие кислоты – непредельными. У насыщенных жирных кислот температура плавления выше, чем у непредельных, поэтому жиры, образованные этими кислотами в естественных условиях жизнедеятельности, находится в твердом состоянии. Такие жиры более характерны для клеток животных. Жидкие непредельные жиры называют маслами. Они могут встречаться у животных (например в составе молока), но более типичны для растений. Особенно биологически важными жироподобными веществами являются фосфолипиды.
Это так же сложные соединения глицерина и жирных кислот. От настоящих жиров они отличаются тем, что содержат остаток фосфорной кислоты. Они основные компоненты мембран клеток.
жирная кислота
Глицерин стеариновая кислота Стеарин
Стеариновая и пальмитиновая (С 15 H 31 COOH) кислоты являются насыщенными (предельными), а олеиновая (С 17 H 33 COOH) и некоторые другие кислоты – непредельными. У насыщенных жирных кислот температура плавления выше, чем у непредельных, поэтому жиры, образованные этими кислотами в естественных условиях жизнедеятельности, находится в твердом состоянии. Такие жиры более характерны для клеток животных. Жидкие непредельные жиры называют маслами. Они могут встречаться у животных (например в составе молока), но более типичны для растений. Особенно биологически важными жироподобными веществами являются фосфолипиды.
Это так же сложные соединения глицерина и жирных кислот. От настоящих жиров они отличаются тем, что содержат остаток фосфорной кислоты. Они основные компоненты мембран клеток.  R
1
,
R
2
– остатки жирных кислот,
R
3
– азотистое основание
Гликолипиды
состоят из углеводов и липидов. Особенно их много в составе ткани мозга и нервных волокон.
R
1
,
R
2
– остатки жирных кислот,
R
3
– азотистое основание
Гликолипиды
состоят из углеводов и липидов. Особенно их много в составе ткани мозга и нервных волокон.  R
– остаток липида (Жирная кислота)
Липопротеиды
представляют собой комплексные соединения различных белков с жирами. Стероиды
– класс органических соединений животного или растительного происхождения, обладающие высокой биологической активностью.
R
– остаток липида (Жирная кислота)
Липопротеиды
представляют собой комплексные соединения различных белков с жирами. Стероиды
– класс органических соединений животного или растительного происхождения, обладающие высокой биологической активностью.  Тестостерон – гормон. По химической природе – стероид.
Жиры –
это смеси сложных эфиров и высших карбоновых кислот и глицерина (трехатомного спирта). Общая формула жиров:
Тестостерон – гормон. По химической природе – стероид.
Жиры –
это смеси сложных эфиров и высших карбоновых кислот и глицерина (трехатомного спирта). Общая формула жиров: 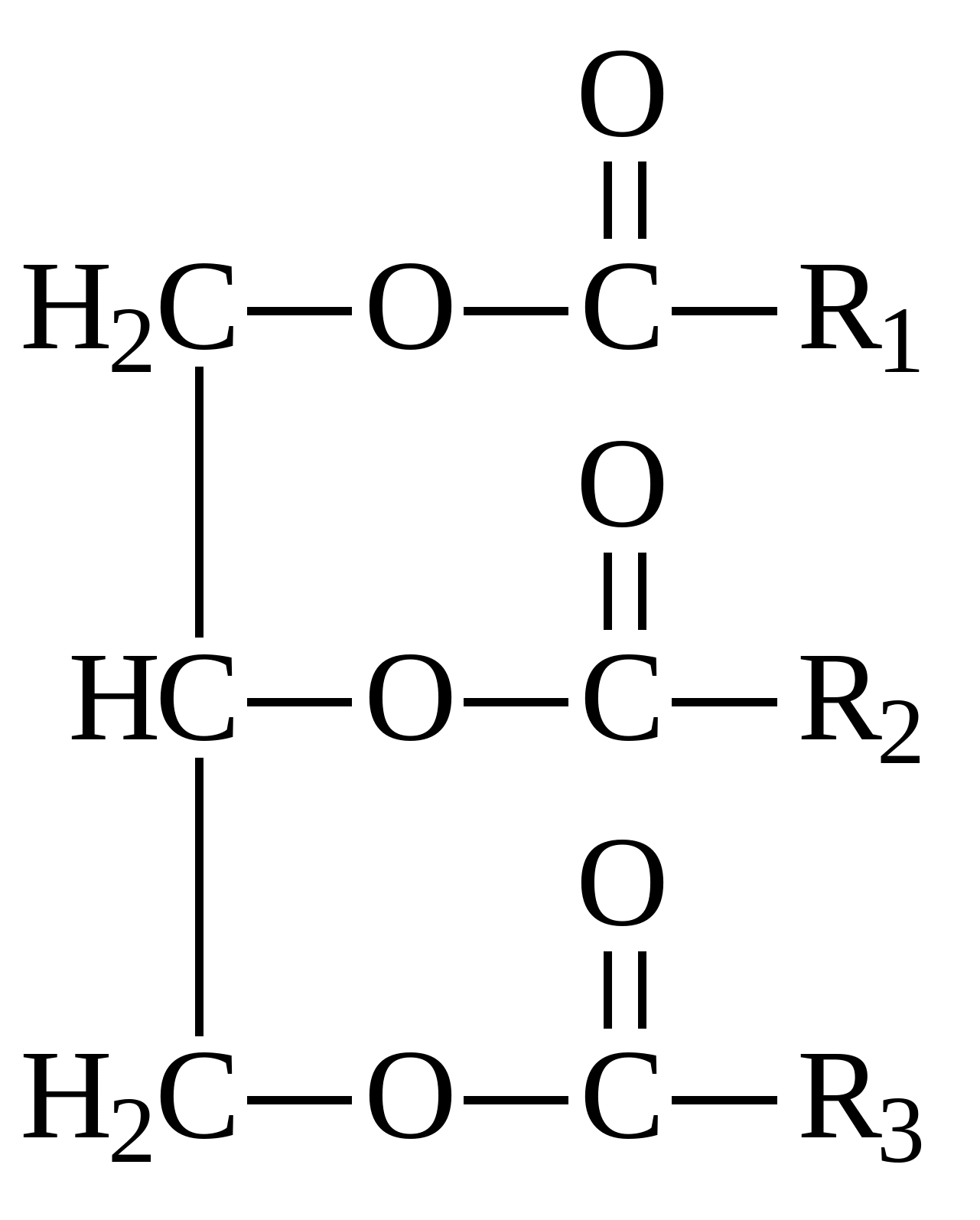 Общая формула жиров.
Если в состав жира входят остатки одной кислоты, то такой жир называют простым. В состав смешанных жиров входят остатки разных жирных кислот. Общее название карбоновых кислот с глицерином – триглицериды.
Чаще всего в состав жиров входят остатки следующих кислот:
Общая формула жиров.
Если в состав жира входят остатки одной кислоты, то такой жир называют простым. В состав смешанных жиров входят остатки разных жирных кислот. Общее название карбоновых кислот с глицерином – триглицериды.
Чаще всего в состав жиров входят остатки следующих кислот:
| Предельные: | |
| Миристиновая | С 13 Н 27 COOH |
| Пальмитиновая | CH 3 (CH 2) 14 COOH |
| Стеариновая | C 1 7 H 3 5 СOOH |
| Непредельные: | |
| Олеиновая | СН 3 (СН 2) 7 СН=СН(СН 2) 7 СООН |
| Линолевая | CH 3 (CH 2) 3 -(CH 2 CH=CH) 2 (CH 2) 7 COOH. |
Функции липидов. 6
| ФУНКЦИЯ | УРОВЕНЬ ОРГАНИЗАЦИИ | ПРИМЕРЫ |
| Защитная | Тканевый | Гликолипиды участвуют в распознавании и связывании токсинов возбудителей опасных болезней – столбняка, холеры, дифтерии. |
| Организменный | 1. Подкожный жир млекопитающих выполняет функцию термоизоляции и амортизации (защита от механических повреждений). 2. Воски являются водоотталкивающими покрытиями. | |
| Регуляторная | Организменный | 1. Производными холестерина являются многие гормоны. 2. Жирорастворимые витамины необходимы для роста и развития организма. 3. Сердечными гликозидами являются простыми липидами (стероидами). 4. Терпенами являются следующие вещества: душистые вещества растений, привлекающие насекомых – опылителей. Гиббереллины – регуляторы роста растений. |
| Энергетическая | Клеточный | Жиры – наилучший источник энергии, при окислении 1г гликогена образуется 17кДж энергии. У позвоночных примерно половина всей энергии, потребляемой в состоянии покоя, образуется за счет окисления жирных кислот, входящих в состав жиров. |
| Резервная | Организменный | 1. источник энергии для синтеза АТФ. Жиры – основное запасающее вещество у животных, масла у растений. 2. Источник метаболической воды (вода, которая образуется в результате обмена веществ). |
| Структурная | Клеточный | 1. двойной сой фосфолипидов является основой клеточной мембраны. 2. Стероид холестерин входит в состав клеточных мембран животных клеток. 3. В состав мембран клеток некоторых тканей входят так же липопротеиды и гликопротеиды. |
| Тканевый и органный | 1. Гликолипиды участвуют в межклеточных контактах в тканях животных, являясь молекулярными рецепторами. 2. Различные фосфолипиды необходимы для нормального функционирования нервной ткани и содержатся там в значительных количествах. 3. Желчные кислоты и их производные являются производными холестирина. 4. Липопротеины являются транспортной формой липидов в организме млекопитающих. 5. Зрительный пурпур глаза является липопротеидом. | |
| Организменный | 1. Большое количество жира уменьшает удельный вес морских животных (тюленей, моржей), и птиц. 2. У млекопитающих, впадающих в спячку, и у грудных детей существует специальная жировая ткань - бурый жир, играющая роль биологического подогревателя. Энергия выделяющаяся при окислении жира, не идет на синтез АТФ, а является только источником тепла. Бурый жир либо окружает жизненно важные органы, либо лежит на пути притекающей к ним крови, таким образом, тепло образующиеся в буром жире, направляется к важнейшим органам. 3. Из воска пчелы строят соты. |
Физические свойства жиров.
Жиры, образованные предельными кислотами, в нормальных условиях – твердые вещества, поэтому животные жиры обычно твердые – в их состав входят насыщенные кислоты. Например, в коровье масло входят глицериды олеиновой, пальмитиновой и стеариновой кислот. Жидкие жиры (масла ), как правило, образованы непредельными кислотами. В большинстве случаев жидкие жиры растительного происхождения. Температура плавления жира определяется его природой, температура кипения жира тем выше, чем выше в нем содержание предельных кислот и чем длиннее углеводородный радикал жирной кислоты. Все жиры легче воды и не растворимы в ней, жиры хорошо растворяются в неполярных органических растворителях, таких как: углеводороды, бензин, дихлорэтан и других.Химические свойства жиров.
Нагревание жира приводит к образованию карбоновых кислот и глицерина, следовательно, жиры можно синтезировать из глицерина и карбоновых кислот: Реакция омыления жиров (гидролиз жиров).
Мылами называют натриевые соли высших карбоновых кислот, т.к. их растворы обладают моющим действием. Для получения мыла жиры подвергают щелочному гидролизу:
Реакция омыления жиров (гидролиз жиров).
Мылами называют натриевые соли высших карбоновых кислот, т.к. их растворы обладают моющим действием. Для получения мыла жиры подвергают щелочному гидролизу:  Жир глицерин мыло
Обычные мыла – это смеси пальмитиновой, стеариновой и олеиновой кислот, причем натриевые соли образуют твердые мыла, а калиевые – жидкие мыла.
Жир глицерин мыло
Обычные мыла – это смеси пальмитиновой, стеариновой и олеиновой кислот, причем натриевые соли образуют твердые мыла, а калиевые – жидкие мыла. Гидрогенизация жиров.
Гидрогенизация жиров – так называют процесс, присоединения водорода к остатком непредельных кислот, входящих в состав жиров. В результате из жидких жиров, молекулы которых содержат ненасыщенные углеводородные радикалы, получают твердые жиры, содержащие остатки придельных (насыщенных) жирных кислот. Гидрирование проводят под давлением в присутствии катализатора: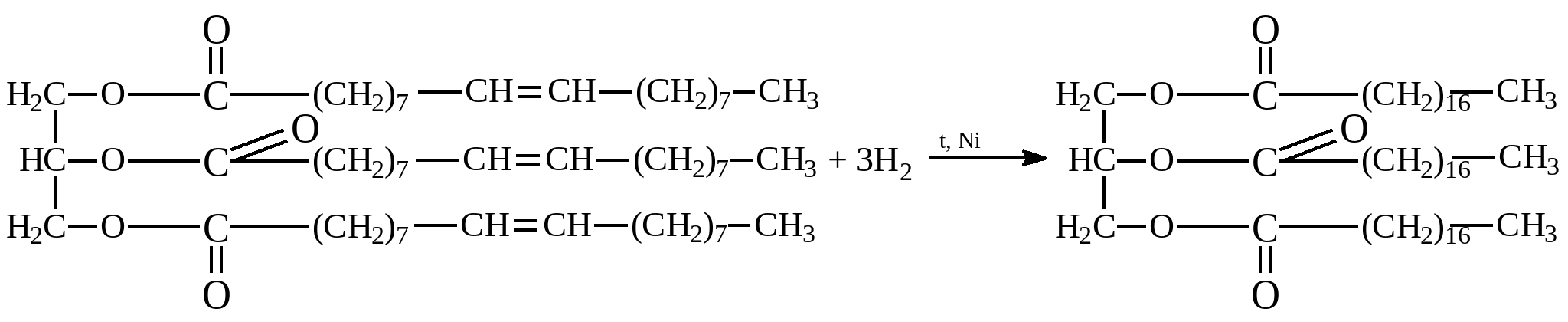 Именно так из растительного масла (жидкий жир) получают твердые гидрогенизированные жиры, которые затем используют в технических целях и для производства маргарина (эмульсии гидрогенизированного растительного масла в молоке с пищевыми добавками). Под действием кислорода воздуха (при хранении) и при нагревании, остатки карбоновых кислот жидких жиров могут «сшиваться» между собой по местам двойных связей с образованием «сшитых полимеров» - твердых пленок. Длительное хранение на воздухе (действие света, влаги, кислорода, тепла) приводит к «прогорканию» жиров – появлению продуктов из разложения (альдегиды, кетоны, карбоновые кислоты, гидроксикислоты). Процесс сопровождается появлением характерного запаха «прогоркшего» масла.
Именно так из растительного масла (жидкий жир) получают твердые гидрогенизированные жиры, которые затем используют в технических целях и для производства маргарина (эмульсии гидрогенизированного растительного масла в молоке с пищевыми добавками). Под действием кислорода воздуха (при хранении) и при нагревании, остатки карбоновых кислот жидких жиров могут «сшиваться» между собой по местам двойных связей с образованием «сшитых полимеров» - твердых пленок. Длительное хранение на воздухе (действие света, влаги, кислорода, тепла) приводит к «прогорканию» жиров – появлению продуктов из разложения (альдегиды, кетоны, карбоновые кислоты, гидроксикислоты). Процесс сопровождается появлением характерного запаха «прогоркшего» масла. Описание задач практикума.
В данной части работы представлены эксперименты, которые могут показать вам основные свойства веществ, представленных в работе. В процессе проведения работ стоит обратить внимание на следующие пункты:- С реактивами нужно обращаться очень осторожно и использовать их строго в определенных практикумом количествах. Результаты качественных реакций лучше всего смотреть на белом фоне.
Тема углеводы.
1. Восстанавливающие свойства моно- и дисахаридов. 7
Данный эксперимент ознакомит вас с методикой постановки качественных реакций на углеводы.Многие из нас знают, что белки необходимы организму, так как в них содержатся аминокислоты. Но далеко не все понимают, что собой представляют эти элементы и почему их наличие в рационе так важно. Сегодня мы выясним, сколько аминокислот входит в как они классифицируются и какую функцию выполняют.
Что такое аминокислоты?
Итак, аминокислоты (аминокарбоновые к-ты) - это органические соединения, которые являются основным элементом, образующим структуру белка. Белки, в свою очередь, принимают участие во всех физиологических процессах человеческого организма. Они формируют кости, сухожилия, связки, внутренние органы, мышцы, ногти и волосы. Белки становятся частью организма в процессе синтеза аминокислот, пришедших с пищей. Следовательно, не белок является важным питательным веществом, а именно аминокислоты. И не все белки одинаково полезны, ведь у каждого из них свой уникальный состав этих самых кислот.
Довольно сложна, рассмотрим ее на базовом уровне. Мы знаем, что аминокарбоновые кислоты являются своеобразными строительными блоками в здании под названием белок и в мегаполисе под названием человек. Однако не во всех белках есть именно те элементы, которые нам нужны. Если взглянуть на белок под микроскопом, можно увидеть цепочку из аминокислот, которые соединяются пептидными связями. Грубо говоря, звенья этой цепочки служат в нашем организме ремонтным и строительным материалом.
Удивительно, но было время, когда ученые не знали о том, сколько различных аминокислот входит в состав белков. Большинство из них были открыты в 19, а остальные в 20-м веке. Ученым понадобилось 119 лет, чтобы окончательно ответить на вопрос: «Сколько аминокислот входит в состав белка?» Строение каждой из них изучалось еще дольше.
На сегодняшний день известно, что для нормальной жизнедеятельности человеческого организма необходимо 20 протеиногенных аминокарбоновых кислот. Эту двадцатку часто называют мажорными кислотами. С точки зрения химии, их классифицируют по множеству признаков. Но простым обывателям наиболее близка классификация по способности кислот синтезироваться в нашем организме. По этому признаку аминокислоты бывают заменимыми и незаменимыми.

В этой классификации есть некоторые недостатки. К примеру, аргинин в некоторых физиологических состояниях считается незаменимым, но он может синтезироваться организмом. А гистидин восполняется в столь малых количествах, что его все-таки необходимо принимать с пищей.
Теперь, когда мы знаем, сколько видов аминокислот входит в состав белков, рассмотрим подробнее оба вида.
Незаменимые (эссенциальные)
Как вы уже поняли, эти вещества не могут самостоятельно синтезироваться организмом, поэтому их необходимо употреблять с едой. Основное количество незаменимых органических кислот содержится в животных белках. Когда в организме недостает того или иного элемента, он начинает забирать его с мышечной ткани. Этот класс состоит из 8 кислот. Познакомимся с каждой из них.
Лейцин
Эта кислота отвечает за восстановление и защиту мышечных тканей, кожных покровов и костей. Именно благодаря лейцину выделяется гормон роста. Кроме того, эта органическая кислота регулирует уровень сахара в крови и способствует сжиганию жиров. Она содержится в мясе, орехах, бобовых, нешлифованном рисе и зернах пшеницы. Лецитин стимулирует а значит, способствует наращиванию мышечной массы.
Изолейцин
Эта кислота ускоряет выработку энергии, поэтому ее так любят спортсмены. После изнурительных занятий она помогает быстрому восстановлению мышечных волокон. Изолейцин снимает так называемую крепатуру, принимает участие в образовании гемоглобина и регулирует количество сахара. Больше всего изолейцина содержится в мясе, рыбе, яйцах, орехах, горохе и сое.

Лизин
Данная аминокислота играет важную роль в работе иммунной системы. Ее главная задача - синтез антител, которые защищают наш организм от воздействия вирусов и аллергенов. Кроме того, лизин регулирует процесс обновления костной ткани и коллагена, а также гормоны роста. Эту органическую кислоту можно найти в таких продуктах питания, как: яйца, картофель, красное мясо, рыба и кисломолочные продукты.
Фенилаланин
Эта альфа-аминокислота отвечает за нормальную работу центральной нервной системы. Ее недостаток в организме приводит к приступам депрессии и хроническим болезням. Фенилаланин помогает нам концентрироваться и запоминать нужную информацию. Входит в состав препаратов, используемых при лечении психических расстройств, в том числе болезни Паркинсона. Положительно сказывается на работе печени и поджелудочной железы. Аминокислота содержится в: орехах, грибах, курице, молочных продуктах, бананах, абрикосах и топинамбуре.
Метионин
Мало кто знает, сколько аминокислот входит в состав белка, зато многим известно, что метионин активно сжигает жировые ткани. Но это далеко не все полезные свойства данной кислоты. Она влияет на выносливость и работоспособность человека. Если ее в организме недостаточно, это сразу можно понять по коже и ногтям. Метионин встречается в таких продуктах питания, как: мясо, рыба, семена подсолнечника, бобовые, лук, чеснок и кисломолочные продукты.
Треонин
Стремясь узнать, сколько аминокислот входит в состав белка, ученные открыли такое вещество, как треонин, одним из последних. А ведь оно очень даже полезно для человека. Треонин отвечает за все важнейшие системы человеческого организма, а именно за нервную, иммунную и сердечно-сосудистую. Первый признак его недостатка - проблемы с зубами и костями. Больше всего треонина человек получает из молочных продуктов, мяса, грибов, овощей и злаков.
Триптофан
Еще одно важнейшее вещество. Оно отвечает за синтез серотонина, который часто называют гормоном хорошего настроения. Недостаток триптофана можно обнаружить по нарушениям сна, аппетита. Данная кислота также регулирует функцию дыхания и артериальное давление. Она содержится преимущественно в: морепродуктах, красном мясе, птице, кисломолочных продуктах и пшенице.
Валин
Выполняет функцию восстановления поврежденных волокон и следит за обменными процессами в мышцах. При сильных нагрузках может оказывать стимулирующее действие. Также играет роль в умственной деятельности человека. Помогает при лечении печени и головного мозга от негативных воздействий алкоголя и наркотиков. Человек может получить валин из: мяса, грибов, сои, молочных продуктов и арахиса.
Примечательно, что 70% всех органических кислот в нашем организме занимают всего три аминокислоты: лейцин, изолейцин и валин. Поэтому они считаются самыми важными в обеспечении нормальной жизнедеятельности организма. В спортивном питании даже выделили специальный комплекс ВСАА, которые содержит именно эти три кислоты.
Продолжаем отвечать на вопрос о том, сколько мажорных аминокислот входит в состав белка, и переходим к заменимым представителям класса.

Заменимые
Главное отличие этой группы состоит в том, что все ее представители могут образовываться в организме путем эндогенного синтеза. Слово «заменимые» вводит многих в заблуждение. Поэтому часто неосведомленные люди говорят, что эти аминокислоты необязательно употреблять с пищей. Конечно же, это не так! Заменимые кислоты, так же как и эссенциальные, обязательно должны быть в составе каждодневного рациона. Они действительно могут образовываться из других веществ. Но происходит это только в случае, когда рацион составлен неправильно. Тогда часть полезных веществ и эссенциальных кислот затрачивается на воссоздание заменимых кислот. Следовательно, это не совсем благоприятно для организма. Разберем незаменимые кислоты, входящие в «мажорную двадцатку».
Аланин
Способствует ускорению метаболизма углеводов и выведению из печени токсинов. Встречается в таких продуктах питания, как: мясо, птица, яйца, рыба и молочные продукты.
Аспарагиновая кислота
Считается универсальным топливом для нашего организма, так как значительно улучшает обмен веществ. Встречается в молоке, тростниковом сахаре, птице и говядине.
Аспарагин
Пытаясь ответить на вопрос: «Сколько аминокислот входит в состав белка?», ученые в первую очередь открыли именно аспарагин. Было это в далеком 1806 году. Данная кислота принимает участие в улучшении работы нервной системы. Она содержится во всех животных белках, а также орехах, картофеле и злаках.
Гистидин
Является важным строительным элементом всех внутренних органов. Играет едва ли не ключевую роль в образовании красных и белых кровяных телец. Положительно влияет на иммунную систему и половую функцию. Из-за широкого спектра применения, запасы гистидина в организме быстро истощаются. Поэтому важно принимать его с пищей. Содержится в мясных, молочных и злаковых продуктах.
Серин
Стимулирует работу головного мозга и центральной нервной системы. Встречается в таких продуктах, как: мясо, соя, злаки, арахис.
Цистеин
Эта аминокислота в организме отвечает за синтез кератина. Без нее не было бы здоровых ногтей, волос и кожи. Находится в таких продуктах, как: мясо, яйца, красный перец, чеснок, лук и брокколи.
Аргинин
Говоря о том, сколько протеиногенных аминокислот входит в состав белков и какие функции они выполняют, мы убедились в том, что каждая из них важна для организма. Однако есть кислоты, которые, по мнению экспертов, считаются наиболее значимыми. К таковым относится аргинин. Он отвечает за здоровую работу мышц, суставов, кожного покрова и печени, а также укрепляет иммунитет и сжигает жиры. Аргинин часто используют бодибилдеры и те, кто желает похудеть, в составе добавок. В природном виде он встречается в мясе, орехах, молоке, злаках и желатине.

Глютаминовая кислота
Является важным элементом для здоровой работы головного и спинного мозга. Часто продается в виде добавки «Глутамат натрия». Встречается в яйцах, мясе, молочных продуктах, рыбе, моркови, кукурузе, помидорах и шпинате.
Глутамин
Нужен в белках для роста и поддержки мышц. Также является «топливом» головного мозга. Кроме того, глутамин выводит из печени все то, что поступает туда с нездоровой пищей. При термической обработке кислота денатурирует, поэтому, чтобы ее восполнить, нужно употреблять петрушку и шпинат в сыром виде.
Глицин
Помогает крови сворачиваться, а глюкозе - перерабатываться в энергию. Встречается в мясе, рыбе, бобовых и молоке.
Пролин
Отвечает за синтез коллагена. При недостатке в организме пролина начинаются проблемы с суставами. Встречается в основном в животных белках, поэтому является едва ли не единственным веществом, с нехваткой которого сталкиваются люди, не употребляющие мясо.
Тирозин
Отвечает за регулировку артериального давления и аппетит. При недостатке этой кислоты человек страдает быстрой утомляемостью. Чтобы таких проблем не было, нужно есть бананы, семечки, орехи и авокадо.

Продукты, богатые аминокислотами
Теперь вы знаете, сколько аминокислот входит в состав белка. Функции и место нахождения каждой из них вам тоже известны. Отметим главные продукты, употребляя которые, можно не переживать о сбалансированности питания в плане аминокислот.
Яйца . Отлично усваиваются организмом, дают ему большое количество аминокислот и обеспечивают белковую подкормку.
Молочные продукты . Способны обеспечить человека множеством полезных веществ, спектр которых, кстати говоря, не ограничивается органическими кислотами.
Мясо . Пожалуй, первый источник белка и входящих в него веществ.
Рыба . Богата на белок и отлично усвояема организмом.
Многие абсолютно уверены, что без продуктов животного происхождения нельзя обеспечить организм должным количеством белка. Это совершенно неверно. И доказательством тому является огромное количество вегетарианцев с прекрасной физической формой. Среди растительных продуктов главными источниками аминокислот являются: бобовые, орехи, крупы, семена.

Заключение
Сегодня мы узнали, сколько аминокислот входит в состав белка. Группы веществ и подробное описание их представителей помогут вам сориентироваться в составлении рациона здорового питания.






