Пространственное строение белков и пептидов. Пространственная организация белковой молекулы
Выполнение белками определенных специфических функций зависит от пространственной конфигурации их молекул, кроме того, клетке энергетически невыгодно держать белки в развернутой форме, в виде цепочки, поэтому полипептидные цепи подвергаются укладке, приобретая определенную трехмерную структуру, или конформацию. Выделяют 4 уровня пространственной организации белков .
Первичная структура белка - последовательность расположения аминокислотных остатков в полипептидной цепи, составляющей молекулу белка. Связь между аминокислотами - пептидная.
Если молекула белка состоит всего из 10 аминокислотных остатков, то число теоретически возможных вариантов белковых молекул, отличающихся порядком чередования аминокислот, - 10 20 . Имея 20 аминокислот, можно составить из них еще большее количество разнообразных комбинаций. В организме человека обнаружено порядка десяти тысяч различных белков, которые отличаются как друг от друга, так и от белков других организмов.
Именно первичная структура белковой молекулы определяет свойства молекул белка и ее пространственную конфигурацию. Замена всего лишь одной аминокислоты на другую в полипептидной цепочке приводит к изменению свойств и функций белка. Например, замена в β-субъединице гемоглобина шестой глутаминовой аминокислоты на валин приводит к тому, что молекула гемоглобина в целом не может выполнять свою основную функцию - транспорт кислорода; в таких случаях у человека развивается заболевание - серповидноклеточная анемия.
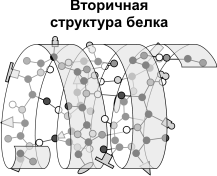
Вторичная структура - упорядоченное свертывание полипептидной цепи в спираль (имеет вид растянутой пружины). Витки спирали укрепляются водородными связями, возникающими между карбоксильными группами и аминогруппами. Практически все СО- и NН-группы принимают участие в образовании водородных связей. Они слабее пептидных, но, повторяясь многократно, придают данной конфигурации устойчивость и жесткость. На уровне вторичной структуры существуют белки: фиброин (шелк, паутина), кератин (волосы, ногти), коллаген (сухожилия).

Третичная структура - укладка полипептидных цепей в глобулы, возникающая в результате возникновения химических связей (водородных, ионных, дисульфидных) и установления гидрофобных взаимодействий между радикалами аминокислотных остатков. Основную роль в образовании третичной структуры играют гидрофильно-гидрофобные взаимодействия. В водных растворах гидрофобные радикалы стремятся спрятаться от воды, группируясь внутри глобулы, в то время как гидрофильные радикалы в результате гидратации (взаимодействия с диполями воды) стремятся оказаться на поверхности молекулы. У некоторых белков третичная структура стабилизируется дисульфидными ковалентными связями, возникающими между атомами серы двух остатков цистеина. На уровне третичной структуры существуют ферменты, антитела, некоторые гормоны.
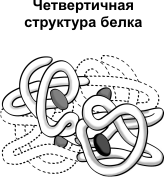
Четвертичная структура характерна для сложных белков, молекулы которых образованы двумя и более глобулами. Субъединицы удерживаются в молекуле благодаря ионным, гидрофобным и электростатическим взаимодействиям. Иногда при образовании четвертичной структуры между субъединицами возникают дисульфидные связи. Наиболее изученным белком, имеющим четвертичную структуру, является гемоглобин . Он образован двумя α-субъединицами (141 аминокислотный остаток) и двумя β-субъединицами (146 аминокислотных остатков). С каждой субъединицей связана молекула гема, содержащая железо.
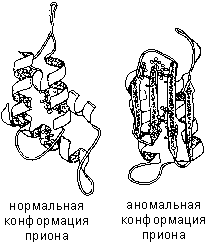
Если по каким-либо причинам пространственная конформация белков отклоняется от нормальной, белок не может выполнять свои функции. Например, причиной «коровьего бешенства» (губкообразной энцефалопатии) является аномальная конформация прионов - поверхностных белков нервных клеток.
Тестовые вопросы
1. Какая связь формирует вторичную структуру белков.
а) водородная связь;
б) ковалентная связь;
в) сложноэфирная;
г) пептидная связь.
Ковалентный скелет белков состоит из сотен индивидуальных связей. Если было бы возможно свободное вращение вокруг даже части этих связей, белки имели бы почти безграничное число трехмерных структур. Однако каждый белок имеет специфическую функцию, что предполагает для него уникальную пространственную структуру. Тот факт, что белки кристаллизуются, дает убедительное доказательство наличия таких структур. Строгий молекулярный порядок в кристалле может быть реализован в том случае, если все молекулы имеют идентичную форму в кристалле. Фермент уреаза с ММ 483кДа был среди первых закристаллизованных белков.
Пространственное расположение атомов в молекуле белка называют его конформацией . Изменения конформации встречаются при вращении вокруг одинарных связей без их разрушения. В белках реализуются четыре уровня архитектуры.
Первичная структура связана с ковалентными связями между аминокислотными остатками (аминокислотная последовательность). Относительное пространственное расположение связанных аминокислот не является специфичным. Полипептидные цепи не могут иметь любые пространственные структуры по выбору. Стерические ограничения, а также множество слабых невалентных взаимодействий приводят к тому, что отдельные пространственные формы более устойчивы чем остальные.
Вторичная структура относится к регулярным расположениям соседних аминокислотных остатков в полипептидной цепи (регулярные конформации). Для вторичной структуры полипептидных цепей наиболее характерны a- спираль и b- конформация .
Третичная структура относится к пространственному расположению всех аминокислот полипептида. Связь между вторичной и третичной структурой в настоящее время не достаточно ясна. Несколько различных типов вторичной структуры часто обнаруживаются в третичной структуре большого белка.
Белки с несколькими пептидными цепями имеют еще один более высокий уровень организации: четвертичную структуру , которая относится к пространственному расположению полипептидных цепей или субъединиц в белке. Можно выделить промежуточные уровни между вторичной и третичной структурой. Устойчивый кластер из нескольких элементов вторичной структуры относят к супервторичной структуре. Еще более высокий уровень структуры представляет домен . Его относят к компактной структуре, включающей возможно от 40 до 400 аминокислот, домен представляет отчетливую единицу в большой полипептидной цепи. Многие домены складываются независимо в термодинамически устойчивые структуры. Большая полипептидная цепь может содержать несколько доменов, которые легко различимы. В некоторых случаях индивидуальные домены имеют отдельные функции.
Конформация белка стабилизируется большим числом слабых невалентных взаимодействий. Устойчивость нативной конформации белка невелика, так разность в свободной энергии сложенных и несложенных состояний в типичных белках в физиологических условиях находится в интервале от 20 до 65 кДж/моль. Энтропия и водородное связывание многих групп полипептидной цепи с растворителем (водой) приводят к раскрытым формам. К складчатым формам приводят химические взаимодействия в виде дисульфидных мостиков, а также невалентные взаимодействия: водородные связи, гидрофобные, ионные и ван-дер-ваальсовы взаимодействия.
Наиболее общей вторичной структурой белков является a-спираль. В этой структуре полипептидный остов закручен относительно длинный оси молекулы, а R-группы аминокислотных остатков расположены с внешней стороны спирали. Шаг спирали составляет 0.56 нм. Вторым типом регулярной структуры в белках является b-конформация, которая способствует укладыванию полипептидных цепей в слои, при этом возможно как параллельное, так и антипараллельное расположение цепей. В некоторых белках (например в коллагене) помимо этих регулярных конформаций встречаются и другие типы вторичной структуры: b-складка и b-виток. Хотя фибриллярные белки имеют только один тип вторичной структуры, глобулярные белки могут включать несколько типов вторичной структуры для одной молекулы. Глобулярные белки, включая ферменты, транспортные белки, некоторые гормоны и иммуноглобулины, образуют складчатые структуры, более компактные чем a- и b- конформации.
Третичная структура представляет трехмерное расположение всех атомов в белке, она имеет дело с дальнодействующими взаимодействиями аминокислотных остатков. Свиной альбумин имеет 584 остатка в одной цепи.
Ниже показаны относительные размеры цепи в b-конформации, в форме a-спирали и нативной глобулярной форме.
b - конформация : 200 х 0.5 нм
a - спираль : 90 х 1.1 нм нативная глобулярная форма : 13х3 нм
Пространственное расположение атомов в кристаллической решетке белка определяют методом рентгеноструктурного анализа исходя из углов и интенсивности дифракций от электронных оболочек атомов. К настоящему времени этим методом установлены третичные структуры сотен глобулярных белков (миоглобин, инсулин, цитохром с, лизоцим, рибонуклеаза и т.д.).
Доля a-спиралей и b-форм в некоторых белках .
Белки могут денатурировать при нагревании, резком изменении рН, обработке органическими растворителями, солями тяжелых металлов с разрушением третичной структуры и потерей функциональной активности.
Третичные структуры не являются жесткими, в процессе синтеза белка они формируются достаточно быстро, не случайным образом. Существует несколько типов третичных структур достаточно общих для многих белков (a/b баррел , b-b сэндвич и другие).
Некоторые белки содержат две и более отдельные пептидные цепи, которые могут быть идентичны или различны по структуре. Пространственное расположение белков и его субъединиц в трехмерном комплексе представляет четвертичную структуру, которую определяют на практике методом рентгеноструктурного анализа монокристалла белка. Таким образом установлена четвертичная структура гемоглобина, который содержит четыре полипептидные цепи и четыре гемпростетические группы.
Некоторые белки образуют надмолекулярные комплексы, которые сохраняют принципы, присущие всем уровням организаций белков. Из этих надмолекулярных комплексов построены биологические машины, осуществляющие функционирование клетки (сокращение мышц, синтез белков в рибосомах, упаковка ДНК, перемещение органелл и т.д.).
Вопросы для самоконтроля
1. Свойства пептидной связи.
2. Влияние рН на конформационную структуру белков.
3. Роль дисульфидных связей.
4. Чем определяется термическая устойчивость нативной структуры белков?
5. Локализация специфических аминокислот на поверхности глобулярных белков.
6. Чем определяется молекулярная масса гемоглобина?
Первичная структура белка - последовательность аминокислотных фрагментов, прочно (и в течение всего периода существования белка) соединенных пептидными связями. Существует период полужизни белковых молекул - для большинства белков около 2-х недель. Если произошел разрыв хотя бы одной пептидной связи, то образуется уже другой белок.Вторичная структура - это пространственная организация стержня полипептидной цепи. Существуют 3 главнейших типа вторичной структуры:
1) Альфа-спираль - имеет определенные характеристики: ширину, расстояние между двумя витками спирали. Для белков характерна правозакрученная спираль. В этой спирали на 10 витков приходится 36 аминокислотных остатков. У всех пептидов, уложенных в такую спираль, эта спираль абсолютно одинакова. Фиксируется альфа-спираль с помощью водородных связей между NH-группами одного витка спирали и С=О группами соседнего витка. Эти водородные связи расположены параллельно оси спирали и многократно повторяются, поэтому прочно удерживают спиралеобразную структуру. Более того, удерживают в несколько напряженном состоянии (как сжатую пружину).
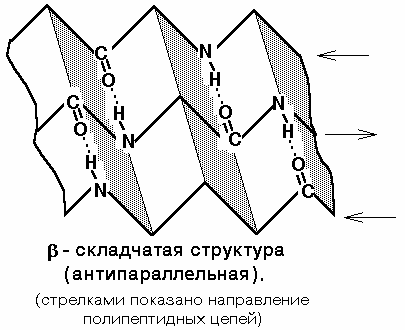
2) Бета-складчатая структура - или структура складчатого листа. Фиксируется также водородными связями между С=О и NH-группами. Фиксирует два участка полипептидной цепи. Эти цепи могут быть параллельны или антипараллельны. Если такие связи образуются в пределах одного пептида, то они всегда антипараллельны, а если между разными полипептидами, то параллельны.
3) ^ Нерегулярная структура - тип вторичной структуры, в котором расположение различных участков полипептидной цепи относительно друг друга не имеет регулярного (постоянного) характера, поэтому нерегулярные структуры могут иметь различную конформацию.
^ Третичная структура - это трехмерная архитектура полипептидной цепи – особое взаимное расположение в пространстве спиралеобразных, складчатых и нерегулярных участков полипептидной цепи. У разных белков третичной структуры различна. В формировании третичной структуры участвуют дисульфидные связи и все слабые типы связей.
Выделяют два общих типа третичной структуры:1) В фибриллярных белках (например, коллаген , эластин) молекулы которых имеют вытянутую форму и обычно формируют волокнистые структуры тканей, третичная структура представлена либо тройной альфа-спиралью (например, в коллагене), либо бета-складчатыми структурами.
2) В глобулярных белках, молекулы которых имеют форму шара или эллипса (латинское название: GLOBULA - шар), встречается сочетание всех трех типов структур: всегда есть нерегулярные участки, есть бета-складчатые структуры и альфа-спирали.
Обычно в глобулярных белках гидрофобные участки молекулы находятся в глубине молекулы. Соединяясь между собой, гидрофобные радикалы образуют гидрофобные кластеры
(центры). Формирование гидрофобного кластера вынуждает молекулу соответствующим образом изгибаться в пространстве. Обычно в молекуле глобулярного белка бывает несколько гидрофобных кластеров в глубине молекулы. Это является проявлением двойственности свойств белковой молекулы: на поверхности молекулы - гидрофильные группировки, поэтому молекула в целом - гидрофильная, а в глубине молекулы - спрятаны гидрофобные радикалы.
Четвертичная структура встречается не у всех белков, а только у тех, которые состоят из двух или более полипептидных цепей. Каждая такая цепь называется СУБЪЕДИНИЦЕЙ данной молекулы (или ПРОТОМЕРОМ). Поэтому белки, обладающие четвертичной структурой, называют ОЛИГОМЕРНЫМИ белками. В состав белковой молекулы могут входить одинаковые или разные субъединицы. Например, молекула гемоглобина «А» состоит из двух субъединиц одного типа и двух субъединиц другого типа, то есть является тетрамером. Фиксируются четвертичные структуры белков всеми типами слабых связей, а иногда еще и дисульфидными связями.
^ Физико-химические свойства белков
Аминокислотный состав белковой молекулы, т.е. особенности первичной структуры определяются не только структурную организацию, биологические функции, но и физико- химические свойства белков. Особенности физико-химических свойств используют для выделения и разделения индивидуальных белков из белковых смесей. Рассматривая физико – химические свойства, говорят о молекулярной массе белковых молекул, об амфотерности, наличии заряда, изоэлектрической точки, способности белков к движению в электрическом поле, о растворимости белков и свойствах растворов, о денатурации белков.
^ Молекулярная масса белков
“Белки - высоко молекулярные соединения”, так начинается определение этого класса веществ. Молекулярная масса белков колеблется от 6 т. дальтон до нескольких миллионов. Например: инсулин – 5733, гемоглобин – 6450, – глобулин человека – 160000, глутаматдегидрогиназа – 1 млн, вирус табачной мозайки – 40 млн. дальтон.
Наиболее точный метод определения молекулярной массы белков расчетный, но для этого надо знать аминокислотный состав (т.е. у белка должна быть расшифрована первичная структура); должно быть известно наличие или отсутствие четвертичной структуры, а поскольку из огромного разнообразия природных белков (10 10 – 10 12) все это известно только у тысячи белков, то основными методами определения молекулярной массы остаются:
вискозиметрические;
осмометрические;
гравиметрические;
гельфильтрация;
электрофорез (особенно последние три метода).
Растворимость белков
Растворимость белков колеблется в широких пределах и определяется:
- аминокислотным составом (чем больше полярных группировок, тем лучше растворимость);
особенностями организации белковой молекулы (глобулярные растворимы лучше, чем фибриллярные);
свойства растворителя (растительные белки лучше растворяются в 60 – 80° спирте, альбумины – в воде и солевых растворах, глобулины – в слабых солевых растворах).
Факторы среды, влияющие на растворимость:
зависит от природы и концентрации растворов солей, что находит отражение в понятии – ионная сила раствора, которая определяется по формуле:
Где с - концентрация соли;
B - валентность (т.е. природа соли).
Соли солей щелочных и щелочноземельных металлов низкой ионной силы повышают растворимость, т.к. увеличивается возможность формирования гидратной оболочки, с увеличением ионной силы – растворимость уменьшается, при этом каждый белок теряет свою растворимость, т.е. осаждается из раствора при вполне определенной ионной силе. Осаждение белков из растворов солями щелочных и щелочноземельных металлов называется высаливанием. Осаждающая способность соли зависит как от катиона, так и от аниона. Катионы и анионы можно разместить в два ряда по уменьшающейся слева направо осаждающей способности:
Катионы:Cs, Rb, K, Na, Li, Ba, Sc, Ca, Mg
Анионы:SO 4 , Cl, Br, NO 3 , J , CNS
Эти ряды носят название лиотропных рядов. Высаливание широко применяется для разделения (например альбуминов от глобулинов) и получения в очищенном виде белков и ферментов. Поскольку высаливание влияет на гидратную оболочку, то этот процесс обратимый. Снять гидратную оболочку и тем самым осадить белок из раствора можно и водоотнимающими веществами – спиртом, ацетоном (используются способ фракционирования белков спиртами различной концентрации – по Кону). Это своеобразное высаливаниеи, если воздействие не очень длительное, процесс обратим.
Растворимость белка зависит от температуры, причем с увеличением температуры до 40°С она увеличивается, а при дальнейшем нарастании – уменьшается вследствие изменения третичной и четвертичной (при ее наличии) структур, что можно выразить графиком

Растворимость белков зависит и от рН среды. В изоэлектрическом состоянии, когда суммарный заряд молекулы равен 0) и гидратная оболочка не формируется, белки выпадают в осадок. На этом свойстве основано определение изоэлектрической точки белка, изоэлектрическое осаждение и разделение белков (при изменении рН среды таким образом, чтобы она соответствовала изоэлектрической точке белка, он будет выпадать в осадок).
Методы фракционирования (разделения) белков по растворимости:
изоэлектрическое осаждение;
высаливание;
разделение с использованием водоотнимающих средств.
Белковые структуры очень чувствительны к изменениям среды, особенно третичная и четвертичная. Белки с неизмененными структурами и свойствами, присущими природным молекулам, называются нативными белками . Любое негидролитическое изменение структуры белка, приводящее к изменению его биологических и физико-химических свойств – называется денатурацией (негидролитическое, т.е. не затрагивающее пептидную связь, первичную структуру).
Факторы денатурации:
физические: температура, давление, ультразвук:
химические: кислоты, щелочи, детергенты, тяжелые металы, мочевина;
биологические: протеолитические ферменты.
Признаки денатурации:
Потеря биологической активности, неспособность выполнять свою функцию.
Изменение конформации молекулы белка.
Увеличение числа функциональных групп (появляются гидрофобные группировки, которые в нативном белке находятся внутри молекулы).
Уменьшение растворимости белка и осаждение его из-за потери гидрофобной оболочки.
Изменение вязкости, оптической активности, прозрачности растворов белка.
Изменение окрашиваемости, что находит применение в гистологии.
Вследствие изменения структуры молекулы белка, появлению на поверхности молекулы новых группировок, внутренние связи в белке становятся более доступными действию протеолитических ферментов, т.е. такой белок лучше переваривается.
Денатурация – процесс обратимый, если воздействие кратковременно и денатурирующий агент удален раньше, чем оказалась затронутой вторичная структура.
Денатурация находит широкое применение в медицине, промышленности, в лабораторной практике, быту.
^ Выделение и очистка белков
Выделение и очистка белков состоит из ряда этапов:
Измельчение ткани вплоть до разрушения клеточных стенок – гомогенизация.
Экстракция – извлечение белков различными растворителями; водой, слабыми солевыми растворами, буферными солевыми растворами и т.д.
Разделение экстракта в начале на фракции, а затем на индивидуальные белки комбинацией различных методов осаждения (высаливание, ИЭТ осаждение, дифференциальное центрифугирование), электрофореза, гельфильтрация, хроматографии.
Очистка белка (диализ, гельфильтрация, переосаждение, дискэлектрофорез).
Кристаллизация (высаливание, лиофилизация).
Установка гомогенности.
Отправить свою хорошую работу в базу знаний просто. Используйте форму, расположенную ниже
Студенты, аспиранты, молодые ученые, использующие базу знаний в своей учебе и работе, будут вам очень благодарны.
Размещено на http://www.allbest.ru/
Пространственное строение белков и пептидов
Каждый белок или пептид специфическим образом свернут в пространстве, и эта конформация определяет его физико-химические и биологические свойства. Пространственная структура белка (пептида) в целом кодируется его первичной структурой. Эта взаимосвязь создает предпосылки для теоретических расчетов и предсказаний вторичной структуры белков на основе их аминокислотной последовательности. Пространственная структура достаточно подвижна, т. е. способна изменяться под воздействием внешних условий или различных агентов, и в этом смысле правильнее говорить о предпочтительной конформации белка или пептида, об одной из многих, энергетически наиболее выгодной пространственной структуре. Среда, даже наиболее естественная, не может не вызывать ответной реакции белковой молекулы, и особенно тех ее группировок, которые расположены на поверхности глобулы и участвуют в многочисленных взаимодействиях. В живой клетке белок находится в постоянно меняющемся окружении и вынужден как-то перестраиваться, когда ему приходится вступать в контакт с соседними белками, рецепторами или такими постоянными партнерами, как нуклеиновые кислоты, липиды, полисахариды, ионы металлов и другие низкомолекулярные соединения. Поэтому естественно стремление исследователя получить более полную информацию о динамических характеристиках белковой молекулы. Образно говоря, он хочет видеть не фотографию, а цветной кинофильм обо всех приключениях и превращениях функционирующей молекулы белка.
Первостепенное значение имеет выяснение конформации нативного белка, которая определяет специфичность биологического действия. Поскольку условия эксперимента при анализе пространственного строения пептидно-белковых веществ обычно отличаются от условий, в которых они функционируют in vivo, в каждом случае необходимо строго доказывать, что исследуемая предпочтительная конформация в целом сохраняется в широком диапазоне параметров среды (например, в растворе или кристалле).
Таким образом, выяснение пространственного строения пептидов и белков представляет собой достаточно сложную задачу. В некоторых случаях трехмерная структура конкретного соединения может быть выяснена на основе какого-либо одного метода (например, с помощью рентгеноструктурного анализа кристаллического белка). При исследовании пептидов и небольших белков в растворах хорошие результаты дает сочетание ряда физико-химических методов. Иногда ценную информацию можно получить на основе применения, наряду с экспериментальными подходами, теоретических расчетных методов.
В белках, как уже отмечалось, различают несколько уровней пространственной организации, т. е. вторичную, третичную и четвертичную структуры. Хотя эти понятия несколько устарели для белков, а для пептидов не применяются вообще, ими пользуются ради преемственности, поскольку в конечном счете представляет интерес полное описание пространственного строения данного белка или пептида с точными координатами атомов, со всеми конформационными переходами -- в непосредственной связи с выполняемой биологической функцией.
Стереохимия аминокислот
белок пептид аминокислота
Все встречающиеся в белках аминокислоты (кроме пролина) могут быть изображены формулой NH2CHRCOOH, где R -- радикалы различной природы. В общем случае это соединения с асимметрическим атомом углерода, и, следовательно, каждая аминокислота может существовать в пространстве в виде двух форм -- с L- и D-конфигурацией асимметрического центра.
Принадлежность аминокислот к L- или D-ряду в случае простейших представителей (аланин, серин) доказывается прямым сведением их к соответствующему глицериновому альдегиду с помощью стереоспецифических превращений.
В состав всех белков входят только L-аминокислоты (исключение составляет оптически неактивный глицин), которые могут быть представлены в виде проекционных формул Фишера:
Принадлежность к L-ряду не обязательно связана с определенным направлением вращения плоскости поляризованного света: L-аминокислоты имеют как положительное, так и отрицательное вращение в зависимости от радикала R и условий исследования.
Противоположную конфигурацию имеют D-аминокислоты:
Остатки D-аминокислот входят в состав многих природных пептидов, прежде всего антибиотиков. В частности, в грамицидин 8 входит Б -фенилаланин, в грамицидин А -- D -валин,D -лейцин,D -триптофан, в актиномицин D -- D-изолейцин, в полимиксин -- D-серин, D-Пролин встречается в эргоалкалоидах.
Некоторые аминокислоты имеют два асимметрических углеродных атома, что обусловливает возможность существования четырех оптически активных стереомерных форм (2n, где n -- число асимметрических атомов). Эти формы проиллюстрированы на схеме для треонина и изолейцина.
Появление заместителя в пирролидиновом кольце пролина также приводит к образованию алло -форм, в которых заместитель (гидроксигруппа) и карбоксильная группа находятся в цис -положении.
При кислотном гидролизе белков получается смесь L-аминокислот, которые с помощью дробной кристаллизации или хроматографии могут быть выделены в чистом виде. Аналогично при гидролизе ряда природных пептидов (грамицидины А и S, актиномицин и т. п.) можно получить и соответствующие чистые D-аминокислоты.
Часто аминокислоты для исследовательских целей и практических нужд получают с помощью микробиологического синтеза (лизин и др.) -- тогда продуктами являются L-изомеры. Если же пользуются химическим синтезом, то обычно образуются смеси L- и D-изомеров аминокислот, т. е. рацематы. Для их разделения используются различные приемы. Одним из наиболее распространенных является избирательный гидролиз ферментами (ацилазами, эстеразами и т. п.) N-ацетил-D,L-аминокислот или соответствующих сложных эфиров D,L-аминокислот; в этом случае расщеплению подвергается лишь L-форма и, таким образом, в растворе образуются свободные L-аминокислоты, которые легко отделяются от стабильных по отношению к ферментативному гидролизу производных D-аминокислот.
Другим приемом является образование солей D, L-аминокислот с оптически активными агентами, например алкалоидами бруцином и стрихнином, а также другими оптически активными аминами, производящимися в промышленных масштабах (амфетамин и др.). В силу различной растворимости соответствующих диастереомерных солей (D,L и L,L) они разделяются путем кристаллизации или дробного осаждения и при последующем разложении кислотами образуют оптически чистые L- и D-аминокислоты. Эти методы, ранее широко применявшиеся в лаборатории, постепенно утрачивают свое значение. В производственных условиях для разделения рацемических аминокислот все шире используются хроматография на оптически активных адсорбентах и иммобилизованные ферменты.
Пептидная связь
Главной структурной единицей белков и пептидов является пептидная (амидная) связь --СО--NH--. Согласно современным представлениям, пептидная связь в белках является практически плоской, ее основные параметры приведены на рисунке. В обычных условиях наблюдаются лишь небольшие отклонения от плоской системы (до 5 -- 10°); большие деформации возможны в напряженных циклических системах. Пептидная связь примерно на 10% короче обычной, простой С--N и имеет характер «частично двойной» связи --С=N--. При изучении этой проблемы Л. Полинг и Р. Кори, анализировавшие методом рентгеноструктурного анализа ряд модельных ди- и трипептидов, предложили в 1948 -- 1955 гг. объяснять особую природу связи С--N «резонансом» между двумя формами пептидной связи а и б.
Другими словами, в белках и пептидах связь С--N является частично кратной (как это показано структурой в) из-за взаимодействия неподеленной пары электронов атома азота с р-электронной системой карбонильной группы, что приводит к затрудненному вращению вокруг связи С--N (барьер вращения составляет 63 -- 84 кДж/моль).
Обычно пептидная связь имеет транс-конфигурацию, т. е. является транспланарной (рис. 33, а). В напряженных циклических системах (некоторые циклопептиды, производные пролина и т. п.), а также при большом размере заместителей у атома азота в N-алкилированных производных пептидная связь может существовать в плоской цис-форме (рис. 33,б). Цис- и транс -пептидные связи можно различить с помощью физических методов (ИК-, ЯМР- спектроскопии и др.). В белках пептидная связь практически всегда имеет транс-конфигурацию.
Валентные углы и длины связей (в нм) в транс- и цис -пептидных связях (а и б соответственно)
Рассмотрим теперь фрагмент пептидной цепи, включающий две плоские пептидные связи с подвижным (своего рода шарнирным) сочленением в точке, где находится асимметрический углеродный атом (рис. 34).
Определение двугранных углов в полипептидной цепи
В этом звене пептидной цепи повороты возможны вокруг двух простых связей N--Сб и Сб--С", примыкающих к асимметрическому атому. Согласно принятой номенклатуре, такие повороты измеряются двугранными углами ц(N--Сб) и ш(Сб--С"); нередко используются также углы щ (вращение вокруг пептидных связей С"--N), а также ч1 и ч2 др. (вращение вокруг связей Сб--Св, Св--Сг и т. д.). В качестве нулевой точки отсчета принимается конформация (рис. 35), в которой ц = ш = щ = 0° (заслоненное расположение остатков основной пептидной цепи). Направление отсчета углов -- положительных (до + 180°) и отрицательных (до -- 180°) -- на рисунке 35 показано стрелками.
Легко понять, что любые конформации пептидной цепи могут быть описаны набором значений углов ц и ш у каждого из Сб-атомов (обычно щ = 180°); другими словами, знание таких значений для всех пептидных звеньев эквивалентно полной информации о пространственном строении основной цепи белка и пептида.
Графически конформационные параметры полипептидной цепи удобно изображать с помощью карт, предложенных Г. Рамачандраном в 1963 г. («карты Рамачандрана») и отражающих зависимость энергии остатка от параметров ц и ш (рис. 36). Значения углов ц и ш откладываются по осям координат от -180° до +180°. В силу взаимодействия между заместителями в пептидной цепи углы ц и ш не могут принимать любые значения -- для них разрешенными оказываются лишь некоторые дискретные области (выделенные на карте темным цветом), которые соответствуют энергетически выгодным конформациям пептидной цепи, т. е., по существу, являются областями минимума энергии. Их достаточно компактная локализация свидетельствует о том, что углы ц и ш взаимосвязаны, изменение одного из них влечет изменение второго. Например, если угол ш приобретает значение в интервале 60 -- 120°, то для угла ц энергетически выгодным оказывается значение, не превышающее -- 60°.
Конформации пептидной цепи, отвечающие нулевым значениям углов ц, ш и щ (черные стрелки указывают направление взгляда наблюдателя)
Невалентные взаимодействия в пептидной цепи
Пространственная структура белков и пептидов в основном определяется невалентными взаимодействиями между различными атомами.К их числу относятся ван-дер-ваальсовые, электростатические, или ионные, ион-дипольные и диполь-дипольные, гидрофобные, торсионные взаимодействия и водородные связи.
Разрешенные области для двугранных углов основной цепи.
Водородные связи, как правило, образуются между подвижным атомом водорода (--ОН,--NН,--SН) и гетероатомом, чаще всего атомом кислорода. Водородная связь имеет донорно-акцепторную природу, т. е. она образуется с участием неподеленной электронной пары гетероатома (донор электронов); акцептором электронов является атом водорода. Наибольшее значение для формирования пространственной структуры белков имеют водородные связи междуСО- и NН-группами пептидного остова.
В неполярном окружении энергия водородной связи СО...НN составляет около 16,7 кДж/моль, а повышение полярности среды снижает эту энергию.
Помимо указанных, возможны и водородные связи с участием функциональных групп боковых цепей, например:
Труднее объяснить гидрофобные взаимодействия. По существу, такие взаимодействия, имеющие энтропийную природу, связаны с тем, что неполярные заместители выталкиваются из воды и стремятся ограничить свой контакт с водой; напротив, вода стремится восстановить свое структурированное состояние и как бы принудительно группирует заместители в кластеры, обладающие минимумом энергии. В такого рода «взаимодействия» вступают в основном неполярные боковые группы аминокислотных остатков.
Ван-дер-ваальсовые взаимодействия, описываемые потенциалом Ленард-Джонса, складываются из дисперсионных сил притяжения атомов и сил взаимного отталкивания их электронных оболочек. Как видно из рисунка, наиболее выгодным является расстояние Rm, равное или близкое сумме эффективных радиусов взаимодействующих атомов.
Потенциал Ленард-Джонса (минимуму потенциала отвечает расстоянию Rm и энергия притяжения Еm)
Энергетический вклад каждого контакта невелик (<0,42 кДж/моль), но ввиду их большого числа ван-дер-ваальсовые взаимодействия дают основной вклад в суммарную энергию внутримолекулярных невалентных взаимодействий.
Ионные, или электростатические, взаимодействия представляют собой взаимодействия заряженных групп. При этом, как известно, одноименно заряженные группы отталкиваются, а разноименно заряженные притягиваются. К ним относятся, в частности, взаимодействия ионогенных групп, образующих солевые связи.
Энергия солевых связей в гидрофобном окружении может достигать 41,9 кДж/моль, но их число в белках сравнительно невелико. Повышение диэлектрической постоянной среды понижает энергию солевых связей. Во многом аналогичны электростатическим ион-дипольные и диполь-дипольные взаимодействия.
Наконец, торсионные взаимодействия характеризуют «скрученность» ординарной связи. В частности, поворот какой-либо группировки вокруг ординарной связи может нарушать электронную структуру этой связи и вызывать своего рода «тормозную» реакцию. Торсионные силы относительно слабы, но при анализе поворотов вокруг связей С--С, С--N в боковых цепях аминокислотных остатков их нельзя не учитывать.
Реализуемая в данных условиях конформация белка и пептида определяется суммой всех перечисленных взаимодействий и является энергетически наиболее выгодной, что и отражается «попаданием» соответствующих углов в разрешенные области конформационных «карт Рамачандрана».
Размещено на Allbest.ru
Подобные документы
Аминокислоты, входящие в состав пептидов и белков. Моноаминодикарбоновые кислоты и их амиды. Энантиомерия аминокислот, образование солей. Мезомерия и строение пептидной связи. Методы выделения и анализа белков. Электрофорез в полиакриламидном геле.
презентация , добавлен 16.12.2013
Роль в живой природе. Состав и свойства белков. Классификация белков. Определение строения белков. Определение наличия белка. Идентификация белков и полипептидов. Синтез пептидов. Искусственное получение белка. Аминокислоты.
реферат , добавлен 01.12.2006
Общая характеристика, классификация, строение и синтез белков. Гидролиз белков с разбавленными кислотами, цветные реакции на белки. Значение белков в приготовлении пищи и пищевых продуктов. Потребность и усвояемость организма человека в белке.
курсовая работа , добавлен 27.10.2010
Оценка сложившегося административно-территориального устройства России. Исследование белков. Классификация белков. Состав и строение. Химические и физические свойства. Химический синтез белков. Значение белков.
реферат , добавлен 13.04.2003
Классификация биополимеров. Аминокислоты, входящие в состав пептидов и белков, строение и свойства. Моноаминодикарбоновые кислоты и их амиды. Образование солей. Пептидная связь. Уровни структурной организации белка. Нуклеиновые кислоты и их производные.
презентация , добавлен 28.02.2012
Белки как полимеры с пептидной связью. Образование макрокомплекса (олигопротеина), состоящий из нескольких полноценных белковых субъединиц. Фибриллярные и глобулярные группы. Анализ и синтез белков. Метод Меррифилда - твердофазный синтез пептидов.
реферат , добавлен 21.02.2009
Характеристика белков как высокомолекулярных соединений, их структура и образование, физико–химические свойства. Ферменты переваривания белков в пищеварительном тракте. Всасывание продуктов распада белков и использование аминокислот в тканях организма.
реферат , добавлен 22.06.2010
Белки как высокомолекулярные природные соединения, состоящие из остатков аминокислот, которые соединены пептидной связью. Качественный состав белков, их структура и функции. Процессы гидролиза (кислотно-основного, ферментативного) и денатурация белков.
презентация , добавлен 11.02.2015
Исследования свойств белков для изучения их химического состава и строения. Аминокислота - основная структурная единица белка. Белковые резервы. Этапы синтеза белка. Регуляция биосинтеза аминокислот. Переваривание белков. Патология белкового обмена.
реферат , добавлен 17.01.2009
Общие пути обмена аминокислот. Значение и функции белков в организме. Нормы белка и его биологическая ценность. Источники и пути использования аминокислот. Азотистый баланс. Панкреатический сок. Переваривание сложных белков. Понятие трансаминирования.