Структурная организация белковой молекулы. Структура белковой молекулы
Полипептидное строение белков . Первые белковые вещества выделили более 250 лет назад, а во второй половине 18 - начале 19 вв. уже неоднократно описывали белковые вещества растений и животных.
В настоящее время хорошо известен химический элементарный состав белков. Они обычно содержат 50-55% С, 21-23% 0 2 , 15-17% N 2 , около 7% Н 2 , от 0 до 3% S. В сложные белки, кроме того, могут входить Р и некоторые металлы.
По современным данным, наиболее часто в составе различных белков обнаруживают 20 видов аминокислот. Именно для 20 аминокислот существует генетический код в виде триплетов (тройки нуклеотидов в ДНК). Иногда в белках присутствуют и другие аминокислоты, они образуются в результате модификации белков уже после их биосинтеза, являются некодируемыми (цистин, гидроксипролин, гидроксилизин и некоторые другие). В составе белков обнаружены только α-аминокислоты, в подавляющем большинстве в L-конфигурации.
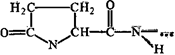
Аминокислоты соединяются друг с другом ковалентной пептидной или амидной связью. Образование ее происходит за счет аминогруппы (NH 2) одной аминокислоты и карбоксильной группы (-СООН) другой с выделением молекулы воды.
H 2 N-СН-С-ОН + Н-N-СН-СООН →H 2 N-СН-С-N-CH-СООН + Н 2 0
Транспептиднаясвязь
В природе распространена транспептидная связь, реже встречается менее устойчивая цис-пептидная связь. Пептидная связь является частично двойной, частично одинарной, между этими структурами есть взаимный переход. Время жизни одинарной связи несколько больше, чем двойной (6:4), пептидная связь на 60% одинарна и на 40% двойная.
В результате явления резонанса образуется флуктуирующая, динамическая связь, которую невозможно описать на основе одной валентной структуры. Так как вращение вокруг двойной связи заторможено, все атомы пептидной связи оказываются расположенными примерно в одной плоскости, т. е. она планарна, только вокруг атома азота связи отчасти сохраняют пирамидальный характер. В настоящее время установлены все валентные углы и длины связей в пептидных группировках (рис. 3).
Рис. 3. Межатомные растояния (нм) и углы в пептидной связи. Все атомы внутри рамки находятся примерно в одной плоскости.
Образованные аминокислотами полимеры называют пептидами или белками в зависимости от числа входящих в них структурных единиц. Условно принято, что пептиды, содержащие до 20 аминокислотных остатков, относятся к олигопептидам, среди них различают ди-, три-, тетрапептиды и т. д. Полипептиды имеют в молекуле от 20 до 50 аминокислотных остатков. Пептидные цепи, объединяющие более 50 аминокислот и имеющие молекулярную массу свыше 6 тыс., относятся к белкам.
Самый низкомолекулярный белок - гормон инсулин, состоящий из 51 аминокислотного остатка. Число аминокислотных звеньев в белке может доходить до нескольких сотен и даже тысяч. Количество видов белков в природе огромно, их разнообразие связано с различным набором аминокислот, входящих в белок, и порядком их чередования в молекуле. Так, уже из трех аминокислот можно получить 6 различных трипептидов, из четырех – 24 тетрапептида, пяти - 120 пентапептидов, из 11-40 млн. изомеров, а из 20 разных аминокислот, каждая из которых встречается только один раз, теоретически может образовываться астрономическое число (2·10 18) изомеров. Однако в живой природе реализуется только малая доля возможных изомеров.
Для описания строения белковых молекул были введены понятия о первичной, вторичной, третичной и четвертичной структурах.
Первичная структура. Под первичной структурой белковой молекулы понимают порядок чередования аминокислот в полипепдептидной цепи (или цепях) и местоположение дисульфидных связей. Полипептидная цепь содержит на одном конце свободную аминогруппу (N-конец), на другом - карбоксильную группу (С-конец). За начало цепи принимается ее N-конец, именно отсюда начинается отсчет аминокислот. Это совпадает с направлением синтеза полипептидной цепи на рибосоме, которое в свою очередь отвечает направлению 5"-3´ мРНК.
Аминогруппа на N-конце полипептидной цепи может быть иногда ацетилированной, присоединившей остаток уксусной кислоты (СНз-СО-NH). Блокированные за счет ацетилирования N-концы характерны также для белков оболочки многих растительных вирусов, некоторых вирусов животных и бактерий.
На С-конце встречается либо свободная карбоксильная группа (у большинства белков), либо амидированная (некоторые гормоны, пчелиный яд). Модификации С-конца более редки по сравнению с N-концевыми модификациями.
Названия отдельных пептидов образуются в соответствии с составляющими их аминокислотными остатками, начиная с N-конца. При этом в названиях всех аминокислот, за исключением последней, меняется окончание на «ил». Например, L-аланил-L-цистеил-L-метионин. Полная аминокислотная последовательность белков указывается в виде сокращенных названий аминокислот. Принято трехбуквенное и однобуквенное обозначение аминокислот (табл. 5).

Таблица 5. Обозначения аминокислотных остатков
Основная связь первичной структуры белков – пептидная связь. Эта связь достаточно жесткая и поэтому конформационная подвижность ее ограничена.
Различия в структуре гомологичных белков также дают ценную информацию о роли отдельных аминокислотных остатков в функционировании молекулы. Остатки, находящиеся в активных участках или определяющие конформацию полипептидной цепи, не могут быть изменены генетически или путем химической модификации без влияния на функцию. Так, известные в настоящее время вариации первичной структуры в цитохроме с разных видов живых организмов не связаны со значительными изменениями функциональных свойств белка, поскольку наименее изменяемыми являются участки вблизи связывания гема, а также участки, ответственные за пространственную укладку
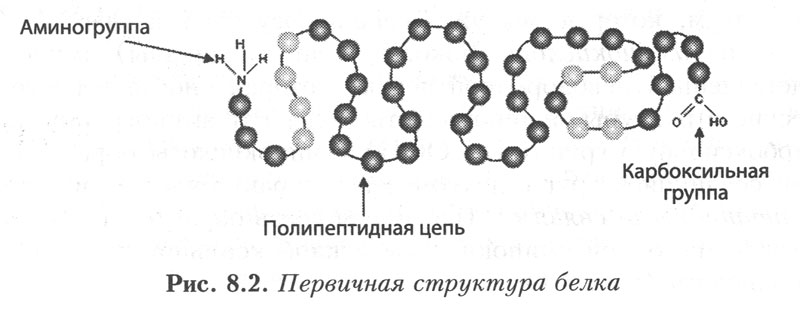
Рис. 4. Первичная структура белка
Установление чередования аминокислот в белках показало также, что в процессе эволюции происходило удвоение и слияние генов. С дупликации соответствующих генов обычно начинается дифференциация белков.
Вторичная структура. Вторичная структура - это упорядоченное пространственное расположение отдельных участков полипептидной цепи без учета типа и конформации боковых радикалов аминокислот. Она образуется за счет замыкания водородных связей между пептидными группами. Вторичная структура представлена в основном такими регулярными структурами как α-спираль, складчатые слои (β-структура), β-изгиб. Часть полипептидной цепи не имеет упорядоченного строения, такие участки называют аморфными или бесструктурными областями.
В α-спиральных участках и участках с β-складчатой структурой все последовательно расположенные пептидные звенья полипептидной цепи имеют идентичные взаимные ориентации, поскольку все торсионные углы φ и все углы ψ у Сα одинаковы. В таком случае участок полипептидной цепи имеет линейную структуру, которая формируется из линейных групп.
Линейная группа представляет собой виток спирали, параметры которой (смещение вдоль оси, приходящееся на повторяющийся элемент, число элементов на виток, радиус и др.) зависят от величины углов ф и ψ. Спираль с числом элементов в витке менее двух невозможна. В белках обнаружено несколько типов линейных групп, не имеющих стерических затруднений; они стабилизированы водородными связями либо в пределах одного участка полипептидной цепи (спираль), либо между соседними участками (β-складчатая структура).
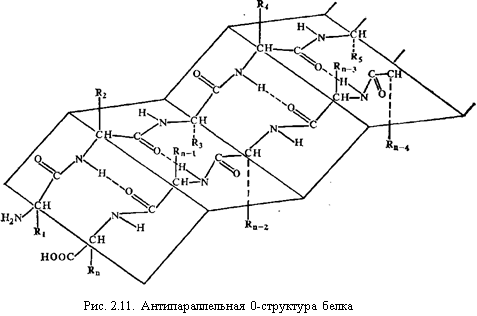
Рис. 5. Антипараллельная β-структура белка.
Складчатые слои могут образовываться не только одной полипептидной цепью (при этом водородные связи будут внутри данной цепи), но и группой близко расположенных полипептидных цепей в молекуле (водородные связи будут замыкаться между цепями). β-Структура второго типа характерна для таких фибриллярных белков, как фиброин шелка, кератин волос, состоящих из нескольких полипептидных цепей. У глобулярных белков в формировании β-складчатой структуры принимает участие обычно около 15% аминокислотных остатков полипептидной цепи. Большинство складчатых слоев содержит менее шести цепей. Как правило, складчатые слои не являются плоскими, для них характерна небольшая левая закрученность.
 Третичная структура.
Третичная структура характеризует пространственное расположение упорядоченных и аморфных участков в полипептидной цепи в целом, которое достигается за счет взаимодействия боковых радикалов и зависит от их типа и конформации. Таким образом, третичная структура описывает пространственную укладку всей молекулы белка, если она образована одной полипептидной цепью. Третичная структура имеет прямое отношение к форме молекул белка, которая может быть различной: от шарообразной до нитевидной. Таким образом, у глобулярных белков третичная структура характеризуется достаточно плотной упаковкой полипептидной цепи в виде клубкообразной молекулы, приближающейся по форме к шару. В поддержании третичной структуры глобулярных белков, ее закреплении принимают участие различные типы связей ковалентные, ионные, или солевые, водородные и гидрофобные взаимодействия (указаны в порядке убывания энергии связи). Преимущественную роль в формировании третичной структуры отводят гидрофобным взаимодействиям, возникающим между неполярными боковыми радикалами аминокислот.
Третичная структура.
Третичная структура характеризует пространственное расположение упорядоченных и аморфных участков в полипептидной цепи в целом, которое достигается за счет взаимодействия боковых радикалов и зависит от их типа и конформации. Таким образом, третичная структура описывает пространственную укладку всей молекулы белка, если она образована одной полипептидной цепью. Третичная структура имеет прямое отношение к форме молекул белка, которая может быть различной: от шарообразной до нитевидной. Таким образом, у глобулярных белков третичная структура характеризуется достаточно плотной упаковкой полипептидной цепи в виде клубкообразной молекулы, приближающейся по форме к шару. В поддержании третичной структуры глобулярных белков, ее закреплении принимают участие различные типы связей ковалентные, ионные, или солевые, водородные и гидрофобные взаимодействия (указаны в порядке убывания энергии связи). Преимущественную роль в формировании третичной структуры отводят гидрофобным взаимодействиям, возникающим между неполярными боковыми радикалами аминокислот.
Фибриллярные белки выполняют в организме, в основном, структурную функцию. Это плохо растворимые или нерастворимые белки, отличающиеся высоким содержанием неполярных аминокислот. К ним принадлежат, например, белки соединительных и сократительных тканей, волос, кожи, некоторые белки клеточных оболочек растений, водорослей и ряд других белков.
 Четвертичная структура.
Четвертичную структуру имеют те белки, молекула которых состоит из двух и более полипептидных цепей, связанных нековалентно. Четвертичная структура характерна, как правило, для белков, относительная молекулярная масса которых больше 50 000-100 000. Белки, имеющие четвертичную структуру, называются олигомерными.
Четвертичная структура.
Четвертичную структуру имеют те белки, молекула которых состоит из двух и более полипептидных цепей, связанных нековалентно. Четвертичная структура характерна, как правило, для белков, относительная молекулярная масса которых больше 50 000-100 000. Белки, имеющие четвертичную структуру, называются олигомерными.
Под четвертичной структурой понимают способ взаимного расположения в пространстве отдельных полипептидных цепей в молекуле, характер связей между ними. К белкам с четвертичной структурой относят иногда и сложные надмолекулярные белковые структуры, в которых объединяются до нескольких сотен субъединиц, например, жгутики бактерий, головки вирусов и т. д.
Определенные представления о пространственном строении и форме белковых молекул были получены в исследованиях с использованием электронного микроскопа. У многих белков форма молекул компактна и представляет шарообразные или вытянутые в виде эллипсоида частицы диаметром 10-30 нм. Другие белковые молекулы вытянуты в виде нитей диаметром 5-15 нм и длиной несколько сотен нм, третьи образуют палоч-ковидные структуры диаметром 10-20 нм и длиной 100-300 нм.
Наиболее точные сведения о пространственном строении белков были получены методом рентгеноструктурного анализа, с помощью которого изучают структуру белковых молекул в кристаллическом состоянии. Как было выяснено, в белковых кристаллах полностью сохраняется нативная конформация молекулы, которая стабилизируется большим количеством криталлизационной воды.
Длинные нитевидные формы белковых молекул принято называть фибриллярными белками. Они содержат длинные параллельные полипептидные цепи, скрепленные поперечными связями (рис.12). Эти белки отличаются высокой механической прочностью и обычно выполняют структурную функцию. К фибриллярным белкам относятся коллаген сухожилий, миозин мышц, фиброин шелка, кератин волос и перьев.
Молекулы со сферической формой называют глобулярными белками. Их полипептидные цепи свернуты в глобулы, имеющие форму эллипсоида вращения разной степени вытянутости. К глобулярным белкам относятся ферменты, регуляторные и транспортные белки, запасные растительные белки.
Между глобулярными и фибриллярными конформациями белковых молекул имеется много переходных форм, характерных для многих белков.
В связи с большими различиями формы белковых молекул и высокой степенью их полимерности существенные трудности возникают при определении молекулярных масс белков, поэтому для этих целей разра-ботаны специальные методы исследований. Для хорошо растворимых и очищенных от примесей белков молекулярные массы могут быть опреде-лены с довольно высокой точностью по изменению осмотического давления белкового раствора. Между молекулярной массой белков и величиной осмотического давления их растворов наблюдается обратная заисимость.
Для кристаллических форм хорошо очищенных белков молекулярные массы с высокой степенью точности определяют методом рент-геноструктурного анализа.
При определении молекулярных масс белков очень часто исполь-зуется метод седиментационного анализа, основанный на измерении ско-рости седиментации (осаждения) молекул белков под действием большой центробежной силы, возникающей при высокоскоростном центри-фугировании белкового раствора. Первая установка для высокоскоростного центрифугирования (ультрацентрифуга) была сконструирована Т. Сведбергом и Д.Б.Никольсом в 1923 г. В современных ультрацентрифугах можно создавать центробежное ускорение более 500000 g. Под действием центробежной силы молекулы белка, равномерно распределенные в растворе, начинают перемещаться с определенной скоростью в направлении действия центробежной силы, образуя удаляющуюся от центра вращения границу раздела между осаждающимися белками и чистым растворителем. Положение границы раздела через определённые промежутки времени регистрируется с помощью оптической системы и на основе этих результатов определяется коэффициент седиментации , который и выражает скорость седиментации белков.
По мере возрастания молекулярной массы белка коэффициент се-диментации увеличивается, однако строго прямой зависимости между этими показателями не наблюдается, так как скорость седиментации зави-сит также от формы молекул.
Значение коэффициента седиментации принято выражать в специальных единицах - сведбергах , которые обозначают символом S. Один сведберг (1S) численно равен 1×10 -13 секунды. Для большинства расти-тельных белков коэффициенты седиментации находятся в пределах 1-20S.
На основе коэффициентов седиментации и диффузии белковых мо-лекул рассчитаны молекулярные массы многих белков, выделенных из различных объектов:
рибонуклеаза 12640 α-амилаза 97600
гемоглобин 64500 каталаза 247500
глиадин пшеницы 27500 эдестин конопли 300000
альбумин яйца 44000 уреаза сои 483000
зеин кукурузы 50000 пепсин 35500
Для определения молекулярных масс полипептидов, входящих в состав олигомерных белков, находит широкое применение метод электро-фореза заряженных частиц в полиакриламидном геле, который позволяет проводить очень точное разделение полипептидов под воздействием электрического поля.
Под влиянием электрического поля заряженные молекулы полипеп-тидов движутся к аноду или катоду через пористый носитель, которым является полиакриламидный гель, образующийся при совместной полиме-ризации акриламида и бисакриламида в определенной буферной среде. Этот гель сильно гидратирован и имеет поры определенных размеров в зависимости от соотношения акриламида и бисакриламида. Скорость дви-жения заряженных частиц в пористом носителе зависит от величины заряда, молекулярной массы и пространственной конфигурации молекул, поэтому в результате электрофореза разделяемые частицы, различающиеся по электрическому заряду и пространственным параметрам, распреде-ляются в полиакриламидном геле в виде узких зон, которые окрашиваются специальным красителем. Размеры окрашенных зон точно указывают концентрацию выделенных при электрофорезе полипептидов, а их общее число - наличие в изучаемой смеси разных полипептидов (рис . 13).
Белки.doc
Белковые вещества
3. БЕЛКОВЫЕ ВЕЩЕСТВА И ИХ СВОЙСТВА
1. Определение
Из органических веществ, входящих в состав растений и других живых организмов, наиболее важными в биологическом отношении являются белковые вещества, или белки. Составляя основу цитоплазмы клеток, белки выполняют основную роль в жизни всех организмов.
Белками называются высокомолекулярные коллоидные соединения, состоящие из α-аминокислот.
2. Локализация белков
Основная масса белков растений концентрируется в семенах и плодах. В других тканях растений их массовая доля относительно невелика по сравнению с тканями животных, где белки составляют до половины и более массы сухого вещества живой клетки.
Так, массовая доля белков в вегетативных органах растений – стеблях, листьях, корнях – колеблется от 0,3 до 3,0%, зато в зерне злаков белков от 8 до 15%, в семенах масличных растений - от 18 до 28, в семенах бобовых растений – от 25 до 50% (в пересчете на сырую массу). В мышцах – 18-23%, печень – 17-19%, мозг – 7-9% (в пересчете на сырую массу).
Величина массовой доли белковых веществ в зерне и семенах во многом определяет биологическую ценность продуктов, получаемых при технологической переработке; лишь в некоторых случаях наличие белков осложняет технологию переработки растительного сырья и ухудшает качество получаемых продуктов. Повышенное содержание белков в корнеплодах свеклы затрудняет кристаллизацию сахарозы из маточных растворов.
При высоком содержании белковых веществ в листьях табака табачный дым приобретает неприятный запах жженных перьев. Такое табачное сырье ценится ниже.
В то же время в виноделии присутствие белков в виноградном сусле придает специфический аромат виноматериалам. В хлебопечении повышенное содержание белка в зерне пшеницы во многом определяет высокое качество и хлеба.
^
3. Функции белков
В растениях белки выполняют разнообразные функции, важнейшими из которых являются:
3.1 Каталитическая. Наиболее многочисленная группа белков – это белки-ферменты, катализирующие биохимические реакции. С помощью белков-ферментов в живой клетке достигается закономерная последовательность химических превращений веществ, обеспечивающая жизнедеятельность организмов.
3.2 Запасная. Запасные белки в больших количествах накапливаются в клетках зерна и семян при созревании на растении, а затем при прорастании зерна и семян гидролизуются до аминокислот или молекулярных пептидов, используемых затем клеткой для формирования нового растения на ранних стадиях развития. В животном организме белки в запас не откладываются поэтому должны поступать вместе с пищей ежедневно в необходимых количествах.
3.3 Защитная. Защитные белки предохраняют живой организм от разрушения или способствуют его выживанию при повреждении. Защитная функция белков – токсинов, вырабатываемых растениями, заключается в том, что они защищают растения от поедания их животными, а также ингибируют протеолитические ферменты насекомых-вредителей, повреждающих семена многих растений.
3.4 Структурная. Структурные белки входят в состав покровных тканей растений, в том числе семян и плодов. Они составляют также структурную основу биомембран клеток, обеспечивая сохранение органеллами клетки необходимой последовательности биохимических реакций.
3.5 Сократительная и двигательная. К этим белкам относится миозин мышц.
3.6 Регуляторная. Эти белки участвуют в регуляции обменных реакций. К ним относятся многие гормоны, например инсулин, регулирующий обмен глюкозы.
3.7 Транспортная. Транспортные белки переносят специфические молекулы или ионы. Например, гемоглобин. Связывают кислород и переносят его к периферическим тканям.
^
4. Элементарный состав белков
В состав белков входят углерод, кислород, водород, азот, иногда сера или селен. Могут входить также железо, медь, цинк, фосфор и некоторые другие элементы. Так, например, в составе белка зерна пшеницы содержится углерода от 51 до 53%, кислорода – от 21 до 23%, водорода – от 6 до 8%, азота – от 16 до 19%, серы – от 0,7 до 1,3%.
^
5. Аминокислотный состав белков
Структурными компонентами белков – их мономерами – являются аминокислоты. При кипячении с крепкими кислотами, щелочами, а также под действием гидролитических ферментов белковые вещества распадаются на аминокислоты.
Несмотря на то что в природе известно свыше 200 аминокислот, белки состоят в основном из 20 аминокислот.
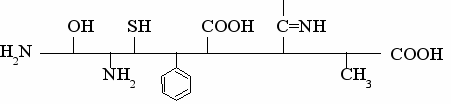
Аминокислоты – это алифатические, ароматические или гетероциклические соединения, содержащие по крайней мере одну амино- и одну карбоксильную группу.
По химическому строению это производные жирных кислот, у которых водород в α-положении замещен на аминную (–NН 2) группу:
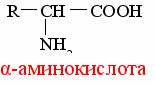
Каждая аминокислота кроме химического имеет тривиальное (традиционное) название, происходящее иногда от источника, из которого аминокислота была впервые выделена, или ее свойств, например: аспарагиновая кислота – первая аминокислота, открытая в 1806 г., была обнаружена в проростках бобового растения аспарагуса, глутаминовая кислота – в клейковине пшеницы (в переводе с английского «gluten
» - клейковина). Глицин получил свое название за сладкий вкус (от греческого «glykos» - сладкий).
^
5.1 Незаменимые амминокислоты
Растения могут синтезировать все аминокислоты, входящие в состав белков. Организм человека и животных не может синтезировать все аминокислоты, необходимые для синтеза белков. Аминокислоты, не синтезируемые организмом человека и животных, но входящие в состав их белков, получили название незаменимых , или обязательных аминокислот .
Для человека такими незаменимыми аминокислотами являются 10 аминокислот: валин, треонин, лейцин, изолейцин, метионин, лизин, аргинин, гистидин, фенилаланин, триптофан.
Эти аминокислоты входят в состав белков, но могут также находиться в живых организмах и в свободном состоянии.
Остальные 10 аминокислот (заменимые аминокислоты), входящие в состав белка, могут синтезироваться организмом животных и человека из других соединений, в том числе и из незаменимых аминокислот.
^
5.2 Биологически полноценная пища
В зависимости от количественного содержания незаменимых аминокислот продукты рассматривают как биологически полноценные или неполноценные. Полноценные продукты – это те продукты в белках которых содержаться все незаменимые аминокислоты в сбалансированном количестве. Эталоном полноценности являются белки женского молока и куриного яйца. К ним относятся молоко и молочные продукты, мясо, белки яиц, рыба. Из растительных продуктов приближаются к полноценным белки семян бобовых. Зерно злаковых культур биологически неполноценно, так как у них мало незаменимых кислот. Это белки пшеницы, ржи, кукурузы, в которых содержится недостаточное количество метионина, лизина, триптофана.
6 Связи, участвующие в формировании молекулы белка
^
6.1 Пептидная связь
В составе белковой молекулы аминокислоты образуют неразветвленную цепь, в которой они связаны ковалентными пептидными связями:
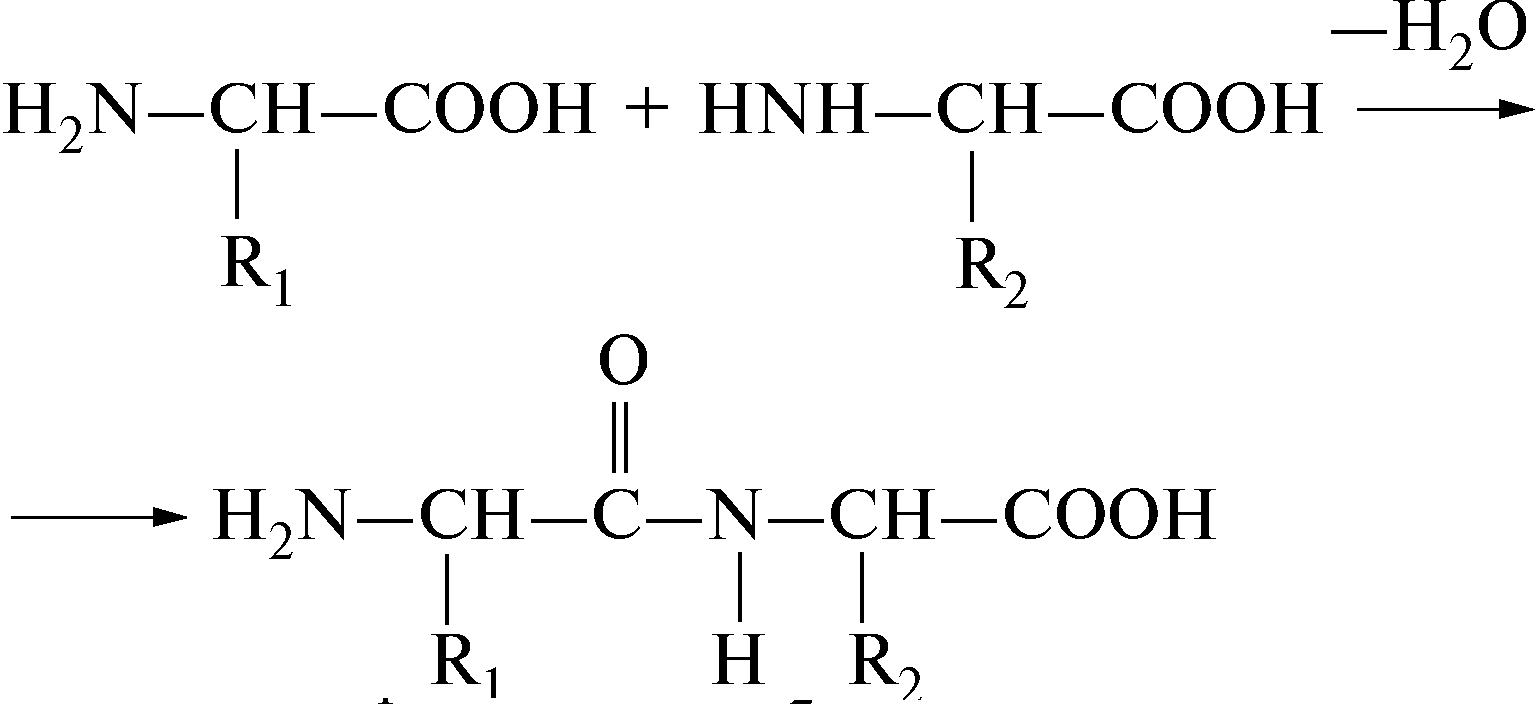
О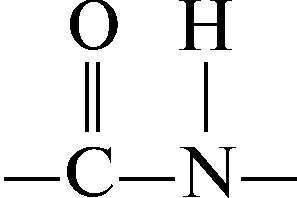 бразовавшееся соединения, являющееся результатом взаимодействия двух молекул аминокислот, называется дипептидом, а связь – пептидной.
бразовавшееся соединения, являющееся результатом взаимодействия двух молекул аминокислот, называется дипептидом, а связь – пептидной.
Свободная карбоксильная группа дипептида может соединяться с аминной группой еще одной молекулы какой-либо аминокислоты, в результате образуется трипептид . В случае соединения пептидными связями четырех остатков аминокислот получается тетрапептид , пяти – пентапептид и т.д. Общее название соединений, состоящих из нескольких аминокислот, - полипептиды – это и есть белки.
Многие из полипептидов встречаются в свободном виде в растениях, тканях животных и микроорганизмах и имеют большое значение в качестве промежуточных продуктов обмена веществ и физиологически весьма активных соединений. Примером может служить открытый выдающимся английским биохимиком Ф. Гопкинсом трипептид глютатион , состоящий из остатков гликокола, цистеина и глютаминовой кислоты:
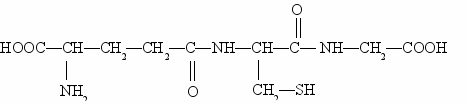
Глютатион содержится во всех живых клетках. Его содержание особенно высоко в зародыше пшеничного зерна и дрожжах. Чрезвычайно важная роль глютатиона в обмене веществ заключается в том, что он является сильным восстановителем и очень легко подвергается окислению.
К числу полипептидов принадлежит ряд антибиотиков, образуемых микроорганизмами веществ, убивающих другие микроорганизмы или угнетающих их рост: грамицидин, тироцидин, лихениформин. Некоторые из этих антибиотиков широко применяются в медицине для борьбы с болезнетворными микробами.
Аминокислоты – это алфавит белковой молекулы: соединив их в различном порядке, можно получить бесконечное множество разнообразных белков.
^
6.2 Дополнительные виды химической связи
Все многообразие биохимических свойств природных белков обусловлено последовательностью соединения аминокислот с различными боковыми радикалами – R-группами в их полипептидной цепи.
Схематично боковые цепи полипептидов могут быть представлены следующим образом:
Различие химических свойств R-групп аминокислот ведет к появлению в структуре белковой молекулы химических связей различной прочности – дисульфидных, водородных, ионных связей и гидрофобных взаимодействий.
^
6.2.1 Дисульфидная связь
Пептидные цепочки аминокислот (в белке их может быть одна, две или несколько) могут быть сшиты внутри себя или между собой за счет образования ковалентной дисульфидной связи –S–S– между сульфгидрильными группами –SН, расположенными в полипептидной цепи цистеинов:
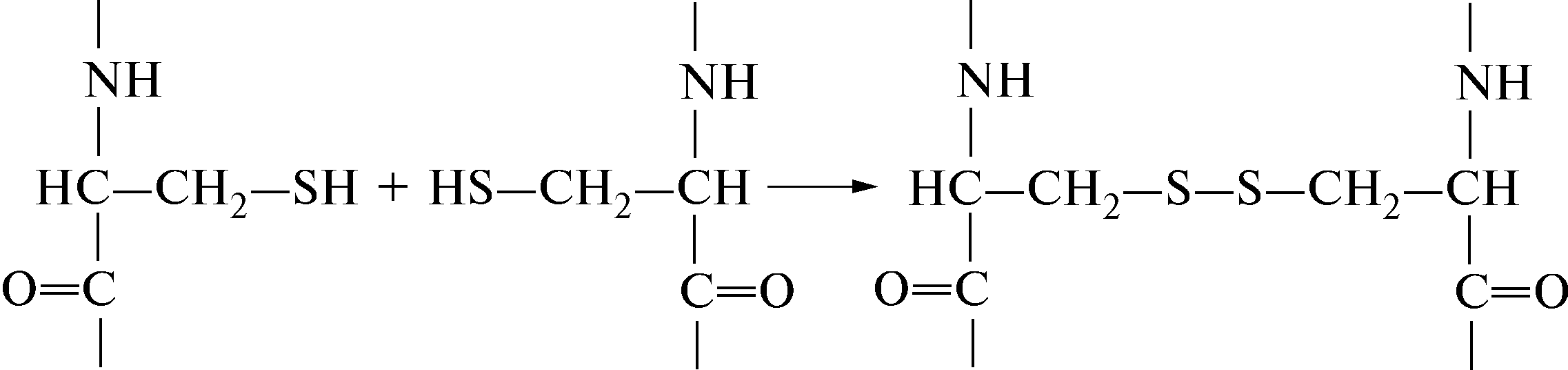
^
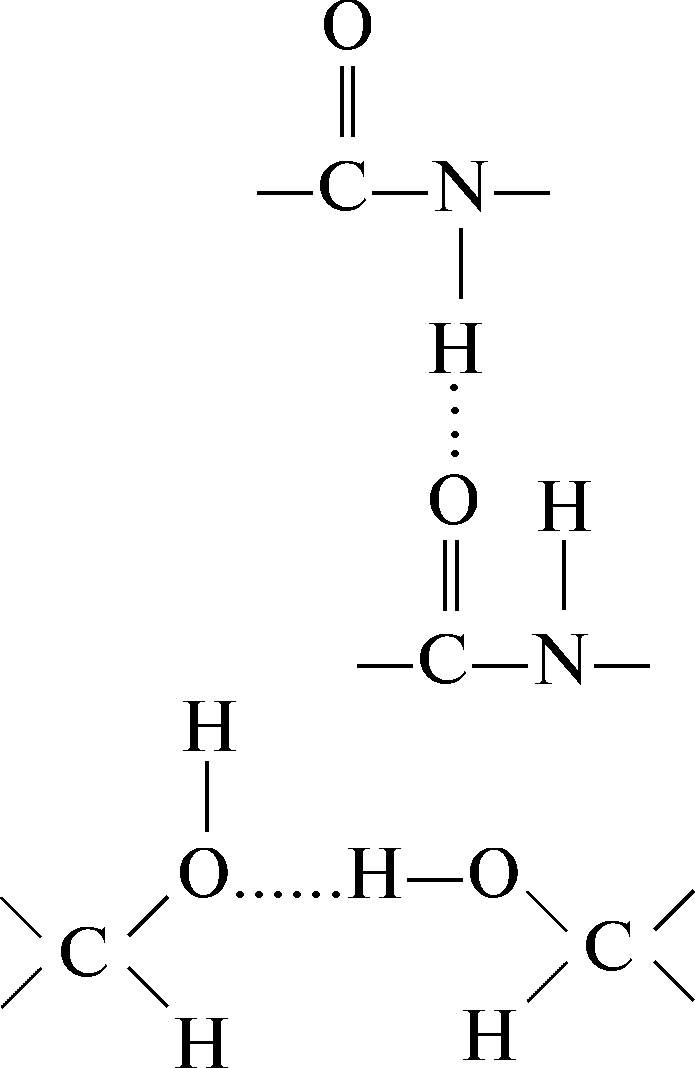
6.2.2 Водородная связь
Водородные связи возникают в результате дипольных взаимодействий между ковалентно связанным водородным атомом, имеющим положительный заряд, и отрицательно заряженным ковалентно связанным атомом – акцептором. Ниже приведены примеры различных водородных связей (обозначены пунктиром), образующихся в белках.
Водородная связь между пептидными группами:
Водородная связь между двумя гидроксильными группами:
Водородная связь между заряженной карбоксильной группой и гидроксильной группой тирозина:
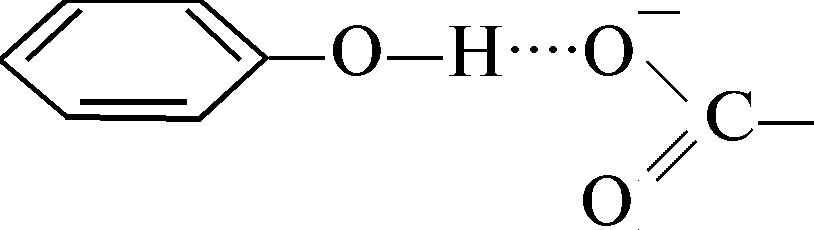
Водородная связь между заряженной аминной группой и заряженной карбоксильной группой:
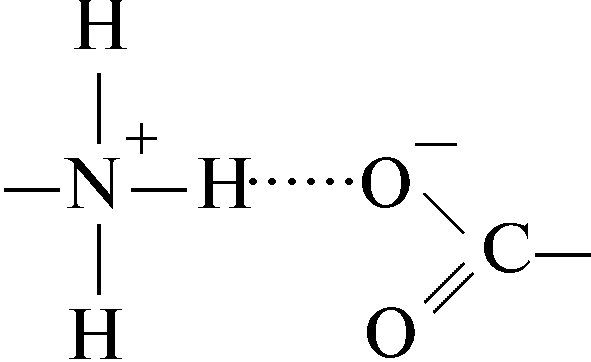
Водородная связь между гидроксильной группой серина и карбонильной пептидной связи:
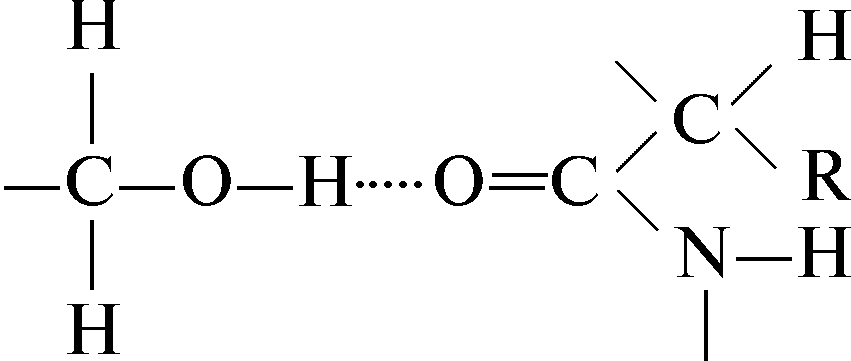
^
6.2.3 Солевая связь
Такие кислоты, как лизин и аспарагиновая, могут образовывать солевые или ионные связи:
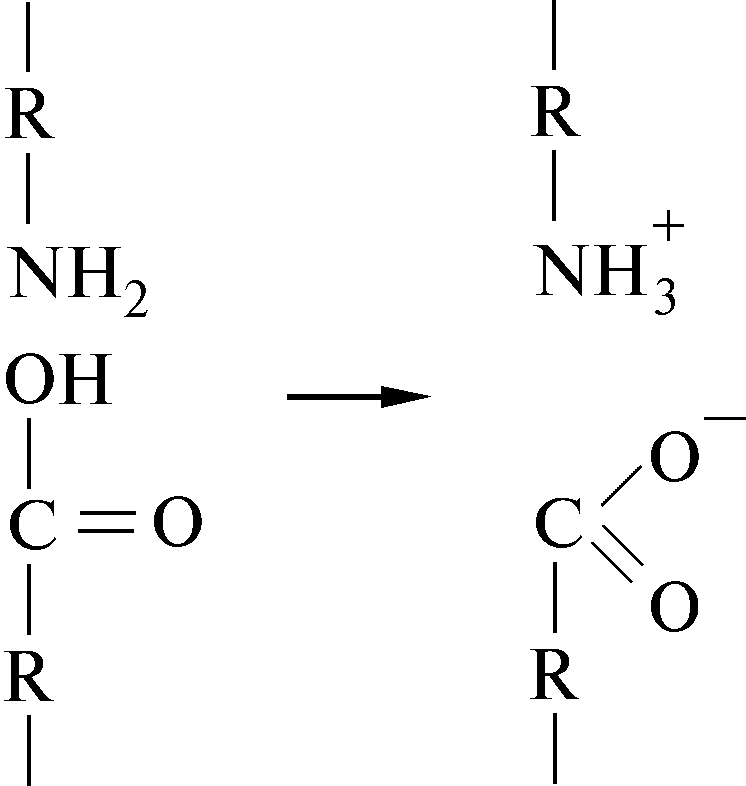
^
6.2.4 Гидрофобное взаимодействие
Если ионные и водородные связи возникают в результате дипольных взаимодействий полярных атомов или заряженных групп двух или более полярных молекул, то гидрофобные взаимодействия связывают неполярные (гидрофобные) части одной или нескольких молекул в водных растворах. Энергия каждого такого взаимодействия мала, но из-за большого числа таких взаимодействий они способны создавать устойчивые структуры.
Под влиянием гидрофобных взаимодействий происходит сближение неполярных участков полипептидной цепи за счет вытеснения молекул воды и ослабления их взаимодействия с водной средой.
Способностью к гидрофобному взаимодействию обладают боковые цепи (R-группы) валина, лейцина, изолейцина, фенилаланина, пролина, триптофана, метионина и цистеина.
Ионнные, водородные связи и гидрофобные взаимодействия определяют и стабилизируют специфическую пространственную структуру молекулы каждого белка.
^
7. Структура белковой молекулы
7.1 Форма белковой молекулы
По форме молекулы и особенностям пространственной структуры белки подразделяют на глобулярные , форма молекулы которых близка к сферической или эллиптической (отношение короткой и длинной осей до 1:50), и фибриллярные , молекула которых имеет более удлиненную форму и может образовывать многомолекулярные нитевидные структуры – фибриллы.
Глобулярные белки состоят из одной полипептидной цепи или нескольких, плотно свернутых за счет нековалентных и ковалентных связей в компактную частицу – глобулу. Эти белки, разнообразные по составу аминокислотных остатков и биологическим функциям, обычно хорошо растворимы в воде. Многие глобулярные белки являются ферментами. Почти все их полярные R-группы находятся на поверхности молекулы и гидратированы, гидрофобные R-группы находятся внутри молекулы.
Фибриллярные белки состоят из вытянутых или скрученных в спирали полипептидных цепей, расположенных параллельно и связанных многочисленными связями нековалентной и ковалентной природы. Как правило, это белки, образующие прочные жесткие структуры, они нерастворимы в воде и более однородны по составу аминокислотных остатков, преимущественно гидрофобных, в полипептидных цепях.
^
7.2 Структура белка
Различают:
7.2.1 Первичную;
7.2.2 Вторичную;
7.2.3 Третичную;
7.2.4 Четвертичную структуру белковых молекул.
7.2.1 Первичной структурой белка называют порядок чередования (последовательность) аминокислотных остатков, соединенных ковалентными пептидными связями, в полипептидной цепи белка.
За счет внутрицепочечных взаимодействий между белковыми R-группами полипептидная цепь белка свертывается в «нативную» (природную) пространственную структуру самопроизвольно.
7.2.2 Вторичная структура белка – это ориентация в пространстве аминокислотных остатков, соединенных в полипептидную цепь. В формировании вторичной структуры участвуют водородные связи. Различают три основных типа вторичной структуры полипептидных цепей: α-спираль, β-структура (складчатый слой) и беспорядочный клубок.
При образовании α-спирали полипептидная цепь закручивается вокруг оси. Наиболее устойчива правая α-спираль.
В β-структуре (складчатом слое) пептидные цепи располагаются параллельно друг другу, образуя пространственную фигуру, подобную складчатому листу, сложенному гармошкой. Как правило, такую структуру образуют вытянутые полипептидные цепи.
Стабилизация β-структуры достигается за счет образования межцепочечных водородных связей, в которых принимают участие все пептидные связи.
Вторичная структура белковой молекулы определяется ее первичной структурой. Поэтому, выяснив аминокислотную последовательность в полипептидной цепи, можно предсказать ее вторичную структуру, так как аминокислоты существенно различаются по способности образовывать α-спираль или β-структуру.
При различных технологических процессах α-спирали или β-структуры белков могут переходить друг в друга. Этим, в частности, объясняется уменьшение размеров шерстяных вещей при стирке их в горячей воде.
7.2.3 Третичная структура белка определяет пространственную организацию белковой молекулы. Образуется самопроизвольно и зависит от размера, формы и полярности аминокислотных остатков, их последовательности расположения в полипептидной цепи, т.е. от первичной структуры белка, а также от типа ее вторичной структуры, определяя пространственную организацию белковой молекулы. Она возникает в результате взаимодействия между цепочками полипептидов и поддерживается дисульфидными и ионными связями, гидрофобными и электростатическими взаимодействиями.
Третичная структура, так же как и вторичная, обусловлена аминокислотной последовательностью в полипептидной цепи, но если вторичная структура определяется взаимодействием аминокислот в близлежащих участках цепи, то третичная структура зависит от аминокислотной последовательности далеко расположенных друг от друга участков цепи.
В результате множества сравнительно слабых связей все части пептидной цепи белка оказываются фиксированными относительно друг друга, образуя компактную структуру.
7.2.4 Четвертичная структура – это ассоциация нескольких полипептидных цепей, которая образуется посредством нековалентных связей (водородных, ионных, гидрофобных взаимодействий, электростатического притяжения). Каждая полипептидная цепь, участвующая в образовании четвертичной структуры, называется субъединицей, или протомером. Молекулы белков, обладающие четвертичной структурой, при определенных условиях могут диссоциировать на субъединицы – протомеры , а при других условиях вновь ассоциировать, образуя димеры, а затем первоначальную олигомерную молекулу.
Ошибочное соединение протомеров в олигомерном белке или соединение с другими белками невозможно (комплементарность).
Комплементарные взаимодействия лежат в основе практически всех биохимических процессов в живых организмах, включая ферментативные процессы переноса соединений через мембраны, защитные реакции белков и множество других процессов, происходящих с участием белковых молекул.
Т.о. белки состоят из аминокислотных остатков, связанных между собой пептидными связями и образующих полипептидные цепи, которые за счет дисульфидных, водородных, ионных связей, а также гидрофобных взаимодействий располагаются в пространстве определенным образом, т.е. имеют при данных условиях определенную конформацию. Нативная конформация возникает при нормальных физиологических условиях.
^
8. Физико-химические свойства белков
8.1 Физические свойства
1. В живых организмах белки находятся в твердом и растворенном состоянии. Многие белки являются кристаллами, однако, они не дают истинных растворов, т.к. молекула их имеет очень большую величину. Водные растворы белков – это гидрофильные коллоиды, находящиеся в протоплазме клеток, и это активные белки. Кристаллические твердые белки – это запасные соединения. Денатурированные белки (кератин волос, миозин мускулов) являются опорными белками.
2. Все белки имеют, как правило, большую молекулярную массу. Она зависит от условий среды (t°, рН) и методов выделения и колеблется от десятков тысяч до миллионов.
3. Оптические свойства. Растворы белка преломляют световой поток, и чем больше концентрация белка, тем сильнее преломление. Пользуясь этим свойством, можно определить содержание белка в растворе.
В виде сухих пленок белки поглощают инфракрасные лучи. Они поглощаются пептидными группами.
^
8.2 Денатурация белков
Нативная конформация глобулярного белка – исключительно лабильная и подвержена изменениям под влиянием химических агентов или энергетических и механических нагрузок. Под влиянием внешних факторов может происходить разрыв большого числа связей, стабилизирующих пространственную структуру белковой молекулы, упорядоченная, уникальная для каждого белка конформация пептидной цепи нарушается, и белковая молекула целиком или большая ее часть принимает форму беспорядочного клубка – происходит его денатурация.
^ Денатурация белка – это внутримолекулярная перегруппировка его молекулы, нарушение нативной конформации, не сопровождающиеся расщеплением пептидной связи. Аминокислотная последовательность белка не изменяется.
В результате денатурации происходит нарушение вторичной, третичной и четвертичной структур белка, образованных нековалентными связями, и биологическая активность белка утрачивается полностью или частично, обратимо или необратимо в зависимости от денатурирующих агентов, интенсивности и продолжительности их действия.
^
8.2.1 Факторы, вызывающие денатурацию
Денатурация происходит под действием различных факторов, которые можно подразделить на:
1. Физические.
Денатурация вызывается высокими температурами – нагреванием раствора белка до 60…80°С. При 100°С все белки денатурируют. Кроме высоких температура, из физических факторов денатурирующее действие на белковую молекулу оказывают излучения различной частоты и природы: α-, β-, γ-излучения, токи высокой частоты, ультразвук, ультрофиолетовое излучение и др.
2. Химические.
Из химических факторов денатурацию белков вызывают концентрированные кислоты и щелочи, соли тяжелых металлов – олова, меди, ртути, мышьяка, кадмия, свинца, марганца и др., а также действие поверхностно-активных веществ, обладающих полярными молекулами, - мочевины, гуанидинхлорида. Эти вещества нарушают нативное распределение связей, стабилизирующих белковую молекулу.
3. Механические – растирание, взбивание, интенсивное перемешивание растворов белка или встряхивание и др.
При денатурации кроме потерь биологической активности возникают потери или снижаются растворимость белка и его водопоглотительная способность, происходит изменение вязкости растворов белка, а также механических свойств белоксодержащих продуктов.
^ Денатурация может быть:
1. Обратимой – в том случае, когда комплекс белок-ингибитор может распадаться, и белок возвращается в исходное состояние (высаливание).
2. Необратимой – нативные свойства белка не восстанавливаются. Обычно происходит под действием специфических факторов денатурации, когда связываются активные группы.
^ 8.2.2 Значение денатурации в пищевой технологии
Денатурация белков имеет большое значение во многих технологических процессах пищевой промышленности – при выпечке хлеба, сушке макарон, овощей, зерна и семян, отжиме растительного масла на прессах, консервировании, кулинарной обработке пищевых продуктов и ряде других.
Под влиянием денатурации белки пищевых продуктов приобретают большую доступность действию протеолитических ферментов, возрастает реакционная способность химических групп, входящих в состав белковой молекулы, изменяется форма белковой молекулы – она «разрыхляется» или становится более компактной в зависимости от условий денатурации, гидрофобность белка растет.
^
8.3 Изоэлектрическая точка
Белки, как и аминокислоты, - амфотерные электролиты, которые мигрируют в электрическом поле со скоростью, зависящей от их суммарного заряда и рН среды. При определенном для каждого белка значении рН его молекулы электронейтральны. Это значение рН называется изоэлектрической точкой белка. Изоэлектрическая точка белка зависит от числа и природы заряженных групп в молекуле. Белковая молекула заряжена положительно, если рН среды ниже величины ее изоэлектрической точки, и отрицательно, если рН среды выше значения изоэлектрической точки данного белка. В изоэлектрической точке белок обладает наименьшей растворимостью и наибольшей вязкостью, в результате чего происходит наиболее легкое осаждение белка из раствора – коагуляция белка. Изоэлектрическая точка – одна из характерных констант белков. Однако если довести раствор белка до изоэлектрической точки, то сам по себе белок все же не выпадает в осадок. Это объясняется гидрофильностью белковой молекулы.
^
8.4 Гидрофильность белка
На поверхности белков расположены различные гидрофильные группы, притягивающие дипольные молекулы воды. Гидрофильность различных групп разная.
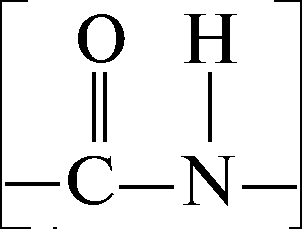
Пептидная связь связывает одну молекулу воды,
карбоксильная группа –СОО – - 4 молекулы воды, – NН 3 -аминная группа – 1 и т.д. Поэтому вокруг белковой молекулы находится так называемая гидратационная оболочка, придающая устойчивость белковым растворам и препятствующая осаждению молекулы белка.
^
8.5 Высаливание белков
Если удалить эту водную оболочку у белковой глобулы, т.е. уменьшить ее гидратацию, то молекулы белка начнут агрегировать, образуя более крупные частицы, и под действием собственной силы тяжести начнут оседать из раствора в виде осадка.
Удалить водную оболочку можно с помощью органических растворителей (спирта, ацетона) или солей щелочных или щелочно-земельных металлов. Поскольку молекулы солей, спирта или ацетона более гидрофильны, чем белковые глобулы, они снимают с белка водную оболочку, в результате чего он легко выпадает в осадок.
Так как осаждение белка из раствора достигается путем добавления к белковому раствору достаточного количества солей, процесс выделения белка из раствора под влиянием солей носит название высаливания . Осаждающая способность соли зависит от химической природы как катиона, так и аниона. По своей осаждающей способности катионы и анионы объединены в так называемые лиотропные ряды, где они размещены по уменьшающейся слева направо осаждающейся способности.
Лиотропные ряды:
Катионы: С S , Rb , К, Nа, Li , Ва 2 , Sr 2 , Са 2 , Мg 2 ;
Анионы: SО 2- 4 , Сl – , Br – , NO – 3 , J – , CNS – .
Высаливание широко применяют для выделения белков, при этом денатурации не происходит.
^
8.6 Набухание белков
При определенных условиях белковые растворы набухают, превращаются в коллоидные системы – гели. В гелях растворитель и белок образуют одну внешне гомогенную массу, подобную студню. Высушенный гель, помещенный в воду, впитывает ее в очень больших количествах. Это впитывание воды называется набуханием геля
. Процессы набухания белков играют важную роль в пищевой промышленности. Набухание зерна при его обработке – замочке, кондиционировании и прорастании, набухание муки при изготовлении теста, образование студней при добавлении желатина к различным кондитерским изделиям – все эти процессы связаны с набуханием белков. Явление, обратное набуханию, т.е. выделение воды из геля, называется синерезисом
.
9 Качественные реакции на белки
9.1. Милоновая реакция – действие на белок растворенной в азотной кислоте металлической ртути и получение вишнево-красного окрашивания. Реакция на фенольные группировки.
9.2. Биуретовая реакция – добавление капли медного купороса к щелочному раствору белка и получение красно-фиолетового окрашивания. Реакция на пептидную связь .
9.3. Реакция Адамкевича. Прибавление глиоксилевой кислоты с крепкой серной кислотой к белку, в результате чего образуется фиолетовое окрашивание. Реакция на индольные группировки.
9.4. Ксантопротеиновая реакция – желтое окрашивание от азотной кислоты. Реакция на бензольные кольца.
9.5. Нингидриновая реакция – окрашивание при добавлении нингидрина.
9.6. Реакция на серу – при добавлении уксуснокислого свинца и нагревании образуется темная окраска (серосодержащие аминокислоты).
10 Классификация белков
Все природные белки (протеины) подразделяют на два больших класса:
10.1 Простые;
10.2 Сложные.
10.1 Простые белки гидролизуются кислотами или щелочами до аминокислот и не дают при гидролизе других органических и неорганических соединений. Они состоят только из остатков α-аминокислот.
Классификация простых белков основана на растворимости.
10.1.1 Альбумины – белки, которые растворяются в воде. К этим белкам относятся белок куриного яйца, белки зародыша семян злаковых (однодольных) растений, белки семян двудольных растений. Из водных растворов эти белки хорошо высаливаются, а при кипячении – денатурируют. Название белков обычно связано с ботаническим названием растения, в котором они локализованы. Альбумины у пшеницы и риса называются лейкозинами, гороха – легумелинами, а у клещевины – рицинами.
10.1.2 Глобулины – белки, растворимые в солях. Обычно для их экстракции применяют 10%-ный раствор NaCl. Глобулины составляют большую часть белков семян масличных культур. Многие альбумины и глобулины обладают ферментивными свойствами. Глобулины кукурузы получили название маизин, фасоли – фазеолин, гороха – легулеин, конопли – эдестин, арахиса – арахин, тыквы – кукурбитин.
10.1.3 Проламины – белки, которые растворяются в 60-80%-ном растворе этилового спирта. Название «проламины» они получили вследствие того, что в их состав входит большое количество аминокислоты пролина. Проламины синтезируются только в семенах злаковых растений. Проламины пшеницы называют глиадинами, кукурузы – зеинами, сорго – каферинами.
10.1.4 Глютелины – белки, которые извлекаются из растительных тканей разбавленными растворами щелочей (0,2%-ный NаОН). Глютелины пшеницы – это глютенин, риса – оризенин.
Проламины и глютелины составляют основную массу клейковины пшеницы. Качество клейковины, а следовательно и муки, зависит от количества и соотношения глиадина и глютенина.
Кроме этих четырех групп белков к простым относят также следующие белки со специфическими свойствами:
10.1.5 Протамины – это белки небольшой молекулярной массы, состоящие на 80% из щелочных аминокислот и не содержащие серу.
Эти белки обнаружены только в сперме (молоках) рыб. По величине молекул протамины – самые малые белки. Некоторые из них даже состоят из семи аминоксилот, среди которых аргинин, пролин и серин составляют больше половины молекулы.
10.1.6 Гистоны – низкомолекулярные белки также основного характера, содержатся в хромосомах клеточных ядер и играют важную роль в образовании структуры хроматина. Гистоны – настоящие белки, в их состав входят почти все белковые аминокислоты. Они характеризуются высоким содержанием основных аминокислот: примерно каждая четвертая аминокислота – это аргинин или лизин. Они локализованы у растений в ядре клетки, рибосомах и митохондриях, где играют роль структурных элементов этих органоидов.
10.2. Сложные белки кроме аминокислотных остатков белковой части молекулы содержат также небелковую, или простетическую группу. Простетическая группа может быть представлена химическими веществами различной природы (табл. 1). Сложные белки подразделяются по небелковому компоненту.
Связи между полипептидными цепями белка и простетической группой могут быть ковалентными и нековалентными.
Таблица 1
Простетические группы некоторых сложных белков
Сложный белок, или холопротеин, в зависимости от химической природы, может диссоциировать на белковую часть, или апопротеин, и простетическую группу:
Холопротеин Апопротеин Простетическая группа
Среди сложных белков липопротеины и нуклеопротеины различаются очень высокой сложностью строения, образуя в живой клетке надмолекулярные структуры, специфическая организация которых обусловлена биохимическими процессами, протекающими с участием этих белков.
Белковая молекула имеет четыре типа структурной организации – первичная, вторичная, третичная и четвертичная.
Первичная структура
Линейная структура, представляющая собой строго определенную генетически обусловленную последовательность аминокислотных остатков в полипептидной цепи. Основной вид связи – пептидная (механизм образования и характеристика пептидной связи рассмотрены выше).
Полипептидная цепь обладает значительной гибкостью и в результате внутри цепочечных взаимодействий приобретает определенную пространственную структуру (конформацию).
В белках различают два уровня конформации пептидных цепей – вторичную и третичную структуры.
Вторичная структура белка
Это укладка полипептидной цепи в упорядоченную структуру благодаря образованию водородных связей между атомами пептидных групп одной полипептидной цепи или смежных цепей.
При формировании вторичной структуры водородные связи образуются между атомами кислорода и водорода пептидных групп:
По конфигурации вторичная структура делится на два типа:
спиральные (α-спираль)
слоистоскладчатые (β-структура и кросс- β-форма).
α-Спираль имеет вид регулярной спирали. Формируется благодаря межпептидным водородным связям в пределах одной полипетидной цепи (рис. 1).
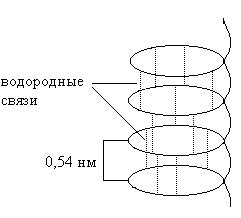
Рис. 1. Схема формирования α-спирали
Основные характеристики α-спирали:
– водородные связи образуются между пептидными группами каждого первого и четвертого аминокислотного остатка;
– витки спирали регулярны, на один виток приходится 3,6 аминокислотных остатков;
– боковые радикалы аминокислот не участвуют в образовании α-спирали;
– в образовании водородной связи участвуют все пептидные группы, что обуславливает максимальную стабильность α-спирали;
– поскольку все атомы кислорода и водорода пептидных групп вовлечены в образование водородных связей, то это приводит к снижению гидрофильности α-спиральных областей;
– α-спираль образуется самопроизвольно и является наиболее устойчивой конформацией полипетидной цепи, отвечающей минимуму свободной энергии;
– препятствуют образованию α-спирали пролин и оксипролин – в местах их расположения регулярность α-спирали нарушается и полипептидная цепь легко изгибается (ломается), так как не удерживается второй водородной связью (рис.2).
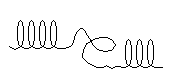
Рис. 2. Нарушения регулярности α-спирали
Атом азота α-иминогруппы пролина при образовании пептидной связи остается без атома водорода, следовательно не может участвовать в образовании водородной связи. Много пролина и оксипролина в полипептидной цепи коллагена (см. классификацию простых белков – коллаген).
Высокая частота α-спирали характерна для миоглобина и глобина (белок, входящий в состав гемоглобина). В среднем глобулярные (округлые или эллипсовидные) белки имеют степень спирализации 60–70 %. Спирализованные участки чередуются с хаотическими клубками. В результате денатурации белка переходы спираль → клубок увеличиваются. На спирализацию (формирование α-спирали) влияют радикалы аминокислот, входящие в состав полипептидной цепи, например, отрицательно заряженные группы радикалов глутаминовых кислот, расположенные вблизи друг от друга, они отталкиваются и препятствуют образованию α-спирали (образуется клубок). По той же причине препятствуют образованию α-спирали близко расположенные аргинин и лизин, имеющие положительно заряженные функциональные группы в радикалах (см. пример протамины и гистоны).
Препятствуют формированию α-спирали также большие размеры радикалов аминокислот (например, радикалы серина, треонина, лейцина).
Таким образом, содержание α-спиралей в белках неодинаково.
β-Структура (слоисто-складчатая) – имеет слабо изогнутую конфигурацию полипептидной цепи и формируется с помощью межпептидных водородных связей в пределах отдельных участков одной полипептидной цепи или смежных полипептидных цепей. Различают две разновидности β-структуры:
– к росс-β-форма (короткая β-структура) – представляет собой ограниченные слоистые участки, образованные одной полипептидной цепью белка (рис. 3).
Рис. 3. Кросс-β-форма белковой молекулы
Большинство глобулярных белков включают короткие β-структуры (слоистые участки). Их состав может быть представлен следующим образом: (αα), (αβ), (βα), (αβα), (βαβ).
– полная β-структура . Этот тип характерен для всей полипептидной цепи, которая имеет вытянутую форму и удерживается межпептидными водородными связями между смежными параллельными или антипараллельными полипептидными цепями (рис. 4).
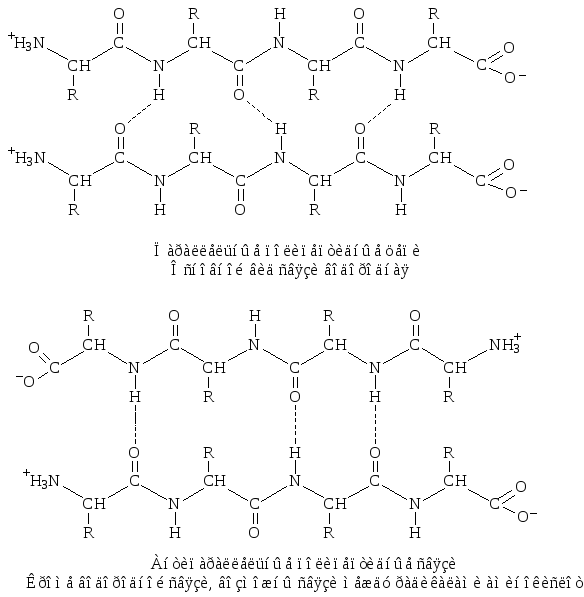
Рис. 4. Полная β-структура
В антипараллельных структурах связи более стабильны, чем в параллельных.
Белки с регулярной β-структурой более прочные, плохо или совсем не перевариваются в желудочно-кишечном тракте.
Формирование вторичной структуры (α-спирали или β-структуры) обусловлено последовательностью аминокислотных остатков в полипептидной цепи (т.е. первичной структурой белка) и, следовательно, генетически предопределено. Благоприятствуют образованию β-структуры такие аминокислоты как метионин, валин, изолейцин и аспарагиновая кислота.
Белки с полной β-структурой имеют фибриллярную (нитевидную) форму. Полная β-структура встречается в белках опорных тканей (сухожилий, кожи, костей, хрящей и др.), в кератине (белок волос и шерсти) (характеристику отдельных белков см. в разделе «Белки пищевого сырья»).
Однако не все фибриллярные белки имеют только β-структуру. Например, α-кератин и парамиозин (белок запирательной мышцы моллюска), тропомиозин (белок скелетных мышц) – относятся к фибриллярным белкам а вторичная структура у них – α-спираль.
Биосинтез белковых молекул происходит в рибосомах клеток путем последовательного соединения пептидной связью аминокислотных остатков. Последовательность их расположения определяется молекулами ДНК, М-РНК и другими, несущими наследственную информацию. По мере синтеза полипептидная цепь как бы «выползает» из маленькой рибосомы в цитоплазму. В цитоплазме гибкая молекула белка принимает ту или иную форму - конформацию, или вторичную структуру, при сохранении всех ковалентных связей, обусловленных ее первичной структурой.
Сравнительная гибкость больших белковых молекул проявляется в наличии многих возможных конформаций, переходящих одна в другую при изменении внешних условий. Этим белковые молекулы существенно отличаются от малых органических молекул классической органической химии.
Одной из наиболее важных и интересных вторичных структур белковых молекул является а-спиральная структура, впервые установленная Полингом и Кори в 1953 г. . Она возникает под действием внутримолекулярных водородных связей между пептидными группами молекулы белка.
Полинг и Кори показали, что а-спиральная структура, т. е. сворачивание пептидной цепи в спираль, обусловлена тремя цепочками водородных связей (рис. 14) между пептидными группами. Первая цепь связывает водород первой пептидной группы с кислородом четвертой, водород четвертой - с кислородом седьмой и т. д. Вторая цепь водородных связей осуществляется между водородом второй пептидной группы с кислородом пятой, водородом пятой - с кислородом восьмой и т. д. Третья цепь водородных связей осуществляется между водородом третьей пентидной группы с кислородом шестой, водородом шестой - с кислородом девятой и т. д. В результате образуется правая спираль с шагом 5,6 А и диаметром 4,56 А. Период спирали 27 А. На пять оборотов спирали приходится 18 остатков аминокислот. Все радикалы располагаются с наружной стороны спирали.
Рис. 14. Три цепи водородных связей в а-спиральной молекуле белка; О - кислород; - водород; - азот; пептидные группы получают номера входящих и них атомов углерода.
Энергия образования одной водородной связи между пептидными группами порядка 0,21 эВ. Следовательно, эта водородная связь относится к типу слабых. О небольшой энергии связи свидетельствует и малое смещение характеристических инфракрасных колебаний атомов в пептидной группе. При образовании водородной связи частота колебаний и частота колебаний изменяются и становятся равными соответственно (Амид I).
Колебание Амид I имеет энергию, равную и большой электрический дипольный момент. Согласно измерениям Ю. Н. Чиргадзе и Е. П. Рашевской разработали метод количественного анализа вторичной структуры белков в водных растворах и кристаллах, основанный на измерениях поляризации и интенсивности полосы поглощения, обусловленной колебаниями Амид I.
Белки и полипептиды, радикалы которых не содержат ароматических групп, поглощают свет в далекой ультрафиолетовой области спектра. Это поглощение обусловлено квантовыми переходами -электронов пептидной группы, участвующих в образовании дополнительной связи между атомами С и N. Полосы поглощения соответствуют частотам 52 600, 60600 и
более длинноволновая из них имеет энергию возбуждения приблизительно 6,52 эВ. Квантовый переход характеризуется большим дипольным моментом перехода
В а-спиральной молекуле белка эта полоса поглощения расщепляется на две полосы с максимумами в области длин волн 1980 А и 1890 А. Они поляризованы соответственно вдоль и поперек молекулы. Моффит (J. Chem. Phys., 1956, 25, 467) показал, что это так называемое давыдовское расщепление обусловлено резонансным взаимодействием периодически расположенных в молекуле пепетидных групп. Величина расщепления порядка
Если в состав первичной структуры белка входит остаток иминокислоты - пролина (8.2), то соответствующая пептидная группа не имеет водорода, так как у пролина атом азота удерживает только один атом водорода, который отщепляется при образовании пептидной связи с выделением молекулы воды. Атом азота такой пептидной группы не может образовать водородную связь с атомом кислорода соседней группы. Поэтому в месте расположения пролина структура а-спирали нарушается - происходит «излом» спирали.
Изгибы спиральной структуры часто происходят также в местах нахождения остатка простейшей аминокислоты - глицина (Гли), радикал которого содержит только атом водорода. Такое нарушение спиральной структуры белковой молекулы наблюдается наиболее часто в окрестности остатка Гли, если с ним соседствуют остатки Сер,
Стабилизация структуры с нарушенными участками спиральной структуры (спираль с локальными изгибами) осуществляется за счет возникающих химических и водородных связей между боковыми радикалами соседних участков молекулы. Из химических связей наиболее существенна дисульфидная связь (S-S), возникающая между атомами серы двух радикалов. Такая связь может возникнуть при сближении и окислении (потеря атома водорода) цистеиновых остатков, содержащих группы SH. Возможны также связи между радикалами, содержащими карбоксильные группы, и другими радикалами, содержащими группы ОН и NH.
В образовании вторичной структуры белка существенную роль играют и электростатические взаимодействия между радикалами, несущими электрические заряды. Отрицательные заряды получают радикалы остатков аспарагиновой и глутаминовой аминокислот при диссоциации в воде. Положительно заряжены остатки основных аминокислот! гистидил, лизил, аргинил. Процесс диссоциации зависит от pH среды.
Электрические взаимодействия между удаленными зарядами в значительной степени экранируются водой. Однако при сближении
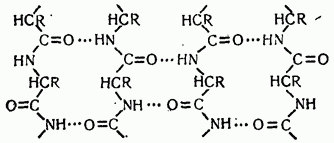
Бета-структура белковых молекул, состоящая из четырех антипараллельных цепей.
противоположно заряженных радикалов их гидратные оболочки разрушаются и возникают так называемые солевые связи. Выигрыш свободной энергии Гиббса при образовании солевых мостиков обусловлен как кулоновским взаимодействием, так и «вменением структуры воды при разрушении гидратных оболочек.
Большинство белков при физиологическом значении pH несет суммарный отрицательный заряд. Некоторые белки в хромосомах содержат много лизина и аспаргинила, поэтому при физиологических условиях они заряжены положительно.
При изгибах полипептидной цепи и последующем сближении отдельных ее участков возможно образование поперечных водородных связей между пептидными группами, а не продольных связей, приводящих к а-спиральной структуре. В этом случае оба участка полимерной цепи выстраиваются параллельно или антипараллельно друг другу (рис. 15). Такой тип водородных связей между пептидными группами называют -формой. Он характерен для параллельно и антипараллельно уложенных полипептидных структур в белковых глобулах и в искусственно образованных полимерах: нейлоне, капроне и др.
В образовании стабильной формы белковой молекулы с нарушенными участками а-спиральной структуры существенную роль играют ее гидрофобные и гидрофильные взаимодействия с водой. Эти взаимодействия приводят к тому, что молекула сворачивается в клубок - глобулу, у которой на поверхности в основном располагаются участки с гидрофильными радикалами (глутамин, тирозин и др.), а внутри - с гидрофобными радикалами (лейцин, аланин, фенилаланин и др.).
Некоторые авторы к вторичной структуре белковой молекулы относят структуру, обусловленную только взаимодействиями между группами атомов внутри пептидной цепи (водородные, химические, ионные связи, дисульфидные мостики и т. д.). Конформацию всей молекулы белка, обусловленную ее взаимодействием с водным окружением, они относят к третичной структуре. Нам кажется такое разделение весьма условным.
В общем случае вторичная и третичная структуры белковой молекулы обусловлены ее первичной структурой, т. е. составом
и расположением аминокислотных остатков вдоль ее полипептидной цепи. Такая структура устанавливается после окончания синтеза всей белковой молекулы на рибосоме. Другими словами, в одинаковых внешних условиях белки с разной первичной структурой имеют и разные вторичную и третичную структуры - конфигурацию или конформацию х. Такая конформация соответствует минимуму свободной гиббсовской энергии системы, состоящей из белковой молекулы и ее окружения. Поскольку форма белковой молекулы существенно зависит от ее взаимодействия с внешней средой (вода, другие молекулы), то один и тот же белок может иметь различную конформацию в разных внешних условиях.
В работах О. Б. Птицына и ряда других авторов предложен метод предсказания вторичной структуры белка по его первичной структуре. Той же проблеме посвящены и исследования В. Лима . В результате этих исследований установлено, что образование длинных спиралей возможно внутри глобулы из участков, содержащих гидрофобные группы. Спиральными будут также участки молекулы, расположенные на поверхности глобулы, если их гидрофобные радикалы направлены внутрь глобулы, а гидрофильные находятся в контакте с водой.
В некоторых случаях несколько пептидных цепей объединяются за счет дисульфидных мостиков, водородных и ионных связей и вандерваальсовых взаимодействий в единую молекулу. Таковы, например, молекулы гемоглобина, «ходящие в состав красных кровяных телец (эритроцитов) крови. Они состоят из четырех пептидных цепей (см. п. 9.1). В этом случае говорят о четвертичной структуре белковой молекулы.
К молекулам, обладающим четвертичной структурой, относятся многие ферменты, катализирующие биологические реакции в клетках (см. § 9). Например, фермент фосфорилаза, ответственный
за занесение и деградацию гликогена в клетках, состоит из двух пептидных цепей с молекулярной массой 96 000 дальтон. А фермент аспартилтранскарбомилаза, входящий в систему, синтезирующую цитидинтрифосфат (ЦТФ), состоит из 12 полимеров. Шесть из них имеют молекулярную массу 35 000 дальтон, а шесть других - 17 000 дальтон. Наличие белков с четвертичной структурой исключительно важно для их физиологической активности (см. п. 9.3).
Белковые молекулы иногда объединяются в более сложные структуры. Например, а-спиральные белковые молекулы часто скручиваются попарно во вторичные спирали. Глобулярные белковые молекулы могут сами образовывать спиральные структуры. Такова, например, структура актиновых нитей в мышечных волокнах (см. п. 19.2).
Вторичная и более высокого уровня структуры обусловлены слабыми водородными связями, гидрофобными, гидрофильными и вандерваальсовыми взаимодействиями. Поэтому эти структуры нарушаются при нагревании до 60-70° С. Для разрушения первичной структуры без участия ферментов необходимы более высокие температуры.
Процесс разрушения вторичной и более высокого уровня структур, при сохранении первичной структуры молекулы, называется денатурацией белков. Вареная и жареная пища содержит денатурированные белки. Денатурация белковых молекул может происходить и при ультрафиолетовом облучении, воздействии солей тяжелых металлов и некоторых органических соединений. При денатурации белок теряет свои биологические функции.
Возможно также значительное изменение структуры белковой молекулы («частичная денатурация») на поверхности воды и в местах раздела водной и неводной среды. Попав на поверхность воды, глобулярная молекула меняет свою форму. Она «развертывается» в двумерную структуру так, чтобы неполярные группы выступили из воды, а полярные и заряженные остались в воде. В результате такой «поверхностной денатурации» молекула глобулярного белка становится более реакционно способной, так как обнажаются группы, скрытые ранее в воде. Вообще говоря, изменение формы белковой молекулы будет происходить и на границе между водой и другой крупной молекулярной структурой, например ферментом.
Обусловленное гидрофобными и гидрофильными взаимодействиями выстраивание белковых молекул происходит в биологических мембранах на границе между водной средой и двойным липидным (жировым) слоем (см. § 12).






