Komplekssete valkude bioloogiline roll. Kompleksvalkude struktuur ja funktsioonid. Müoglobiini ja hemoglobiini struktuur ja funktsioonid
1. Liht- ja kompleksvalkude struktuuri tunnused
Koostise järgi jagunevad valgud lihtne, mis koosneb ainult aminohappejääkidest (valkudest) ja keeruline(valgud). Komplekssed võivad sisaldada metalliioone (metaloproteiine) või pigmenti (kromoproteiine), moodustada tugevaid komplekse lipiididega (lipoproteiinid), nukleiinhapetega (nukleoproteiinid) ning samuti siduda kovalentselt fosforhappejääki (fosfoproteiinid), süsivesikuid (glükoproteiine) või nukleiinhappeid. mõnede viiruste genoomid).
1.1 Lihtvalgud (valgud)
Mitmete iseloomulike omaduste jaoks valgud jagatud mitmeks rühmaks.
Albumiinid. Need lahustuvad vees, koaguleeruvad kuumutamisel, neutraalsed, soolalahustega suhteliselt raskesti sadestuvad. Nende näideteks on: munavalgu albumiin, vereseerumi albumiin, lihaskoe albumiin, piimaalbumiin.
Globuliinid. Need on vees lahustumatud, kuid lahustuvad väga nõrkades soolalahustes. Globuliinid on näiteks: fibrinogeen, vereseerumi globuliin, lihaskoe globuliin, munavalgu globuliin.
Histoonid. Põhivalgud. Neid leidub nukleoproteiinide kujul leukotsüütides ja punastes verelibledes.
Protamiinid. Need ei sisalda väävlit, on suhteliselt tugevate aluseliste omadustega, annavad kristallilisi sooli; leidub (nukleoproteiinide kujul) kalade spermatosoidides.
Prolamiinid. Leidub erinevate teraviljade terades. Nende tähelepanuväärne omadus on lahustuvus 80% alkoholis. Gliadiin, mis on gluteeni põhiosa, võib olla nende valkude esindaja.
Skleroproteiinid. Lahustumatud valgud, mis moodustavad looma keha väliskatte ja mida leidub luustikus ja sidekoes. Nende hulka kuuluvad keratiin, kollageenid, elastiin, fibroiin.
Keratiin on juuste, sarvede, kabjade, küünte, sulgede ja naha ülemise kihi põhikomponent. Keratiini keemiline koostis on väävlirikas.
kollageenid.Äärmiselt levinud elusorganismides. Sidekude koosneb kollageenidest; nad on kõhres. Selgroogsete luud koosnevad anorgaanilistest ainetest (kaltsiumfosfaat ja -karbonaat), rasvast ja kollageenidest.
Elastiin on osa veenidest ja muudest sidekoe elastsetest ainetest.
1.2 Komplekssed valgud (valgud)
Valgud on kompleksvalgud, mis koosnevad valkudest ja mittevalgulistest osadest. Valgu nimetuse määrab selle proteesrühma nimi). Niisiis, nukleiinhapped on nukleoproteiinide mittevalguline osa, fosforhape on osa fosfoproteiinidest, süsivesikud on glükoproteiinid ja lipiidid on lipoproteiinid. Valgud võib jagada ka mitmesse rühma.
Nukleoproteiinid. Need on olulised, sest nende mittevalgulist osa esindavad DNA ja RNA. Proteesirühma esindavad peamiselt histoonid ja protamiinid. Selliseid DNA komplekse histoonidega leidub spermatosoidides ja histoonidega - somaatilistes rakkudes, kus DNA molekul on "keeratud" ümber histooni molekulide. Nukleoproteiinid on oma olemuselt rakuvälised viirused - need on viiruse nukleiinhappe ja valgu kesta - kapsiidi kompleksid.
Kromoproteiinid. Need on kompleksvalgud, mille proteeside rühma esindavad värvilised ühendid. Kromoproteiinide hulka kuuluvad hemoglobiin, müoglobiin (valgelihas), mitmed ensüümid (katalaas, peroksidaas, tsütokroomid) ja ka klorofüll.
Hemoglobiin(Hb) koosneb valkudest globiin ja mittevalguline osa hema, sealhulgas Fe(II) aatom, mis on ühendatud protoporfüriiniga. Hemoglobiini molekul koosneb 4 alaühikust: kaks a ja kaks b ning vastavalt sellele sisaldab nelja kahe erineva polüpeptiidahelat. Iga a-ahel sisaldab 141 ja b-ahel 146 aminohappejääki.
Raua aatom võib moodustada kuus koordinatsioonisidemet. Neli sidet on suunatud pürroolitsüklite lämmastikuaatomitele, ülejäänud kaks sidet on porfüriini tsükli tasapinnaga risti mõlemal pool seda. Heemid paiknevad valgugloobuli pinna lähedal spetsiaalsetes taskutes, mille moodustavad globiini polüpeptiidahelate voldid. Normaalse funktsioneerimise ajal võib hemoglobiin olla ühes kolmest vormist: ferrohemoglobiin (tavaliselt viidatud kui desoksühemoglobiin või lihtsalt hemoglobiin), oksühemoglobiin ja ferrihemoglobiin (methemoglobiin). Ferrihemoglobiinis on raud raudvormis Fe (II), üks kahest porfüriinitsükli tasapinnaga risti olevast sidemest on suunatud histidiinijäägi lämmastikuaatomile, mida nimetatakse proksimaalseks (naaber), teisel pool porfüriini tsükkel ja sellest kaugemal on teine histidiin, ülejäänud osa on distaalne histidiin, mis ei ole otseselt rauaaatomiga seotud. Molekulaarse hapniku koostoime vaba heemiga viib heemi raua aatomi pöördumatu oksüdatsioonini. Seetõttu kaitseb globiin desoksühemoglobiinis rauda oksüdatsiooni eest.


Molekulaarse hapniku interaktsioonil hemoglobiiniga on viimase oksüdeerumise tõenäosus väike, kuid piiratud: O 2 molekul ei liitu, vaid oksüdeerib rauda: Fe 2+ + O 2 Þ Fe 3+ + O 2 -. Seetõttu moodustub hingamise ajal erütrotsüütides pidevalt methemoglobiin. Selle taastamiseks erütrotsüüdis on spetsiaalne ensümaatiline süsteem, mis taastab methemoglobiini ja muudab selle normaalseks desoksühemoglobiiniks. Kui seda süsteemi rikutakse, tekib tõsine haigus - methemoglobineemia, mille korral hemoglobiin lakkab olemast hapniku kandja.
Hapniku lisamine muudab hemoglobiini happe-aluse omadusi. Oksühemoglobiin on tugevam hape kui desoksühemoglobiin. Seetõttu seob hemoglobiin kudedes, kus märkimisväärne osa hemoglobiinist kaotab hapnikku ja muutub tugevamaks aluseks, metaboolsete intratsellulaarsete protsesside käigus tekkinud süsihappegaasi. Kopsu alveoolides muudetakse deoksühemoglobiin tagasi oksühemoglobiiniks, muutudes tugevamaks happeks ja aidates eemaldada CO2. Kudedest eralduv süsihappegaas ei lahustu tõhusaks transpordiks piisavalt. Karboanhüdraasi ensüümi abil, mis kiirendab edasi- ja tagurpidi reaktsioone:
CO 2 + H 2 O Û HCO 3 - + H +,
Süsinikdioksiid muundatakse hästi lahustuvaks vesinikkarbonaadi aniooniks. Kudede kapillaarides suurendab hapniku eemaldamine desoksühemoglobiini sisaldust, mis seob prootoneid ja nihutab reaktsiooni tasakaalu paremale. Kergesti lahustuv vesinikkarbonaadi ioon kandub veres. Kopsu alveoolides rikastub hemoglobiin hapnikuga, prootonid vabanevad ja tasakaal nihkub vasakule. Tekib halvasti lahustuv süsinikdioksiid CO 2, mis eemaldatakse vesifaasist ja hingatakse välja. Seega toimib hemoglobiin muutuva pH väärtusega puhvrina. Hemoglobiini funktsioon süsihappegaasi kandjana pole vähem oluline kui hapniku kandja funktsioon.
Müoglobiin. Lihastes leiduv kromoproteiin. See koosneb ainult ühest ahelast, mis on analoogne hemoglobiini subühikuga. Müoglobiin on hingamisteede pigment lihaskoes. See seondub hapnikuga palju kergemini kui hemoglobiin, kuid seda on raskem vabastada. Müoglobiin loob hapnikuvarusid lihastes, kus selle kogus võib ulatuda 14%-ni organismi üldhapnikust. See on oluline eelkõige südamelihaste töö jaoks. Mereimetajatel (hüljes, morss) leiti kõrge müoglobiinisisaldus, mis võimaldab neil pikka aega vee all püsida.
Glükoproteiinid. Need on kompleksvalgud, mille proteesrühma moodustavad süsivesikute derivaadid (aminosuhkrud, heksuroonhapped). Glükoproteiinid on osa rakumembraanidest. Seega on bakterite kopsuseinad üles ehitatud peptidoglükaanid, mis on lineaarsete polüsahhariidide derivaadid, mis kannavad nendega kovalentselt seotud peptiidfragmente. Need fragmendid viivad läbi polüsahhariidahelate ristsidumise, moodustades mehaaniliselt tugeva võrgustiku struktuuri. Näiteks rakusein E . coli on ehitatud polüsahhariidahelatest, mis on moodustunud N-atsetüülglükoosamiini jääkidest, mis on seotud b-(1®4) sidemetega, kusjuures iga teine jääk kannab külge piimhappe, L-alaniini, D-glutamaadi jääkidest koosneva C3 aatomiga seotud fragmenti ühendatud amiidsidemetega (läbi g-karboksüüli), mesodiaminonimelinaadi ja D-alaniini:

Selle peptiidi iga C-terminaalne rühm, mis kuulub D-alaniini jääki, moodustab amiidsideme diaminonimüeliinhappe jäägi aminorühmaga, mis kuulub külgnevasse polüsahhariidahelasse.
Lisaks ülaltoodud funktsioonile osalevad glükoproteiinid erinevate ainete transpordis, vere hüübimise, immuunsuse protsessides ning on seedetrakti lima ja eritiste komponendid. Arktilistes kalades täidavad antifriiside rolli glükoproteiinid – ained, mis takistavad jääkristallide teket nende keha sees.
Fosfoproteiinid. Neil on mittevalgukomponendina fosforhape. Nende valkude esindajad on piimakaseinogeen, vitelliin (munakollase valk), ihtiuliin (kalamarja valk). See fosfoproteiinide lokaliseerimine näitab nende tähtsust arenevale organismile. Täiskasvanute vormides esinevad need valgud luu- ja närvikudedes.
Lipoproteiinid. Kompleksvalgud, mille proteesrühma moodustavad lipiidid. Struktuuri järgi on need väikesed (150-200 nm) sfäärilised osakesed, mille väliskesta moodustavad valgud (mis võimaldab neil läbi vere liikuda) ja sisemise osa - lipiidid ja nende derivaadid. Lipoproteiinide põhiülesanne on lipiidide transport läbi vere. Sõltuvalt valkude ja lipiidide hulgast jagatakse lipoproteiinid külomikroniteks, madala tihedusega lipoproteiinideks (LDL) ja kõrge tihedusega lipoproteiinideks (HDL), mida mõnikord nimetatakse a- ja b-lipoproteiinideks.
Külomikronid on lipoproteiinidest suurimad ja sisaldavad kuni 98-99% lipiide ja ainult 1-2% valku. Need tekivad soole limaskestas ja tagavad lipiidide transpordi soolestikust lümfi ja sealt edasi verre.
LDL-is on valkude hulk 9-20%, lipiididest on ülekaalus kolesterool ja triatsüülglütseroolid (kuni 40%). HDL-i valguosa jääb vahemikku 35-50% ning valguosa moodustavad fosfolipiidid ja kolesterool. Seega transporditakse kolesterooli läbi vere lipoproteiinide, eriti LDL-i osana.
2. Koduse toiduvalmistamise keemilised alused
Oravad. Temperatuuril 70 0 C toimub valkude koagulatsioon (koagulatsioon). Nad kaotavad oma võime vett kinni pidada (paisuda), s.t. hüdrofiilsusest muutuvad nad hüdrofoobseks, samal ajal kui liha, kala ja linnuliha mass väheneb. Valgumolekulide tertsiaarne ja sekundaarne struktuur on osaliselt hävinud, osa valke muundatakse polüpeptiidahelateks, mis aitab kaasa nende paremale lõhustumisele seedetrakti proteaaside poolt.
Valgud, mis on toodetes lahuse kujul, kõverduvad keetmisel helvestena ja moodustavad puljongi pinnale vahu. Sidekoe kollageen ja elastiin muudetakse glutiiniks (želatiiniks). Valgu kogukadu kuumtöötlemisel on vahemikus 2 kuni 7%.
Temperatuuri ja töötlemisaja ületamine aitab kaasa lihaskiudude tihenemisele ja toodete konsistentsi halvenemisele, eriti maksast, südamest ja mereandidest valmistatud toodete puhul. Tugeval kuumutamisel hävib tärklis toote pinnal ning suhkrute ja aminohapete vahel tekivad reaktsioonid melanoidide tekkega, mis annavad koorikule tumeda värvuse, spetsiifilise aroomi ja maitse.
Lihatooted kaotavad küpsetamisel ja praadimisel valkude tihenemise, rasva sulamise ning niiskuse ja lahustuvate ainete keskkonda kandumise tagajärjel kuni 30-40% oma massist. Kõige väiksemad kaod on iseloomulikud paneeritud kotleti massitoodetele, kuna valkude poolt väljapressitud niiskus jääb täiteainesse (leiva) kinni ning paneerimiskiht takistab selle aurustumist praepinnalt.
Rasvad. Kuumutamisel sulatatakse toodete rasv. Selle toiteväärtus väheneb rasvhapete lagunemise tõttu. Seega on linool- ja arahhidoonhapete kadu 20-40%. Toiduvalmistamisel läheb puljongisse kuni 40% rasvast, osa sellest emulgeerub ja oksüdeerub. Puljongis sisalduvate hapete ja soolade toimel laguneb emulgeeritud rasv kergesti glütserooliks ja rasvhapeteks, mis muudavad puljongi häguseks, annavad ebameeldiva maitse ja lõhna. Sellega seoses tuleks puljongit keeta mõõdukalt ja pinnale kogunev rasv tuleb perioodiliselt eemaldada.
Röstimisel tekivad sügavad rasvamuutused. Kui panni temperatuur ületab 180 0 C, siis rasv laguneb suitsu tekkega, samal ajal kui toodete maitse halveneb järsult. Prae toidu temperatuur peaks olema 5-10 0 C allpool suitsupunkti.
Praadimisel kaob rasv põhiliselt selle pritsimise tõttu. See on tingitud vee kiirest aurustumisest rasva kuumutamisel üle 100 0 C. Pritsimise ajal tekkivat rasvakadu nimetatakse jäätmeteks ja need on olulised nii palju vett sisaldavate rasvade (margariini) puhul kui ka niiske praadimisel. toiduained (toores kartul, liha jne). Üldine rasvakaotus on paneeritud toodetes väiksem.
Kõige olulisemad keemilised muutused rasvades toimuvad friteerimisel. Hüdrolüüsi, oksüdatsiooni ja polümerisatsiooni tulemusena kogunevad kahjulikud ühendid, mis annavad rasvale ebameeldiva lõhna ja rääsunud maitse. Praetud toodete pinnale adsorbeeritakse rasvade termilise oksüdatsiooni mürgised saadused (aldehüüdid ja ketoonid). Lisaks on rasv saastunud sinna sattunud toote osakestega.
Soovimatute rasvamuutuste ärahoidmiseks kasutatakse fritreid, mille alumises osas on nn külmtsoon, kus rasva temperatuur on palju madalam ning sinna sattunud toote osakesed ei põle läbi. Sügavrasva riknemise eest kaitsmiseks kasutatakse mitmeid tehnoloogilisi meetodeid: fritüürid filtreeritakse perioodiliselt, käed ja seadmed määritakse taimeõliga, friteerimiseks mõeldud tooteid ei paneerita riivsaias.
Süsivesikud. Tärklise kuumutamisel väikese koguse veega toimub selle želatiniseerumine, mis algab temperatuuril 55-60 0 C ja kiireneb temperatuuri tõusuga kuni 100 0 C. Kartuli kuumtöötlemisel toimub tärklise želatiniseerumine. kartulis endas sisalduvale niiskusele.
Taignatoodete küpsetamisel tärklis želatiniseerub kalgendatud gluteenvalkude poolt vabaneva niiskuse tõttu. Sarnane protsess toimub ka vees eelnevalt paisutatud kaunviljade küpsetamisel. Kuivtoodetes (teravili, pasta) sisalduv tärklis želatiniseerub keetmisel keskkonna niiskuse imendumise tõttu, samas suureneb toodete mass.
Toortärklis ei imendu inimkehas, seega süüakse kõik tärkliserikkad toidud pärast kuumtöötlemist. Kui tärklis kuumutatakse ilma veeta üle 110 0 C, laguneb tärklis dekstriinidena, mis lahustuvad vees. Dekstriniseerumine toimub küpsetatud toodete pinnal kooriku moodustumisel, jahu hautamisel, teravilja praadimisel ja pasta küpsetamisel.
Kuumtöötlemine soodustab taimerakke koos hoidva protopektiini üleminekut pektiiniks. Samal ajal omandavad tooted õrna tekstuuri ja imenduvad paremini. Järgmised tegurid mõjutavad protopektiini pektiiniks muutumise kiirust:
toodete omadused: mõnes on protopektiin vähem stabiilne (kartul, puuviljad), teistes on see stabiilsem (kaunviljad, peet, teravili);
Küpsetustemperatuur: mida kõrgem see on, seda kiiremini muundub protopektiin pektiiniks;
keskkonna reaktsioon: happeline keskkond aeglustab seda protsessi, seetõttu ei tohiks suppide keetmisel kartulit hapukapsa või muu happelise toidu järel panna ning kaunvilju leotades ei tohi lasta neil hapneda.
Kiud on taimerakkude seinte peamine struktuurne komponent – kuumtöötlemisel see paisub ja muutub poorsemaks.
vitamiinid. Rasvlahustuvad vitamiinid (A, D, E, K) säilivad hästi kuumtöötlemisel. Seega ei vähenda porgandi praadimine selle vitamiiniväärtust, vastupidi, rasvades lahustunud karoteen muundub kergemini A-vitamiiniks. Selline karoteeni stabiilsus võimaldab hautatud köögivilju pikka aega rasvades säilitada, kuigi vitamiinid hävivad osaliselt. pikaajaline ladustamine õhuhapniku kokkupuute tõttu.
B-rühma veeslahustuvad vitamiinid on happelises keskkonnas kuumutamisel stabiilsed ning leeliselises ja neutraalses keskkonnas hävivad 20-30%, lähevad osaliselt keetmiseks. Suurimad tiamiini ja püridoksiini kaod tekivad kombineeritud kuumutamisel (kustutamine jne). Kõrge säilivus lühikese kuumtöötlusega ja vähese mahla väljavoolamisega. PP-vitamiin on kuumenemisele kõige vastupidavam.
C-vitamiin hävib kuumtöötlemisel kõige tugevamalt õhuhapnikuga oksüdeerumise tõttu, seda soodustavad järgmised tegurid:
toidu valmistamine avatud kaanega;
toidu asetamine külma vette;
· toidu kuumtöötlemise ja pikaajalise säilitamise suurenemine kuumas olekus toidusoojendajal;
· toote kokkupuutepinna suurendamine hapnikuga (lihvimine, hõõrumine).
Happeline keskkond aitab kaasa C-vitamiini säilimisele. Keetmisel muutub see osaliselt keetmiseks. Kartulite praadimisel sügavas rasvas hävib C-vitamiin vähem kui põhilisel praadimisel.
Mineraalid. Mineraalide (kaalium, naatrium, fosfor, raud, vask, tsink jne) maksimaalne kadu (25-60%) tekib suures koguses vees keetmisel nende ülemineku tõttu keetmisele. Seetõttu kasutatakse esmaroogade ja kastmete valmistamiseks mahejuurviljade keetmisi.
Toitainete kadude üldistatud väärtused toodete termilisel kulinaarsel töötlemisel, %
| Tooted |
Süsivesikud |
Mineraalid |
vitamiinid |
Energia väärtus |
||||||||||
| B-karoteen |
||||||||||||||
| juurvilja |
||||||||||||||
| Loomad |
||||||||||||||
| Keskmine |
||||||||||||||
Värvained. Roheliste köögiviljade klorofüll hävib hapete toimel küpsetamise ajal pruunide ainete moodustumisega. Ploomide, kirsi, musta sõstra antotsüaniinid, samuti porgandi ja tomati karoteen on kuumtöötlusele vastupidavad. Peedipigmendid muutuvad pruunikaks, seetõttu loovad need erksa värvuse säilitamiseks happelise keskkonna ja puljongi suurenenud kontsentratsiooni. Liha muudab hemoglobiinisisalduse muutuste tõttu värvi erkroosast halliks.
Toitainete maksimaalset kadu täheldatakse toiduvalmistamise ajal peamiselt võrreldes teiste toodete kuumtöötlusega. Toitainete kadu aitab kaasa ka tehnoloogia keerukus (tükeldamine, toore ja keedetud toiduainete hõõrumine, hautamine).
Väärtuslike toitainete säilitamise seisukohalt on kõige ratsionaalsemad kuumtöötlused: taimsete toodete puhul - keetmine ilma puljongit kurnamata ja koores keetmine; loomadele - hautamine, küpsetamine, liha kasutamine kotlettide, eriti aurude kujul.
Kasutatud allikate ja kirjanduse loetelu
1. Guskova E.V. Biokeemia kaubateaduses [Tekst]: õpik. meetod. kompleks / E.V. Guskov; Tšeljab. in-t (fil) GOU VPO "RGTEU" .- Tšeljabinsk: [b.i.], 2008. - 52 lk.
2. Murray, R., Grenner, D., Meyes, P., Rodwell, V. Inimese biokeemia. 2 köites. 1. köide. Tõlge inglise keelest: - M .: Mir, 1993. - 384 lk.
3. Mityakina Yu.A. Biokeemia [Tekst]: õpik. toetus / Yu.A. Mityakina - M.: RIOR, 2005. - 113 lk.
4. Netšajev, A.P. Toidukeemia [Tekst] / A.P. Netšajev, S.E. Traubenberg ja teised - Peterburi: GIORD, 2003. - 640 lk.
SÕJAJA-MEDITSIINI AKADEEMIA
Nt nr __
Kliinilise biokeemia ja laboratoorse diagnostika osakond
"KINNITA"
Osakonnajuhataja kt
kliiniline biokeemia ja
laboratoorne diagnostika
meditsiiniteenistuse kolonel
V. PASTUSHENKOV
"___" _____________ 2008
Kliinilise biokeemia ja laboratoorse diagnostika osakonna dotsent
arstiteaduste doktor V.ANTONOV
_____________________________________________________________________
ametikoht, akadeemiline kraad, akadeemiline auaste, sõjaväeline auaste, eesnime algustäht, autori(te) perekonnanimi
LOENG nr 4
distsipliin: "Biokeemia"
___________________________________________________________
(akadeemilise distsipliini nimi)
teemal: " Liht- ja kompleksvalkude biokeemia. Nukleiinhapete ehitus ja talitlus. Geeni molekulaarbioloogia. Geenitehnoloogia»
________________________________________________
(tundide teema nimetus vastavalt distsipliini õppimise teemaplaanile)
kadettide ja arstide väljaõppe teaduskondade 2. kursuse üliõpilastega
(välisvägede sõjaväearstid)
Arutati ja kinnitati osakonna koosolekul
"____" ____________ 200___
Protokoll nr ______
Uuendatud (uuendatud):
"____" ____________ 200___
_____________________________________
(sõjaväeline auaste, allkiri, eesnime initsiaal, perekonnanimi)
Loeng teemal: “Liht- ja kompleksvalkude biokeemia. Nukleiinhapete ehitus ja talitlus. Geeni molekulaarbioloogia. Geenitehnoloogia"
õpperühmad: FPV 2. kursuse kadetid ja üliõpilased
Loengu eesmärk: Vaatleme lihtsate ja keerukate valkude struktuuri, funktsiooni, klassifikatsiooni, nukleiinhapete struktuuri ja funktsiooni. Geenibioloogia molekulaarsed aspektid. Tehke sissejuhatus geenitehnoloogiasse
loengu aeg: 2 tundi
Loengu kava.
Sissejuhatus.
Kompleksvalkude klassifikatsioon, struktuuri ja funktsiooni üldised omadused.
Nukleiinhapped
Geenitehnoloogia
Järeldus
Sissejuhatus
Lihtvalgud on ehitatud ainult aminohapetest. Komplekssed valgud koosnevad kahest komponendist – lihtsast valgust ja mittevalgulisest ainest, mida nimetatakse proteesrühmaks. Proteesrühmad on tugevalt seotud molekuli valguosaga.
Komplekssete valkude klassifikatsioon
Komplekssete valkude klassifikatsioon sõltub proteesirühma struktuurist.
Glükoproteiinid (sisaldavad süsivesikuid).
Lipoproteiinid (sisaldavad lipiide).
Fosfoproteiinid (sisaldavad fosforhapet).
Kromoproteiinid (sisaldavad värvilist proteesirühma).
Metalloproteiinid (sisaldavad erinevate metallide ioone).
Nukleoproteiinid (sisaldavad nukleiinhappeid).
Glükoproteiinid. Nende valkude proteesrühmad on esindatud süsivesikute ja nende derivaatidega.
Glükoproteiinid sisaldavad 1 kuni 30% süsivesikuid, mis on tihedalt seotud molekuli valguosaga. Neid esindavad mitmesugused monosahhariidid, nende atsetüülaminoderivaadid, desoksüsahhariidid, neuramiin- ja siaalhapped. Need võivad olla ka lineaarsed või hargnenud oligosahhariidid.
Glükoproteiinide funktsioonid:
enamik valke loomarakkude välispinnal (retseptorid);
enamik sünteesitud raku valke (interferoonid);
enamik vereplasma valke (va albumiinid):
immunoglobuliinid;
vere rühma ained;
fibrinogeen, protrombiin;
haptoglobiin, transferriin;
tseruloplasmiin;
membraani ensüümid;
hormoonid (gonadotropiin, kortikotropiin).
Seos süsivesikute komponentide ja valguosa vahel glükoproteiinides on kovalentne glükosiidne seriini, treoniini OH-rühmade või lüsiini, asparagiini, glutamiini NH-rühma kaudu.
Lipoproteiinid on komplekssed valgud. Nende proteeside rühma esindavad mitmesugused lipiidid. Lipiidide klasse on mitu. Igaüks neist täidab teatud bioloogilist funktsiooni:
Struktuurne (näiteks tsütoskeleti osana);
Transport (näiteks transport ja plasma lipoproteiinid).
Fosfoproteiinid on komplekssed valgud. Nende proteeside rühma esindab fosforhape. Fosfaadijäägid on molekuli valguosaga ühendatud estersidemetega aminohapete seriini ja treoniini hüdroksürühmade kaudu.
Fosfoproteiinide hulka kuuluvad kaseiinid – piimavalgud, vitelliinid – munakollane, ovalbumiin – kanamunavalk. Suur osa neist sisaldub kesknärvisüsteemis. Paljud olulised rakuensüümid on aktiivsed ainult fosforüülitud kujul. Fosfoproteiinid on energiaallikas ja plastmaterjalid.
Metalloproteiinid sisaldavad lisaks valkudele ühe või mitme metalli ioone. Metalliioonid on ühendatud koordinatsioonisidemetega valgu funktsionaalrühmadega.
Metalloproteiinide näide:
ferritiin, transferriin - Fe;
alkoholdehüdrogenaas - Zn;
tsütokroomoksüdaas - Cu;
proteinaasid - Mg, K;
ATPaas - Na, K, Ca, Mg.
Reeglina on metalloproteiinid ensüümid. Metalliioonid täidavad järgmisi funktsioone:
on ensüümi aktiivne koht;
toimida sillana ensüümi aktiivse tsentri ja substraadi vahel, viia need kokku;
toimivad ensümaatilise reaktsiooni teatud etapis elektronide aktseptoritena.
Nukleoproteiinid on kompleksvalgud, mille mittevalgukomponentideks on nukleiinhapped – DNA (desoksüribonukleiinhape) või RNA (ribonukleiinhape).
Nukleiinhapped
Nukleiinhappemolekulid on negatiivselt laetud, mistõttu nad moodustavad positiivselt laetud valgukomponentidega ioonsidemeid.
Nukleiinhapped on lineaarsed (harvem tsüklilised) heteropolümeerid, nende monomeerideks on mononukleotiidid. Mononukleotiid koosneb kolmest osast:
lämmastikalus (kõikide nukleiinhapete jaoks);
pentoosid (riboos RNA-s või desoksüriboos DNA-s) – koos moodustavad nad nukleosiidi;
fosforhappe jääk. Erinevate mononukleotiidide nomenklatuur on esitatud tabelis.
Nukleotiidide nomenklatuur.
Monomeerid, millest seejärel nukleiinhapped koosnevad, koosnevad lämmastikalusest, suhkrujäägist (desoksüriboos või riboos) ja fosfaadist. Suhkruid koos lämmastiku alusega nimetatakse nukleosiidideks (adenosiin, guanosiin, tümidiin, tsütidiin). Kui nende külge on kinnitatud 1-, 2- või 3-fosforijäägid, nimetatakse kogu seda struktuuri vastavalt nukleotiidi monofosfaadiks, difosfaadiks või trifosfaadiks või nukleotiidiks (adeniin, guaniin, tümiin, tsütosiin).
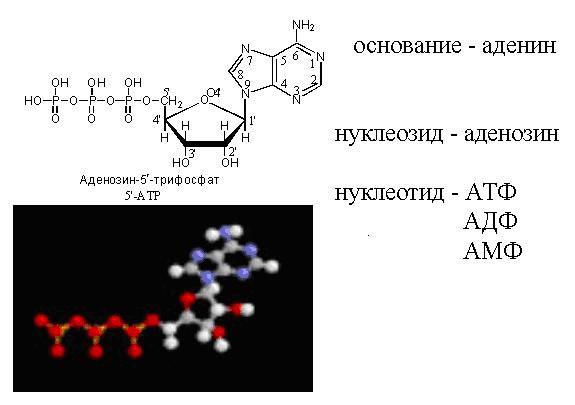
ATP mudel tasapinnas ja ruumis.
TMP-d leidub ainult DNA-s ja UMF-i ainult RNA-s. Kui mononukleotiid sisaldab desoksüriboosi, lisatakse selle nime algusesse eesliide "desoksü".

Nukleiinhapete koostises on mononukleotiidid seotud 3,5-fosfodiestersidemetega naabermononukleotiidide ribooside (desoksüribooside) vahel fosforhappejäägi kaudu. Seega, kui nukleiinhappemolekul ei ole tsükliline, on selle otsad erinevad.
Üks neist on tähistatud 3-terminalina ja teine 5-terminalina. 5-otsa peetakse esialgseks.

DNA esmane struktuur
Nagu igal polümeeril, on ka DNA molekulil primaarstruktuur, mille moodustab kordumatu järjestus, mis koosneb 4 tüüpi vahelduvatest monomeeridest: lämmastiku alustest, millest 2 on puriinid ja 2 on pürimidiinid, mis on ühendatud homopolümeeri suhkrufosfaatahelaga. Fosfoestersidemed ühendavad järjestikku iga eelmise nukleotiidi desoksüriboosijäägi 3-tollise süsinikuaatomi järgmise nukleotiidi 5-tollise süsinikuaatomiga, luues pideva kovalentse sidemega molekuli karkassi. Lämmastiku aluste järjestus on tegelikult geneetiline maatriks, millele kolmikkoodi abil registreeritakse kogu organismi pärilik informatsioon. Üsna tinglikult on võimalik tõmmata analoogia seda tüüpi kodeeringu ja tähestiku tähtede vahel, mis teatud järjekorras sõnu ja fraase moodustavad. Kuigi geenisõnaraamatus on ainult neli tähte, piisab neist 20 erineva aminohappe järjestuse krüpteerimiseks, millest koosnevad kõik tulevased valgumolekulid – funktsioneerivate geenide lõpp-produktid. Genoomi regulatoorsed piirkonnad on kodeeritud samamoodi - promootorid ja võimendajad, start- ja stoppkoodonid jne.
DNA molekuli esmase struktuuri stabiilsus võimaldab rakkudel põlvest põlve säilitada iga organismi jaoks ainulaadset pärilikku teavet (genotüüpi). Muutused vahelduvate lämmastikualuste järjestuses (mutatsioonid) võivad põhjustada päriliku teabe vigu, mille erinevaid võimalikke tagajärgi kirjeldatakse allpool.
Rangelt võttes ei ole DNA esmane struktuur, kuigi sellel on märkimisväärne konservatiivsus, endiselt püsiv. Mobiilsete hajutatud geenide, transposoonide avastamine näitas, et molekuli üksikud osad on normaalse funktsioneerimise ja rakkude diferentseerumise käigus võimelised liikuma mööda ahelat, muutes samal ajal molekuli esmast struktuuri. Sellised ümberkorraldused on eriti iseloomulikud lümfoidkoe rakkudele: need on seotud naiivsete lümfotsüütide terminaalse diferentseerumisega, mis viib kõrgelt spetsialiseerunud immunokompetentsete rakkude kloonide ilmumiseni. Selliste piirkondade mittejuhuslikkus ja geneetilise teabe diskreetsus võimaldavad selliste liikumiste ajal säilitada genoomi terviklikkust.
Teisest küljest on mõned viirused (retro-, adenoviirused jne) võimelised lisama peremeesorganismi DNA rakkudesse lisaelemente, samuti lohistama geenilõike või terveid geene DNA molekuli ühest lookusest teistesse. Ioniseeriva kiirguse, keemiliste kantserogeenide ja mutageenide toime, vead DNA replikatsiooniprotsessis toovad kaasa ka muutusi molekuli primaarstruktuuris. Sellised muutused on reeglina juhuslikud ja muudavad seetõttu genoomi terviklikkust ja kujutavad endast somaatilisi mutatsioone. Selliste muutuste tagajärjed pole selged.
Kui mutatsioon sai alguse DNA "mõttetust" osast, on see tavaliselt ükskõikne. Mutatsioonid, mis esinevad konstitutiivselt represseeritud geenides, on sama iseloomuga. Konstitutiivse repressiooni mõiste on koespetsiifiline ja on seotud rakkude diferentseerumise tunnustega ning seetõttu võib teatud tüüpi rakkudes represseeritud geen olla funktsionaalselt oluline erineva histogeneesiga rakkudes. Näiteks terminaalne (pärilik, st esineb antud organismi kõigis rakkudes) geenimutatsioon BRCA1/2 põhjustab ülikõrget rinna- või munasarjavähi varase arengu riski, kuid ei avaldu teiste kudede rakkudes.
Kui mutatsioon on mõjutanud toimivat geeni, siis ei saa selle tagajärjed olla ükskõiksed, kuid ka sel juhul ei ole need üheselt mõistetavad: kui geeni regulatoorsetes piirkondades muutub alusjärjestus, siis nii selle ekspressiooni nõrgenemine kuni täieliku väljalülitumiseni. (geeni knockout) ja ebanormaalne aktivatsioon (hüper- või üleekspressioon) kuni püsiva reguleerimata aktiivsuse saavutamiseni. Lõpuks mutatsioon geeni "mõistes" osas, mis kodeerib teatud valguprodukt (missense mutatsioon) võib põhjustada muutunud valgu ilmnemist. Omakorda võib muudetud valguprodukt oma funktsionaalsete omaduste poolest täielikult vastata "metsik" tüüpi valgule: kas neil on vähenenud spetsiifiline ac-| aktiivsus; või vastupidi, hüperaktiivsus; või lõpuks omandada teist tüüpi aktiivsus, mis ei ole "metsik" tüüpi valgule iseloomulik. Seega, sõltuvalt paljude tegurite kombinatsioonist, võivad somaatilised mutatsioonid viia nii raku elujõulisuse vähenemiseni, selle jagunemise ja surma peatamiseni ning, vastupidi, selle kasvu ja jagunemiseni kuni kasvaja transformatsioonini. .
DNA sekundaarne struktuur
DNA sekundaarstruktuuri esindab kaksikheeliks, mille mudeli avastasid enam kui pool sajandit tagasi tulevased Nobeli preemia laureaadid (auhind anti just selle avastuse eest) James Watson ja Francis Crick. Selle mudeli järgi koosneb natiivne DNA molekul kahest peegelpildist (üksteist komplementaarsete puriini ja pürimidiini lämmastikualuste suhtes) antiparalleelsest (ühe ahela 5'-ots külgneb teise ahela 3'-otsaga. ) ahelad, mis on omavahel ühendatud komplementaarsete vastasmõjujõududega. DNA kõige olulisem omadus on selektiivsus sidemete moodustamisel (komplementaarsus). Aluste ja kaksikheeliksi suurused on looduses valitud nii, et tümiin (T) moodustab vesiniksidemeid ainult adeniiniga (A), tsütosiin (C) aga ainult guaniiniga (G).

Vesiniksidemed ei ole kovalentsed ja seetõttu saab neid suhteliselt kergesti hävitada, mis viib mõlema ahela lahknemiseni – denatureerumiseni molekulideks.DNA. See protsess (lokaalne denaturatsioon) on absoluutselt vajalik selleks, et DNA molekul saaks täita oma matriitsi funktsioone, aga ka molekuli enda replikatsiooniks.
2-ahelalise (2-ahelalise) molekuli osana on mõlemad DNA ahelad parempoolsed heeliksid, millel on ühine telg: lämmastiku alused on pööratud molekuli sees, moodustades hüdrofoobse tsooni ja mõlemad suhkru-fosfaatahelad asuvad perifeerselt (plektoneemiline spiraal). Tuntud on mitmed topeltspiraali kanoonilised vormid, mis erinevad geomeetriliste mõõtmete poolest. 1953. aastal Watsoni ja Cricki modelleeritud klassikalisel B-kujul on järgmised omadused: üks pööre paremakäeline molekul sisaldab 10 paari nukleotiide, selle projektsiooni pikkus teljel on 34 A (angstrom), läbimõõt (fosforiaatomite järgi) 18 A; molekulil on suured ja väikesed külgmised sooned läbimõõduga vastavalt 17 ja 11 A.

Kaheahelalise DNA molekuli kolm esitust:
a ja b - kaheahelalise DNA klassikalised kujutised;
c - DNA kui kaheahelaline struktuur, millel on ebakindlad füüsikalised parameetrid, kuid üksteisega komplementaarsed ahelad;
A, C, G, T - polümeerse DNA molekuli monomeersed üksused;
C-G, T-A - komplementaarsed aluspaarid, mis ühendavad kahte ahelat
See molekuli vorm esineb preparaatides, mille niiskustase on lähedane füsioloogilisele. Osalise dehüdratsiooniga läheb DNA üle A-vormi, milles üks pööre sisaldab juba 11 aluspaari, pöörde projektsioon teljele on 28 A, läbimõõt väheneb 1 A võrra ja võrreldakse mõlema soone laiust. Liitiumisoolade juuresolekul moodustunud C-vorm, vastupidi, on lõdvem kui B-vorm: pööre sisaldab 9 nukleotiidipaari. Täiesti ainulaadne, avatud suhteliselt hiljuti levoza-väänatud DNA Z-vorm, mis sisaldab 12 nukleotiidi pöörde kohta. Kanooniliste vormide sees võib esineda teatud vahevariante, mille vahelisi üleminekuid ei toimu kooperatiivselt, erinevalt kooperatiivsetest üleminekutest ühest kanoonilisest vormist teise.
Konformatsioonilised üleminekud hiiglasliku DNA molekuli üksikutes piirkondades on olulised kromatiini kõrgema organiseerituse ja funktsioneerimise jaoks ning neid arutatakse vastavas jaotises. Siinkohal tuleb ka märkida, et topeltheeliksi olemasolu mis tahes kanoonilises vormis on võimalik mitte ainult kahe ahela osalusel, vaid ka 1-ahelalise molekuli eraldi sektsioonis, eeldusel, et see sektsioon kannab palindroomne järjestus, st sümmeetriliselt peegeldas komplementaarsete aluste järjestust, näiteks "...ATCAG...CTGAT...". Sellises 2-ahelalise DNA molekuli lõikes võib tekkida "juuksenõel" või "rist", mis on sümmeetriline dupleksprotsess, mille telg on risti molekuli peateljega. Molekuli "juuksenõelte", "risti" ja konformatsiooniliste üleminekute pöörduv moodustumine mängib üksikute geenide aktiivsuse reguleerimisel teatud rolli.
Kõrgemat järku DNA struktuuridorganisatsioonid
Eelmistes osades on lühidalt kirjeldatud DNA molekuli enda struktuuri, ilma et see oleks seotud teiste kromatiini komponentidega. Kõik järgnevad selle biopolümeeri organiseerituse tasemed hõlmavad DNA supramolekulaarse kompleksi struktuuri.
Kromatiini osana on DNA molekul interaktsioonis suure hulga valkudega (DNA:valgu massisuhe erinevate rakkude tuumades on erinev, kuid keskmiselt on see lähedane suhtele 1:1 - 1:2) , mis jagunevad 2 ebavõrdseks histoonide ja kromatiini mittehistoonvalkude rühmaks. Histoonid (aluselised valgud, lahustuvad hapetes) moodustavad suurema osa (kuni 80%) tuuma valkudest, mittehistooni valgud (happelised, neutraalsed ja mõned nõrgalt aluselised) moodustavad kvantitatiivselt väiksema osa tuumavalkudest, kuid ühinevad nende rühmas on palju suurem valik kromatiini struktuurseid, ensümaatilisi ja regulatoorseid valgukomponente.
Nukleohistooni kompleksi struktuur on hästi uuritud ja selle määrab 2 selle organiseerituse taset: nukleosomaalne ja nukleomeerne. Nukleosoomid on 10 nm läbimõõduga nukleoproteiini osakesed, mis koosnevad tsentraalsest (tuuma) valguosakesest, mille pinnal on solenoiditaoline kaheahelalise DNA molekuli pakend. Tuumosakeseks on 4 histoonist koosnev oktameer (inimestel histoonid H2a, H2b, H3 ja H4), millest 2 molekuli 1 osakese kohta. Tuumaosakesega vahetult kokku puutuva DNA segmendi pikkus on 140 aluspaari (bp), mis vastab molekulmassile (MW) u. 100 kDa. Tuumaosakestega kokkupuutuv DNA on steeriliselt kaitstud endonukleaaside toime eest. DNA molekul moodustab tuumaosakese pinnal 2 pööret, misjärel läheb see ilma purunemata üle järgmisele tuumaosakesele. Vaba DNA piirkonna pikkus külgnevate tuumaosakeste (linker) vahel on hinnanguliselt 30–60 aluspaari. (10-20 nm). Morfoloogiliselt näeb kromatiini organiseerituse nukleosomaalne tase välja nagu "helmed nööril".

Inimese kromatiini ja N-i histooni H3 organiseerimise skeem (a), histoonide H3 ja H4 translatsioonijärgsete modifikatsioonide võimalikud kohad (b).
Nukleosoomi pinnal on histooni H N-ots ja teiste histoonide otsad kujutatud konatiivse domeenina; histooni H3 diagrammil on märgitud järgmised mos: ja levinuim translatsioonijärgne mos; katioonid: atsetüülimine (lipp), fosforüülitud (ring) ja metüülimine (kuusnurk), mõned modifikatsioonid globulaarses dos on täiesti võimalikud: Ruumiline per- metüleeritud.
Histoon HI on seotud linkeriga, mis kaitseb endonukleaasi toime DN vaba ekstranukleosomaalset piirkonda ja on oluline kromaadi nukleomeeride, mis on superbid moodustavate nukleosoomide oligosoomid (inglise keelest). i helmed - suured pallid) spiraal. Nukleomeerne organisatsioon on iseloomulik transkriptsiooniliselt inaktiivsele kromatiinile ja tagab selle kõrge taseme ning kaitse nukleaasi lõhustumise eest.
Nukleosoomide olemasolu geenide promootorpiirkondades takistab RNA polümeraasi ja transkriptsioonifaktoreid sisaldava transkriptsiooni initsiatsioonikompleksi teket ning transkriptsiooni initsiatsiooniks on vajalik kromatiini nukleosomaalse struktuuri lokaalne hävitamine promootori ja regulatoorsete elementide läheduses. Samal ajal ei ole konstitutiivselt transkribeeritud geenidel promootorpiirkonnas üldse nukleosomaalset struktuuri.
Mehhanism, mille abil säilib piirkonna pidev olemasolu nukleosoomivaba DNA järjestuse kujul, ei ole täiesti selge: kas transkriptsioonifaktoritel on aega promootorpiirkonnaga interakteeruda juba enne nukleosoomide kokkupanemist või seostuvad need tegurid vastavad nukleosoome sisaldavad DNA piirkonnad ja destabiliseerivad viimased. Seda eeldust toetab tuumahistoonide võime arvukatele pöörduvatele modifikatsioonidele: fosforüülimine, atsetüülimine, metüülimine, mis põhjustavad konformatsioonilisi muutusi molekulides ja vastavalt muutusi valkude ja valkude interaktsioonides. Eelkõige põhjustab konserveerunud H3 ja H4 histooni domeenide keemiline modifitseerimine tuumaoktameeri destabiliseerumist, mis dissotsieerub ja vabastab 2 H2a/H2b dimeeri; samas kui H3/H4 dimeerid säilitavad DNA sidumise, kuid ei sega struktuurselt replikatiivsete või transkriptsiooniliste komplekside läbimist.
Seega on nukleosoomide pööratav kokkupanek-demonteerimine geenide funktsionaalse aktiveerimise regulatiivne element ning transkriptsiooniliselt inaktiivse kromatiini säilitamine kromomeeride superbid-heeliksi kujul hoiab ära geneetilise materjali nukleaasiga seedimise ohu.
; DNA ja mittehistooni kromatiini valkude vahelisi seoseid on palju vähem uuritud. Esiteks on selle põhjuseks mittehistoonvalkude tohutu hulk, millest mõnel on liigi- ja koespetsiifilisus. Kahemõõtmelise elektroforeesi kohaselt ületab mittehistooni tuumavalkude arv, sealhulgas modifitseeritud vormid, 450, kuid see arv võtab arvesse ainult peamisi fraktsioone, mis on visualiseerimiseks saadaval olemasolevate elektroforegrammide mittespetsiifilise värvimise meetodite abil. Võttes arvesse raku tuuma väiksemaid valgukomponente, saab mittehistooni kromatiini valkude tegelikku kogust mõõta tuhandetes.
Seni puudub mittehistoonvalkude ühtne klassifikatsioon, nende klassifitseerimiseks kasutavad nad kromatiiniga seotuse tugevust (ekstraheeritavus), füüsikalis-keemilisi (lahustuvus, isoelektriline punkt, molekulmass, liikuvus elektroforeesi ajal jne), funktsionaalseid omadusi. , ensümaatiline aktiivsus.
Sageli klassifitseeritakse mittehistoonvalgud selle alusel, kuidas need eraldatakse kromatiini üldpreparaatidest erineva ioontugevusega ja erinevaid dissotsieeruvaid aineid sisaldavates lahustes. Seega saab kromatiinist ekstraheerida kuni 10% mittehistoonvalkudest ekstraheerimisel 0,35 M NaCl-ga (globuliin-uus kromatiini fraktsioon); kuni 90% mittehistooni valkudest eemaldatakse tuumade töötlemisel 2,0 M NaCl 5 M uurea või 37% guanidiinkloriidi lahusega. Enamiku ülejäänud valkudest pärast seda ekstraheerimist saab eraldada naatriumdodetsüülsulfaadi (SDS), 2-merkaptoetanooli ja leelisega. Kuid isegi pärast sellist töötlemist jääb DNA-ga seotuks väike kogus valku, mida ei eemaldata isegi siis, kui DNA deproteiinitakse fenooli või kloroformiga. Järelikult ei ole DNA suhe erinevate mittehistoonvalkudega samaväärne ja supramolekulaarse kromatiini kompleksi natiivsest struktuurist saab rääkida ainult isoleeritud kromatiini spetsiifiliste preparaatide teatud interaktsioonide puutumatuse säilitamise seisukohast.
Kõigist mittehistoonilistest kromatiinivalkudest tuleb välja tuua tuumamaatriksi komponendid (tuuma luustiku fibrillaarne-granulaarne struktuur) ja väike rühm valke, mis tavaliselt on nendega seotud (alammembraani kiulise kihi komponendid). tuumas - lamiinid, tuumapooride valgud ja mõned teised). Just need raku tuuma komponendid moodustavad ruumilise maatriksi, millel toimub DNA molekuli reguleeritud funktsioneerimine.
Gene- päriliku teabe materiaalne kandja, mille kogu vanemad annavad edasi oma järglastele. Praegu, sisse molekulaarbioloogia leidis, et geenid on piirkonnad DNA, mis kannab mis tahes terviklikku teavet - ühe struktuuri kohta molekulid orav või üks molekul RNA. Need ja teised funktsionaalsed molekulid määravad kasvu ja funktsiooni organism.
Samas iseloomustab iga geeni hulk spetsiifilisi regulatiivsed DNA järjestused, nagu näiteks promootorid, mis on otseselt seotud geeniekspressiooni reguleerimisega. Reguleerivad järjestused võivad paikneda mõlema vahetus läheduses avatud lugemisraam valku kodeeriv või RNA järjestuse algus, nagu promootorite puhul (nn cis-regulatiivsed elemendid, Inglise cis-regulatiivsed elemendid) ja paljude miljonite aluspaaride kaugusel ( nukleotiidid), nagu ka juhul võimendajad ja summutajad(mõnikord klassifitseeritakse kui transregulatiivsed elemendid, Inglise regulatiivsed elemendid). Seega ei piirdu geeni mõiste ainult DNA kodeeriva piirkonnaga, vaid on laiem mõiste, mis hõlmab regulatsioonijärjestusi.
Algselt ilmus termin geen diskreetse päriliku teabe edastamise teoreetilise üksusena. Bioloogia ajalugu mäletab arutelu selle üle, mille üle molekulid võivad olla päriliku teabe kandjad. Enamik teadlasi uskus, et sellised kandjad saavad olla ainult oravad, kuna nende struktuur (20 aminohapped) võimaldab luua rohkem valikuid kui DNA struktuur, mis koosneb vaid neljast tüübist nukleotiidid. Hiljem tõestati eksperimentaalselt, et just DNA sisaldab pärilikku informatsiooni, mida väljendati kui Molekulaarbioloogia keskne dogma.
Inimkeha sisaldab üle 50 000 üksiku valgu, mis erinevad esmase struktuuri, konformatsiooni, aktiivse tsentri struktuuri ja funktsioonide poolest. Seni puudub aga ühtne ja sidus klassifikatsioon, mis võtaks arvesse valkude erinevaid omadusi. Olemasolevad klassifikatsioonid põhinevad erinevatel tunnustel. Seega võib valgud klassifitseerida:
valgumolekulide kuju järgi (kerakujuline - ümar või fibrillaarne - filamentne)
molekulmassi järgi (madal molekulmass, kõrge molekulmass)
vastavalt täidetavatele funktsioonidele (transport, konstruktsioon, kaitse, reguleeriv jne)
lokaliseerumise järgi rakus (tuuma, tsütoplasmaatiline, lüsosomaalne jne)
Struktuuriliste iseärasuste ja keemilise koostise järgi jagunevad valgud kahte rühma: lihtsad ja komplekssed. Lihtvalke esindab ainult aminohapetest koosnev polüpeptiidahel. Kompleksvalgud koosnevad valguosast ja mittevalgulisest komponendist (proteesirühm). Kuid ka see klassifikatsioon pole ideaalne, kuna lihtsad valgud on puhtal kujul organismis haruldased.
lihtsate valkude iseloomustus.
Lihtsate valkude hulka kuuluvad histoonid, protamiinid, albumiinid ja globuliinid, prolamiinid ja gluteliinid, proteinoidid.
Histoonid- paljude kromatiini DNA-ga seotud organismide koevalgud. Need on väikese molekulmassiga (11-24 tuhat Da) valgud. Elektrokeemiliste omaduste järgi kuuluvad nad selgelt väljendunud põhiomadustega valkude hulka (polükatioonsed valgud), IEP histoonides jääb vahemikku 9-12. Histoonidel on ainult tertsiaarne struktuur, nad on koondunud peamiselt raku tuumadesse. Histoonid on seotud DNA-ga desoksüribonukleoproteiinide osana. Histooni-DNA side on elektrostaatiline, kuna histoonidel on suur positiivne laeng, samas kui DNA ahel on negatiivne. Histoonide koostises domineerivad diaminomonokarboksüülaminohapped arginiin, lüsiin.
Histoone on 5 tüüpi. Jaotus põhineb mitmetel tunnustel, millest peamine on lüsiini ja arginiini suhe fraktsioonides, neli histooni H2A, H2B, H3 ja H4 moodustavad oktameerise valgukompleksi, mida nimetatakse "nukleosoomi tuumaks". DNA molekul "tuuleb" histooni oktameeri pinnal, tehes 1,75 pööret (umbes 146 aluspaari). Sellist histooni valkude kompleksi DNA-ga nimetatakse kromatiini peamiseks struktuuriüksuseks "nukleosoom" .
Histoonide põhifunktsioon on struktuurne ja reguleeriv. Struktuurne funktsioon seisneb selles, et histoonid osalevad DNA ruumilise struktuuri ja järelikult ka kromatiini ja kromosoomide stabiliseerimises. Reguleeriv funktsioon on võime blokeerida geneetilise teabe ülekandmist DNA-st RNA-sse.
Protamiinid- histoonide originaalsed bioloogilised asendajad, kuid erinevad neist koostise ja struktuuri poolest. Need on madalaima molekulmassiga valgud (M - 4-12 tuhat Da), millel on selgelt väljendunud põhiomadused, kuna neis on kõrge arginiinisisaldus (80%).
Nagu histoonid, on protamiinid polükatioonsed valgud. Nad seonduvad sperma kromatiini DNA-ga ja neid leidub kalapiimas.
Salmin - protamiin lõhepiimast.
Makrell - makrellipiimast.
Protamiinid muudavad sperma DNA kompaktseks, st. täidavad sarnaselt histoonidega struktuurset funktsiooni, kuid ei täida regulatiivset funktsiooni.
albumiinid ja globuliinid.
Albumiinid (A) ja globuliinid (G).
A- ja G-valgud, mida leidub kõigis kudedes. Seerum on nende valkude poolest rikkaim. Albumiinide sisaldus selles on 40-45 g / l, globuliinid 20-30 g / l, st albumiinid moodustavad üle poole vereplasma valkudest.
Albumiinid- suhteliselt väikese molekulmassiga valgud (15-70 tuhat Jah); neil on negatiivne laeng ja happelised omadused, IET - 4,7, sisaldavad palju glutamiini aminohapet. Need on kõrge hüdraatunud valgud, nii et need sadestuvad ainult vett eemaldavate ainete kõrge kontsentratsiooni korral.
Kõrge hüdrofiilsuse, väikese molekuli suuruse ja märkimisväärse kontsentratsiooni tõttu on albumiinidel oluline roll vere osmootse rõhu säilitamisel. Kui albumiini kontsentratsioon on alla 30 g/l, muutub vere osmootne rõhk, mis toob kaasa turse. Umbes 75–80% vere osmootsest rõhust moodustab albumiin.
Albumiinide iseloomulik omadus on nende kõrge adsorptsioonivõime. Nad adsorbeerivad polaarseid ja mittepolaarseid molekule, täites transpordirolli. Need on mittespetsiifilised kandjad; nad transpordivad hormoone, kolesterooli, bilirubiini, ravimaineid, kaltsiumiioone. Pika ahelaga rasvhapete sidumine ja transport on seerumi albumiinide peamine füsioloogiline funktsioon. Albumiinid sünteesitakse peamiselt maksas ja uuenevad kiiresti, nende poolväärtusaeg on 7 päeva.
Globuliinid- albumiinidest suurema molekulmassiga valgud. Globuliinid on nõrgalt happelised või neutraalsed valgud (IET = 6 - 7,3). Mõnedel globuliinidel on võime spetsiifiliselt aineid (spetsiifilisi kandjaid) siduda.
Vere seerumi valgud on võimalik fraktsioneerida albumiinideks ja globuliinideks, soolades need välja (NH 4) 2 SO 4 -ga. Küllastunud lahuses sadestuvad albumiinid heledama fraktsioonina, poolküllastunud lahuses globuliinid.
Kliinikus on laialt levinud vereseerumi valkude fraktsioneerimise meetod elektroforeesiga. Vere seerumi valkude elektroforeetilise eraldamisega saab eristada 5–7 fraktsiooni: Vere seerumi valgufraktsioonide muutuste olemus ja määr erinevate patoloogiliste seisundite korral pakub diagnostilisel eesmärgil suurt huvi. Albumiini vähenemist täheldatakse nende sünteesi rikkumise, plastmaterjali puuduse, maksa sünteetilise funktsiooni rikkumise ja neerukahjustuse tagajärjel. Krooniliste nakkusprotsesside korral suureneb globuliinide sisaldus.
Seerumi valgu elektroforees.
Prolamiinid ja gluteliinid.
See on rühm taimseid valke, mida leidub eranditult teraviljataimede seemnete gluteenis, kus nad toimivad säilitusvalkudena. Prolamiinide iseloomulik tunnus on see, et nad ei lahustu vees, soolalahustes, leelistes, kuid lahustuvad 70% etanoolilahuses, samas kui kõik teised valgud sadestuvad. Enim uuritud valgud on gliadiin (nisu) ja zeiin (mais). On kindlaks tehtud, et prolamiinid sisaldavad 20-25% glutamiinhapet ja 10-15% proliini. Need valgud, nagu gliadiin, lagunevad tavaliselt inimestel, kuid mõnikord pole seda valku lagundavat ensüümi sünnihetkel. Seejärel muundatakse see valk lagunemissaadusteks, millel on toksiline toime. Areneb tsöliaakia – taimsete valkude talumatus.
Gluteliinid on ka taimsed valgud, mis ei lahustu vees, soolalahustes ja etanoolis. Need lahustuvad nõrkades leelistes.
Proteinoidid.
Tugikudede (luud, kõhred, kõõlused, sidemed) valgud, keratiinid - karvade, sarvede, kabjavalgud, kollageenid - sidekoe valgud, elastiin - elastsete kiudude valk.
Kõik need valgud on fibrillaarsed, nad ei hüdrolüüsita seedetraktis. Kollageen moodustab 25-33% valgu koguhulgast täiskasvanud inimese kehas ehk 6% kehakaalust. Kollageeni peptiidahel sisaldab umbes 1000 aminohappejääki, millest iga 3. aminohape on glütsiin, 20% proliin ja hüdroksüproliin, 10% alaniin. Sekundaarsete ja tertsiaarsete struktuuride moodustumisel ei saa see valk moodustada tüüpilisi a-heelikse, kuna aminohapped proliin ja hüdroksüproliin võivad moodustada ainult ühe vesiniksideme. Seetõttu on polüpeptiidahel piirkonnas, kus need aminohapped asuvad, kergesti painutatud, kuna seda ei hoia, nagu tavaliselt, teine vesinikside.
Elastiin - see on elastsete kiudude peamine struktuurikomponent, mis sisalduvad olulise elastsusega kudedes (veresooned, sidemed, kopsud). Elastsuse omadused avalduvad nende kudede suures venitatavuses ning esialgse kuju ja suuruse kiires taastamises pärast koormuse eemaldamist. Elastiin sisaldab palju hüdrofoobseid aminohappeid (glütsiin, valiin, alaniin, leutsiin, proliin).
KOMPLEKSSED VALGUD
Komplekssed valgud sisaldavad lisaks polüpeptiidahelatele oma koostises mittevalgulist (proteesilist) osa, mida esindavad erinevad ained. Sõltuvalt mittevalguosa keemilisest olemusest eristatakse järgmisi kompleksvalkude rühmi:
kromoproteiinid
süsivesikute-valgu kompleksid
lipiid-valgu kompleksid
nukleoproteiinid
fosfoproteiinid
3.4.2. Hemoproteiinide hulka kuuluvad: hemoglobiin, müoglobiin, tsütokroomid, peroksidaas, katalaas. Need valgud sisaldavad proteesrühmana kalliskivi.
Vastavalt oma keemilisele struktuurile on heem protoporfüriin IX seotud raudraudaga. Protoporfüriin IX on porfüriinide klassi kuuluv orgaaniline ühend. Protoporfüriin IX sisaldab nelja asendatud pürroolitsüklit, mis on ühendatud metiinsildadega. =CH-. Pürroolitsüklite asendajad on: neli metüülrühma CH3 -, kaks vinüülbändi CH2 \u003d CH - ja kaks propioonhappe jääki - CH2-CH2-COOH. Heem ühendub valguosaga järgmisel viisil. mittepolaarsed rühmad. protoporfüriin IX interakteerub hüdrofoobsete sidemete kaudu aminohapete hüdrofoobsete piirkondadega. Lisaks on valguahelas rauaaatomi ja histidiini imidasooli radikaali vahel koordinatsiooniside. Hapniku ja teiste ligandide sidumiseks saab kasutada teist rauaaatomi koordinatsioonisidemet.
Heemi sisaldavate valkude olemasolu bioloogilises materjalis tuvastatakse bensidiini testi abil (bensidiini ja vesinikperoksiidi lisamisel muutub uuritav lahus sinakasroheliseks).
3.4.3. Võrrelge müoglobiini ja hemoglobiini struktuuri ja funktsiooni, pidage meeles iga selle valgu iseloomulikke tunnuseid.
müoglobiin- kromoproteiin, mis esineb lihaskoes ja millel on kõrge afiinsus hapniku suhtes. Selle valgu molekulmass on umbes 16 000 Da. Müoglobiini molekulil on tertsiaarne struktuur ja see on heemiga ühendatud üks polüpeptiid ahel. Müoglobiinil ei ole allosteerilisi omadusi (vt 2.4.), selle hapnikuküllastuse kõver on hüperbooli kujul (joonis 4). Müoglobiini ülesanne on luua lihastesse hapnikuvaru, mida tarbitakse vastavalt vajadusele, kompenseerides ajutise hapnikupuuduse.
Hemoglobiin (Hb)- erütrotsüütides esinev kromoproteiin, mis osaleb hapniku transportimisel kudedesse. Täiskasvanute hemoglobiini nimetatakse hemoglobiiniks A (HbA). Selle molekulmass on umbes 65 000 Da. Hb A molekulil on kvaternaarne struktuur ja see sisaldab nelja subühikut – polüpeptiidahelaid (tähistatud α1, α2, β1 ja β2, millest igaüks on seotud heemiga.
Pidage meeles, et hemoglobiin on allosteeriline valk, selle molekulid võivad pöörduvalt muutuda ühest konformatsioonist teise. See muudab valgu afiinsust ligandide suhtes. Konformatsiooni, millel on ligandi suhtes väikseim afiinsus, nimetatakse pingeliseks ehk T-konformatsiooniks. Ligandi suhtes kõrgeima afiinsusega konformatsiooni nimetatakse lõdvestunud või R-konformatsiooniks.
Hemoglobiini molekuli R- ja T-konformatsioonid on dünaamilises tasakaalus:
Erinevad keskkonnategurid võivad seda tasakaalu ühes või teises suunas nihutada. Allosteerilised regulaatorid, mis mõjutavad Hb afiinsust O2 suhtes, on: 1) hapnik; 2) H+ kontsentratsioon (söötme pH); 3) süsinikdioksiid (CO2); 4) 2,3-difosfoglütseraat (DPG). Hapnikumolekuli kinnitumine ühele hemoglobiini subühikutest soodustab pingelise konformatsiooni üleminekut lõdvestunud konformatsioonile ja suurendab sama hemoglobiini molekuli teiste subühikute hapnikuafiinsust. Seda nähtust nimetatakse koostööefektiks. Hemoglobiini hapnikuga seondumise kompleksne olemus kajastub hemoglobiini O2 küllastuskõveras, millel on S-kuju (joonis 3.1).