Основные радикалы аминокислот. Общие свойства и строение аминокислот. Классификация аминокислот. Аминокислотный состав белка
Аминокислоты являются компонентами молекул белков. Белки состоят из аминокислот соединенных пептидными связями.
В настоящее время насчитано 20 аминокислот, которые образуют в нашем организме более 50 тысяч различных протеинов и 20 тысяч энзимов, ферментов (сложные вещества белковой природы). Из этих 28 аминокислот любой здоровый человеческий организм может синтезировать любой необходимый белок.
Разделение аминокислот на заменимые и незаменимые.
Разделение аминокислот на заменимые и незаменимые производится по их возможности синтезироваться в организме. Для разных организмов список заменимых/незаменимых аминокислот различен. Ниже приведено разделение аминокислот характерное для человека.
Незаменимые аминокислоты.
- изолейцин;
- лейцин;
- лизин;
- метионин;
- фенлаланин;
- треонин;
- триптофан;
- валин.
Незаменимые аминокислоты не могут синтезированы, в организме человека, из других аминокислот. Эти аминокислоты обязательно должны поступать с пищей.
Условнонезаменимые аминокислоты.
- гистидин;
- цистин;
- тирозин.
Условно-незаменимые аминокислоты синтезируются или нет в организме при определенных условиях. Например, синтезирование аргинина в организме после 30 лет значительно снижается.
Заменимые аминокислоты.
- аланин
- аспарагин
- аспарагиновая кислота
- глицин.
Заменимые аминокислоты могут синтезироваться в организме (из других аминокислот, в реакциях переаминирования)
Строение аминокислот.
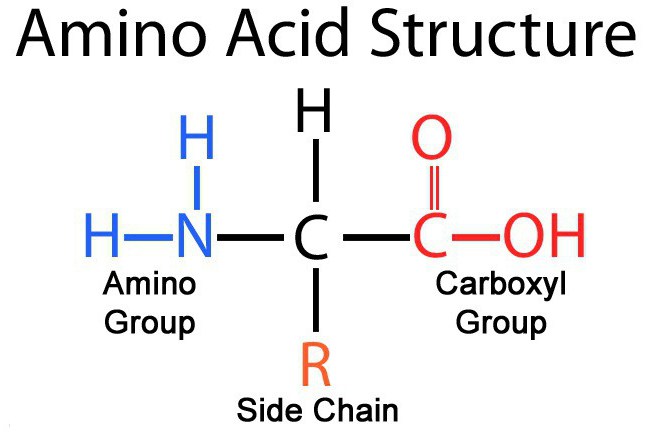
В каждой молекуле аминокислоты присутствует атом углерода, связанный с четырьмя заместителями. Один из них - атом водорода, второй - карбоксильная группа - СООН. От карбоксильной группы легко отделяется ион водорода Н + , благодаря чему в названии аминокислот и присутствует слово «кислота». Третий заместитель - аминогруппа - NH 2 . Четвертый элемент аминокислоты - группа атомов, которую в общем случае обозначают R . У всех аминокислот R-группы разные, и каждая из них играет свою, очень важную роль. R-группа также называется боковая цепь .
Общую формулу аминокислоты в нейтральной среде (ph=7) можно записать как NH 2 + CHRCOO –
Что же касается группы - СООН, то химики-органики относятся к ней с большим почтением: всем другим атомам углерода в молекуле даются обозначения в зависимости от степени их удалённости от карбоксильной группы. Ближайший к ней атом именуют альфа -атомом, второй - бета -атомом, и т.д. Атом углерода в аминокислотах, который находится ближе всех к карбоксильной группе, т. е. альфа-атом, связан также с аминогруппой, поэтому природные аминокислоты, входящие в состав белка, называют альфа-аминокислотами .
В природе встречаются также аминокислоты, в которых NH 2 -группа связана с более отдалёнными от карбоксильной группы атомами углерода. Однако для построения белков природа выбрала именно альфа-аминокислоты. Это обусловлено прежде всего тем, что только альфа-аминокислоты, соединённые в длинные цепи, способны обеспечить достаточную прочность и устойчивость структуры больших белковых молекул.
Число альфа-аминокислот, различающихся R-группой, велико. Но чаще других в белках встречается всего 20 разных аминокислот. Их можно рассматривать как алфавит «языка» белковой молекулы. Химики называют эти главные аминокислоты стандартными, основными или нормальными. Условно основные аминокислоты делят на четыре класса.
Первый класс аминокислот - аминокислоты с неполярными боковыми цепями.
Второй - аминокислоты, содержащие полярную группу.
Следующие два класса составляют аминокислоты с боковыми цепями, которые могут заряжаться положительно (они объединяются в третий класс) или отрицательно (четвёртый). Например, диссоциация карбоксильной группы даёт анион - СОО-, а протонирование атома азота - катион, например -NH 3 + . Боковые цепи аспарагиновой и глютаминовой кислот имеют ещё по одной карбоксильной группе -СООН, которая при значениях рН, характерных для живой клетки (рН = 7), расстаётся с ионом водорода (Н +) и приобретает отрицательный заряд. Боковые цепи аминокислот лизина, аргинина и гистидина заряжены положительно, поскольку у них есть атомы азота, которые, наоборот, могут ион водорода присоединять.
Изомеры аминокислот. D- и L-формы аминокислот.
Каждая альфа-аминокислота (кроме глицина) в зависимости от взаимного расположения четырёх заместителей может существовать в двух формах. Они отличаются друг от друга, как предмет от своего зеркального отражения. Такие соединения получили название хиральных (от грен. «хир» - «рука»).
Хиральные молекулы открыл в 1848 г. великий французский учёный Луи Пастер. Два типа оптических изомеров (энантиомеров ) органических молекул получили названия D-форма (от лат. dexter - «правый») и L-форма (от лат. laevus - «левый»). Кстати, одно из названий других хиральных молекул - глюкозы и фруктозы - декстроза и левулоза.
В состав всех изученных в настоящее время белков входят только аминокислоты L-ряда, у которых, если рассматривать хиральный атом со стороны атома H, группы NH3+, COO- и радикал -R расположены по часовой стрелке. Необходимость при построении биологически значимой полимерной молекулы строить ее из строго определенного энантиомера очевидна - из рацемической смеси двух энантиомеров получилась бы невообразимо сложная смесь диастереоизомеров.
В состав белков входят только L-аминокислоты.
Следует отметить, что D-аминокислоты достаточно широко распространены в живой природе и, более того, входят в состав биологически значимых олигопептидов.
Для нормальной жизнедеятельности организм нуждается в полном наборе из 20 основных альфа-L-аминокислот.
Аминокислоты – производные жирных или ароматических жирных кислот, которые содержат аминную или карбоксильную группировку, которые различаются только радикалами.
Все аминокислоты содержат: 1) карбоксильную группу (–СООН), 2) аминогруппу (–NH 2), 3) радикал или R-группу (остальная часть молекулы). Строение радикала у разных видов аминокислот - различное. В зависимости от количества аминогрупп и карбоксильных групп, входящих в состав аминокислот, различают: нейтральные аминокислоты, имеющие одну карбоксильную группу и одну аминогруппу; основные аминокислоты, имеющие более одной аминогруппы; кислые аминокислоты, имеющие более одной карбоксильной группы.
Аминокислоты являются амфотерными соединениями , так как в растворе они могут выступать как в роли кислот, так и оснований. В водных растворах аминокислоты существуют в разных ионных формах.
Аминокислотный состав белка:
Белки - непериодические полимеры, мономерами которых являются α-аминокислоты. Обычно в качестве мономеров белков называют 20 видов α-аминокислот, хотя в клетках и тканях их обнаружено свыше 170.
В зависимости от того, могут ли аминокислоты синтезироваться в организме человека и других животных, различают: заменимые аминокислоты - могут синтезироваться; незаменимые аминокислоты - не могут синтезироваться. Незаменимые аминокислоты должны поступать в организм вместе с пищей. Растения синтезируют все виды аминокислот.
В зависимости от аминокислотного состава, белки бывают: полноценными - содержат весь набор аминокислот; неполноценными - какие-то аминокислоты в их составе отсутствуют. Если белки состоят только из аминокислот, их называют простыми. Если белки содержат помимо аминокислот еще и неаминокислотный компонент (простетическую группу), их называют сложными. Простетическая группа может быть представлена металлами (металлопротеины), углеводами (гликопротеины), липидами (липопротеины), нуклеиновыми кислотами (нуклеопротеины).
Классификация аминокислот:
Моноаминомонокарбоновые
R-CH 3 аланин
R-CH 2 OH серин
R-SH-CH 2 цистеин
R-CH 3 -S-CH 2 -CH 2 метионин
Диаминомонокарбоновые
CH 2 -NH 2 -CH 2 -CH 2 ливин
Моноаминодикарбоновые
COOH-CH 2 аспарагиновая аминокислота
COOH-CH 2 -CH 2 глутаминовая аминокислота
Диаминодикарбоновые
Цистин (два цистеина)
Циклические аминокислоты (фенилаланин, тирозин, триптофан)
Незаменимые аминокислоты – не способны синтезироваться в организме человека и животных (триптофан, фенилаланин, лизин, валин, треонин, лейцин, изолейцин, метионин)
Среди огромного разнообразия природных веществ аминокислоты занимают особое место. Оно объясняется их исключительным значением как в биологии, так и в органической химии. Дело в том, что из аминокислот состоят молекулы простых и сложных белков, являющихся основой всех без исключения форм жизни на Земле. Именно по этой причине наука уделяет серьезное внимание изучению таких вопросов, как строение аминокислот, их свойства, получение и применение. Велико значение этих соединений и в медицине, где они применяются в качестве лечебных препаратов. Для тех людей, кто серьезно занимается собственным здоровьем и ведет активный способ жизни, одной из форм пищи (так называемое спортивное питание). Некоторые их виды применяются в химии органического синтеза в качестве исходного сырья при производстве синтетических волокон - энанта и капрона. Как видим, аминокарбоновые кислоты играют очень важную роль как в природе, так и в жизни человеческого общества, поэтому познакомимся с ними более подробно.
Особенности строения аминокислот
Соединения этого класса относятся к амфотерным органическим веществам, то есть содержат две функциональные группы, а, значит, проявляют двойственные свойства. В частности, в составе молекул присутствуют углеводородные радикалы, соединенные с аминогруппами NH 2 и карбоксильными группами СООН. В химических реакциях с другими веществами аминокислоты выступают то как основания, то как кислоты. Изомерия таких соединений проявляется вследствие изменения или пространственной конфигурации углеродного скелета, или положения аминогруппы, а классификация аминокислот определяется на основании особенностей строения и свойств углеводородного радикала. Он может иметь форму неразветвленной или разветвленной цепи, а также содержать циклические структуры.
Оптическая активность аминокарбоновых кислот
Все мономеры полипептидов, а их 20 видов, представленных в организмах растений, животных и человека, относятся к L-аминокислотам. Большинство из них содержат ассиметричный атом карбона, поворачивающий при вращении поляризованный пучок света влево. Два мономера: изолейцин и треонин - имеют два таких атома углерода, а аминоуксусная кислота (глицин) - ни одного. Классификация аминокислот по оптической активности широко применяется в биохимии и молекулярной биологии при изучении процесса трансляции в биосинтезе белка. Интересно, что D-формы аминокислот никогда не входят в состав полипептидных цепей белков, зато присутствуют в бактериальных оболочках и в продуктах метаболизма грибов-актиномицетов, то есть, по сути, их обнаруживают в природных антибиотиках, например в грамицидине. В биохимии широко известны вещества с D-формой пространственного строения, как цитруллин, гомосерин, орнитин, играющие важную роль в реакциях клеточного метаболизма.
Что такое цвиттер-ионы?
Еще раз напомним, что мономеры белков имеют в своем составе функциональные группы аминов и карбоновых кислот. Частицы -NH 2 и СООН взаимодействуют между собой внутри молекулы, что приводит к появлению внутренней соли, называемой биполярным ионом (цвиттер-ионом). Такое внутреннее строение аминокислот объясняет их высокую способность к взаимодействию с полярными растворителями, например с водой. Присутствие же в растворах заряженных частиц обуславливает их электропроводность.
Что представляют собой α-аминокислоты
Если аминная группа расположена в молекуле при первом атоме карбона, считая от места нахождения карбоксила, такую аминокислоту относят к классу α-аминокислот. Они занимают ведущее место в классификации, потому что именно из этих мономеров и построены все биологически активные белковые молекулы, например такие, как ферменты, гемоглобин, актин, коллаген и т. д. Строение аминокислот этого класса можно рассмотреть на примере глицина, того самого, который широко применяют в неврологической практике, как успокоительный препарат при лечении легких форм депрессии и неврастении.

Международное название этой аминокислоты - α-аминоуксусная, она имеет оптическую L-форму и является протеиногенной, то есть участвует в процессе трансляции и входит в состав белковых макромолекул.
Роль белков и их мономеров в обмене веществ
Невозможно себе представить нормальную жизнедеятельность организма млекопитающих, в том числе и человека, без гормонов, состоящих из белковых молекул. аминокислот, входящих в их состав, подтверждает их принадлежность к α-формам. Например, трийодтиронин и тироксин вырабатываются щитовидной железой. Они регулируют обмен веществ и синтезируются в ее клетках из α-аминокислоты тирозина. В простых и сложных белках находятся как 20 основных мономеров, так и их производные. В протромбине, который регулирует свертываемость крови, присутствует карбоксиглутаминовая кислота, в миозине (мышечном протеине) обнаруживается метиллизин, в ферменте пероксидазе - селеноцистеин.
Пищевая ценность белков и их мономеров
Рассматривая строение аминокислот и их классификацию, остановимся на градации, основанной на способности или невозможности белковых мономеров синтезироваться в клетках. Аланин, пролин, тирозин и другие соединения образуются в реакциях пластического обмена, а триптофан и еще семь других аминокислот должны попасть в наш организм только с пищевыми продуктами.
Одним из показателей правильного и сбалансированного питания является уровень потребления человеком белковой пищи. Он должен составлять не менее четвертой части от всего количества еды, поступившей в организм за сутки. Особенно важно, чтобы протеины содержали в своем составе валин, изолейцин и другие незаменимые аминокислоты. В этом случае белки будут называться полноценными. Они поступают в организм человека из растительной пищи или продуктов, содержащих грибы.
Сами же незаменимые мономеры белков не могут синтезироваться в клетках млекопитающих. Если рассматривать строение молекул аминокислот, которые являются незаменимыми, можно убедиться, что они принадлежат к различным классам. Так, валин и лейцин относятся к алифатическому ряду, триптофан - к ароматическим аминокислотам, а треонин - к гидроксиаминокислотам.