Сходные функции жиров и углеводов. Биохимия: предмет, задачи. Липиды, углеводы, белки: структура, химические и физико-химические свойства, классификация, биологическая роль
Белки́ (протеи́ны, полипепти́ды) – высокомолекулярные органические вещества, состоящие из соединённых в цепочку пептидной связью альфааминокислот. В живых организмах аминокислотный состав белков определяется генетическим кодом, при синтезе в большинстве случаев используется 20 стандартных аминокислот. Множество их комбинаций дают большое разнообразие свойств молекул белков. Кроме того, аминокислоты в составе белка часто подвергаются посттрансляционным модификациям, которые могут возникать и до того, как белок начинает выполнять свою функцию, и во время его «работы» в клетке. Часто в живых организмах несколько молекул белков образуют сложные комплексы, например, фотосинтетический комплекс. Белки, или протеины (от греч. «протос» – «первый»), – это природные органические соединения, которые обеспечивают все жизненные процессы любого организма.
Впервые белок был выделен (в виде клейковины) в 1728 г. итальянцем Якопо Бартоломео Беккари (1682-1766) из пшеничной муки. Это событие принято считать рождением химии белка. Определение аминокислотной последовательности первого белка – инсулина – методом секвенирования белков принесло Фредерику Сенгеру Нобелевскую премию по химии в 1958 году. Первые трёхмерные структуры белков гемоглобина и миоглобина были получены методом дифракции рентгеновских лучей, соответственно, Максом Перуцем и Джоном Кендрю в 1958 году, за что в 1962 году они получили Нобелевскую премию по химии.
1.1 Уровни организации
Кроме последовательности аминокислот полипептида (первичной структуры), крайне важна третичная структура белка, которая формируется в процессе фолдинга (от англ. folding, «сворачивание»). Третичная структура формируется в результате взаимодействия структур более низких уровней. Выделяют четыре уровня структуры белка (см. рисунок 1).
Рисунок 1 – Уровни структур белка
Первичная структура – последовательность аминокислот в полипептидной цепи. Важными особенностями первичной структуры являются консервативные мотивы – сочетания аминокислот, играющих ключевую роль в функциях белка. Консервативные мотивы сохраняются в процессе эволюции видов, по ним часто удаётся предсказать функцию неизвестного белка.
Первичная структура – число и последовательность аминокислот, соединенных друг с другом пептидными связями в полипептидной цепи
Вторичная структура – локальное упорядочивание фрагмента полипептидной цепи, стабилизированное водородными связями. Ниже приведены самые распространённые типы вторичной структуры белков:
– α-спирали – плотные витки вокруг длинной оси молекулы, один виток составляют 3,6 аминокислотных остатка, и шаг спирали составляет 0,54 нм (так что на один аминокислотный остаток приходится 0,15 нм), спираль стабилизирована водородными связями между H и O пептидных групп, отстоящих друг от друга на 4 звена. Спираль построена исключительно из одного типа стереоизомеров аминокислот (L). Хотя она может быть как левозакрученной, так и правозакрученной, в белках преобладает правозакрученная. Спираль нарушают электростатические взаимодействия глутаминовой кислоты, лизина, аргинина. Расположенные близко друг к другу остатки аспарагина, серина, треонина и лейцина могут стерически мешать образованию спирали, остатки пролина вызывает изгиб цепи и также нарушает α-спирали;
– β-листы (складчатые слои) – несколько зигзагообразных полипептидных цепей, в которых водородные связи образуются между относительно удалёнными друг от друга (0,347 нм на аминокислотный остаток) в первичной структуре аминокислотами или разными цепями белка, а не близко расположенными, как имеет место в α-спирали. Эти цепи обычно направлены N-концами в противоположные стороны (антипараллельная ориентация). Для образования β-листов важны небольшие размеры боковых групп аминокислот, преобладают обычно глицин и аланин;
– π-спирали;
– 310-спирали;
– неупорядоченные фрагменты.
Для всякого белка характерна помимо первичной еще и определенная вторичная структура. Обычно белковая молекула напоминает растянутую пружину.
Третичная структура – пространственное строение полипептидной цепи (набор пространственных координат составляющих белок атомов). Структурно состоит из элементов вторичной структуры, стабилизированных различными типами взаимодействий, в которых гидрофобные взаимодействия играют важнейшую роль. В стабилизации третичной структуры принимают участие:
– ковалентные связи (между двумя остатками цистеина – дисульфидные мостики);
– ионные связи между противоположно заряженными боковыми группами аминокислотных остатков;
– водородные связи;
– гидрофильно-гидрофобные взаимодействия. При взаимодействии с окружающими молекулами воды белковая молекула «стремится» свернуться так, чтобы неполярные боковые группы аминокислот оказались изолированы от водного раствора; на поверхности молекулы оказываются полярные гидрофильные боковые группы.
Полипептидные цепи свернуты особым образом в компактную глобулу. Способ свертывания полипептидных цепей глобулярных белков называется третичной структурой.
Четвертичная структура (или субъединичная, доменная) – взаимное расположение нескольких полипептидных цепей в составе единого белкового комплекса. Белковые молекулы, входящие в состав белка с четвертичной структурой, образуются на рибосомах по отдельности и лишь после окончания синтеза образуют общую надмолекулярную структуру. В состав белка с четвертичной структурой могут входить как идентичные, так и различающиеся полипептидные цепочки. В стабилизации четвертичной структуры принимают участие те же типы взаимодействий, что и в стабилизации третичной. Надмолекулярные белковые комплексы могут состоять из десятков молекул. Многие белки с особо сложным строением состоят из нескольких полипептидных цепей. Способ совместной упаковки и укладки этих полипептидных цепей называют четвертичной структурой белка.
1.2 Физические свойства
Белки – амфотерные электролиты. При определенном значении pH среды число положительных и отрицательных зарядов в молекуле белка одинаково. Белки имею разнообразное строение. Есть белки нерастворимые в воде, есть белки легко растворимые в воде. Есть белки, имеющие вид нитей, достигающих в длину сотен нанометров; есть белки, имеющие форму шариков диаметром всего 5-7 нм. Они имеют большую молекулярную массу (104-107). Образуют коллоидные растворы, из которых выпадают при увеличении концентрации неорганических солей, добавлении солей тяжелых металлов, органических растворителей или при нагревании (денатурация).
1.3 Денатурация
Как правило, белки сохраняют структуру и, следовательно, физико-химические свойства, например, растворимость в условиях, таких как температура и pH, к которым приспособлен данный организм. Изменение этих условий, например, нагревание или обработка белка кислотой или щёлочью, приводит к потере четвертичной, третичной и вторичной структур белка. Потеря белком (или другим биополимером) структуры называется денатурацией. Денатурация может быть полной или частичной, обратимой или необратимой. Самый известный случай необратимой денатурации белка в быту – это приготовление куриного яйца, когда под воздействием высокой температуры растворимый в воде прозрачный белок овальбумин становится плотным, нерастворимым и непрозрачным. Денатурация в некоторых случаях обратима, как в случае осаждения (преципитации) водорастворимых белков с помощью солей аммония, и используется как способ их очистки. Денатурация – потеря белками их естественных свойств вследствие нарушения пространственной структуры их молекул.
1.4 Биуретовая реакция
Биуретовая реакция – качественная на все без исключения белки, а также продукты их неполного гидролиза, которые содержат не менее двух пептидных связей. Биуретовая реакция обусловлена присутствием в белках пептидных связей, которые в щелочной среде образуют с сульфатом меди (ІІ) окрашенные медные солеобразные комплексы. Биуретовую реакцию дают также некоторые небелковые вещества, например биурет (NH2-CO-NH-CONH2), оксамид (NH2CO-CO-NH2), ряд аминокислот (гистидин, серин, треонин, аспарагин) (см. рисунок 2).
Рисунок 2 – Биуретовая реакция
1.5 Функции белков
Так же как и другие биологические макромолекулы (полисахариды, липиды) и нуклеиновые кислоты, белки – необходимые компоненты всех живых организмов, они участвуют в большинстве жизненных процессов клетки. Белки осуществляют обмен веществ и энергетические превращения. Белки входят в состав клеточных структур – органелл, секретируются во внеклеточное пространство для обмена сигналами между клетками, гидролиза пищи и образования межклеточного вещества.
Следует отметить, что классификация белков по их функции достаточно условна, потому что уэукариот один и тот же белок может выполнять несколько функций. Хорошо изученным примером такой многофункциональности служит лизил-тРНК-синтетаза – фермент из класса аминоацил-тРНКсинтетаз, который не только присоединяет лизин к тРНК, но и регулирует транскрипцию нескольких генов. Многие функции белки выполняют благодаря своей ферментативной активности. Так, ферментами являются двигательный белок миозин, регуляторные белки протеинкиназы, транспортный белок натрий-калиеваяаденозинтрифосфатаза и др.
Каталитическая функция. Наиболее хорошо известная роль белков в организме – катализ различных химических реакций. Ферменты – группа белков, обладающая специфическими каталитическими свойствами, то есть каждый фермент катализирует одну или несколько сходных реакций. Ферменты катализируют реакции расщепления сложных молекул (катаболизм) и их синтеза (анаболизм), а также репликации и репарации ДНК и матричного синтеза РНК. Известно несколько тысяч ферментов; среди них такие как, например, пепсин расщепляют белки в процессе пищеварения. В процесс посттрансляционной модификации некоторые ферменты добавляют или удаляют химические группы на других белках. Известно около 4000 реакций, катализируемых белками. Ускорение реакции в результате ферментативного катализа иногда огромно: например, реакция, катализируемая ферментом оротат-карбоксилазой, протекает в 1017 раз быстрее некатализируемой (78 миллионов лет без фермента, 18 миллисекунд с участием фермента). Молекулы, которые присоединяются к ферменту и изменяются в результате реакции, называются субстратами.
Хотя ферменты обычно состоят из сотен аминокислот, только небольшая часть из них взаимодействует с субстратом, и ещё меньшее количество – в среднем 3-4 аминокислоты, часто расположенные далеко друг от друга в первичной аминокислотной последовательности – напрямую участвуют в катализе. Часть фермента, которая присоединяет субстрат и содержит каталитические аминокислоты, называется активным центром фермента.
Транспортная функция. Растворимые белки, участвующие в транспорте малых молекул, должны иметь высокое сродство (аффинность) к субстрату, когда он присутствует в высокой концентрации, и легко его высвобождать в местах низкой концентрации субстрата. Примером транспортных белков можно назвать гемоглобин, который переносит кислород из лёгких к остальным тканям и углекислый газ от тканей к лёгким, а также гомологичные ему белки, найденные во всех царствах живых организмов.
Некоторые мембранные белки участвуют в транспорте малых молекул через мембрану клетки, изменяя её проницаемость. Липидный компонент мембраны водонепроницаем (гидрофобен), что предотвращает диффузию полярных или заряженных (ионы) молекул. Мембранные транспортные белки принято подразделять на белки-каналы и белки-переносчики. Белкиканалы содержат внутренние заполненные водой поры, которые позволяют ионам (через ионные каналы) или молекулам воды (через белки-аквапорины) перемещаться через мембрану. Многие ионные каналы специализируются на транспорте только одного иона; так, калиевые и натриевые каналы часто различают эти сходные ионы и пропускают только один из них. Белкипереносчики связывают, подобно ферментам, каждую переносимую молекулу или ион и, в отличие от каналов, могут осуществлять активный транспорт с использованием энергии АТФ. «Электростанция клетки» – АТФсинтаза, которая осуществляет синтез АТФ за счёт протонного градиента, также может быть отнесена к мембранным транспортным белкам.
Защитная функция. Существуют несколько видов защитных функций белков:
– физическая защита. В ней принимает участие коллаген – белок, образующий основу межклеточного вещества соединительных тканей (в том числе костей, хряща, сухожилий и глубоких слоёв кожи (дермы)); кератин, составляющий основу роговых щитков, волос, перьев, рогов и др. производных эпидермиса. Обычно такие белки рассматривают как белки со структурной функцией. Примерами этой группы белков служат фибриногены и тромбины, участвующие в свёртывании кров;
– химическая защита. Связывание токсинов белковыми молекулами может обеспечивать их детоксикацию. Особенно важную роль в детоксикации у человека играют ферменты печени, расщепляющие яды или переводящие их в растворимую форму, что способствует их быстрому выведению из организма;
– иммунная защита. Белки, входящие в состав крови и других биологических жидкостей, участвуют в защитном ответе организма, как на повреждение, так и на атаку патогенов. Белки системы комплемента и антитела (иммуноглобулины) относятся к белкам второй группы; они нейтрализуют бактерии, вирусы или чужеродные белки. Антитела, входящие в состав адаптативной иммунной системы, присоединяются к чужеродным для данного организма веществам, антигенам, и тем самым нейтрализуют их, направляя к местам уничтожения. Антитела могут секретироваться в межклеточное пространство или закрепляться в мембранах специализированных В-лимфоцитов, которые называются плазмоцитами. В то время как ферменты имеют ограниченное сродство к субстрату, поскольку слишком сильное присоединение к субстрату может мешать протеканию катализируемой реакции, стойкость присоединения антител к антигену ничем не ограничена.
Структурная функция. Структурные белки цитоскелета, как своего рода арматура, придают форму клеткам и многим органоидам и участвуют в изменении формы клеток. Большинство структурных белков являются филаментозными белками: например, мономеры актина и тубулина – это глобулярные, растворимые белки, но после полимеризации они формируют длинные нити, из которых состоит цитоскелет, позволяющий клетке поддерживать форму. Коллаген и эластин – основные компоненты межклеточного вещества соединительной ткани (например, хряща), а из другого структурного белка кератина состоят волосы, ногти, перья птиц и некоторые раковины.
Гормональная (сигнальная) функция. Сигнальная функция белков – способность белков служить сигнальными веществами, передавая сигналы между клетками, тканями, о́рганами и разными организмами. Часто сигнальную функцию объединяют с регуляторной, так как многие внутриклеточные регуляторные белки тоже осуществляют передачу сигналов. Сигнальную функцию выполняют белки-гормоны, цитокины, факторы роста и др.
Гормоны переносятся кровью. Большинство гормонов животных – это белки или пептиды. Связывание гормона с рецептором является сигналом, запускающим в клетке ответную реакцию. Гормоны регулируют концентрации веществ в крови и клетках, рост, размножение и другие процессы. Примером таких белков служит инсулин, который регулирует концентрацию глюкозы в крови.
Клетки взаимодействуют друг с другом с помощью сигнальных белков, передаваемых через межклеточное вещество. К таким белкам относятся, например, цитокины и факторы роста.
Цитокины – небольшие пептидные информационные молекулы. Они регулируют взаимодействия между клетками, определяют их выживаемость, стимулируют или подавляют рост, дифференцировку, функциональную активность и апоптоз, обеспечивают согласованность действий иммунной, эндокринной и нервной систем. Примером цитокинов может служить фактор некроза опухоли, который передаёт сигналы воспаления между клетками организма.
Питательная функция. К таким белкам относятся так называемые резервные белки, которые запасаются в качестве источника энергии и вещества в семенах растений и яйцеклетках животных; белки третичных оболочек яйца (овальбумины) и основной белок молока (казеин) также выполняют, главным образом, питательную функцию. Ряд других белков используется в организме в качестве источника аминокислот, которые в свою очередь являются предшественниками биологически активных веществ, регулирующих процессы метаболизма.
Моторная (двигательная) функция. Целый класс моторных белков обеспечивает движения организма, например, сокращение мышц, в том числе локомоцию (миозин), перемещение клеток внутри организма (например, амебоидное движение лейкоцитов), движение ресничек и жгутиков, а также активный и направленный внутриклеточный транспорт (кинезин, динеин). Динеины и кинезины проводят транспортировку молекул вдоль микротрубочек с использованием гидролиза АТФ в качестве источника энергии. Динеины переносят молекулы и органоиды из периферических частей клетки по направлению к центросоме, кинезины – в противоположном направлении. Динеины также отвечают за движение ресничек и жгутиков эукариот. Цитоплазматические варианты миозина могут принимать участие в транспорте молекул и органоидов по микрофиламентам.
1.6 Структура белка
Молекулы белков представляют собой линейные полимеры, состоящие из α-L-аминокислот (которые являются мономерами) и, в некоторых случаях, из модифицированных основных аминокислот (правда, модификации происходят уже после синтеза белка на рибосоме). Для обозначения аминокислот в научной литературе используются одно- или трёхбуквенные сокращения. Хотя на первый взгляд может показаться, что использование в большинстве белков «всего» 20 видов аминокислот ограничивает разнообразие белковых структур, на самом деле количество вариантов трудно переоценить: для цепочки всего из 5 аминокислот оно составляет уже более 3 миллионов, а цепочка из 100 аминокислот (небольшой белок) может быть представлена более чем в 10^130 вариантах. Белки длиной от 2 до нескольких десятков аминокислотных остатков часто называют пептидами, при большей степени полимеризации – белками, хотя это деление весьма условно. При образовании белка в результате взаимодействия αаминогруппы (-NH2) одной аминокислоты с α-карбоксильной группой (COOH) другой аминокислоты образуются пептидные связи. Концы белка называют C- и N-концом (в зависимости от того, какая из групп концевой аминокислоты свободна: – COOH или – NH2, соответственно). При синтезе белка на рибосоме новые аминокислоты присоединяются к C-концу, поэтому название пептида или белка даётся путём перечисления аминокислотных остатков начиная с N-конца.
Последовательность аминокислот в белке соответствует информации, содержащейся в гене данного белка. Эта информация представлена в виде последовательности нуклеотидов, причём одной аминокислоте соответствует в ДНК последовательность из трёх нуклеотидов – так называемый триплет или кодон. То, какая аминокислота соответствует данному кодону в мРНК, определяется генетическим кодом, который может несколько отличаться у разных организмов. Синтез белков на рибосомах происходит, как правило, из 20 аминокислот, называемых стандартными. Триплетов, которыми закодированы аминокислоты в ДНК, у разных организмов от 61 до 63 (то есть из числа возможных триплетов (4³ = 64) вычтено число стоп-кодонов (13). Поэтому появляется возможность, что большинство аминокислот может быть закодировано разными триплетами. То есть, генетический код может являться избыточным или, иначе, вырожденным. Это было окончательно доказано в эксперименте при анализе мутаций. Генетический код, кодирующий различные аминокислоты, имеет разную степень вырожденности (кодируются от 1 до 6 кодонами), это зависит от частоты встречаемости данной аминокислоты в белках, за исключением аргинина. Часто основание в третьем положении оказывается несущественным для специфичности, то есть одна аминокислота может быть представлена четырьмя кодонами, различающимися только третьим основанием. Иногда различие состоит в предпочтении пурина пиримидину. Это называют вырожденностью третьего основания.
Такой трёхкодонный код сложился эволюционно рано. Но существование различий в некоторых организмах, появившихся на разных эволюционных стадиях, указывает на то, что он был не всегда таким. Гомологичные белки (предположительно имеющие общее эволюционное происхождение и нередко выполняющие одну и ту же функцию), например, гемоглобины разных организмов, имеют во многих местах цепи идентичные, консервативные остатки аминокислот. В других местах находятся различные аминокислотные остатки, называемые вариабельными. По степени гомологии (сходства аминокислотной последовательности) возможна оценка эволюционного расстояния между таксонами, к которым принадлежат сравниваемые организмы.
1. Структура белков.
2. Стрктура углеводов.
3. Структура липидов.
1. Структура белков.
Белки - органические соединения, состоящие из аминокислот, связанных между собой пептидной связью. Аминокислоты - кабоновые кислоты, содержащие аминную и карбоксильную групп, находящиеся у одного и того же углеродного атома.В состав белков входят 22 аминокислоты, которые по свойствам боковой цепи делят на 4 группы: гидрофобные,
гидрофильные неионные, гидрофильные с отрицательным зарядом и гидрофильные с положительным зарядом.
I. гидрофобные аминокислоты.



Глицин. Аланин Валин Лейцин

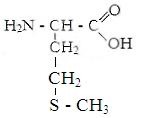


Изолейцин Метионин Цистин Фенилаланин

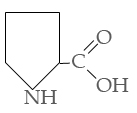
Триптофан Пролин
II.гидрофильные неионные аминокислоты.

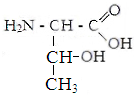


Серин Треонин Аспарагин Глутамин

Оксипролин
III. гидрофильные аминокислоты с состоящая из остатковα-Д- глюкопиранозы.




Аспарагиновая Глутаминовая Цистеин Тирозин
кислота кислота
IV. гидрофильные аминокислоты с положительно заряженным радикалом.
![]()
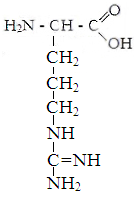

Лизин Аргинин Гистидин
Физико-химические свойства белков.
Находящиеся на поверхности белковой молекулы радикалы аспарагиной, глутаминовой кислот, тирозина и цистина, диссоциируя на ион водорода, придают ей отрицательный заряд. Радикалы лизина, аргинина и гистидина, диссоциирующие на ион гидроксила, наоборот придают молекуле белка положительный заряд. У большинства белков отрицательных зарядов на молекуле больше. Благодаря заряду они отталкиваются друг от друга и не слипаются в конгломераты. Слипанию препятствует также наличие вокруг молекулы белка водной оболочки.
В слабокислой среде тормозится диссоциация части отрицательно заряженных радикалов аминокислот, количество положительных и отрицательных зарядов сравнивается, молекулы белков становятся электронейтральными и слипаются в конгломераты и выпадабт в осадок. Слипанию их способствует и нагревание, приводящее к потере водной оболочки. Значение рН, при котором молекула белка становится электронейтральной, называется изоэлектрической точкой белка.
Классификация белков . Белки делятся на простые, состоящие только из аминокислот (альбумины, глобулины, проламины, глютелины, протамины, гистоны и пртеиноиды) и сложные, состоящие из белковой и небелковой части. У хромопротеинов небелковой частью может быть окрашенное вещество (например гем у гемоглобина), у липопротеинов - липидная часть, у гликопротеинов - гетерополисахарид, у фосфопротеинов - фосфорная кислота, у нуклеопротеинов - ДНК или РНК. Нуклеиновые кислоты состоят из нуклеотидов. Последние состоят из азотистого основания, пуринового (аденин и гуанин) или пиримидинового [цитозин, тимин (у ДНК) или урацил (у РНК)], дезоксирибозы (у ДНК) или рибозы (у РНК) и фосфорной кислоты. Сборка нуклеотида из аденина, дезоксирибозы и фосфорной кислоы показана ниже.

Молекула ДНК состоит из четырех разновидностей нуклеотидов6 дезоксиаденозинмонофосфата (дАМФ), дезоксигуанозинмонофосфата (дГМФ), дезоксицитидинмонофосфата (дЦМФ) и дезокситимидинмонофосфата (дТМФ). Нуклеотиды связаны между собой посредством фосфодиэфирной связи межде вторым углеродным атомом дезоксирибозы и фосфорной кислотой соседнего нуклеотида, как показано в фформуле фрагмента ДНК, состоящего из дАМФ, дГМФ, дЦМФ и дТМФ.

Структура и биологическая роль углеводов .
Углеводы – полиоксикарбонильные соединения, являющиеся по своей природе альдо- или кетоспиртами или их производными. По химической структуре различают: 1) моносахариды (рибоза, дезоксирибоза, глюкоза, галактоза, фруктоза и др.); 2) олигосхариды (сахароза, мальтоза, лактоза и др.); 3) гомопосахариды (гликоген, крахмал, клетчатка и др.) и гетероплсахариды (гиалуроновая, хондроитинсерная кислоты, кератансульфат и др.).
1. Моносахариды.

Превращение Д-дезоксирибозы в α-Д- дезоксирибофуранозу.
Превращение
Д-глюкозы в α-Д-
глюкопиранозу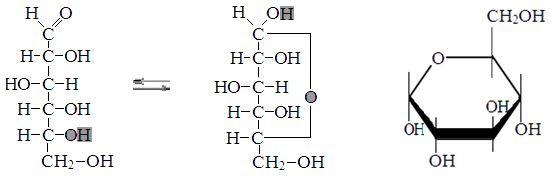
Превращение Д-глюкозы в α-Д- глюкопиранозу

Превращение Д-глюкозы в β-Д- глюкопиранозу

Превращение Д-глюкозы в β-Д- глюкопиранозу

Превращение Д-фруктозыозы в β-Д- фруктофуранозу
2. Олигисахариды

Мальтоза
Лактоза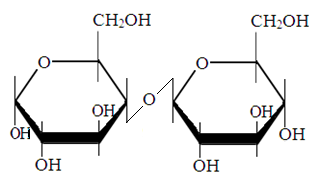

Сахароза.
3. Гомоолисахариды

Клетчатка, состоящая из остатков β-Д- глюкопиранозы.

Крахмал, состоящий из остатков α-Д- глюкопиранозы.
![]()

Гиалуроновая и хондроитинсерная кислоты, компоненты гетерополисахаридов.
Биологическая роль углеводов.
Углеводы являются основным энергетическим материалом в организме. При окислении 1 г глюкозы высвобождается 4,1 ккал. Углеводы необходимы для окисления липидов. Гликоген и крахмал являются запасным энергетическим материалом.
Рибоза входит в состав нуклеотидов РНК, АТФ, НАД, ФАД, витамина В 12 и других веществ, а дезоксирибоза - в состав ДНК.
Углеводы являются источником пластического материала для биосинтеза триглицеридов, холестерина, заменимых аминокислот и других веществ.
Гетерополисахариды являются небелковой частью гликопротеинов, участвующих в многих процессах: формировании соединительной ткани, развитии иммунной реакции, свертывании крови и др.
Лекция №2
Витамины: номенклатура, классификация, биологическая роль .
1. Классификация витаминов.
2. Гиповитаминозы
3. Жирорастворимые витамины.
4. Водорастворимые витамины.
5. Витаминоподобные вещества.
Витамины – низкомолекулярные органические соединения, необходимые для жизнедеятельности организма, но не синтезирующиеся в нем или синтезирующиеся в недостаточных количествах и поэтому поступающие в малых количествах с пищей или от микроорганизмов, базирующихся в органах пищеварительной системы.
Еще в 1880 г. Н.И. Лунин доказал, что, кроме белков, углеводов, липидов, воды и минеральных веществ, организму необходимы дополнительные вещества. К. Функ выделил из рисовых отрубей одно из таких веществ, витамин В 1 , содержащий аминогруппу. Поэтому он предложил называть эти вещества витаминами (vita– жизнь). Потом оказалось, что не все витамины содержат аминогруппу.
Классификация витаминов . Из делят на 2 группы: жиро- и водорастворимые. У каждого витамина имеется 3 названия: буквенное, клиническое и химическое. Существуют еще ряд витаминоподобных веществ, не подходящих по какому-то из признаков к понятию «витамины». При отсутствии поступления витаминов развиваются авитаминозы, при сниженном поступлении – гиповитаминозы. При чрезмерном поступлении некоторых витамино (А, Д и др.) возможны гипервитаминозы.
Причины гиповитаминозов .
А. Экзогенныегиповитаминозы развиваются при:
1) отсутствии определенных продуктов питания: свежих овощей, мяса, жиров и т.д.;
2) потери витаминов при хранении, обработке продуктов, приготовлении пищи и т.д.
Б. Эндогенныегиповитаминозы развиваются при:
1) недостаточно эффективном поступлении витаминов из кишечника при воспалении его, а также из-за нарушения поступление в него желчных кислот при патологии печени и перекрытии желчевыводящих путей, приводящего к снижению гидролиза и всасывания липидов с растворенными в них витаминами;
2) гибели микроорганизмов пищеварительного тракта при кормлении высоко концентратными кормами, лечении антибиотиками и от других причин;
3) нарушении транспорта витаминов кровью при снижении содержания в ней некоторых белков;
4) нарушении превращения провитаминов в витамины при недостаточном ультрафиолетовом облучении, отсутствии ферментов, осуществляющих это превращение;
5) поступлении в организм антивитаминов.
Жирорастворимые витамины.
Витамин А (антиксерофтальмический); ретинол.

Биологическая роль витамина А:
1. Является компонентом биологических мембран, способствует биосинтезу их углевод-белковых комплексов, стабилизирует структуру клеток, особенно эпителиальных, поддерживает барьерную функцию их.
2. Обладает антиоксидантными свойствами.
3. Регулирует рост, дифференциацию тканей, развитие организма в целом, особенно организма молодняка.
4. Поддерживает функцию иммунной системы.
5. Входит в состав родопсина (зрительного пурпура) колбочек и палочек сетчатки глаза. Под действием света родопсин расщепляется на белок опсин и ретинальдегид (производное витамина А), что приводит к генерации светового импульса.
Суточная потребность (для человека) – 2,3 мг.
Продукты, богатые витамином А : рыбий жир, печень, молочные продукты, яичный желток и др. Каротин (предшественник витамина А, состоящий из двух остатков его) содержится в моркови и других коренеплодах, зеленых листьях, сочных кормах и т.д. В организме животного каротин расщепляется до витамина А каротиназой.
Проявления гиповитаминоза А :
Первые проявления его – ухудшение зрения в темноте (куриная слепота). Замедляется рост и развитие организма. Снижается иммунитет. Из-за нарушения барьерной функции эпителия поражаются слезные протоки, слеза не проходит к роговице глаза и она размягчается (ксерофтальмия). Поражается также эпителий дыхательных, мочеполовых путей, кожи и других структур, что приводит к их воспалению.
Витамины группы Д (антирахитические); кальциферолы (эргокальциферол и холекальциферол) Предшественником первого из них является эргостерин, который после облучения ультрафиолетовыми лучами превращается в эргокальциферол (витамин Д 2). В коже содержится второй провитамин Д, который также после облучения ультрафиолетовыми лучами превращается в холекальциферол (витамин Д 3). Обо витамина поступают в печень, где у них 25-й атом углерода подвергается гидроксилированию под действием 25-гидроксилазы, а затем – в почки. В последней под действием 1-гидроксилазы гидроксилируется еще и первый атом углерода и образуются 1,25-дигидрокальциферолы, обладающие биологической активностью. При недостаточной активности 25- и 1- гидроксилазы развивается Д-резистентный рахит.
Суточная потребность (у человека)- 10-25 мкг.
Биологическая роль витаминов Д:
1) являются компонентом Са ++ -связывающего белка стенки тонкого кишечника, участвующего в всасывании этого иона;
2) способствуют обратному всасыванию (реабсорбции) ионов кальция и фосфата из почечных канальцев;
3) активируют щелочную фосфатазу.
Благодаря этому, они поддерживают постоянство концентрации ионов кальция и фосфата в крови, способствуя минерализации костной ткани.
Продукты, богатые витаминами Д: рыбий жир, печень, растительные масла, молочные продукты, дрожжи, желток и др.
Проявление гиповитаминоза Д у молодняка – рахит. Из-за снижения концентрации ионов кальция и фосфата в крови нарушается снабжение ими костной ткани. Кости размягчаются (остеопороз) и под тяжестью тела искривляются конечности. С опозданием зарастают роднички, прорезываются зубы, нарушается рост и развитие организма.
Витамины группы Е (антистерильные); токоферолы. Отличаются друг от друга расположение метильных групп в бензольном цикле. Синтезирован водорастворимый аналог витаминов К викасол. Антивитамин К – дикумарин- применяют при повышенной свертываемости крови.
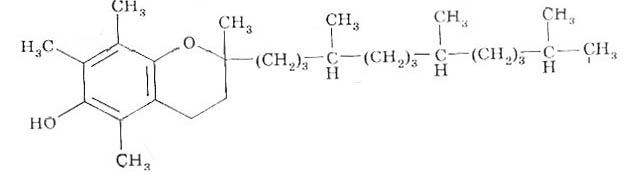
Биологическая роль.
1. Являются антиоксидантами (предотвращают образование перекисей в мембранных структурах клетки). Встраиваясь в мембраны клетки и ее органелл, токоферолы своей гидрофобной боковой цепью прикрывают двойные связи ненасыщенных жирных кислот фосфолипидов мембран от активных форм кислорода. При этом последние инактивируются, реагируя с хроманоловым циклом токоферола. Образовавшаяся окисленная форма витамина Е восстанавливается аскорбиновой кислотой. Образовавшийся при этом дегидроаскорбат обратно восстанавливается в аскорбат глутатионом, трипертидом состоящим из глутаминовой кислоты, цистеина и глицина. Донором ионов водорода являютя SH-группы цистеина.
2. Участвуют в окислительно-восстановительных процессах, протекающих в дыхательной цепи митохондрий, во время превращения креатина в креатинфосфат, в генах в процессе транскрипции и др.
Благодаря этим свойствам, токоферолы поддерживают структуру и функцию клеток различных органов, но особенно органов репродуктивной системы, весьма чувствительных к повреждению. Они поддерживают сперматогенез, образование яйцеклетки, способствуют ее оплодотворению, развитию беременности, ее течению. Поэтому витамины Е называют антистерильными.
Суточная потребность (у человека) - 5 мг.
Продукты, богатые витаминами Е: семена облепихи, злаков, сливочное и растительные масла, печень, мясо, капуста, сочные корма и т.д.
Проявления гиповитаминоза
У самцов развиваются дегенеративные изменения в семенниках, нарушается сперматогенез, вырабатываются сперматозоиды, не способные оплодотворить клетку. В тяжелых случаях развивается атрофия семенников с последующей деградацией половых признаков.
У самок нарушается образование яйцеклетки. Если оплодотворение ее, эмбриогенез происходят, то плод может не вынашиваться, появляются выкидыши.
Из-за нарушения окислительно-восстановительных процессов в мышечных волокнах наступает дегенерация миофибрилл. Из-за неэффективного превращения креатина в креатинфосфат он поступает из мышечных волокон в кровь (гиперкреатинемия) и появляется в моче (кретинурия). Это наблюдается при мышечнойц дистрофии у лошадей и крупного рогатого скота.
Витамины группы К (антигеморрагические): филлохинон (витамин К 1) и менахинон (витамин К 2). В основе структуры их цикл 1,4-нафтохинона и боковая изопреноавя цепь.

Биологическая роль
Участвуют в процессах свертывания крови, являясь коферментами энзимов, превращающих неактивные факторы свертывания крови в активные: протромбина в тромбин, проконвертина – в конвертин, фибриногена – в фибрин. В процессе активации этих факторов происходит превращение содержащейся в их составе глутаминовой кислоты в γ-карбоксиглутаминовую кислоту.
Суточная потребность (у человека) - 10-15 мг.
Продукты, богатые витаминами К: крапива, печень, капуста, коренеплоды, сочные корма и др. Образуют витамины К микроорганизмы пищеварительного тракта.
Проявления гиповитаминоза К – желудочные, кишечные, маточные и другие кровотечения.
Водорастворимые витамины
Витамин В 1 (антиневритный); тиамин содержит в своем составе пиримидиновый и тиозоловый циклы. Является предшественником в биосинтезе тиаминдифосфата (ТДФ): Тиамин + АТФТиаминкиназа ТДФ + АМФ.

Биологическая роль
ТДФ является одним из пяти коферментов, входящих в состав полиферментных комплексов, осуществляющий одновременное отщепление ионов водорода и углекислого газа от пировиноградной кислоты (пируватдегидрогеназа; реакция аэробного гликолиза) и α-кетоглутаровой кислоты (α-кетоглутаратдегидрогеназа; реакция цикла Кребса). ТДФ также является коферментом транскетолазы.
Суточная потребность (у человека) - 1,5- 2 мг.
Продукты, богатые витаминами В 1 : зерно злаков, гречихи, бобовые культуры, печень, мясо и др.
Проявления гиповитаминоза В 1 :
1. Торможение пируватдегидрогеназной реакции, ведущее к накоплению в нервной ткани пировиноградной кислоты. Она повреждает нервные стволы, развивается их воспалении - полиневриты. Снижается также выработка ацетил-КоА, что приводит к дефициту энергетического и пластического материала;
2. Недостатку последнего способствует и торможение активности транскетолазы, ключевого фермента окислительной ветви пентозного цикла;
3. Возможно развитие тиамин-зависимой анемии, поскольку ТДФ участвует в кроветворении;
Витамин В 2 (фактор роста); рибофлавин имеет в основе своей структуры
изоаллоксаззиновый цикл. Является предшественником в биосинтезе коферментов флавинмононуклеотида (ФМН) и флавинадениндинуклеотида (ФАД).

Биологическая роль:
1. ФМН является коферментом одного из энзимов дыхательной цепи митохондрий.
2. ФАД, как и ТДФ, является одним из пяти коферментов, входящих в состав пируватдегидрогеназного и α-кетоглутаратдегидрогеназного полиферментных комплексов, осуществляющий одновременное отщепление ионов водорода и углекислого газа соответственно от пировиноградной (реакция аэробного гликолиза) и α-кетоглутаровой кислот (реакция цикла Кребса).
3. ФАД является коферментом ацил-КоА-дегидрогеназы (фермент β-окисления жирных кислот), глутатионредуктазы, восстанавливающей глутатиондисульфид, и других энзимов.
Суточная потребность (у человека) - 1,7 мг.
2 : зерна злаков, яйца, печень, мясо, овощи, сочные корма и др.
Проявления гиповитаминоза В 2 :
1. Торможение реакций гликолиза, цикла Кребса, функции дыхательной цепи митохондрий приводит к снижению эффективности выработки АТФ, процессов биосинтеза с последующим нарушением роста и развития молодняка, снижению резистентности организма к патогенным факторам. 2. Из-за недостатка пластического материала нередко нарушается биосинтез гемоглобина, развивается малокровие.
3. Нередко развиваются васкуляризация, воспаление глазного яблока, роговой оболочки (кератит), помутнение хрусталика (катаракта).
Витамин В 3 (антидерматитный); пантотеновая кислота состоит из 2,4-дигидрокси-3,3-диметилмасляной кислоты и β-аланина, соединенных между собой через пептидную связь. Является предшественником в биосинтезе коферментаHS-коэнзима А (КоА).
НО - СН 2 - С----СН – СО –NH - СН 2 -СН 2 - COOH
2,4-диокси-3,3-диметил- β - а л а н и н
масляная кислота
Биологическая роль
1. КоА, как и ФАД и ТДФ, является одним из пяти коферментов, входящих в состав пируватдегидрогеназного и α-кетоглутаратдегидрогеназного полиферментных комплексов, осуществляющий одновременное отщепление ионов водорода и углекислого газа соответственно от пировиноградной (реакция аэробного гликолиза) и α-кетоглутаровой кислот (реакция цикла Кребса).
2. Будучи компонентом активированных жирных и других кислот (ацил-КоА), КоА участвует в реакциях их окисления.
3. В составе ацетил-КоА и других активированных органических кислот КоА принимает участие в биосинтезе многих веществ (жирных кислот, ацилглицеролов, холестерола, стероидных гормонов, гемма и др.).
Суточная потребность (у человека) - 3-5 мг.
Продукты, богатые витамином В 3 : печень, дрожжи и многие другие пищевые продукты.
Проявления гиповитаминоза В 3 :
Воспаление кожных покровов (дерматит) и выпадение шерсти
(аллопеция);
Поражение сердца, почек, желудка, надпочечников и других
внутренних органов;
Повреждение тканей головного мозга, выражающееся в нарушении
координации движений.
Витамин В 5 (РР; антипеллагрический); никотиновая кислота и никотинамид имеет в своей основе цикл пиридина. Является предшественником в биосинтезе коферментов НАД и НАДФ.
Биологическая роль
НАД и НАДФ являются коферментами более чем 50 дегидрогеназ гликолиза, β-окисления жирных кислот, окислительного дезаминирования глутамата, цикла Кребса, дыхательной цепи митохондрий, пентозного цикла и др.
Суточная потребность (у человека) - 18 мг.
Продукты, богатые витамином В 2 : печень, мясо, зерна злаков, картофель, корнеплоды, сочные корма, дрожжи и другие пищевые продукты.
Проявление гиповитаминоза В 5 – пеллагра. Признаки ее:
1) Воспаление в форме бабочки на открытых участках кожных покровов (дерматит);
2) Поражение тканей пищеварительной системы: гастрит со сниженной кислотностью, поражение кишечника, кровавый понос (диарея);
3) Повреждение нервных клеток и нарушение функции головного мозга.
Витамин В 6 (антидерматитный); пиридоксин, пиридоксамин и пиридоксаль имеет в своей основе также цикл пиридина. Является предшественником в биосинтезе кофермента пиридоксальфосфат (ПФ).

Биологическая роль :
ПФ является коферментом энзимов метаболизма аминокислот: аминотрансфераз (аспартатаминотрансферазы, аланинаминотрансферазы и др.), декарбоксилаз (глутаматдекарбоксилазы, гистидиндекарбоксилазы и др.). Велика его роль в метаболизме серосодержащих аминокислот, синтезе гемма из аминолевулиновой кислоты, пиридоксина из триптофана и др.
Суточная потребность (у человека) - 2 мг.
Продукты, богатые витамином В 6 : печень, зерна злаков, дрожжи и др.
Проявление гиповитаминоза В 5 :
1) поражение эпителиальной ткани: пеллагроподобный дерматиты, воспаление слизистых оболочек глаз, полости рта, глотки и др.;
2) нарушение функции центральной нервной системы – эпилептоподобные припадки;
3) возможно появление в моче промежуточных продуктов обмена серосодержащих аминокислот: гомоцистеина и цистатиона.
Витамин В 12 (антианемический); кобаламин содержит в своем составе кобальт, соединенный с атомами азота четырех пиррольных колец, остатки рибозы, фосфорной кислоты и другие радикалы. Кобаламин является предшественником в биосинтезе двух коферментов:метил кобаламина (СН з -витамин В 12) идезоксиаденозил кобаламина (дезоксиаденозил- витамин В 12).
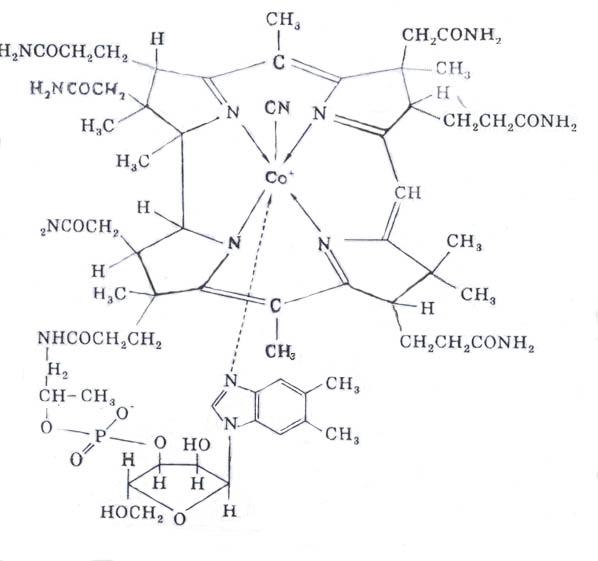
Биологическая роль витамина В 12
1. Метилкобаламин является коферментом энзимов, катализирующих реакции переноса групп –СН 3 и других одноуглеродных радикалов от одного вещества к другому, например от метил-тетрагидрофолиевой кислоты (СН 3 -ТГФК) к гомоцистеину (рекция биосинтеза метионина):
СН 3 -ТГФК + ГомоцистеинТетрагидроптероилглутамат- Метионин + ТГФК
метилтрансфераза
Кобаламин
2. Дезоксиаденозилкобаламин входит в состав ферментов, катализирующих реакции изомеризации. Так при метаболизме аминокислот валина, изолейцина и треонина, а также пропионовой кислоты, образовавшейся в преджелудках жвачных при расщеплении микроорганизмами клетчатки, образуется одинаковый конечный продукт- метилмалонил-КоА. Последний вступает в реакцию изомеризации, катализируемую S-метилмалонил-КоА-мутазой, коферментом которой является дезоксиаденозилкобаламин:
Метилмалонил-КоА S -метилмалонил-КоА-мутаза Сукцинил-КоА
Дезоксиаденозилкобаламин
3. Производные кобаламина способствуют биосинтезу нуклеиновых кислот, участвуя в реакциях образования дезоксирибозы, тиминовых нуклеотидов и других веществ, особенно в кроветворных органах.
Суточная потребность (у человека) - 3 мкг. У жвачных она удовлетворяется за счет деятельности микрофлоры пищеварительного тракта.
Продукты, богатые витамином В 12 : говяжья печень, мясо, рыба, яйца. Для того, чтоб всосаться в кишечнике, кобаламин должен вступить в комплекс с гастромукопротеином, вырабатываемым в желудке. У жвачных полностью, а у других животных - частично потребность в витамине витамин В 12 удовлетворяется за счет деятельности микрофлоры пищеварительного тракта.
Проявление гиповитаминоза В 12 :
1. При высоко концентратном кормлении жвачных животных нарушается деятельность микрофлоры, вырабатывающей витамина В 12, что приводит не только к торможению превращения метилмалонил-КоА в сукцинил-КоА с последующим развитием кетоацидоза, но и к дефициту метионина и других липотропных веществ, способствующему накоплению в печени ацилглицеролов..
2. При патологии желудка нарушается выработка гастромукопротеина, что приводит к нарушению всасывания витамина В 12, последующим торможением биосинтеза нуклеиновых кислот в кроветворных органах и развитием малокровия.
3. Накопление в тканях головного мозга метилмалонил-КоА приводит к вовлечению его вместо малонил-КоА в реакции биосинтеза жирных кислот. Это приводит к образованию жирных кислот с разветвленной цепью, способствующему нарушению структуры миэлиновых оболочек нервных волокон.
Витамин В с (антианемический); фолиевая кислота содержит в своем составе птеридиновый цикл (1), связанный с п-аминобензойной (2) и глутаминовой кислотами (3).

Биологическая роль :
Фолиевая кислота является предшественницей в биосинтезе коферментов трансфераз, участвующих в переносе метильной (–СН 3), метиленовой (-СН 2 -), метенильной (-СН=), формильной (-СОН) и формиминовых групп
(-СН=NH). Данные энзимы участвуют в биосинтезе пуриновых нуклеотидов, холина, аминокислот серина, метионина, глицина и других веществ.
Суточная потребность (у человека) – 0,1 мг.
Продукты, богатые витамином В 12 : листья растений, дрожжи, люцерновая мука, соевый шрот, картофель и др.
Гиповитаминоз В с развивается при дефиците фолиевой кислоты в кормах, нарушении всасывания в кишечнике при патологии его. Проявляется он в малокровии, сниженном содержание лейкоцитов в крови, нарушении роста, развития, снижении продуктивности животного. В тяжелых случаях возможны паралич шеи и конечностей.
Витамин С (антицинготный); аскорбиновая кислота. Является витамином лишь для человека, африканских обезьян и морских свинок. У других животных способна синтезироваться, но ее может недоставать при патологических состояниях. Структурно аскорбиновая кислота представляет собой производное спирта сорбита - лактон 2,3-диенол-гулоновой кислоты.
отдает два иона водорода, связанные со вторым и третьим углеродными атомами, превращаясь в дегидроаскорбат.
Биологическая роль :аскорбиновой кислоты
1. Является антиоксидантом. В водной фазе клеток взаимодействует с активными кислородными метаболитами, инактивируя их. В липидной фазе клеток восстанавливает глутатиондисульфид, образовавшийся в реакции восстановления токоферилхинона глутатионом или при взаимодействии последнего с активными кислородными метаболитами.
2. Поддерживает функцию дыхательной цепи митохондрий, передавая ионы водорода цитохромам или молекуле кислорода.
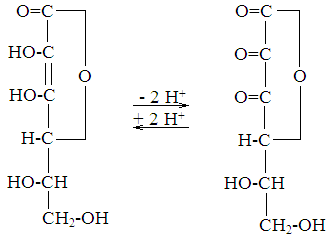
Аскорбиновая Дегидроаскорбино-
кислота ваяя кислота
3. Способствует созреванию соединительной ткани, участвуя в реакциях гидроксилирования пролина в оксипролин и лизина в оксилизин.
4. Участвует в других реакциях гидроксилирования, сопряженных с катаболизмом тирозина до тироксина, меланина, дофамина, норадреналина и адреналина, биосинтезом гликопротеинов межклеточного вещества соединительной ткани, стероидных гормонов, желчных кислот и других веществ.
Суточная потребность (у человека) – 100 мг.
Продукты, богатые витамином В 12 : фрукты, ягоды, свежие овощи, шиповник и др.
Проявление недостатка аскорбиновой кислоты в организме
Из-за нарушения биосинтеза межклеточного вещества соединительной
ткани изменяется структура базальной мембраны кровеносных сосудов, что приводит к повышенной кровоточивости, появлению множественных точечных кровоизлияний (петехий).
Нарушение синтеза органического матрикса костной ткани приводит к
ее хрупкости, частым переломам, ослаблению структуры альвеол челюстей, выпадению из них зубов.
3. Торможение функции антиоксидантной системы приводит к сниженной сопротивляемости организма к патогенным факторам, уменьшению продуктивности животных, сокращению времени их эксплуатации.
Витамин Р (капилляроукрепляющий); биофлавоноиды (флавонол, рутин, кверцетин, эриодиктин, гесперидин и др.) - группа веществ, построенных на основе дифенилпропанового цикла хромона или флавана.

Биологическая роль :
1. В состав межклеточного вещества соединительной ткани входит гетерополисахарид гиалуроновая кислота. Рутин ингибирует гиалуронидазу, ее расщепляющую, стабилизируя структуры, построенные из соединительной ткани.
2. Вместе с аскорбиновой кислотой, с которой тесно функционально связан, рутин регулирует окислительно-восстановительные процессы, является антиоксидантом.
Продукты, богатые витамином Р: свежие овощи, фрукты, чай.
Проявление гиповитаминоза Р:
1) повышение проницаемости кровеносных сосудов, кровоизлияния в ткани, кровотечения;
2) Снижение резистентности организма к патогенным факторам, общая слабость, боль в конечностях.
Витаминоподобные вещества также необходимы для жизнедеятельности организма, но не соответствуют по какому-то из признаков понятию «витамины».
Холин по своей структуре является аминоэтиловым спиртом, содержащим у атома азота три метильные группы: НО-СН 2 - СН 2 –N≡(CH 3) 3
Биологическая роль холина.
1. Входит в состав фосфатидилхолина (лецитина), компонента мембранных структур клетки. Участвуя в биосинтезе этого фосфоглицерида, холин способствует выходу из печени ацилглицеролов, предотвращая жировую инфильтрацию этого органа.
2. В качестве донора метильных групп участвует в биосинтезе метионина, адреналина, креатина, и других веществ.
3. Входит в состав ацетилхолина, передающего импульс от нервной клетки.
Источники холина в клетках.
Частично животные получают холин с животной и растительной пищей, а частично - за счет эндогенного синтеза: декарбоксилированием аминокислоты серин с последующим метилированием образовавшегося этаноламина. Донорами метильных групп могут быть метионие, фолиевая кислота и витамин В 12 .
Проявление недостатка холина в организме: жировая инфильтрация печени, геморрагическая дистрофия почек, нарушение свертывания крови вследствие недостаточно эффективного синтеза акцелерина и др.
Инозитол (инозит) является по своей структуре циклическим шестичленным спиртом.
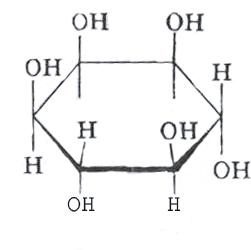
Биологическая роль :
1. Является компонентом фосфоглицерида фосфатидилинозитола.. От последнего в результате реакции, катализируемой фосфолипазой Д, отщепляется инозитол-1,4,5-трифосфат, являющийся вторичным посредником при воздействие на клетки инсулина, паратгормона, тиреокальцитонина и других биологически активных веществ;
2. Обладает липотропным эффектом, предотвращает жировую инфильтрацию печени;
3. регулирует перестальтику кишечника, осмотическое давление в сперматозоидах, окисление жирных кислот, активность амилазы и др.
Продукты, богатые инозитолом: зародыши пшеницы, апельсины, зеленый горошек. Много его и в продуктах животного происхождения: печени, мясе, молоке.
Проявление недостатка инозитола наиболее выражено у мышей и крыс. Оно выражается в остановке роста и развития, жировой инфильтрации печени с отложением в нее холестерина.
Коэнзим Q (убихинон)похимической структуре представляет собой 2,3-диметокси-5-метил-1,4-бензохинон с изопреновой цепью в шестом положении.
![]()
Биологическая роль убихинона : является обязательным компонентом дыхательной цепи митохондрий, осуществляя перенос электронов от мембранных дегидрогеназ на цитохромы.
Источники убихинона в клетках.
Организм животного получает это вещество с различными кормами, а частично – в результате эндогенного биосинтеза из мевалоновой кислоты и продуктов метаболизма фенилаланина и тирозина.
Проявление недостатка убихинона в организме . Это состояние развивается при поступлении в организм недостаточного количества пищи, богатой белками. Это приводит к развитию анемии, не поддающейся лечению обычными средствами, но поддающейся лечению убихиноном. Недостаток последнего может привести и к мышечной дистрофии и сердечно-сосудистой недостаточности.
Витамин Н (антидерматитный); биотин.
Молекула его состоит из имидазольного и тиофенового циклов. К последнему присоединяется остаток валерьяновой кислоты.
H 2 C CH - (CH 2) 4 – COOH
Биотин
Биологическая роль биотина :
Из этого вещества путем связывания его с ε-аминогруппой аминокислоты лизинобразуется коферментная форма витамина Н. Последняя входит в состав карбоксилаз, катализирующих две группы реакций: а) протекающих с участием АТФ (ацетил-КоА-, пропионил-КоА- и пируваткарбоксилаза); б) протекающих без участия АТФ (метилмалонил-КоА-карбоксилаза и др.). Поэтому биотин принимает активное участие в биосинтезе жирных кислот, пуриновых нуклеотидов и других веществ.
Суточная потребность (у человека) – 0,25 мг.
Источники биотина в клетках : растительные (картофель, бобовые растения, шпинат, томаты и др.) и животные продукты (печень, почки, желток яйца, молоко и др.). У животных биотин способен вырабатываться микрофлорой пищеварительного тракта.
Проявление недостатка биотина в организме: сниженный аппетит сонливость, малокровие, боли в мышцах, дерматиты, сопровождающиеся усиленной функцией сальных желез, выпадение шерсти и др.
Липоевая кислота; 1,2-дитиолан-3-валериановая кислота. Существует в окисленной (-S-S-) и восстановленной (-SH) формах, что позволяет ей выполнятькоферментную функцию.
H 2 CCH– (СН 2) 4 - СООН
S------- S
Липоевая кислота
Биологическая роль липоевой кислоты: входит в состав мультиферментных комплексов, осуществляющих одновременное отщепление ионов водорода и углекислого газа (окислительное декарбоксилирование) от пировиноградной и α-кетоглутаровой кислот.
Проявление недостатка липоевой кислоты в организме – « пирувизм», проявляющийся в повышенной концентрации пировиноградной и других кетокислот в крови, метаболическом ацидозе, мышечных спазмах, а в тяжелых случаях – в полиневрите.
Витамин U (противоязвенный фактор); метилметионин
HOOC- CH - CH 2 - CH 2 - S+
Биологическая роль метилметионина:
1) обладает положительным эффектом при язвах желудка и кишечника, стимулируя регенерацию эпителия этих органов;
2) метилируя биогенный амин гистамин в метилгистамин, способствует выведению его из организма;
3) как и метионин, является донором метильных групп при биосинтезе холина, креатина и других веществ;
4) способствует удалению из организма избытка холестерина.
Продукты, богатые метилметионином: свежая капуста, зелень петрушки и репы, зеленый чай, бананы, помидоры и др.
Проявление недостатка метилметионина в организме – развитие язв желудка и тонкого кишечника.
Витамин В 15 (пангамовая кислота) является эфиромглюконовой кислотыи диметилглицина:СООН
(Н-С-ОН) 4 CH 3
СН 2 -О-СО- СН 2 -N
Биологическая роль пангамовая кислоты:
1) участвует в биосинтезе холина, метионина и креатина в качестве источника метильных групп и поэтому обладает липотропными свойствами.;
2) принимает участие в процессах тканевого дыхания, биосинтеза белка, в функционировании надпочесников.
Продукты, богатые пангамовой кислотой: семена растений, дрожжи, печень и др.
Проявление недостатка пангамовой кислоты:
1) жировая инфильтрация печени;
2) кислородное голодание.
п-Аминобензойная кислота необходима для жизнедеятельности микроорганизмов и животных.

Биологическая роль п-аминобензойной кислоты:
1) входя в состав витамина фолиевой кислоты, принимает участие в реакциях, в которых участвует синтезирующийся из нее кофермент тетрагидрофолиевая кислота: синтез нуклеиновых кислот и др.
2) участвуя в биосинтезе из тирозина пигмента меланин, способствует пигментации кожи, шерсти, перьев и др.
Продукты, богатые п-аминобензойной кислотой: зародыши пшеницы, картофель, дрожжи, мясо, печень, почки животных и др.
В медицине и ветеринарии применяются аналоги п-аминобензойной кислоты сульфаниламиды. Последние вследствие структурного сходства конкурентно замещают п-аминобензойную кислоту в ферментах микроорганизмов с последущей остановкой из размножения.
Витамин F ; ненасыщенные жирные кислоты. Свойствами витаминаFобладают олеиновая (С 17 Н 33 –СООН), линолевая (С 17 Н 31 –СООН), линоленовая (С 17 Н 29 –СООН) и арахидоновая (С 19 Н 31 -СООН) кислоты.
Биологическая роль ненасыщенных жирных кислот:
1) входят в состав фосфолипидов биологических мембран клеток. Поэтому необходимы для образования и репарации клеток, особенно клеток репродуктивных органов, кожи и эндотелия кровеносных сосудов. 2) из ненасыщенных жирных кислот синтезируются простогландины, тромбоксаны, лейкотриены и другие сигнальные молекулы.
Продукты, богатые витамином F : олеиновая, линолевая и линоленовая кислоты содержатся в составе растительных и в меньшей степени – животных жиров. Арахидоновая кислот содержится только в составе животных жиров.
При дефиците ненасыщенных жирных кислот нарушается функция репродуктивных органов, развиваются заболевания кожи, увеличение концентрации холестерина в крови, склероз кровеносных сосудов.
В состав клеток входит множество органических соединений: углеводы, белки, липиды, нуклеиновые кислоты и другие соединения, которых нет в неживой природе. Органическими веществами называют химические соединения, в состав которых входят атомы углерода.
Атомы углерода способны вступать друг с другом в прочную ковалентную связь, образуя множество разнообразных цепочечных или кольцевых молекул.
Самыми простыми углеродсодержащими соединениями являются углеводороды - соединения, которые содержат только углерод и водород. Однако в большинстве органических, т. е. углеродных, соединений содержатся и другие элементы (кислород, азот, фосфор, сера).
Биологические полимеры (биополимеры). Биологические полимеры - это органические соединения, входящие в состав клеток живых организмов и продуктов их жизнедеятельности.
Полимер (от греч. «поли» - много) - многозвеньевая цепь, в которой звеном является какое-либо относительно простое вещество - мономер. Мономеры, соединяясь между собой, образуют цепи, состоящие из тысяч мономеров. Если обозначить тип мономера определенной буквой, например А, то полимер можно изобразить в виде очень длинного сочетания мономерных звеньев: А-А-А-А-...-А. Это, например, известные вам органические вещества: крахмал, гликоген, целлюлоза и др. Биополимерами являются белки, нуклеиновые кислоты, полисахариды.
Свойства биополимеров зависят от строения их молекул: от числа и разнообразия мономерных звеньев, образующих полимер.
Если соединить вместе два типа мономеров А и Б, то можно получить очень большой набор разнообразных полимеров. Строение и свойства таких полимеров будут зависеть от числа, соотношения и порядка чередования, т. е. положения мономеров в цепях. Полимер, в молекуле которого группа мономеров периодически повторяется, называют регулярным. Таковы, например, схематически изображенные полимеры с закономерным чередованием мономеров:
А Б А Б А Б А Б...
А А Б Б А А Б Б...
А Б Б А Б Б А Б Б А Б Б...
Однако значительно больше можно получить вариантов полимеров, в которых нет видимой закономерности в повторяемости мономеров. Такие полимеры называют нерегулярными. Схематически их можно изобразить так:
ААБАБББАААББАБББББААБ...
Допустим, что каждый из мономеров определяет какое-либо свойство полимера. Например, мономер А определяет высокую прочность, а мономер Б - электропроводность. Сочетая эти два мономера в разных соотношениях и по-разному чередуя их, можно получить огромное число полимерных материалов с разными свойствами. Если же взять не два типа мономеров (А и Б), а больше, то и число вариантов полимерных цепей значительно возрастет.
Рис. 2. Строение молекулы глюкозы
Оказалось, что сочетание и перестановка нескольких типов мономеров в длинных полимерных цепях обеспечивает построение множества вариантов и определяет различные свойства биополимеров, входящих в состав всех организмов. Этот принцип лежит в основе многообразия жизни на нашей планете.
Углеводы и их строение. В составе клеток всех живых организмов широкое распространение имеют углеводы. Углеводами называют органические соединения, состоящие из углерода, водорода и кислорода. В большинстве углеводов водород и кислород находятся, как правило, в тех же соотношениях, что и в воде (отсюда их название - углеводы). Общая формула таких углеводов С n (Н 2 0) m . Примером может служить один из самых распространенных углеводов - глюкоза, элементный состав которой С 6 Н 12 0 6 (рис. 2). Глюкоза является простым сахаром. Несколько остатков простых сахаров соединяются между собой и образуют сложные сахара. В составе молока находится молочный сахар, который состоит из остатков молекул двух простых сахаров (дисахарид). Молочный сахар - основной источник энергии для детенышей всех млекопитающих.
Тысячи остатков молекул одинаковых сахаров, соединяясь между собой, образуют биополимеры - полисахариды. В составе живых организмов имеется много разнообразных полисахаридов: у растений это крахмал (рис. 3), у животных - гликоген, тоже состоящий из тысяч молекул глюкозы, но еще более ветвистый. Крахмал и гликоген играют роль как бы аккумуляторов энергии, необходимой для жизнедеятельности клеток организма. Очень богаты крахмалом картофель, зерна пшеницы, ржи, кукурузы и др.

Рис. 3. Участок ветвящейся полимерной молекулы крахмала, где каждое звено - крахмал
Функции углеводов. Важнейшая функция углеводов - энергетическая. Углеводы служат основным источником энергии для организмов, питающихся органическими веществами. В пищеварительном тракте человека и животных полисахарид крахмал расщепляется особыми белками (ферментами) до мономерных звеньев - глюкозы. Глюкоза, всасываясь из кишечника в кровь, окисляется в клетках до углекислого газа и воды с освобождением энергии химических связей, а избыток ее запасается в клетках печени и мышц в виде гликогена. В периоды интенсивной мышечной работы или нервного напряжения (либо при голодании) в мышцах и печени животных расщепление гликогена усиливается. При этом образуется глюкоза, которая потребляется интенсивно работающими мышечными и нервными клетками.
Таким образом, биополимеры полисахариды - это вещества, в которых запасается используемая клетками энергия растительных и животных организмов.
В растениях в результате полимеризации глюкозы образуется не только крахмал, но и целлюлоза. Из целлюлозных волокон строится прочная основа клеточных стенок растений. Благодаря особому строению целлюлоза нерастворима в воде и обладает высокой прочностью. По этой причине целлюлозу используют и для изготовления тканей. Ведь хлопок почти чистая целлюлоза. В кишечнике человека и большинства животных нет ферментов, способных расщеплять связи между молекулами глюкозы, входящими в состав целлюлозы. У жвачных животных целлюлозу расщепляют ферменты бактерий, постоянно обитающих в специальном отделе желудка.
Известны также сложные полисахариды, состоящие из двух типов простых сахаров, которые регулярно чередуются в длинных цепях. Такие полисахариды выполняют структурные функции в опорных тканях животных. Они входят в состав межклеточного вещества кожи, сухожилий, хрящей, придавая им прочность и эластичность. Таким образом, важной функцией углеводных биополимеров является структурная функция.
Имеются полимеры сахаров, которые входят в состав клеточных мембран; они обеспечивают взаимодействие клеток одного типа, узнавание клетками друг друга. Если разделенные клетки печени смешать с клетками почек, то они самостоятельно разойдутся в две группы благодаря взаимодействию однотипных клеток: клетки почек соединятся в одну группу, а клетки печени - в другую. Утрата способности узнавать друг друга характерна для клеток злокачественных опухолей. Выяснение механизмов узнавания и взаимодействия клеток может иметь важное значение, в частности для разработки средств лечения рака.
Липиды. Липиды разнообразны по структуре. Всем им присуще, однако, одно общее свойство: все они неполярны. Поэтому они растворяются в таких неполярных жидкостях, как хлороформ, эфир, но практически нерастворимы в воде. К липидам относятся жиры и жироподобные вещества. В клетке при окислении жиров образуется большое количество энергии, которая расходуется на различные процессы. В этом заключается энергетическая функция жиров.
Жиры могут накапливаться в клетках и служить запасным питательным веществом. У некоторых животных (например, у китов, ластоногих) под кожей откладывается толстый слой подкожного жира, который благодаря низкой теплопроводности защищает их от переохлаждения, т. е. выполняет защитную функцию.
Некоторые липиды являются гормонами и принимают участие в регуляции физиологических функций организма. Липиды, содержащие остаток фосфорной кислоты (фосфолипиды), служат важнейшей составной частью клеточных мембран, т. е. они выполняют структурную функцию.
- Охарактеризуйте строение молекул углеводов в соответствии с их функциями в клетке.
- Укажите функции каждого из перечисленных веществ в организме: глюкоза, целлюлоза, крахмал, гликоген.
- Используя знания, полученные из § 1 и 2, ответьте на вопрос, в чем заключается единство живого и неживого.