Первинна структура білків
|
ВИЗНАЧЕННЯ ПЕРВИННОЇ СТРУКТУРИ БІЛКУ |
Визначення первинної структурибілка вимагає попереднього проведення низки операцій. Білок має бути ретельно очищений, чистота матеріалу має бути підтверджена як мінімум двома незалежними методами. Найчастіше використовується гель-електрофорез на поліакриламіді (ПААГ) та ультрацентрифугування. Після очищення білка його ділять на дві-три чи більше частин. Кожну частину обробляють різними ферментами-протеїназами (трипсин, хімотрипсин) або реагентами (бромціан, йодозобензойнакислота). В результаті одержують два-три (або більше) набори поліпептидів (відрізків білка). До ферментів-протеїназів пред'являються особливі вимоги щодо чистоти, інакше буде утруднено подальше визначення послідовності чергування відрізків пептидів у нативному ланцюзі білка. Особливі складності є розпізнавання місць дисульфідних містків між залишками цистеїну. Отримана суміш пептидів розділяється електрофорезом, після чого можна розпочати безпосередньо процедуру севенування. Довжина окремого пептиду має перевищувати 40 АК-залишків.
Найбільш часто використовуваним методом секвенування пептидів (встановлення послідовності АК-залишків у них) є процедура П. Едмана, з використанням фенілізотіоціанату(ФІТЦ). Процедура лежить в основі роботи автоматичних секвенаторів. Зразок очищеного пептиду наноситься на поверхню реакційної судини у вигляді плівки. Часто здійснюють ковалентне пришивання пептиду з кінця вільної групи СООН з матеріалом поверхні реакційної судини. Після чого проводять цикли, що повторюються, із серії реакцій. Одна серія реакцій включає:
- взаємодія ФІТЦ з кінцевим АК-залишком, що має вільну NH 2 -групу, при цьому утворюється так зване ФТК-( фенілтіокарбамоїл)-похідне:
- надлишок ФІТЦ видаляється, змінюється рН середовища додаванням гептафторолійнийкислоти, при цьому відбувається перетворення ФТК на ФТГ ( фенілтіогідантоїн)-похідне:
- ФТГ-похідне амінокислоти видаляється з реакційного середовища екстракцією з 1-хлорбутаном і серія реакцій повторюється в наступному циклі.
За один цикл видаляється один амінокислотний залишок з NH2 краю пептиду. Оскільки реакції з ФІТЦ протікають не кількісно, а в найкращому випадку, На 95 відсотків, поступово накопичуються заважають фактори-ФТГ-похідні від не прореагували в попередні цикли АК-залишків. У найсприятливіших випадках вдається надійно ідентифікувати послідовність лише близько 40 АК-залишків. Однак, завдяки автоматизації процесу, робота все ж таки істотно полегшується.
РОЗШИФРУВАННЯ ЗА ДОПОМОГОЮ ПЕПТИДАЗ:
а) з N-кінцевих залишків за допомогою АМІНОПЕПТИДАЗ ( хроматографічнаідентифікація та кінетика накопичення відповідних АК.
б) з С-кінців за допомогою карбоксипептидаз(Аналогічно).
ГІДРАЗИНОЛІЗ (у безводному середовищі при 100 град С) за винятком останнього залишку з вільною СООН, всі перетворюються на гідразиди кислот:
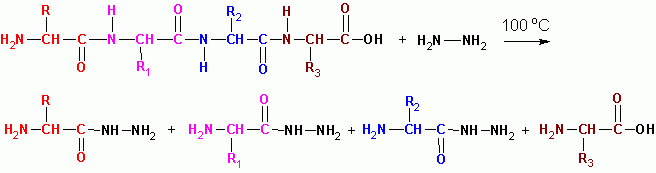
Порядок чергування пептидів у молекулах білків визначається з перекривання фрагментів пептидів:
G-W-V-R A-O-V-K C-E-C-Dтриптичні пептиди (трипсин)
G-W V-R-A-O V-K-C-E-C-D хімотриптичніпептиди (хімотрипсин)
РЕКОМЕНДУЄМА ЛІТЕРАТУРА:
1. Строєв Є.А. Біологічна хімія М., 1986.
2. Страйєр Л. Біохімія, в 3-х т. М., Світ, 1984.
3. Уайт, Хендлер, Сміт та ін. Основи біохімії, в 3-х т. М., Світ, 1981.
4. Овчинніков Ю.А. Біоорганічна хімія, М., Просвітництво, 1987.
5. Анісімов та ін. Основи біохімії. М., Вища школа, 1986.
Однією з особливостей білків є їхня складна структурна організація. Всі білки мають первинну, вторинну і третинну структуру, а ті, які у своєму складі мають дві і більше ППЦ, мають і четвертинну структуру (НС).
Первинна структура білка (ПСБ) – це порядок чергування (послідовність) амінокислотних залишків у ППЦ.
Навіть однакові за своєю довжиною та амінокислотним складом білки можуть бути різними речовинами. Наприклад, з двох амінокислот можна скласти 2 різні дипептиди:
При числі амінокислот, що дорівнює 20, кількість можливих комбінацій дорівнює 210 18 . А якщо врахувати, що в ППЦ кожна амінокислота може зустрітися більше 1 разу, то кількість можливих варіантів важко підрахувати.
Визначення первинної структури білка (ПСБ).
ПСБ білків можна визначити за допомогою фенілтіогідантоїнового
методу
. Цей метод заснований на реакції взаємодії фенілізотіоціанату
(ФІТЦ) з α-АК. В результаті утворюється комплекс цих двох сполук ФІТЦ-АК
.
Наприклад, розглянемо пептид ![]() з метою визначення його ПСБ, тобто послідовності сполуки амінокислотних залишків.
з метою визначення його ПСБ, тобто послідовності сполуки амінокислотних залишків.
ФІТЦ взаємодіє з кінцевою амінокислотою (а). Утворюється комплекс ФТГ-а, його відокремлюють від суміші та визначають справжність амінокислоти. а. Наприклад, це – асн
![]() і т.д. Послідовно відокремлюють та ідентифікують всі інші амінокислоти. Це трудомісткий процес. Визначення ПСБ білка середнього розміру триває кілька місяців.
і т.д. Послідовно відокремлюють та ідентифікують всі інші амінокислоти. Це трудомісткий процес. Визначення ПСБ білка середнього розміру триває кілька місяців.
Пріоритет у розшифровці ПСБ належить Сенджеру(1953), який відкрив ПСБ інсуліну (Лауреат Нобелівської премії). Молекула інсуліну складається з 2х ППЦ – A та B.
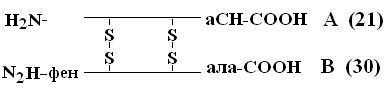
А-ланцюг складається з 21 амінокислоти, ланцюг - з 30. Між собою ППЦ з'єднуються дисульфідними містками. Число білків, ПСБ яких визначено, на сьогодні досягає 1500. Навіть невеликі зміни первинної структури можуть суттєво змінити властивості білка. В еритроцитах здорових людейміститься HbA – при заміні в -ланцюзі HbA, у 6-му положенні глуна валвиникає тяжке захворювання серповидно-клітинна анемія, при якій діти, що народилися з цією аномалією, гинуть у ранньому віці. З іншого боку, можливі варіанти зміни ПСБ, які не позначаються на його фізико-хімічних та біологічних властивостях. Наприклад, HbC містить у 6-му положенні b-ланцюга замість глу – ліз, HbС майже не відрізняється за своїми властивостями від HbA, а люди, які мають в еритроцитах такий Hb, практично здорові.
Стабільність ПСБзабезпечується в основному міцними ковалентними пептидними зв'язками та, у другу чергу, дисульфідними зв'язками.
Вторинна структура білка (ВСБ).
ППЦ білків мають великою гнучкістюі набувають певної просторової структури або конформацію. У білках розрізняють 2 рівні такої конформації – це ВСБ та третинна структура (ТББ).
ВСБ – це конфігурація ППЦ, тобто спосіб її укладання або скручування в якусь конформацію відповідно до програми, закладеної в ПСБ.
Відомі три основні типи ВСБ:
1) -спіраль;
2) b-структура(складчастий шар або складчастий листок);
3) безладний клубок.
-спіраль .
Її модель запропонована В. Полінг. Вона найімовірніша для глобулярних білків. Для будь-якої системи найбільш стійким є стан, що відповідає мінімуму вільної енергії. Для пептидів такий стан має місце, коли CO-і NH-групи з'єднуються між собою слабким водневим зв'язком. У a -спіралі NH-групи 1-го амінокислотного залишку взаємодіє з CO-групою 4-ї за рахунком амінокислотою. В результаті пептидний кістяк утворює спіраль, на кожен виток якої припадає 3,6 АК-залишку.
1 крок спіралі (1 виток) = 3,6 АК = 0,54 нм, кут підйому – 26°
Закручування ППЦ відбувається за годинниковою стрілкою, тобто у спіралі правий хід. Через кожні 5 витків (18 АК; 2,7 нм) конфігурація ППЦ повторюється.
Стабілізується ВСБнасамперед водневими зв'язками, і в другу – пептидними та дисульфідними. Водневі зв'язки в 10-100 разів слабші від звичайних хімічних зв'язків; однак за рахунок їх великої кількості вони забезпечують певну жорсткість та компактність ВСБ. Бічні R-ланцюги a-спіралі звернені до зовні та розташовані по різні боки від її осі.
b -структура .
Це складчасті ділянки ППЦ, що формою нагадують листок, складений у гармошку. Шари ППЦ можуть бути паралельними, якщо обидва ланцюги починаються з N- або С-кінця.
Якщо суміжні ланцюги у шарі орієнтовані протилежними кінцями N–С та С–N, то вони називаються антипаралельними.
 паралельні
паралельні
антипаралельні
Утворення водневих зв'язків відбувається, як і в a-спіралі, між CO-і NH-групами.
Визначення первинної структури білків
Визначення первинної структури передує денатурація та розрив поперечних дисульфідних зв'язків у білку. Це досягається за допомогою надлишку меркаптоетанол.
Цистін перетворюється на два залишки цистеїну, які потім блокують надлишком йодоцтової кислоти, щоб запобігти зворотному утворенню зв'язків - S-S-.
Розщеплення поліпептидного ланцюгана фрагменти проводять зазвичай за допомогою протеолітичних ферментів, таких як трипсин, хімотрипсин або пепсин. Ці ферменти діють різні ділянки полипептидной ланцюга, оскільки мають підвищену спорідненість до різних амінокислотним залишкам. Необхідно враховувати також сусідні залишки амінокислот, тобто. просторове оточення пептидного зв'язку, що атакується. Виявилося, що трипсин гідролізує тільки ті пептидні зв'язки, в освіті яких бере участь карбоксильна група лізину або аргініну, а хімотрипсин гідролізує зв'язки фенілаланіну, триптофану і тирозину. Зазвичай протеолітичні ферменти, що гідролізують поліпептидні ланцюги, попередньо іммобілізують на нерозчинних матрицях для легшого відокремлення їх від продуктів гідролізу. Далі визначають амінокислотні послідовності кожного поліпептидного фрагмента. Для цього найчастіше використовують метод Едмана, який полягає в аналізі поліпептиду тільки з N-кінця. Кінцева амінокислота при взаємодії з фенілізотіоціанатом у лужному середовищі утворює стійку сполуку, яку можна відщепити від поліпептиду без її деградації. Фенілтіогідантоїнове (ФТГ) похідне амінокислоти ідентифікується хроматографічним методом.
Після ідентифікації кінцевого N-амінокислотного залишку мітка вводиться наступний амінокислотний залишок, який стає кінцевим. Метод Едмана можна автоматизувати, користуючись секвенатором (від англ. sequetice -послідовність) за допомогою якого ФТГ-похідні відщеплюються від поліпептиду та ідентифікуються за допомогою високоефективної рідинної хроматографії.
Ф. Сенгер вперше повністю розшифрував первинну структуру білкового гормону інсуліну, використовуючи метод Едмана.
Іншим високочутливим методом є так званий дансильний метод, пов'язаний з приєднанням до кінцевої амінокислоти дансилхлориду (1-диметиламіно-нафталін-5-сульфохлориду) за наступною схемою:
Первинна структура білка може бути встановлена опосередковано наступним чином: спочатку отримують відповідну кДНК., потім ідентифікують клон, що відноситься до аналізованого білка, і чергування в ньому нуклеотидів з використанням бібліотеки амінокислотних послідовностей визначають первинну структуру білка.
Визначення вторинної структури білків
Для визначення вторинної структури білків використовуються переважно оптичні методи. Звичайно, надійнішим є рентгеноструктурний метод, проте його застосування пов'язане з певними труднощами і потребує значного часу. Такі оптичні методи, як дисперсія оптичного обертання та круговий дихроїзм, є більш простими і, що дуже важливо, дозволяють визначати зміни вторинної структури білка у розчинах. За допомогою дисперсії оптичного обертання можна отримати інформацію про рівень спіралізації білкової макромолекули. Незважаючи на те, що метод наближений, досить чітко проглядаються переходи типу спіраль-клубок. Що стосується методу кругового дихроїзму, то його спектр визначається набором кутів ш і ц, властивих тому чи іншому типу вторинної структури. Обидва методи можна розцінювати як скринінгові, і для повної ідентифікації вторинної структури їх треба комбінувати з рентгеноструктурним аналізом білків.
Методи вивчення будови білків
Повний гідроліз або в лужному або в кислому середовищі.
Кислотний гідроліз проводять протягом 24 годин при t=1106-NHCl. Продукти гідролізу поділяються методом іонообмінної хроматографії (на колонці) із сульфолірованим полістиролом. Фракцинування амінокислоти: за допомогою нінгідрону за забарвленням визначають кількість амінокислоти. Потім вимивають та фотометрично визначають кожну амінокислоту. Таким чином, можна визначити легкі амінокислоти (відбитки пальців). Якщо білків мала кількість 10 -9, то використовують реактив-флуорескамін.
Визначення амінокислотної послідовності.
Треба переконатися, що ланцюг один.
1.Метод Сенгера:визна. одну АК сN-кінця
Можна використовувати дансилхлорид
(Так само як і в попередній р-ції тільки по хлору)

2. Метод Едмана – дозволяє визначити з N-кінця десятки амінокислот
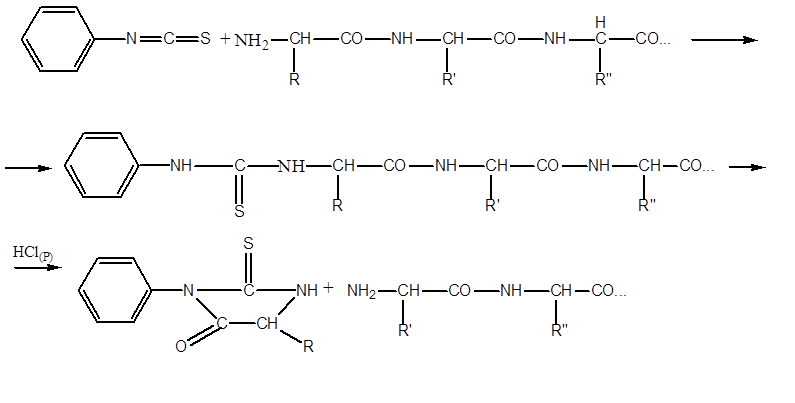
Едман сконструював прилад-секвенатор. білок поміщений у вигляді тонкої плівки в циліндр, що обертається. судину, де він піддається розщепленню Розшифрував 60 амінокислот з N-кінця міоглобіну кита.
3.Визначення 1-ої амінокислоти з-кінця гідразином.
4.Фермент карбоксипептидази може послідовно відщеплювати по 1-ій амінокислоті з С-кінця.Використовують для визначення невеликих поліпептидів (до 100)
Якщо більше ніж 100.
Трепсин- Розщеплює пептидні зв'язки, утворені з С-кінцем основних амінокислот - лізину та аргеніну.
Хемотрепсин– розщеплює пептидний зв'язок із с-кінця ароматичних та дикарбонових кислот.
Поділяють хроматоргафічно, починають визначати. Беруть знову порцію поліпептиду. Розщеплюють іншим способом, за допомогою хімічного реагенту використовують бромціан – розщеплення з С-кінця метиламіну. Дивляться, ділянки, що перекриваються, зіставляють.
Гідроксиламін-NH 2 OH-розщеплює зв'язок аспарагін-гліцин.
2-нітро-5тіоціанобензоат – розщеплює там де аміногрупа цистоїну.
1953 р. – інсулін – найперша послідовність. Імуноглобулін (4 поліпептидні ланцюги) – найбільший 1300 амінокислотних залишків.
У білках можна визначити всі амінокислоти.
Метод відбитків пальців
Бромціан розщипує з С-кінця метіаміну (90%HCOOH)
Визначення послідовності необхідне:
1) Для виявлення молекулярної основи біол. активності.
2) Як первинна структура впливає на втор-третій і четвертинну.
3) Зміна у послідовності може призвести до захворювання (спадкові).
4) Дані про білкову послідовність можуть багато сказати про еволюцію.
2 РНК
РНК- Н 3 РO 4; Рибоза; Аденін; Гуанін; цитозин; Урацил

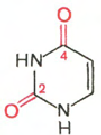
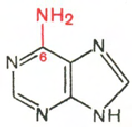
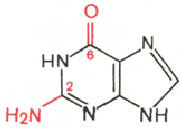
Цитозин Урацил Аденін Гуанін
Вуглеводи (рибоза та дезоксирибоза) у молекулах ДНК та РНК знаходяться у β-D-рибофуранозній формі:
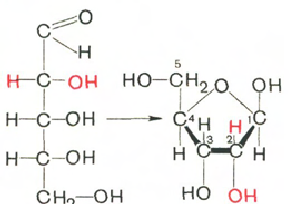
D-рибоза β-D-рибофураноза
Про кількість РНК немає точних даних, оскільки її у різних клітинах значною мірою визначається інтенсивністю синтезу білка. Перед РНК припадає близько 5–10% від загальної маси клітини. Сучасна класифікація різних типів клітинної РНК ґрунтується на даних топографії, функції та молекулярної маси. Виділяють три основні види РНК: матричну (інформаційну) - мРНК, яка становить 2-3% від усієї клітинної РНК; рибосомну – рРНК, що становить 80–85% та транспортну – тРНК, якій близько 16%. Ці 3 види відрізняються нуклеотидним складом та функціями.
Матрична РНК утворюється у процесі транскрипції. Вона несе точну копію генетичної інформації, закодованої в певній ділянці ДНК, а саме про послідовність амінокислот у білках.
Матрична РНК (мРНК) синтезується в ядрі на матриці ДНК, потім надходить у рибосому, виконуючи матричну функцію синтезу білка. мРНК при надходженні з ядра в цитоплазму утворює зі специфічними РНК-білками, що зв'язують, комплекси – так звані інформосоми, здатні до оборотної дисоціації. Інформосоми розглядаються як транспортна форма мРНК, що сприяє утворенню полірибосом у цитоплазмі.
Транспортні РНК
(тРНК) мають невелику молекулярну масу і містяться у розчинній фракції цитоплазми, виконуючи функцію перенесення амінокислот до місця білкового синтезу- Рібосомі. Молекула тРНК є одиночним полінуклеотидним ланцюгом, закрученим «на себе». Всі тРНК побудовані за одним планом, всі вони укладаються в модель «конюшинний лист». Головний принцип - утворення максимальної кількості водневих зв'язків між азотистими основами. Конюшинний лист містить п'ять спіралізованих стебел, чотири з яких закінчуються петлями з неспарених нуклеїтидів. У центрі молекули знаходиться неспіралізована область. 3' і 5' - кінці полінуклеотидного ланцюга спарені, утворюють акцептуючий стебло. Протистоїть акцептуючого стебла антикодонове стебло. Він несе антикодонову петлю, що складається з 7 нуклеотидів. Антикодонова петля містить у своїй середній частині антикодон, що складається з 3 нуклеотидів, комплементарний кодону даної амінокислоти в мРНК. Петля псевдоуридину, яку несе Т - стебло, містить мінорний компонент псевдоуридину. Вона складається із 7 нуклеотидних залишків. Припускають, що саме цією петлею тРНК взаємодіє з рибосомою. D-стебло несе петлю з 8-12 нуклеотидів. Це петля дигідроуридину, в ній завжди міститься кілька залишків мінорного компонента дигідроуридину. 
Рибосомна РНК - та основа, де розташовуються білки, утворюючи рибосому. Рибосоми локалізуються головним чином у цитоплазмі, крім того, - в ядрі мітохондріях та хлоропластах. Нуклеотидний склад подібний: переважають гуанілові нуклеотиди, уридилові та цитидилові – знаходяться у малих кількостях, мінорних підстав немає. За розмірами та молекулярною масою рибосоми ділять:
Бактеріальні рибосоми (щодо дрібних). Константа седиментації 70S.
Рибосоми еукаріотичних клітин. Константа седиментації 80S.
Рибосоми мітохондрій та хлоропластів.
При гідролізі РНК утворюються рибоза, аденін, гуанін, урацил, цитозин, фосфорна кислота.
Для опису будови білкової молекули були введені поняття про первинну, вторинну, третинну і четвертинну структури білкової молекули. У останні рокиз'явилися ще такі поняття, як надвторинна структура, що характеризує енергетично кращі агрегати вторинної структури, і домени - частини білкової глобули, що є досить відокремленими глобулярними ділянками.
Кількість та послідовність розташування амінокислот, та місце розташування дисульфідних зв'язків у поліпептидному ланцюгу визначають первинну структуру білка. Між первинною структурою білка та його функцією у даного організмуіснує сама тісний зв'язок. Для того, щоб білок виконував властиву йому функцію, необхідна певна послідовність амінокислот в поліпептидному ланцюгу цього білка. Навіть невеликі зміни в первинній структурі можуть значно змінювати властивості білка і, відповідно, його функції. Наприклад, в еритроцитах здорових людей міститься білок-гемоглобін з певною послідовністюамінокислот. Невелика частина людей має вроджену аномалію структури гемоглобіну: їх еритроцити містять гемоглобін, у якого в одному положенні замість глутамінової кислоти (зарядженої, полярної) міститься амінокислота валін (гідрофобна, неполярна). Такий гемоглобін суттєво відрізняється за фізико-хімічними та біологічним властивостямвід нормального. Поява гідрофобної амінокислоти, що призводить до виникнення «липкого» гідрофобного контакту (еритроцити погано пересуваються в кровоносних судинах), до зміни форми еритроциту (з двояковогнутого в серповидний), а також до погіршення перенесення кисню і т.д. Діти, що народилися з цією аномалією, ранньому дитинствігинуть від серповидноклітинної анемії.
Вичерпні докази на користь твердження, що біологічна активність визначається амінокислотною послідовністю, були отримані після штучного синтезу ферменту рибонуклеази (Мерріфілд). Синтезований поліпептид з тією ж амінокислотною послідовністю, що і природний фермент, мав таку ж ферментативну активність.
Дослідження останніх десятиліть показали, що первинна структура закріплена генетично і у свою чергу визначає вторинну, третинну та четвертинну структури білкової молекули та її загальну конформацію. Першим білком, у якого була встановлена первинна структура, був білковий гормон інсулін (містить 51 амінокислоту). Це було зроблено 1953 р. Фредеріком Сенгером. Наразі розшифровано первинну структуру понад десять тисяч білків, але це дуже невелика кількість, якщо врахувати, що у природі білків близько 10 12 .
Знаючи первинну структуру білка, можна точно написати його структурну формулуякщо білок представлений одним поліпептидним ланцюгом. Якщо до складу білка входить кілька поліпептидних ланцюгів, їх попередньо роз'єднують, використовуючи спеціальні реактиви. Для визначення первинної структури окремого поліпептидного ланцюга, методами гідролізу з використанням амінокислотних аналізаторів, встановлюють його амінокислотний склад. Потім, застосовуючи спеціальні методита реагенти, визначають природу кінцевих амінокислот. Для встановлення порядку чергування амінокислот поліпептидний ланцюг піддають ферментативному гідролізу, при якому утворюються уламки цього поліпептидного ланцюга - короткі пептиди. Ці пептиди поділяють методом хроматографії та встановлюють послідовність амінокислот у кожному. Таким чином, досягається етап, коли послідовність амінокислот в окремих пептидах (фрагментах білка) відома, але залишається нез'ясованою послідовність самих пептидів. Останню встановлюють за допомогою так званих пептидів, що перекриваються. Для цього використовуються будь-який інший фермент, що розщеплює вихідний поліпептидний ланцюг в інших ділянках, і визначають амінокислотну послідовність знову отриманих пептидів. Пептиди, утворені під дією двох ферментів, містять однакові фрагменти амінокислотних послідовностей, поєднуючи їх встановлюють загальну амінокислотну послідовність поліпептидного ланцюга.
Великий внесоку вивчення будови білкової молекули зробили Л.Полінг та Р.Корі. Звернувши увагу на те, що в молекулі білка найбільше пептидних зв'язків, вони першими провели ретельні рентгеноструктурні дослідження цього зв'язку. Вивчили довжини зв'язків, кути під якими розташовуються атоми, напрямок розташування атомів щодо зв'язку. З досліджень було встановлено такі основні характеристики пептидного зв'язку.
1. Чотири атоми пептидного зв'язку та два приєднані
a-вуглецевих атомів лежать в одній площині. Групи R і Н a-вуглецевих атомів лежать поза цією площиною.
2. Атоми Про та Н пептидного зв'язку та два a-вуглецевих атоми та R-групи мають транс-орієнтацію щодо пептидного зв'язку.
3. Довжина зв'язку С-N, що дорівнює 1,32 Å, має проміжне значення між довжиною подвійного ковалентного зв'язку (1,21 Å) і однорідного ковалентного зв'язку (1,47 Å). Звідси випливає, що зв'язок С-N має частково характер подвійного зв'язку. Тобто. пептидна зв'язок може існувати у вигляді резонансних та таутамерних структур, у кето-енольній формі.

Обертання навколо зв'язку –С=N– утруднено і всі атоми, що входять до пептидної групи, мають планарну транс-конфігурацію. Цис-конфігурація є енергетично менш вигідною і зустрічається лише деяких циклічних пептидах. Кожен пептидний планарний фрагмент містить два зв'язки з a-вуглецевими атомами, здатними до обертання. Це зв'язку З a –N (кут обертання навколо зв'язку позначається j) і зв'язок З a –З (кут обертання навколо зв'язку позначається y).
Пептидна зв'язок за своєю хімічною природою є ковалентною і надає високої міцності первинної структури білкової молекули. Будучи повторюваним елементом поліпептидного ланцюга і маючи специфічні особливості структури, пептидний зв'язок впливає не тільки на форму первинної структури, але і на найвищі рівніорганізації поліпептидного кола.
Особливості будови пептидного зв'язку, її впливом геть формування вторинної структури білка (а-спіраль, складчастий лист, статистичний клубок). Зв'язки, що стабілізують вторинну структуру білкової молекули.
Вторинна структурабілкової молекули утворюється в результаті того чи іншого виду вільного обертання навколо зв'язків, що з'єднують
a-вуглецеві атоми в поліпептидному ланцюзі.
У природних поліпептидних ланцюгах виявлено три основні типи структури: a-спіраль, складчастий лист та статистичний клубок. Спіральна структура утворюється якщо в ланцюзі однакові кути поворотів (j) для всіх зв'язків С a -N і кутом повороту (y) для всіх зв'язків С a -З рівні відповідно -48º і -57º. Найчастіше зустрічається правозакручена
a-спіраль. Ця структура дуже стабільна, т.к. в ній майже або повністю відсутні стеричні труднощі, особливо R-груп бічних ланцюгів амінокислот. R-групи амінокислот спрямовані назовні від центральної осі a-спіралі. В a-спіралі диполі =С=О і N-Н сусідніх пептидних зв'язків орієнтовані оптимальним чином (майже коаксіальні) для дипольної взаємодії, утворюючи внаслідок цього велику систему внутрішньомолекулярних кооперативних водневих зв'язків, що стабілізують a-спіраль. Крок спіралі (один повний виток) 5,4Å включає 3,6 амінокислотних залишку.

Малюнок 1 – Структура та параметри a-спіралі білка
Спіральну структуру можуть порушити два фактори:
1) наявність залишку проліну, циклічна структура якого вносить злам у пептидний ланцюг – немає групи –NН 2 , тому неможливо утворення внутрішньоланцюжкового водневого зв'язку;

2) якщо в поліпептидному ланцюзі поспіль розташовано багато залишків амінокислот, що мають позитивний заряд (лізин, аргінін) або негативний заряд (глутаміновий, аспарагінової кислот), у цьому випадку сильне взаємне відштовхування однойменнозаряджених груп (–СОО – або –NН 3 +) значно перевищує стабілізуючий вплив водневих зв'язків у
a-спіралі.
Структура типу складчастого листа також стабілізована водневими зв'язками між тими самими диполями =NН...... О=С<. Однако в этом случае возникает совершенно иная структура, при которой остов полипептидной цепи вытянут таким образом, что имеет зигзагообразную структуру. Углы вращения для связей С a -N (j) и С a -С (y) близки соответственно к –120+135 0 . Складчатые участки полипептидной цепи проявляют кооперативные свойства, т.е. стремятся расположиться рядом в белковой молекуле, и формируют параллельные

однаковоспрямовані поліпептидні ланцюги або антипаралельні,

які зміцнюються завдяки водневим зв'язкам між цими ланцюгами. Такі структури називаються b-складчастими листами (рисунок 2).

Малюнок 2 – b-структура поліпептидних ланцюгів
a-Спіральні складчасті листи – це впорядковані структури, у яких є регулярне укладання амінокислотних залишків у просторі. Ділянки білкового ланцюга з нерегулярним укладанням амінокислотних залишків у просторі, які також утримуються завдяки водневим зв'язкам – називаються невпорядкованими, безструктурними – статистичним клубком. Всі ці структури виникають спонтанно та автоматично внаслідок того, що даний поліпептид має певну амінокислотну послідовність, яка зумовлена генетично. a-спіралі та
b-структури зумовлюють певну здатність білків до виконання специфічних біологічних функцій. Так, a-спіральна структура (a-кератин) добре пристосована до того, щоб утворювати зовнішні захисні структури-пір'я, волосся, роги, копита. b-структура сприяє утворенню гнучких та нерозтяжних ниток шовку та павутини, а конформація білка колагену забезпечує високу міцність на розрив, необхідну для сухожиль. Наявність тільки a-спіралей або b-структур характерна для ниткоподібно-фібрилярних білків. У складі глобулярно-кулястих білків вміст a-спіралей і b-структур і безструктурних ділянок сильно варіює. Наприклад: інсулін спіралізований на 60%, фермент рибонуклеазу – 57%, білок курячого яйця лізоцим – на 40%.
Відомості про чергування амінокислотних залишків у поліпептидному ланцюгу, а також про наявність у білковій молекулі спіралізованих, складчастих і невпорядкованих ділянок ще не дають повного уявлення ні про об'єм, ні про форму, ні тим більше про взаємне розташування ділянок поліпептидного ланцюга по відношенню один до одного.
Ці особливості будови білка з'ясовуються щодо його третинної структури, під якою розуміють загальне розташування у просторі у певному обсязі поліпептидної ланцюга.






