Первичная структура белков
|
ОПРЕДЕЛЕНИЕ ПЕРВИЧНОЙ СТРУКТУРЫ БЕЛКА |
Определение первичной структуры белка требут
предварительного проведения ряда операций. Белок
должен быть тщательно очищен, чистота материала должна быть подтверждена как
минимум двумя независимыми методами. Чаще всего использется
гель-электрофорез на полиакриламиде
(ПААГ) и ультрацентрифугирование
. После очистки белка его делят на
две-три или более частей. Каждую часть обрабатывают разными ферментами-
протеиназами
(трипсин,
химотрипсин) или реагентами (бромциан, иодозобензойная
кислота). В результате получают два-три (или более) наборов полипептидов
(отрезков белка). К ферментам-протеиназам
предъявляются особые требования по чистоте, иначе будет затруднено последующее
определение последовательности чередования отрезков пептидов в нативной
цепи белка. Особые сложности представляет
распознавание мест дисульфидных
мостиков между
остатками цистеина. Полученная смесь пептидов разделяется электрофорезом, после
чего возможно начать непосредственно процедуру севенирования
.
Длина отдельного пептида не должна превышать 40 АК-остатков.
Наиболее часто используемым методом секвенирования
пептидов (установления последовательности АК-остатков в них) является процедура
П. Эдмана
,
с использованием
фенилизотиоцианата
(ФИТЦ). Процедура лежит в основе
работы автоматических
секвенаторов
.
Образец очищенного пептида наносится на поверхность реакционного сосуда в виде
пленки. Часто осуществляют ковалентное пришивание пептида с конца свободной
СООН-группы с материалом поверхности реакционного сосуда. После чего проводят
повторяющиеся циклы из серии реакций. Одна серия реакций включает:
- взаимодействие ФИТЦ с концевым АК-остатком, имеющим свободную NH 2 -группу,
при этом образуется так называемое ФТК-
(фенилтиокарбамоил
)-производное:
- избыток ФИТЦ удаляется, меняется рН среды добавлением гептафтормасляной
кислоты, при этом происходит превращение ФТК в ФТГ (фенилтиогидантоин
)-производное:
- ФТГ-производное аминокислоты удаляется из реакционной среды экстракцией с 1-хлорбутаном
и серия реакций повторяется в следующем цикле.
За один цикл удаляется один аминокислотный остаток с NH2-края пептида. Поскольку,
реакции с ФИТЦ протекают не количественно, а в лучшем случае, на 95 процентов,
постепенно накапливаются мешающие факторы-
ФТГ-производные от не прореагировавших в предыдущие циклы АК-остатков. В самых
благоприятных случаях удается надежно идентифицировать последовательность всего
только около 40 АК-остатков. Однако, благодаря автоматизации процесса, работа
все же существенно облегчается.
РАСШИФРОВКА ПРИ ПОМОЩИ ПЕПТИДАЗ:
а) с N-концевых остатков при помощи АМИНОПЕПТИДАЗ (хроматографическая идентификация и кинетика накопления соответствующих АК.
б) с С-концов при помощи карбоксипептидаз (аналогично).
ГИДРАЗИНОЛИЗ (в безводной среде при 100 град С) за исключением последнего остатка со свободной СООН, все превращаются в гидразиды кислот:
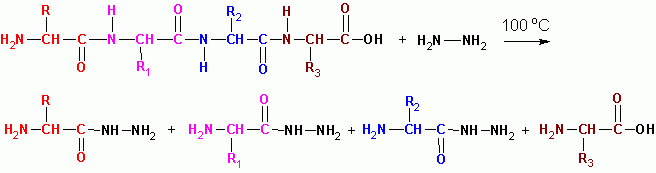
Порядок чередования пептидов в молекулах белков определяется по перекрыванию фрагментов пептидов:
G-W-V-R A-O-V-K C-E-C-D триптические пептиды (трипсин)
G-W V-R-A-O V-K-C-E-C-D химотриптические пептиды (химотрипсин)
РЕКОМЕНДУЕМАЯ ЛИТЕРАТУРА:
1. Строев Е.А. Биологическая химия. М., 1986.
2. Страйер
Л. Биохимия, в 3-х т. М., Мир, 1984.
3. Уайт, Хендлер
, Смит и др. Основы биохимии, в 3-х
т. М., Мир, 1981.
4. Овчинников Ю.А. Биоорганическая химия, М., Просвещение, 1987.
5. Анисимов и др. Основы биохимии. М., Высшая школа, 1986.
Одной из особенностей белков является их сложная структурная организация. Все белки обладают первичной, вторичной и третичной структурой, а те, которые в своем составе имеют две и больше ППЦ обладают и четвертичной структурой (ЧС).
Первичная структура белка (ПСБ) – это порядок чередования (последовательность) аминокислотных остатков в ППЦ .
Даже одинаковые по своей длине и аминокислотному составу белки могут быть разными веществами. Например, из двух аминокислот можно составить 2 разных дипептида:
При числе аминокислот, равном 20, число возможных комбинаций равно 210 18 . А если учесть, что в ППЦ каждая аминокислота может встретиться больше 1 раза, то число возможных вариантов трудно поддается подсчету.
Определение первичной структуры белка (псб).
ПСБ
белков можно определить с помощью
фенилтиогидантоинового
метода
.
Этот метод основан на реакции взаимодействия
фенилизотиоцианата
(ФИТЦ) с
α-АК. В результате образуется комплекс
этих двух соединений – ФИТЦ
-АК
.
Например, рассмотрим пептид![]() с
целью определения его ПСБ, то есть
последовательности соединения
аминокислотных остатков.
с
целью определения его ПСБ, то есть
последовательности соединения
аминокислотных остатков.
ФИТЦ
взаимодействует с концевой аминокислотой
(а). Образуется комплекс ФТГ-а
,
его отделяют от смеси и определяют
подлинность аминокислоты а
.
Например, это – асн
![]() и т.д. Последовательно отделяют и
идентифицируют все остальные аминокислоты.
Это трудоемкий процесс. Определение
ПСБ белка среднего размера занимает
несколько месяцев.
и т.д. Последовательно отделяют и
идентифицируют все остальные аминокислоты.
Это трудоемкий процесс. Определение
ПСБ белка среднего размера занимает
несколько месяцев.
Приоритет в расшифровке ПСБ принадлежит Сенджеру (1953), который открыл ПСБ инсулина (Лауреат Нобелевской премии). Молекула инсулина состоит из 2х ППЦ – A и B.
А-цепь состоит из 21 аминокислоты, цепь В – из 30. Между собой ППЦ соединяются дисульфидными мостиками. Число белков, ПСБ которых определена, к настоящему времени достигает 1500. Даже небольшие изменения первичной структуры могут существенно изменить свойства белка. В эритроцитах здоровых людей содержится HbA – при замене в -цепи HbA, в 6-м положении глу на вал возникает тяжелейшее заболевание серповидно-клеточная анемия , при которой дети, родившиеся с этой аномалией, погибают в раннем возрасте. С другой стороны, возможны варианты изменения ПСБ, которые не сказываются на его физико-химических и биологических свойствах. Например , HbC содержит в 6-м положении b-цепи вместо глу – лиз, HbС почти не отличается по своим свойствам от HbA, а люди, имеющие в эритроцитах такой Hb, практически здоровы.
Стабильность ПСБ обеспечивается в основном прочными ковалентными пептидными связями и, во вторую очередь, дисульфидными связями.
Вторичная структура белка (всб).
ППЦ белков обладают большой гибкостью и приобретают определенную пространственную структуру или конформацию . В белках различают 2 уровня такой конформации – это ВСБ и третичная структура (ТСБ).
ВСБ – это конфигурация ППЦ, то есть способ ее укладки или скручивания в какую-нибудь конформацию, в соответствии с программой, заложенной в П СБ.
Известны три основных типа ВСБ :
1) -спираль ;
2) b -структура (складчатый слой или складчатый листок);
3) беспорядочный клубок.
-спираль .
Ее модель предложена В. Полингом. Она наиболее вероятна для глобулярных белков. Для любой системы наиболее устойчивым является состояние, соответствующее минимуму свободной энергии. Для пептидов такое состояние имеет место, когда CO– и NH– группы соединяются между собой слабой водородной связью. В a -спирали NH– группы 1-го аминокислотного остатка взаимодействует с CO–группой 4-ой по счету аминокислотой. В результате пептидный остов образует спираль, на каждый виток которой приходится 3,6 АК-остатка.
1 шаг спирали (1 виток) = 3,6 АК = 0,54 нм, угол
подъема –
26°
Закручивание ППЦ происходит по часовой стрелке, то есть у спирали – правый ход. Через каждые 5 витков (18 АК; 2,7 нм) конфигурация ППЦ повторяется.
Стабилизируется ВСБ в первую очередь водородными связями, и во вторую – пептидными и дисульфидными. Водородные связи в 10-100 раз слабее обычных химических связей; однако за счет их большого количества они обеспечивают определенную жесткость и компактность ВСБ. Боковые R-цепи a-спирали обращены к наружи и расположены по разные стороны от ее оси.
b -структура .
Это складчатые участки ППЦ, по форме напоминающие листок, сложенный в гармошку. Слои ППЦ могут быть параллельными, если обе цепи начинаются с N– или С–конца.
Если смежные цепи в слое ориентированы противоположными концами N–С и С–N, то они называются антипараллельными .
 паралельные
паралельные
антипараллельные
Образование водородных связей происходит, как и в a-спирали, между CO– и NH– группами.
Определение первичной структуры белков
Определению первичной структуры предшествует денатурация и разрыв поперечных дисульфидных связей в белке. Это достигается посредством избытка меркаптоэтанола.
Цистин превращается в два остатка цистеина, которые затем блокируют избытком иодуксусной кислоты, чтобы предотвратить обратное образование связей - S-S-.
Расщепление полипептидной цепи на фрагменты проводят обычно при помощи протеолитических ферментов, таких, как трипсин, химотрипсин или пепсин. Эти ферменты действуют на различные участки полипептидной цепи, так как имеют повышенное сродство к различным аминокислотным остаткам. Необходимо учитывать также соседние аминокислотные остатки, т.е. пространственное окружение атакуемой пептидной связи. Оказалось, что трипсин гидролизует только те пептидные связи, в образовании которых участвует карбоксильная группа лизина или аргинина, а химотрипсин гидролизует связи по фенилаланину, триптофану и тирозину. Обычно протеолитические ферменты, гидролизующие полипептидные цепи, предварительно иммобилизуют на нерастворимых матрицах для более легкого отделения их от продуктов гидролиза. Далее определяют аминокислотные последовательности каждого полипептидного фрагмента. Для этого чаще всего используют метод Эдмана, заключающийся в анализе полипептида только с N-конца. Концевая аминокислота при взаимодействии с фенилизотиоцианатом в щелочной среде образует стойкое соединение, которое можно отщепить от полипептида без его деградации. Фенилтиогидантоиновое (ФТГ) производное аминокислоты идентифицируется хроматографическим методом.
После идентификации концевого N-аминокислотного остатка метка вводится в следующий аминокислотный остаток, который становится концевым. Метод Эдмана можно автоматизировать, пользуя секвенатор (от англ. sequetice - последовательность) с помощью которого ФТГ-производные отщепляются от полипептида и идентифицируются посредством высокоэффективной жидкостной хроматографии.
Ф. Сэнгер впервые полностью расшифровал первичную структуру белкового гормона инсулина, используя метод Эдмана.
Другим высокочувствительным методом является так называемый дансильный метод, связанный с присоединением к концевой аминокислоте дансилхлорида (1-диметиламино-нафталин-5-сульфохлорида) по следующей схеме:
Первичная структура белка может быть установлена косвенно следующим образом: сначала получают соответствующую кДНК., затем идентифицируют клон, относящийся к анализируемому белку, и по чередованию в нем нуклеотидов с использованием библиотеки аминокислотных последовательностей определяют первичную структуру белка.
Определение вторичной структуры белков
Для определения вторичной структуры белков используются в основном оптические методы. Конечно, более надежным является рентгеноструктурный метод, однако его применение сопряжено с определенными трудностями и требует значительного времени. Такие оптические методы, как дисперсия оптического вращения и круговой дихроизм, являются более простыми и, что весьма важно, позволяют определять изменения вторичной структуры белка в растворах. При помощи дисперсии оптического вращения можно получить информацию о степени спирализации белковой макромолекулы. Несмотря на то, что метод является приближенным, достаточно отчетливо просматриваются переходы типа спираль-клубок. Что касается метода кругового дихроизма, то его спектр определяется набором углов ш и ц, свойственных тому или иному типу вторичной структуры. Оба метода можно расценивать как скриннинговые, и для полной идентификации вторичной структуры их надо комбинировать с рентгеноструктурным анализом белков.
Методы изучения строения белков
Полный гидролиз либо в щелочной, либо в кислой среде.
Кислотный гидролиз проводят в течение 24 часов при t= 110 6-NHCl. Продукты гидролиза разделяются методом ионообменной хроматографии (на колонке) с сульфолированным полистиролом. Фракцинирование аминокислоты: с помощью нингидрона по окраске определяют количество аминокислоты. Затем вымывают и фотометрически определяют каждую аминокислоту. Таким образом можно определить легкие аминокислоты (отпечатки пальцев). Если белков малое количество 10 -9 , то используют реактив- флуорескамин.
Определение аминокислотной последовательности.
Надо убедиться, что цепь одна.
1.Метод Сенгера: опред. одну АК сN-конца
Можно использовать дансилхлорид
(так же как и в предыдущей р-ции только по хлору)

2. Метод Эдмана – позволяет определить с N-конца десятки аминокислот
Эдман сконструировал прибор– секвенатор. белок помещен в виде тонкой пленки во вращающейся цилиндр. сосуд, где он подвергается расщеплению Расшифровал 60 аминокислот с N-конца миоглобина кита.
3.Определение 1-ой аминокислоты с с-конца гидразином.
4.Фермент карбоксипептидазы может последовательно отщеплять по 1-ой аминокислоте с С-конца. Используют для определения небольших полипептидов (до 100)
Если больше 100.
Трепсин – расщепляет пептидные связи, образованные с С-концом основных аминокислот – лизина и аргенина.
Хемотрепсин – расщепляет пептидную связь с с-конца ароматических и дикарбоновых кислот.
Разделяют хроматоргафически, начинают определять. Берут снова порцию полипептида. Расщепляют другим способом, с помощью химического реагента, используют бромциан – расщепление с С-конца метиламина. Смотрят, перекрывающиеся участки сопоставляют.
Гидроксиламин –NH 2 OH- расщепляет связь аспарагин-глицин.
2-нитро-5тиоцианобензоат – расщепляет там где аминогруппа цистоина.
1953 г. – инсулин – самая 1-ая последовательность. Иммуноглобулин (4 полипептидные цепи) – самый крупный 1300 аминокислотных остатков.
В белках могут быть определены все аминокислоты.
Метод отпечатков пальцев
Бромциан расщипляет с С-конца метиамина(в 90% HCOOH )
Определение последовательности нужно для:
1) Для выявления молекулярной основы биол. активности.
2) Как первичная структура влияет на втор- трет- и четвертичную.
3) Изменение в последовательности может привести к заболеванием (наследственные).
4) Данные о белковой последовательности могут многое сказать об эволюции.
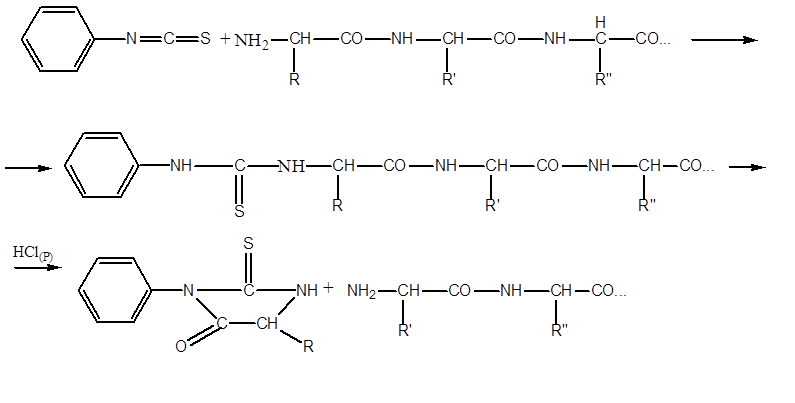
2 РНК
РНК - Н 3 РO 4 ; Рибоза; Аденин; Гуанин; Цитозин; Урацил

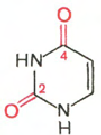
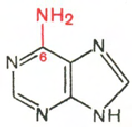
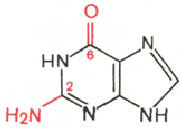
Цитозин Урацил Аденин Гуанин
Углеводы (рибоза и дезоксирибоза) в молекулах ДНК и РНК находятся в β-D-рибофуранозной форме:
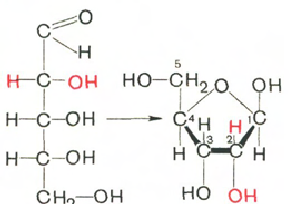
D-рибоза β-D-рибофураноза
О количестве РНК нет точных данных, поскольку содержание ее в разных клетках в значительной степени определяется интенсивностью синтеза белка. На долю РНК приходится около 5–10% от общей массы клетки. Современная классификация различных типов клеточной РНК основывается на данных топографии, функции и молекулярной массы. Выделяют три главных вида РНК: матричную (информационную) – мРНК, которая составляет 2–3% от всей клеточной РНК; рибосомную – рРНК, составляющую 80–85% и транспортную – тРНК, которой около 16%. Эти 3 вида различаются нуклеотидным составом и функциями.
Матричная РНК образуется в процессе транскрипции. Она несет точную копию генетической информации, закодированной в определенном участке ДНК, а именно о последовательности аминокислот в белках.
Матричная РНК (мРНК) синтезируется в ядре на матрице ДНК, затем поступает в рибосому, выполняя матричную функцию при синтезе белка. мРНК при поступлении из ядра в цитоплазму образует со специфическими РНК-связывающими белками комплексы – так называемые информосомы, способные к обратимой диссоциации. Информосомы рассматриваются как транспортная форма мРНК, способствующая образованию полирибосом в цитоплазме.
Транспортные
РНК
(тРНК) имеют небольшую молекулярную
массу и содержатся в растворимой фракции
цитоплазмы, выполняя функцию переноса
аминокислот к месту белкового синтеза
– рибосоме. Молекула тРНК представляет
собой одиночную полинуклеотидную цепь,
закрученную «на себя». Все тРНК построены
по одному плану, все они укладываются
в модель «клеверный лист». Главный
принцип – образование максимального
числа водородных связей между азотистыми
основаниями. «Клеверный лист» содержит
пять спирализованных стеблей, четыре
из которых заканчиваются петлями из
неспаренных нуклеитидов. В центре
молекулы находится неспирализованная
область. 3’ и 5’ – концы полинуклеотидной
цепи спарены, образуют акцептирующий
стебель. Противостоит акцептирующему
стеблю антикодоновый стебель. Он несет
антикодоновую петлю, которая состоит
из 7 нуклеотидов. Антикодоновая петля
содержит в своей средней части антикодон,
состоящий из 3 нуклеотидов, комплементарный
кодону данной аминокислоты в мРНК. Петля
псевдоуридина, которую несет Т - стебель,
содержит минорный компонент псевдоуридин.
Она состоит из 7 нуклеотидных остатков.
Предполагают, что именно этой петлей
тРНК взаимодействует с рибосомой.D– стебель несет петлю из 8-12 нуклеотидов.
Это петля дигидроуридина, в ней всегда
содержится несколько остатков минорного
компонента дигидроуридина.
Рибосомная РНК - та основа, на которой располагаются белки, образуя рибосому. Рибосомы локализуются главным образом в цитоплазме, кроме того,- в ядре митохондриях и хлоропластах. Нуклеотидный состав сходен: преобладают гуаниловые нуклеотиды, уридиловые и цитидиловые – находятся в малых количествах, минорных оснований нет. По размерам и молекулярной массе рибосомы делят:
Бактериальные рибосомы (относительно мелкие). Константа седиментации 70S.
Рибосомы эукариотических клеток. Константа седиментации 80S.
Рибосомы митохондрий и хлоропластов.
При гидролизе РНК образуются рибоза, аденин, гуанин, урацил, цитозин, фосфорная кислота.
Для описания строения белковой молекулы были введены понятия о первичной, вторичной, третичной и четвертичной структурах белковой молекулы. В последние годы появились еще такие понятия, как сверхвторичная структура, характеризующая энергетически предпочтительные агрегаты вторичной структуры, и домены – части белковой глобулы, представляющие собой достаточно обособленные глобулярные области.
Количество и последовательность расположения аминокислот, и местоположение дисульфидных связей в полипептидной цепи определяют первичную структуру белка. Между первичной структурой белка и его функцией у данного организма существует самая тесная связь. Для того, чтобы белок выполнял свойственную ему функцию, необходима совершенно определенная последовательность аминокислот в полипептидной цепи этого белка. Даже небольшие изменения в первичной структуре могут значительно изменять свойства белка и соответственно его функции. Например, в эритроцитах здоровых людей содержится белок– гемоглобин с определенной последовательностью аминокислот. Небольшая часть людей имеет врожденную аномалию структуры гемоглобина: их эритроциты содержат гемоглобин, у которого в одном положении вместо глутаминовой кислоты (заряженной, полярной) содержится аминокислота валин (гидрофобная, неполярная). Такой гемоглобин существенно отличается по физико-химическим и биологическим свойствам от нормального. Появление гидрофобной аминокислоты, приводит к возникновению «липкого» гидрофобного контакта (эритроциты плохо передвигаются в кровеносных сосудах), к изменению формы эритроцита (из двояковогнутого в серповидный), а также к ухудшению переноса кислорода и т.д. Дети, родившееся с этой аномалией, в раннем детстве погибают от серповидноклеточной анемии.
Исчерпывающие доказательства в пользу утверждения, что биологическая активность определяется аминокислотной последовательностью, были получены, после искусственного синтеза фермента рибонуклеазы (Меррифилд). Синтезированный полипептид с той же аминокислотной последовательностью, что и естественный фермент, обладал такой же ферментативной активностью.
Исследования последних десятилетий показали, что первичная структура закреплена генетически и в свою очередь определяет вторичную, третичную и четвертичную структуры белковой молекулы и ее общую конформацию. Первым белком, у которого была установлена первичная структура, был белковый гормон инсулин (содержит 51 аминокислоту). Это было сделано в 1953 г. Фредериком Сэнгером. К настоящему времени расшифрована первичная структура более десяти тысяч белков, но это очень небольшое количество, если учесть, что в природе белков около 10 12 .
Зная первичную структуру белка, можно точно написать его структурную формулу, если белок представлен одной полипептидной цепью. Если в состав белка входит несколько полипептидных цепей, то их предварительно разъединяют, используя специальные реактивы. Для определения первичной структуры отдельной полипептидной цепи, методами гидролиза с использованием аминокислотных анализаторов, устанавливают ее аминокислотный состав. Затем, применяя специальные методы и реагенты, определяют природу концевых аминокислот. Для установления порядка чередования аминокислот, полипептидную цепь подвергают ферментативному гидролизу, при котором образуются осколки этой полипептидной цепи – короткие пептиды. Эти пептиды разделяют методом хроматографии и устанавливают последовательность аминокислот в каждом. Таким образом, достигается этап, когда последовательность аминокислот в отдельных пептидах (фрагментах белка) известна, но остается невыясненной последовательность самих пептидов. Последнюю устанавливают с помощью так называемых перекрывающихся пептидов. Для этого используются какой-либо другой фермент, расщепляющий исходную полипептидную цепь в других участках, и определяют аминокислотную последовательность вновь полученных пептидов. Пептиды, образованные под действием двух ферментов, содержат одинаковые фрагменты аминокислотных последовательностей., совмещая их устанавливают общую аминокислотную последовательность полипептидной цепи.
Большой вклад в изучение строения белковой молекулы сделали Л.Полинг и Р.Кори. Обратив внимание на то, что в молекуле белка больше всего пептидных связей, они первыми провели кропотливые рентгеноструктурные исследования этой связи. Изучили длины связей, углы под которыми располагаются атомы, направление расположения атомов относительно связи. На основании исследований были установлены следующие основные характеристики пептидной связи.
1. Четыре атома пептидной связи и два присоединенных
a-углеродных атома лежат в одной плоскости. Группы R и Н a-углеродных атомов лежат вне этой плоскости.
2. Атомы О и Н пептидной связи и два a-углеродных атома и R-группы имеют транс-ориентацию относительно пептидной связи.
3. Длина связи С-N, равная 1,32 Å, имеет промежуточное значение между длиной двойной ковалентной связи (1,21 Å) и однородной ковалентной связи (1,47 Å). Отсюда следует, что связь С-N имеет частично характер двойной связи. Т.е. пептидная связь может существовать в виде резонансных и таутамерных структур, в кето-енольной форме.

Вращение вокруг связи –С=N– затруднено и все атомы, входящие в пептидную группу, имеют планарную транс-конфигурацию. Цис-конфигурация является энергетически менее выгодной и встречается лишь в некоторых циклических пептидах. Каждый планарный пептидный фрагмент содержит две связи с a-углеродными атомами, способными к вращению. Это связи С a –N (угол вращения вокруг этой связи обозначается j) и связь С a –С (угол вращения вокруг этой связи обозначается y).
Пептидная связь по своей химической природе является ковалентной и придает высокую прочность первичной структуре белковой молекулы. Являясь повторяющимся элементом полипептидной цепи и имея специфические особенности структуры, пептидная связь влияет не только на форму первичной структуры, но и на высшие уровни организации полипептидной цепи.
Особенности строения пептидной связи, ее влияние на формирование вторичной структуры белка (а-спираль, складчатый лист, статистический клубок). Связи стабилизирующие вторичную структуру белковой молекулы.
Вторичная структура белковой молекулы образуется в результате того или иного вида свободного вращения вокруг связей, соединяющих
a-углеродные атомы в полипептидной цепи.
В природных полипептидных цепях обнаружены три основных типа структуры: a-спираль, складчатый лист и статистический клубок. Спиральная структура образуется если в цепи одинаковые углы поворотов (j) для всех связей С a –N и углом поворота (y) для всех связей С a –С и равны соответственно –48º и –57º. Наиболее часто встречается правозакрученная
a-спираль. Эта структура очень стабильна, т.к. в ней почти или полностью отсутствуют стерические затруднения, особенно для R-групп боковых цепей аминокислот. R-группы аминокислот направлены наружу от центральной оси a-спирали. В a-спирали диполи =С=О и >N–Н соседних пептидных связей ориентированы оптимальным образом (почти коаксиальны) для дипольного взаимодействия, образуя вследствие этого обширную систему внутримолекулярных кооперативных водородных связей, стабилизирующих a-спираль. Шаг спирали (один полный виток) 5,4Å включает, 3,6 аминокислотных остатка.

Рисунок 1 – Структура и параметры a-спирали белка
Спиральную структуру могут нарушить два фактора:
1) в наличие остатка пролина, циклическая структура которого вносит излом в пептидную цепь – нет группы –NН 2 , поэтому невозможно образования внутрицепочечной водородной связи;

2) если в полипептидной цепи подряд расположено много остатков аминокислот, имеющих положительный заряд (лизин, аргинин) или отрицательный заряд (глутаминовой, аспарагиновой кислот), в этом случае сильное взаимное отталкивание одноименнозаряженных групп (–СОО – или –NН 3 +) значительно превосходит стабилизирующее влияние водородных связей в
a-спирали.
Структура типа складчатого листа также стабилизирована водородными связями между теми же диполями =NН...... О=С<. Однако в этом случае возникает совершенно иная структура, при которой остов полипептидной цепи вытянут таким образом, что имеет зигзагообразную структуру. Углы вращения для связей С a -N (j) и С a -С (y) близки соответственно к –120+135 0 . Складчатые участки полипептидной цепи проявляют кооперативные свойства, т.е. стремятся расположиться рядом в белковой молекуле, и формируют параллельные

одинаковонаправленные полипептидные цепи или антипараллельные,

которые укрепляются благодаря водородным связям между этими цепями. Такие структуры называются b-складчатые листы (рисунок 2).

Рисунок 2 – b-структура полипептидных цепей
a-Спиральные складчатые листы – это упорядоченные структуры, в них имеется регулярная укладка аминокислотных остатков в пространстве. Участки белковой цепи с нерегулярной укладкой аминокислотных остатков в пространстве, которые также удерживаются благодаря водородным связям – называются неупорядоченными, бесструктурными – статистическим клубком. Все эти структуры возникают самопроизвольно и автоматически вследствие того, что данный полипептид имеет определенную аминокислотную последовательность, которая предопределена генетически. a-спирали и
b-структуры обуславливают определенную способность белков к выполнению специфических биологических функций. Так, a-спиральная структура (a-кератин) хорошо приспособлена к тому, чтобы образовывать наружные защитные структуры-перья, волосы, рога, копыта. b-структура способствует образованию гибких и нерастяжимых нитей шелка и паутины, а конформация белка коллагена обеспечивает высокую прочность на разрыв, необходимую для сухожилий. Наличие только a-спиралей или b-структур характерно для нитевидных-фибрилярных белков. В составе глобулярных-шаровидных белков содержание a-спиралей и b-структур и бесструктурных участков сильно варьирует. Например: инсулин спирализован-на 60%, фермент рибонуклеаза – 57%, белок куриного яйца лизоцим – на 40%.
Сведения о чередовании аминокислотных остатков в полипептидной цепи, а также о наличии в белковой молекуле спирализованных, складчатых и неупорядоченных участков еще не дают полного представления ни об объеме, ни о форме, ни тем более о взаимном расположении участков полипептидной цепи по отношению друг к другу.
Эти особенности строения белка выясняются при изучении его третичной структуры, под которой понимают общее расположение в пространстве в определенном объеме полипептидной цепи.






