องค์ประกอบของโปรตีน การใช้วิตามินอี บันทึกบรรยาย
เอนไซม์ - ตัวเร่งปฏิกิริยาโปรตีนที่ควบคุมอัตราการเกิดปฏิกิริยาเคมีในร่างกาย
ฮอร์โมนธรรมชาติของโปรตีน - สารควบคุมการเผาผลาญของร่างกาย
สารควบคุมโปรตีนเฉพาะเช่นโปรตีนของโทรโปนินคอมเพล็กซ์ - สารควบคุมการหดตัวของกล้ามเนื้อ
พลาสติก, หน้าที่ในการสร้าง: โปรตีนเป็นวัสดุก่อสร้างของสิ่งมีชีวิต, พื้นฐานของเซลล์, เมมเบรน, อนุภาคย่อยเซลล์
ฟังก์ชั่นการกำกับดูแล:
กล้ามเนื้อและกระดูก (โปรตีน - คอลลาเจน)
หดตัว (ไมโรซิน, แอคติน)
โปรตีนหน่วยความจำ
รสโปรตีน
ฟังก์ชั่นที่เป็นพิษ (สารพิษโบทูลินัมเป็นโปรตีน)
การควบคุมยีน - การควบคุมกิจกรรมเมทริกซ์และการถ่ายโอนข้อมูลทางพันธุกรรม
ตัวรับ (สร้างพื้นฐานของโครงสร้างของตัวรับเมมเบรนและตัวรับ cytosolic)
ฟังก์ชั่นการขนส่ง: โปรตีนในพลาสมาในเลือดขนส่งไขมันในเลือด ตัวอย่างทั่วไปของโปรตีนขนส่งคือเฮโมโกลบิน โปรตีนพาหะ acyl เป็นต้น
ฟังก์ชันการป้องกัน: ตัวอย่าง ได้แก่ อิมมูโนโกลบูลิน โปรตีนการแข็งตัวของเลือด อินเตอร์เฟอรอน เป็นต้น
โปรตีนให้สปีชีส์และความจำเพาะส่วนบุคคล (เช่น โปรตีนกรุ๊ปเลือด)
คุณสมบัติเฉพาะอื่นๆ:
สำรอง (ไข่ ovalbulin เป็นวัสดุสำรองสำหรับการพัฒนาเซลล์)
พลังงาน (ฟังก์ชันที่ไม่เฉพาะเจาะจง: ในระหว่างการสลายโปรตีน 1 กรัม พลังงาน 17.1 kJ จะถูกปล่อยออกมา)
ในแง่ของเนื้อหาเชิงปริมาณในร่างกาย โปรตีนเกิดขึ้นที่สองหลังน้ำในแง่ของความสำคัญ - ที่แรก โดยเฉลี่ยแล้ว วัตถุแห้งของร่างกายมีโปรตีนสูงถึง 40-50%
มีเพียงการศึกษารายละเอียดโครงสร้างของโปรตีนและคุณสมบัติของโปรตีนเท่านั้นที่จะเข้าใจทั้งคุณสมบัติที่ระบุไว้ของโปรตีนและหน้าที่ของโปรตีน
องค์ประกอบพื้นฐานของโปรตีน
โปรตีนเป็นสารประกอบอินทรีย์ที่มีน้ำหนักโมเลกุลสูงประกอบด้วยไนโตรเจนประกอบด้วยกรดอะมิโนที่เชื่อมต่อด้วยพันธะเปปไทด์เป็นโพลีเปปไทด์และมีสารเชิงซ้อน โครงสร้างองค์กร. คำจำกัดความนี้รวมถึง ลักษณะเฉพาะโปรตีนโดยเฉพาะคุณสมบัติขององค์ประกอบธาตุ
องค์ประกอบของโปรตีนได้รับการศึกษาในศตวรรษที่ผ่านมาและสามารถแสดงเป็น% ดังนี้: C -50-55, O -21-24, N -15-18, H -6.5-7, - สูงถึง 2.5, เถ้า - มากถึง 0.5 สัดส่วนไนโตรเจนที่ค่อนข้างคงที่ 16% ดึงดูดความสนใจ มันพบว่า การใช้งานจริงเมื่อกำหนดปริมาณโปรตีน: ปริมาณของเอมีนไนโตรเจนที่พบโดยการวิเคราะห์จะถูกคูณด้วยปัจจัย 6.25 (พบจากสัดส่วนของโปรตีน 100 กรัม - 16 กรัม N \u003d x g ของโปรตีน - 1 กรัม N)
โมโนเมอร์ - หน่วยโครงสร้างของโปรตีนคือกรดα-อะมิโนซึ่งโปรตีนจะสลายตัวในระหว่างการไฮโดรไลซิส (เทคนิคที่ใช้ในการศึกษาองค์ประกอบของโปรตีน)
คุณสมบัติของกรดอะมิโนที่สร้างโปรตีน
กรดอะมิโนที่สร้างโปรตีนคือกรด α-อะมิโน (กลุ่มอะมิโนอยู่ในตำแหน่ง α ที่สัมพันธ์กับกลุ่มคาร์บอกซิล) กรดอะมิโนต่างกันในอนุมูล:
H 2 N - CH - COOH
กรดอะมิโนทั้งหมดยกเว้นไกลซีนมีอะตอมของคาร์บอนอสมมาตร
กรดอะมิโนทั้งหมดมีฤทธิ์ทางสายตา: IO ของพวกมันคือ levorotatory (-), 7 คือ dextrorotatory (+)
กรดอะมิโนโปรตีนอยู่ใน L-series
กรดอะมิโนมีทั้งคุณสมบัติของกรดและด่าง กล่าวคือ พวกมันเป็นแอมโฟเทอริก ในช่วง pH 4.0 ถึง 9.0 กรดอะมิโนเกือบทั้งหมดมีอยู่ในรูปของสวิตเตอร์ไอออนที่มีหมู่อะมิโนที่ถูกโปรตอนและหมู่คาร์บอกซิลที่แยกตัวออกจากกัน
กรดอะมิโนแต่ละชนิดควบคู่ไปกับ คุณสมบัติทั่วไปมีคุณสมบัติเฉพาะหลายประการ
วิธีการหลักในการตรวจหากรดอะมิโนในไฮโดรไลเสตคือโครมาโตกราฟี (การแลกเปลี่ยนไอออน) โดยใช้เครื่องวิเคราะห์กรดอะมิโน ปฏิกิริยาของสีมีความเฉพาะเจาะจงน้อยกว่า
กระทรวงศึกษาธิการและวิทยาศาสตร์
สาธารณรัฐคาซัคสถาน
นวัตกรรมมหาวิทยาลัยยูเรเซียน
ข้อมูลสรุปการบรรยาย
ตามระเบียบวินัย
"ชีวเคมี"
สำหรับนักศึกษาพิเศษ
050727 "เทคโนโลยีผลิตภัณฑ์อาหาร"
PAVLODAR 2009
ที่ได้รับการอนุมัติ
ผู้อำนวยการ สถาบันวิศวกรรมหมอ สัตวแพทย์ วิทยาศาสตร์ ศ. _________ อี.บี. Nikitin
"___" _______________ 200 กรัม
เรียบเรียงโดย : ปริญญาเอก รองศาสตราจารย์ _______________ K.M. โอมาโรวา
ภาควิชาเทคโนโลยีชีวภาพประยุกต์
^ ข้อมูลสรุปการบรรยาย
ในสาขาวิชา "ชีวเคมี"
สำหรับนักศึกษาพิเศษ 050727 "เทคโนโลยีผลิตภัณฑ์อาหาร"
พัฒนาบนพื้นฐานของมาตรฐานภาคบังคับของรัฐ อุดมศึกษา 050727 - "เทคโนโลยีผลิตภัณฑ์อาหาร" มาตรฐานการศึกษาของรัฐแห่งสาธารณรัฐคาซัคสถาน 3.08.353-2549 "การศึกษาระดับมืออาชีพที่สูงขึ้น ปริญญาตรี หลักสูตรต้นแบบสำหรับสาขาวิชา "ชีวเคมี" และหลักสูตรการทำงานสำหรับสาขาวิชา "ชีวเคมี" (2552)
ทบทวนในที่ประชุมภาควิชาเทคโนโลยีชีวภาพประยุกต์
นาทีที่ __ ของ "__" _____________ 200__
รองหัวหน้า ภาควิชาเทคโนโลยีชีวภาพประยุกต์
แคน. เทคโนโลยี วิทยาศาสตร์ ศาสตราจารย์ _____________ MS ลอบสเตอร์
ได้รับการอนุมัติจากที่ประชุมสภาวิทยาศาสตร์และระเบียบวิธีของคณะครุศาสตร์เต็มเวลาของสถาบันวิศวกรรมศาสตร์และแนะนำให้ตีพิมพ์
นาทีที่ ___ จาก __________ 200__
ประธาน อสม. คณะครุศาสตร์เต็มเวลา สถาบันวิศวกรรมศาสตร์
แคน. เทคโนโลยี วิทยาศาสตร์, ศาสตราจารย์ ______________ เอก. Ordabaev
ตกลง:
หัวหน้า IMO
แคน. เท้า. วิทยาศาสตร์ ศาสตราจารย์ ___________ น.ม. Ushakov
บริจาคให้ห้องสมุด _____________________
^ แผนการบรรยาย
| № | หัวข้อบรรยาย | จำนวน ชั่วโมง |
| 1 | เบื้องต้น | 1 |
| 2 | ชีวเคมีของโปรตีนและกรดนิวคลีอิก | 2 |
| 3 | ชีวเคมีของคาร์โบไฮเดรต | 2 |
| 4 | ชีวเคมีของไขมัน | 2 |
| 5 | การจัดโครงสร้างเซลล์และระบบอวัยวะที่เกี่ยวข้องกับโภชนาการ องค์ประกอบทางเคมีสิ่งมีชีวิต | 2 |
| 6 | แนวคิดทั่วไปของการเผาผลาญและพลังงานในร่างกาย | 2 |
| 7 | ออกซิเดชันทางชีวภาพ | 2 |
| 8 | ความสัมพันธ์ระหว่างเมแทบอลิซึมของโปรตีน กรดนิวคลีอิก คาร์โบไฮเดรต และไขมัน | 2 |
| ทั้งหมด: | 15 |
|
^ บรรยาย #1 (1 ชั่วโมง)
เบื้องต้น
ชีวเคมีสามารถกำหนดเป็นเคมีของสิ่งมีชีวิต (เซลล์และสิ่งมีชีวิต) วัตถุที่มีชีวิตแตกต่างจากสิ่งไม่มีชีวิตในความสามารถในการเผาผลาญและสืบพันธุ์ (ด้วยการถ่ายโอนข้อมูลทางพันธุกรรม) ในขณะเดียวกัน สิ่งมีชีวิตก็คือ ส่วนสำคัญธรรมชาติและปฏิบัติตามกฎพื้นฐานของธรรมชาติทั้งหมด เช่น กฎการอนุรักษ์มวลและพลังงาน และกฎของอุณหพลศาสตร์
^ สิ่งมีชีวิตแทน ระบบเปิด(ในแง่ของอุณหพลศาสตร์) หรือ ระบบที่ค่อนข้างโดดเดี่ยว(จากมุมมองของไซเบอร์เนติกส์) ในทั้งสองกรณีนี้หมายความว่าระบบสิ่งมีชีวิตมีส่วนเกี่ยวข้องในการแลกเปลี่ยนกับสิ่งแวดล้อม การแลกเปลี่ยนกับสิ่งแวดล้อมนี้ดำเนินการโดยใช้สารตั้งต้น (แหล่งพลังงานอิสระ) และข้อมูลที่มาจากภายนอก (ซึ่งนำไปสู่การลดลงของเอนโทรปีและเพิ่มระดับการจัดระบบสิ่งมีชีวิต) การแลกเปลี่ยนกับสิ่งแวดล้อมแบบนี้เป็นไปตามหลักการสำคัญของ Le Chatelier และนำไปสู่ สถานะคงที่ของระบบ. สามารถกำหนดลักษณะเป็นสถานะไดนามิกซึ่งในช่วงเวลาที่กำหนด ระบบได้รับจาก สิ่งแวดล้อมปริมาณของสสารและพลังงานเท่าเดิมที่ส่งกลับคืนสู่สสาร และด้วยเหตุนี้ ความเข้มข้นของสสารภายในระบบจึงยังคงไม่เปลี่ยนแปลง นี่เป็นหนึ่งใน ลักษณะเฉพาะวัตถุที่มีชีวิตซึ่งแยกความแตกต่างจากระบบแยกที่ไม่มีชีวิตซึ่งอยู่ในสมดุลที่ไม่ขึ้นกับเวลา ในระบบที่ไม่มีชีวิตดังกล่าว ปริมาณสสารและพลังงานทั้งหมดยังคงไม่เปลี่ยนแปลงและกระบวนการทั้งหมดจะหยุดลง
ปฏิกิริยาของระบบสิ่งมีชีวิตดำเนินไปในลักษณะนี้ ในเวลาและสถานที่. ตามระดับของการพัฒนา ระบบเหล่านี้แตกต่างกันไปตามระดับความซับซ้อนของโครงสร้าง
^ โครงสร้างของวัตถุที่มีชีวิต มักเกิดขึ้นจากอนินทรีย์ธรรมดาและ อินทรียฺวัตถุและมีมิติที่แน่นอน การกำหนดค่าซึ่งไม่ได้สะท้อนจากสูตรทางเคมีที่ง่ายที่สุด คุณลักษณะนี้ต้องคำนึงถึงเมื่อพิจารณาถึงการเกิดปฏิกิริยา ซึ่งมักจะขึ้นอยู่กับการกำหนดค่า สารประกอบที่ค่อนข้างง่ายจะรวมกันเป็นโมเลกุลขนาดใหญ่และสุดท้ายกลายเป็นโครงสร้างซุปเปอร์โมเลกุลซึ่งเป็นพื้นฐานของหน่วยการสร้างหลักที่ประกอบเป็นสิ่งมีชีวิต ระบบ เซลล์และออร์แกเนลล์ของพวกมัน โมเลกุลของระบบสิ่งมีชีวิตมี บางขนาดและรูปร่างที่เกี่ยวข้องกับหน้าที่ในสิ่งมีชีวิต
การทำงานของระบบสิ่งมีชีวิตขึ้นอยู่กับ ปฏิกิริยาทางชีวเคมีเกิดขึ้นทั้งในโครงสร้างเซลล์และเซลล์ย่อยที่กล่าวถึงแล้ว และในสารละลายของไซโตพลาสซึมหรือในของเหลวระหว่างเซลล์
^ ปฏิกิริยาทางชีวเคมี เกิดขึ้นในช่วงพารามิเตอร์ทางกายภาพและเคมีที่ค่อนข้างแคบ นอกจากข้อจำกัดของอุณหภูมิและความดันแล้ว ยังใช้กับช่วงความเข้มข้นหรือกิจกรรมของไฮโดรเจนไอออน ( ค่า pH). ค่า pH จะถูกรักษาไว้ที่ระดับที่เหมาะสม ระบบบัฟเฟอร์, ปฏิบัติตามสมการ เฮนเดอร์สัน-ฮัสเซลบาลช์. ค่าคงที่สัมพัทธ์ของค่า pH เป็นสิ่งสำคัญมากในการป้องกัน ความแตกแยกทางชีววิทยา สารออกฤทธิ์เนื่องจากเป็นผลให้มีการเปลี่ยนแปลงรูปร่างและปฏิกิริยาของโมเลกุลโปรตีน และด้วยเหตุนี้ การเปลี่ยนแปลงในความเสถียรของโครงสร้างหรือกิจกรรมของเอนไซม์สามารถเกิดขึ้นได้ ปฏิกิริยาทางชีวเคมีบางอย่างเกิดขึ้นกับ ความเร็วที่เหมาะสมที่สุดกับบางอย่างเท่านั้น แรงดันออสโมติกและความแข็งแรงของไอออนิกในสภาพแวดล้อมที่อัตราส่วนของไอออนบางอย่างคงที่อย่างเคร่งครัด ปัจจัยทั้งหมดเหล่านี้มีผลอย่างมากต่อคุณสมบัติและหน้าที่ของโมเลกุลและระดับการกระจายตัวของระบบ เราแยกความแตกต่างระหว่างสารละลายจริง สารละลายคอลลอยด์ และสารแขวนลอย ทั้งนี้ขึ้นอยู่กับธรรมชาติของสารละลายและขนาดของอนุภาคที่ละลาย
ปฏิกิริยาทางชีวเคมีสามารถเกิดขึ้นได้ภายใต้เงื่อนไขบางประการเท่านั้น ความต้องการพลังงาน. แหล่งพลังงานหลักบนโลกของเราคือรังสีของดวงอาทิตย์ พลังงานบางส่วนนี้ถูกเก็บอยู่ในรูป พลังงานเคมีในพันธะเคมีของสารต่างๆ ปัจจุบันโลกถูกครอบงำโดย เงื่อนไขแอโรบิกและระบบสิ่งมีชีวิตได้รับพลังงานส่วนใหญ่จาก กระบวนการรีดอกซ์(และสาเหตุหลักมาจากการเกิดออกซิเดชันของสารประกอบอินทรีย์โดยออกซิเจนในบรรยากาศ) ปฏิกิริยาที่เกิดขึ้นในสิ่งมีชีวิตก็คือ exergonic(เกิดขึ้นเองตามธรรมชาติ) หรือ endergonic(พวกเขาต้องการสำหรับการดำเนินการของพวกเขา แหล่งภายนอกพลังงาน). ปฏิกิริยา endergonic หลายอย่างสามารถเกิดขึ้นได้เพราะพวกมัน conjugatedด้วยปฏิกิริยา exergonic ตัวพาพลังงานที่พบมากที่สุดคือโมเลกุล อะดีโนซีน ไตรฟอสเฟต(เอทีพี).
ปฏิกิริยาทางชีวเคมีเกิดขึ้นกับ ความเร็วขึ้นอยู่กับ ความเข้มข้นโมเลกุลที่ทำปฏิกิริยาและ อัตราคงที่ลักษณะของปฏิกิริยาประเภทนี้ ความเร็วเหล่านี้สามารถเปลี่ยนแปลงได้อย่างมีนัยสำคัญ (มักจะเพิ่มขึ้น) ต่อหน้า ตัวเร่งปฏิกิริยา(เอ็นไซม์). ผลกระทบที่เป็นอันตรายสภาพแวดล้อมจะแสดงในระดับเอนไซม์เป็นหลัก ยับยั้งปฏิกิริยาที่เกี่ยวข้อง
ปฏิกิริยาแยกจากวัตถุที่มีชีวิต ควบคุมในหลากหลายวิธี การควบคุมนี้ดำเนินการทั้งโดยการเปลี่ยนแปลงปัจจัยเชิงพื้นที่ (การเปลี่ยนแปลงของเอนโทรปีของระบบสิ่งมีชีวิต) และโดยการเปลี่ยนแปลงอัตราการเกิดปฏิกิริยา
^ บรรยาย #2 (2 ชั่วโมง)
หัวข้อ: ชีวเคมีของโปรตีนและกรดนิวคลีอิก
โปรตีนชีวเคมี
โมเลกุลขนาดใหญ่: โปรตีนและกรดนิวคลีอิกมีบทบาทสำคัญในการสร้างสิ่งมีชีวิตและการนำกระบวนการชีวิตไปใช้ เนื่องจากโปรตีนเป็นโครงสร้างและการทำงานของสิ่งมีชีวิต และกรดนิวคลีอิก โอกาสที่เป็นไปได้สิ่งมีชีวิต (ข้อมูลทางพันธุกรรมและการใช้งานด้วยความช่วยเหลือของ RNA และโปรตีน)
คุณสมบัติที่มีอยู่ในโปรตีนและผิดปกติสำหรับสารประกอบอินทรีย์อื่น ๆ :
โมเลกุลโปรตีนยักษ์มีความโดดเด่นด้วยโครงสร้างที่หลากหลายไม่สิ้นสุดพร้อมความจำเพาะที่เข้มงวดในตัว เฉพาะประเภทกระรอก.
โปรตีนมีอยู่ในความสามารถในการโต้ตอบภายในโมเลกุล ซึ่งทำให้มั่นใจไดนามิกของโครงสร้างของโมเลกุล ความแปรปรวนและความเป็นพลาสติกของรูปร่าง การย้อนกลับของการเปลี่ยนจากสถานะทรงกลมเป็นไฟบริล
ด้วยใบหน้ามากมาย คุณสมบัติทางเคมีอนุมูลของกรดอะมิโนตกค้างในโครงสร้างของสายโซ่พอลิเปปไทด์ โมเลกุลโปรตีนโดยรวมและแต่ละส่วนสามารถเข้าสู่ปฏิกิริยาทางเคมีและกายภาพที่หลากหลายทั้งระหว่างกันและกับกรดนิวคลีอิก โพลีแซคคาไรด์ ลิพิด ฯลฯ การสร้างสารเชิงซ้อนซุปเปอร์โมเลกุลที่สร้างโครงสร้างย่อยเซลล์พื้นฐาน
คุณสมบัติที่สำคัญที่สุดกลไกการเกิดขึ้นของสารเชิงซ้อนเหล่านี้คือ "การรับรู้" ซึ่งกันและกันโดยส่วนผสมและการไหลของกระบวนการเชื่อมโยงเองตามหลักการของการประกอบตัวเอง
โมเลกุลโปรตีนเปลี่ยนโครงสร้างตามธรรมชาติภายใต้อิทธิพลของปฏิสัมพันธ์ภายนอกและฟื้นฟูสภาพเดิมเมื่อถูกกำจัดออกไป และอาจเกี่ยวข้องกับการยอมรับและการเปลี่ยนแปลงของพลังงาน
โปรตีนหลายชนิดมีความสามารถพิเศษในการเร่งปฏิกิริยาทางเคมีของร่างกาย กล่าวคือ เติมเต็ม ฟังก์ชันตัวเร่งปฏิกิริยา. โปรตีนทำหน้าที่อื่น ๆ อีกมากมายเช่นกัน
หน้าที่ทางชีวภาพของโปรตีน
พลาสติก, หน้าที่ในการสร้าง: โปรตีนเป็นวัสดุก่อสร้างของสิ่งมีชีวิต, พื้นฐานของเซลล์, เมมเบรน, อนุภาคย่อยเซลล์
ฟังก์ชั่นการกำกับดูแล:
B) ฮอร์โมนธรรมชาติของโปรตีน - ควบคุมการเผาผลาญของร่างกาย;
C) โปรตีนควบคุมเฉพาะเช่นโปรตีนของโทรโปนินคอมเพล็กซ์ - สารควบคุมการหดตัวของกล้ามเนื้อ
ฟังก์ชั่นการขนส่ง: โปรตีนในพลาสมาในเลือดขนส่งไขมันในเลือด ตัวอย่างทั่วไปของโปรตีนขนส่งคือเฮโมโกลบิน โปรตีนพาหะ acyl เป็นต้น
ฟังก์ชันการป้องกัน: ตัวอย่าง ได้แก่ อิมมูโนโกลบูลิน โปรตีนการแข็งตัวของเลือด อินเตอร์เฟอรอน เป็นต้น
โปรตีนให้สปีชีส์และความจำเพาะส่วนบุคคล (เช่น โปรตีนกรุ๊ปเลือด)
คุณสมบัติเฉพาะอื่นๆ:
B) หดตัว (ไมโอซิน, แอคติน);
B) โปรตีนหน่วยความจำ
D) ลิ้มรสโปรตีน
E) ฟังก์ชั่นที่เป็นพิษ (สารพิษโบทูลินัมเป็นโปรตีน);
E) การควบคุมยีน - การควบคุมกิจกรรมเมทริกซ์และการถ่ายโอนข้อมูลทางพันธุกรรม
G) รีเซพเตอร์ (สร้างพื้นฐานของโครงสร้างของเมมเบรนและตัวรับ cytosolic);
สำรอง (ไข่อัลบูมินเป็นวัสดุสำรองสำหรับการพัฒนาเซลล์)
พลังงาน (ฟังก์ชันที่ไม่เฉพาะเจาะจง: ในระหว่างการสลายโปรตีน 1 กรัม พลังงาน 17.1 kJ จะถูกปล่อยออกมา)
มีเพียงการศึกษารายละเอียดโครงสร้างของโปรตีนและคุณสมบัติของโปรตีนเท่านั้นที่จะเข้าใจทั้งคุณสมบัติที่ระบุไว้ของโปรตีนและหน้าที่ของโปรตีน
^ องค์ประกอบพื้นฐานของโปรตีน
โปรตีนเรียกว่าสารประกอบอินทรีย์ที่มีไนโตรเจนโมเลกุลสูงซึ่งประกอบด้วยกรดอะมิโนที่เชื่อมต่อด้วยพันธะเปปไทด์เป็นโพลีเปปไทด์และมีโครงสร้างที่ซับซ้อน คำจำกัดความนี้รวมถึงคุณลักษณะเฉพาะของโปรตีน โดยเฉพาะอย่างยิ่ง คุณสมบัติขององค์ประกอบองค์ประกอบ
องค์ประกอบองค์ประกอบของโปรตีนได้รับการศึกษาในศตวรรษที่ผ่านมาและสามารถแสดงเป็น% ดังนี้: C - 50-55, O - 21-24, N - 15-18, H- 6.5-7, เถ้า - สูงถึง 0.5 . สัดส่วนไนโตรเจนที่ค่อนข้างคงที่ 16% ดึงดูดความสนใจ พบการประยุกต์ใช้ในทางปฏิบัติในการกำหนดปริมาณโปรตีน: ปริมาณของเอมีนไนโตรเจนที่พบในการวิเคราะห์จะถูกคูณด้วยปัจจัย 6.25 (พบจากสัดส่วนของโปรตีน 100 กรัม - 16 กรัม N \u003d X g ของโปรตีน - 1 กรัม . น).
โมโนเมอร์ - หน่วยโครงสร้างของโปรตีนคือกรดอะมิโน ซึ่งโปรตีนจะสลายตัวในระหว่างการไฮโดรไลซิส (เทคนิคที่ใช้ในการศึกษาองค์ประกอบของโปรตีน)
^ คุณสมบัติของกรดอะมิโนที่สร้างโปรตีน
กรดอะมิโนที่สร้างโปรตีนเป็นของกรดอะมิโน (กลุ่มอะมิโนจะอยู่ในตำแหน่ง ซึ่งสัมพันธ์กับกลุ่มคาร์บอกซิล) กรดอะมิโนต่างกันในอนุมูล:
H2N - CH - COOH
กรดอะมิโนทั้งหมดยกเว้นไกลซีนมีอะตอมของคาร์บอนอสมมาตร
กรดอะมิโนทั้งหมดมีการเคลื่อนไหวทางสายตา: 10 ตัวเป็นแบบถนัดซ้าย (-), 7 ตัวเป็นแบบถนัดขวา (+)
กรดอะมิโนที่สร้างโปรตีนอยู่ใน L-series
กรดอะมิโนมีทั้งคุณสมบัติของกรดและด่าง กล่าวคือ พวกมันเป็นแอมโฟเทอริก ในช่วง pH 4.0 ถึง 9.0 กรดอะมิโนเกือบทั้งหมดมีอยู่ในรูปของสวิตเตอร์ไอออนที่มีหมู่อะมิโนที่ถูกโปรตอนและหมู่คาร์บอกซิลที่แยกตัวออกจากกัน
กรดอะมิโนแต่ละชนิดพร้อมกับคุณสมบัติทั่วไปมีคุณสมบัติจำเพาะหลายประการ
วิธีการหลักในการตรวจหากรดอะมิโนในไฮโดรไลเสตคือโครมาโตกราฟี (มักเป็นการแลกเปลี่ยนไอออน) การใช้เครื่องวิเคราะห์กรดอะมิโน ปฏิกิริยาของสีมีความเฉพาะเจาะจงน้อยกว่า
การจำแนกกรดอะมิโน
ในธรรมชาติมีกรดอะมิโนประมาณ 200 ชนิดพบ 60 ชนิดในร่างกาย แต่ในโครงสร้างของโปรตีนจะพบอย่างต่อเนื่อง - 18 ซึ่งเรียกว่าโปรตีน
มีการจำแนกประเภททางเคมีจำนวนหนึ่งตามโครงสร้างของกรดอะมิโน (acyclic และ cyclic) จำนวนกลุ่มอะมิโนและคาร์บอกซิล (monoaminomonocarboxylic, diaminomonocarboxylic, monoaminodicarboxylic) คุณสมบัติของอนุมูล (ไม่ชอบน้ำ, ชอบน้ำ, มีประจุบวกและลบ) เป็นต้น . ซึ่งสามารถพบได้ในรายละเอียดเพิ่มเติมในตำราเรียน ควรจะจ่าย ความสนใจเป็นพิเศษว่าด้วยการจำแนกทางชีววิทยา: การแบ่งกรดอะมิโนออกเป็นส่วนจำเป็น (ซึ่งร่างกายไม่สามารถสังเคราะห์ได้และต้องได้รับเป็นอาหาร) และไม่จำเป็น (สามารถสังเคราะห์ได้จาก กรดอะมิโนที่จำเป็นหรือเกิดปฏิกิริยาเมตาบอลิซึม) เพื่ออำนวยความสะดวกในการจดจำชื่อกรดอะมิโนที่จำเป็น วลีที่ผิดหลักไวยากรณ์จึงถูกแต่งขึ้นจากตัวอักษรตัวแรก:
พึงระลึกไว้เสมอว่าตัวอักษร "A" มีกรดอะมิโนสามตัว: อะลานีน, กรดแอสปาร์ติกและอาร์จินีนแต่เพียงอย่างหลัง เช่น ไดอะมิโนตัวที่สอง กรดคาร์บอกซิลิก- ไลซีนเป็นสิ่งที่ขาดไม่ได้ ในทำนองเดียวกัน กรดอะมิโนสามตัวขึ้นต้นด้วยตัวอักษร "T" แต่ตัวที่สาม ไทโรซีน สามารถสังเคราะห์ได้ง่ายในร่างกายจากฟีนิลอะลานีนและไม่จำเป็น
โปรตีนมีมากถึง 55% - จาก; 20-25% – อู๋; 16% – นู๋, เช่นเดียวกับ S, P, Mgและอื่น ๆ ส่วนแบ่งของไนโตรเจนซึ่งแตกต่างจากองค์ประกอบอื่น ๆ นั้นใกล้เคียงกันและมีจำนวน 16% และปริมาณโปรตีนในวัสดุมักจะถูกกำหนดโดยปริมาณไนโตรเจน ( การเผาไหม้ตาม Kjeldal). ข้อยกเว้นคือโปรตีนโปรตามีน ซึ่งประกอบด้วย ~30% N.
นายคือน้ำหนักโมเลกุลสัมพัทธ์ของโปรตีน มันใหญ่มากจาก ≈ 6000 Da ถึงหลายล้าน Da
ตัวอย่างเช่น นายอินซูลิน = 5733 ใช่ และไวรัสโมเสคยาสูบ - 40 ล้านดา
โมโนเมอร์หรือหน่วยโครงสร้างของโปรตีน.
สามารถกำหนดได้โดยกรดไฮโดรไลซิสของโปรตีน โมโนเมอร์ของโปรตีนคือ α-AA ของ L-series การเชื่อมต่อของ AA เข้ากับสายโซ่โพลีเปปไทด์ (PPC) เกิดขึ้นผ่านพันธะโควาเลนต์เปปไทด์ -CO-NH-.
โครงสร้างองค์กรที่ซับซ้อน.
โพลีเปปไทด์จากธรรมชาติบางชนิดรวมทั้งที่ได้จากการประดิษฐ์อาจมี Mr ขนาดใหญ่ แต่ไม่สามารถนำมาประกอบกับโปรตีนได้ พวกมันแตกต่างจากโปรตีนโดยมีลักษณะเฉพาะซึ่งมีอยู่ในโปรตีนเท่านั้น - การทำให้เสียสภาพ. ภายใต้การกระทำของสารบางอย่างที่เรียกว่า ผงซักฟอก, มีการสูญเสียคุณสมบัติทางเคมีกายภาพของโปรตีน และที่สำคัญที่สุด - กิจกรรมทางชีวภาพ , โดยที่ พันธะเปปไทด์อย่าทำลาย ดังนั้นโปรตีนจึงมีโครงสร้างเชิงพื้นที่ที่ซับซ้อน
เหล่านี้คือ ลักษณะเฉพาะโปรตีน
รูปร่างของโมเลกุลโปรตีน
ในธรรมชาติพบโปรตีนทั้งในรูปของเส้นใย - ไฟบริล, และในรูปแบบของลูกบอล - ลูกกลม บางครั้งรูปทรงกลมและไฟบริลลาร์เกิดขึ้นเป็นเชิงซ้อน (in เนื้อเยื่อกล้ามเนื้อแอคติน - ไมโอซินคอมเพล็กซ์ พลาสมาในเลือดประกอบด้วยเส้นใยโปรตีน - ไฟบริโนเจน เช่นเดียวกับโปรตีนทรงกลม - อัลบูมินและโกลบูลิน)
หน้าที่ของโปรตีน
1. ตัวเร่งปฏิกิริยา– เอนไซม์หรือตัวเร่งปฏิกิริยาทางชีวภาพมากกว่า 99% เป็นโปรตีน เช่น catalase, aspartate aminotransferase ในยุค 90 ของศตวรรษที่ 20 มีการระบุเอนไซม์โปรตีนมากกว่า 2,000 รายการ
2. มีคุณค่าทางโภชนาการ(หรือสำรอง) - เคซีน - โปรตีนนม, โอวัลบูมิน - โปรตีนจากไข่
3. ขนส่ง – ฟังก์ชั่นทางเดินหายใจโดยเฉพาะอย่างยิ่งเลือดการถ่ายโอน O 2 ดำเนินการโดยเฮโมโกลบิน (Hb) ซึ่งเป็นโปรตีนของเม็ดเลือดแดง
4. ป้องกัน- โปรตีนป้องกันเฉพาะ - แอนติบอดีต่อต้านการกระทำของโปรตีน - แอนติเจนจากต่างประเทศ
5. คอนแทรคไทล์- โปรตีนจากเนื้อเยื่อของกล้ามเนื้อจำเพาะ แอคตินและไมโอซินจัดเตรียมให้ การหดตัวของกล้ามเนื้อและการผ่อนคลาย กล่าวคือ การจราจร.
6. โครงสร้าง- ฟังก์ชั่นนี้ดำเนินการโดยโปรตีน - คอลลาเจน เนื้อเยื่อเกี่ยวพัน,เคราติน-ในผม,เล็บ,ผิวหนัง
7. ฮอร์โมน- การควบคุมการเผาผลาญดำเนินการโดยฮอร์โมน - โปรตีนหรือโพลีเปปไทด์ของต่อมใต้สมอง, ตับอ่อน
คุณสมบัติทางเคมีฟิสิกส์ของกรดอะมิโน
α-AAs เป็นส่วนประกอบในการสร้างโปรตีน สายโซ่โพลีเปปไทด์ (ปชป.)และที่จริงแล้ว ตัวโปรตีนเอง กรดอะมิโนเป็นอนุพันธ์ของกรดคาร์บอกซิลิกซึ่งไฮโดรเจนหนึ่งในสายโซ่คาร์บอนถูกแทนที่ด้วยอาร์
โดยการไฮโดรไลซิส 19-25 α-AAs ถูกแยกออกจากโปรตีนจากสัตว์ แต่มักจะได้ 20 ตัว สูตรทั่วไปของกรดอะมิโน:
กรดอะมิโนเป็นสารผลึกไม่มีสีที่หลอมละลายที่อุณหภูมิสูง (>250°C) ละลายได้ง่ายในน้ำและไม่ละลายในตัวทำละลายอินทรีย์ เนื่องจากมีองค์ประกอบ NH 2 ซึ่งเป็นกลุ่มพื้นฐานและ COOH ซึ่งมีคุณสมบัติเป็นกรด AA จึงเป็นแอมโฟเทอริก ในสารละลายที่เป็นน้ำ α-AA ส่วนใหญ่อยู่ในรูปแบบ ไอออนสองขั้วหรือ zwitterionด้วยกลุ่ม COO - - ที่แยกจากกันและกลุ่ม NH 3 + - ที่โปรตอน
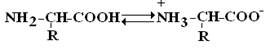
Zwitterion
AA อาจอยู่ในรูปของแอนไอออน ไอออนบวก ไบโพลาร์ไอออนที่เป็นกลาง ทั้งนี้ขึ้นอยู่กับสภาพแวดล้อม pH หรือรูปแบบผสมกัน
ในสภาพแวดล้อมที่เป็นกรดสูงมี AA เป็นไอออนบวก (q+)

ใน สภาพแวดล้อมที่เป็นด่างอย่างแรง– อยู่ในรูปของแอนไอออน (–q)

ค่า pH ที่สวิตเตอร์ไอออนเหนือกว่าในสารละลายที่เป็นน้ำ เช่น ความเข้มข้นสมดุลของกรดอะมิโน "+" และ "-" คิว เช่นเดียวกับโปรตีน เรียกว่า จุดไอโซอิเล็กทริก (ปี่). เมื่อถึงค่า pH ดังกล่าว โปรตีนจะไม่เคลื่อนที่ในสนามไฟฟ้าและตกตะกอน ซึ่งใช้ใน อิเล็กโตรโฟรีติกวิธีการวิเคราะห์โปรตีนและกรดอะมิโน
สเตอริโอเคมีของกรดอะมิโน.
คุณสมบัติที่สำคัญของ AK คือของพวกเขา กิจกรรมทางแสงในสารละลายที่เป็นน้ำ คุณสมบัติของ AA นี้เกิดจากการมีอยู่ในโครงสร้าง อะตอม chiral C. อะตอม chiralหรือ chiral center อะตอมเรียกว่าซึ่งพันธะทั้งหมดจะถูกแทนที่ด้วยอนุมูลต่างๆ(ร):
สเตอริโอไอโซเมอร์– เหล่านี้เป็นไอโซเมอร์ที่มีลำดับอะตอมเชื่อมต่อกัน แต่มีการจัดเรียงต่างกันในอวกาศ.
 |  |
ถ้าสเตอริโอไอโซเมอร์ 2 ตัวมีความสัมพันธ์กันในฐานะวัตถุและภาพสะท้อนในกระจก จะเรียกว่า อีแนนทิโอเมอร์
Enantiomers แสดงคุณสมบัติทางเคมีและทางกายภาพเหมือนกันเสมอ ยกเว้นสิ่งหนึ่ง - ทิศทางการหมุนของระนาบของลำแสงโพลาไรซ์ อิแนนชิโอเมอร์ซึ่งหมุนระนาบโพลาไรซ์ตามเข็มนาฬิกาเรียกว่า dextrorotatory (« + ”) และทวนเข็มนาฬิกา - l derotatory (« – ") กรดอะมิโนธรรมชาติมีทั้ง "+" และ "-"
ส่วนผสมของจำนวนโมเลกุลเท่ากันของอิแนนชิโอเมอร์ด้านขวาและด้านซ้ายเรียกว่า racemicส่วนผสม
เพื่อนร่วมการแข่งขันไม่มีกิจกรรมเกี่ยวกับสายตา โดย การจัดพื้นที่อะตอมและอนุมูลรอบศูนย์กลาง chiral แยกความแตกต่างระหว่างกรดอะมิโน D- และ L-series เพื่อตรวจสอบว่า AA เป็นของ D- หรือ L-series การกำหนดค่าของศูนย์ chiral จะถูกเปรียบเทียบกับ enantiomer ของ glyceraldehyde (GA)
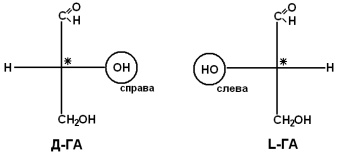
โดยการเปรียบเทียบในกรดอะมิโน หากกลุ่ม NH 2 อยู่ทางด้านขวาของแกน COOH-R แสดงว่าเป็น D-AA และหากอยู่ทางซ้าย L-AA
 |
กรดอะมิโนทั้งหมดของโปรตีนธรรมชาติคือ α-AA
โปรตีนนมประกอบด้วยสารอินทรีย์ธรรมชาติทั้งหมด: คาร์บอน ไฮโดรเจน ออกซิเจน และองค์ประกอบเฉพาะของโปรตีน - ไนโตรเจน
นอกจากนี้ยังมีกำมะถันและฟอสฟอรัส
โปรตีนมีลักษณะเด่นโดยการมีไนโตรเจนกำมะถันและฟอสฟอรัสอยู่ในตัว วิธีการกำหนดโปรตีนในนมขึ้นอยู่กับผลการวิเคราะห์ธาตุ โดยเฉพาะไนโตรเจน ในการกำหนดปริมาณไนโตรเจนในสารประกอบอินทรีย์ ได้มีการพัฒนาวิธีเจลดาห์ล (ในปี พ.ศ. 2426) ซึ่งยังคงเป็นวิธีการที่เชื่อถือได้ในการกำหนดโปรตีนในนมและผลิตภัณฑ์จากนม ปริมาณโปรตีนถูกกำหนดตามปริมาณไนโตรเจนในตัวอย่างนมที่วิเคราะห์ โดยคำนึงถึงปัจจัยการแปลง โดยการเผาไหม้ตัวอย่างและการตรึงไนโตรเจนในภายหลัง เนื้อหาของตัวอย่างจะถูกกำหนด ปัจจัยการแปลงมีค่าเท่ากับ 6.38 โดยพิจารณาจากข้อเท็จจริงที่ว่าเคซีนบริสุทธิ์ 100 กรัมมีไนโตรเจน 15.65% (ตามผลการวิเคราะห์องค์ประกอบองค์ประกอบของเคซีน - (100:15.65 = 6.38) องค์ประกอบองค์ประกอบเฉลี่ย ของเคซีนใน% : ไนโตรเจน - 15.65 คาร์บอน - 53.00 ออกซิเจน - 22.60 ไฮโดรเจน - 7.10 กำมะถัน - 0.80 ฟอสฟอรัส - 0.85)
องค์ประกอบองค์ประกอบของเคซีนและเวย์โปรตีนแตกต่างกันอย่างมีนัยสำคัญในเนื้อหาฟอสฟอรัส ส่วนประกอบของเคซีนยังมีปริมาณฟอสฟอรัสต่างกัน
เคซีนเป็นฟอสโฟโปรตีนที่เด่นชัดและเวย์โปรตีนไม่มีฟอสฟอรัสเลยหรือเล็กน้อย
ฟอสฟอรัสมีอยู่ในรูปของฟอสเฟตเอสเทอร์ของกรดไฮดรอกซีอะมิโนซีรีนและทรีโอนีน ประเภทของพันธะฟอสฟอรัสในเคซีนมีบทบาทในการก่อตัวของสะพานแคลเซียมฟอสเฟตในเคซีนคอมเพล็กซ์และระหว่างเคซีนซับมิเซลล์:
CH 2 - O - P \u003d O - พันธะโมโนอีเธอร์;
CH 2 - O - P - O - CH 2 - - พันธบัตรดีสเตอร์
CH 2 - O - P - O - P - O - CH 2 - - พันธะไพโรฟอสเฟตเอสเทอร์
ที่ เวย์โปรตีนกำมะถันมากกว่าเคซีน β-Lactoglobulin มีหมู่ SH และสามารถทำหน้าที่เป็นสารต้านอนุมูลอิสระ การปรากฏตัวของกำมะถันเกิดจากการมีกรดอะมิโนที่ประกอบด้วยกำมะถันในเวย์โปรตีน - เมไทโอนีน ซีสทีน และซิสเทอีน พวกเขามีอิทธิพลต่อการเปลี่ยนแปลงในรสชาติของนมในระหว่างการอบร้อน บทบาทใหญ่ในการพิจารณาคุณสมบัติของโปรตีน โครงสร้างของโปรตีนจะเล่นโดยองค์ประกอบของกรดอะมิโน
การรู้องค์ประกอบของกรดอะมิโนของโปรตีนช่วยให้คุณสร้างลำดับของกรดอะมิโนในโมเลกุลโปรตีนและเปิดเผยโครงสร้างของมันได้ จากจำนวนและชนิดของกรดอะมิโน เราสามารถตัดสินการมีอยู่ของกลุ่มหน้าที่ นั่นคือ ปฏิกิริยาที่เป็นไปได้ และคุณค่าทางโภชนาการและคุณค่าทางโภชนาการขึ้นอยู่กับเนื้อหาของกรดอะมิโนที่จำเป็น คุณค่าทางชีวภาพโปรตีน
โปรตีนนมมีกรดอะมิโนเกือบทั้งหมดที่พบได้ในโปรตีน: กรดอะลิฟาติก กรดไฮดรอกซีอะมิโน ไดคาร์บอกซิลิก กรดไดอะมิโน อะโรมาติก ซึ่งประกอบด้วยกำมะถัน โปรตีนนมที่สำคัญเมื่อเทียบกับโปรตีนทรงกลมอื่นๆ ผลิตภัณฑ์อาหารมีลิวซีน ไอโซลิวซีน ไลซีน กรดกลูตามิกในปริมาณที่ค่อนข้างมาก ตามเนื้อหาและอัตราส่วนของกรดอะมิโนที่จำเป็น โปรตีนนมเป็นโปรตีนที่สมบูรณ์ทางชีวภาพ
การเปรียบเทียบองค์ประกอบกรดอะมิโนของโปรตีนนมหลักทำให้ ได้ข้อสรุปดังต่อไปนี้:
เวย์โปรตีนมีกรดอะมิโนที่จำเป็นมากกว่า (ไอโซอิเลซีน, ลิวซีน, ไลซีน, เมไทโอนีน, ฟีนิลอะลานีน, ทริปโตเฟน, ทรีโอนีน, วาลีน) มากกว่าเคซีน;
เคซีนมีลักษณะเฉพาะมากกว่า เนื้อหาสูงกรดอะมิโนไดคาร์บอกซิลิก - กลูตามิกและแอสปาร์ติก;
คุณสมบัติทางกายภาพและเคมีของโปรตีน
เคซีนเป็นเคซีเนตแคลเซียมฟอสเฟตคอมเพล็กซ์คุณสมบัติทางเคมีกายภาพที่สำคัญของเคซีนคือเคซีนมีอยู่ในนมในรูปของแคลเซียมเคซิเนตร่วมกับแคลเซียมฟอสเฟตคอลลอยด์
แคลเซียมไอออนสามารถยึดติดกับกลุ่มคาร์บอกซิลของเคซีน:
R – COOH + Ca 2+ → R – COOCa +
2R - COOH + Ca 2+ → Ca
แต่อย่างแรกเลย พวกมันมีปฏิกิริยากับกรดฟอสฟอริกที่ตกค้างของเคซีน ในกรณีนี้ แคลเซียมสามารถรวมกับกลุ่มกรด OH หนึ่งหรือสองกลุ่ม:
R - CH 2 - O - P \u003d O + Ca 2+ → R - CH 2 - O - P \u003d O
เคซีน แคลเซียมเคซีเนต
R - CH 2 - O - P \u003d O + Ca 2+ → R - CH 2 - O - P Ca OH O
เคซีน แคลเซียมเคซีเนต
ในกรณีแรก แคลเซียมมีความจุอิสระและสามารถสร้างสะพานแคลเซียมระหว่างกลุ่มซีรีนฟอสเฟตของโมเลกุลเคซีน 2 ตัว:
R - CH 2 - O - P \u003d O O \u003d P - O - CH 2 - R
นอกเหนือจากแคลเซียมไอออนแล้วคอลลอยด์แคลเซียมฟอสเฟตของนมในรูปของ n หรือ n สามารถเข้าร่วมกลุ่มซีรีนฟอสเฟตของโมเลกุลเคซีน (องค์ประกอบที่แน่นอนของคอลลอยด์แคลเซียมฟอสเฟตยังไม่ได้รับการชี้แจง)
Ca-O-P-O-Ca
R - CH 2 - O - P \u003d O O \u003d P - O - CH 2 - R
อนินทรีย์อินทรีย์
ดังนั้นเคซีนในนมจึงอยู่ในรูปแบบ ซับซ้อน ซับซ้อนแคลเซียมเคซิเนตกับแคลเซียมฟอสเฟตคอลลอยด์ที่เรียกว่าเคซีเนตแคลเซียมฟอสเฟตคอมเพล็กซ์ - CCPC
คุณสมบัติทางเคมีฟิสิกส์ของโปรตีนยังรวมถึงคุณสมบัติทางไฟฟ้าและความสามารถในการละลาย คุณสมบัติทางแสง และการเปลี่ยนสภาพ
คุณสมบัติทางไฟฟ้าและความสามารถในการละลาย . ในระหว่างการก่อตัวของโครงสร้างของโปรตีน กลุ่มหน้าที่อิสระจะยังคงอยู่บนผิวของอนุภาค ซึ่งแยกตัวออกจากเฟสที่เป็นน้ำและก่อตัวเป็นไอออน กลุ่มที่แตกตัวเป็นไอออนให้คุณสมบัติทางไฟฟ้าแก่โมเลกุลโปรตีน ตัวอย่างเช่น กลุ่มคาร์บอกซิลและฟอสเฟตบริจาคโปรตอนและไปอยู่ในรูปของแอนไอออน:
R – COOH ↔ R – COO - + H + ;
R - O - P \u003d O ↔ R - O - P \u003d O + 2H +;
หมู่อะมิโนสามารถติดโปรตอนและไปอยู่ในรูปของไพเพอร์: R - NH 2 + H + ↔ R - N + H 3
สิ่งนี้อธิบายประจุบางอย่างของโปรตีนพื้นเมืองและการปฐมนิเทศทางไฟฟ้า (ประจุลบมีอิทธิพลเหนือพื้นผิวของโปรตีนพื้นเมือง ซึ่งกำหนดคุณสมบัติที่เป็นกรดของโปรตีน)
คุณสมบัติที่สำคัญของโปรตีนขึ้นอยู่กับจำนวนประจุไฟฟ้าและอัตราส่วนบนพื้นผิวของอนุภาคโปรตีน:
ความสามารถในการให้น้ำและละลายด้วยการก่อตัวของสารละลายคอลลอยด์
ความสามารถในการเคลื่อนที่ในสนามไฟฟ้า
ลักษณะเปรี้ยวหรือพื้นฐาน
ความสามารถในการสร้างเกลือ
โปรตีนมีลักษณะการให้ความชุ่มชื้นในระดับสูงเนื่องจากแรงของปฏิกิริยาไฟฟ้าสถิตระหว่างกลุ่มขั้วของพวกมันกับแรงไดโพลของโมเลกุลน้ำ เปลือกไฮเดรชั่นที่เกิดขึ้นรอบๆ อนุภาคโปรตีนช่วยป้องกันการรวมตัวของโมเลกุลโปรตีนในสภาพดั้งเดิมและการแข็งตัวของเลือด การมีอยู่และความแข็งแรงเป็นหนึ่งในปัจจัยในสถานะโปรตีนคอลลอยด์ที่เสถียร โปรตีนเนื่องจากการมีอยู่บนพื้นผิว จำนวนมากหมู่ไอออไนซ์เป็นส่วนประกอบที่จับกับน้ำได้มากที่สุดในกลุ่ม ระบบชีวภาพ. ยิ่งโปรตีนมีประจุมากเท่าไหร่ ก็ยิ่งมากขึ้นเท่านั้น น้ำมากขึ้นพวกเขาสามารถแนบและมีเสถียรภาพมากขึ้นในการแก้ปัญหา
ต้องคำนึงถึงความสามารถของโปรตีนในการจับน้ำในการผลิต ผลิตภัณฑ์นมหมัก, ผลิตภัณฑ์นมแห้ง ตลอดจนการเลือกความชื้นในการจัดเก็บ
จำนวนประจุและอัตราส่วนบนพื้นผิวของอนุภาคโปรตีนเป็นตัวกำหนดความสามารถในการละลาย ความเร็วของการเคลื่อนที่ในสนามไฟฟ้า และเป็นพื้นฐานสำหรับการแยกโปรตีนด้วยอิเล็กโตรโฟเรติกและการระบุตัวตนของพวกมัน
จำนวนประจุและความสามารถในการละลายขึ้นอยู่กับปัจจัยหลายประการ โดยเฉพาะอย่างยิ่ง pH สิ่งแวดล้อมทางน้ำประกอบด้วยอนุภาคโปรตีน กลุ่มฟังก์ชันที่แตกตัวเป็นไอออนจะปฏิบัติตามกฎของปฏิกิริยาสมดุลและถูกกำหนดโดยค่าของ K D (ค่าคงที่การแยกตัวออกจากกัน):
![]()
ด้วยการเพิ่มความเข้มข้นของไฮโดรเจนไอออนในตัวกลาง การแตกตัวของกลุ่มคาร์บอกซิลค่อนข้างช้าลงเพื่อรักษาสมดุล R - COOH ↔ R - COO - + H + . ที่ pH ต่ำมาก หมู่คาร์บอกซิลมีอยู่ในรูปแบบที่ไม่แยกจากกัน ในทางตรงกันข้ามในช่วง pH ที่เป็นด่างจะแยกตัวออกจากกันอย่างสมบูรณ์
เมื่อค่า pH ในนมลดลง ไฮโดรเจนไอออนจะจับกับกลุ่มคาร์บอกซิลที่แตกตัวเป็นไอออนตามสภาวะสมดุล และจำนวนประจุลบบนพื้นผิวของอนุภาคโปรตีนจะลดลง เนื่องจากการสูญเสียประจุ (เชิงลบ) เปลือกไฮเดรชั่นจะถูกรบกวนด้วย และด้วยเหตุนี้ ความสามารถในการละลายของโปรตีนจะเสื่อมลง เมื่อถึงค่า pH 4.6 (จุดไอโซอิเล็กทริกของโปรตีน) โปรตีนจะตกตะกอน
ด้วยการเพิ่มความเข้มข้นของไฮโดรเจนไอออนในตัวกลาง โปรตอนของหมู่อะมิโนเกิดขึ้นบนพื้นผิวของอนุภาคโปรตีน ประจุทั้งหมดจะเพิ่มขึ้นอีกครั้ง แต่ประจุที่เด่นกว่านั้นเป็นประจุบวกอยู่แล้ว ภายใต้เงื่อนไขเหล่านี้ โปรตีนจะละลายอีกครั้ง การเปลี่ยนแปลงในอัตราส่วนของประจุบนพื้นผิวของอนุภาคโปรตีนแสดงไว้ในแผนภาพ 5.6.
ดังนั้น ที่จุดไอโซอิเล็กทริก (pH 4.6) จำนวนประจุบนพื้นผิวของอนุภาคโปรตีนจึงไม่มีนัยสำคัญ ดังนั้นความชุ่มชื้นของโปรตีนภายใต้สภาวะดังกล่าวจึงอ่อนแอที่สุดและความเสถียรของโปรตีนก็ต่ำที่สุด ที่จุดไอโซอิเล็กทริก โปรตีนมีความสามารถที่เด่นชัดในการตกตะกอน กล่าวคือ ค่า pH จะกำหนดสถานะบางอย่างของโปรตีน: ในรูปแบบที่ละลายน้ำได้หรือในตะกอน
ข้าว. 5.6. การเปลี่ยนแปลงในอัตราส่วนของประจุบนพื้นผิวของอนุภาคโปรตีนที่มีค่า pH ลดลง (ตามแผนผัง):
เอ - ค่า pH ลดลงถึงจุดไอโซอิเล็กทริก
b - ค่า pH ลดลงเกินจุดไอโซอิเล็กทริก
ความสามารถของโปรตีนในการเปลี่ยนความสามารถในการละลายเมื่อ pH ของตัวกลางลดลงถึงจุด isoelectric เป็นสาระสำคัญของการแข็งตัวของกรดของโปรตีนซึ่งเป็นพื้นฐานสำหรับการผลิตผลิตภัณฑ์นมหมักทั้งหมด: เครื่องดื่ม, ชีสกระท่อม, ครีม, บางชนิดชีส
ในบริเวณที่เป็นด่างของ pH กลุ่มคาร์บอกซิลจะแยกตัวออกจากกันอย่างสมบูรณ์และโปรตีนอยู่ในสถานะละลาย
ปัจจัยที่สองที่ส่งผลต่อความสามารถในการละลายของโปรตีนคือความเข้มข้นของเกลือแคลเซียมและแมกนีเซียมในระบบ ที่ความเข้มข้นของเกลือต่ำ (ระดับที่สอดคล้องกับปริมาณในนม) ความสามารถในการละลายของโปรตีนนั้นดี โปรตีนดูดซับแคลเซียมและแมกนีเซียมไอออนบนผิวของมัน ซึ่งจะเป็นการเพิ่มประจุรวมและเสริมความแข็งแรงของเปลือกความชุ่มชื้น ความเข้มข้นของเกลือที่สูงมากมีผลตรงกันข้าม ไอออนของแคลเซียมและแมกนีเซียมจะแข่งขันกับอนุภาคโปรตีน และเนื่องจากความหนาแน่นของประจุที่เพิ่มขึ้น จึงสามารถขจัดน้ำที่ให้ความชุ่มชื้นออกจากอนุภาคเหล่านี้ได้ ปราศจากเปลือกชุ่มชื้น โปรตีนก่อตัวเป็นก้อนและตกตะกอน
ความสามารถในการละลายของโปรตีนยังเปลี่ยนแปลง (ลดลง) ภายใต้อิทธิพลของตัวทำละลายอินทรีย์ (แอลกอฮอล์ อะซิโตน) ค่าคงที่ไดอิเล็กตริกของสารละลายในน้ำจะลดลง ซึ่งจะช่วยลดความชุ่มชื้น ปฏิกิริยาระหว่างโปรตีนกับแอลกอฮอล์ยิ่งแรง ยิ่งมีโปรตีนไม่เสถียรในสารละลาย คุณสมบัตินี้ใช้เพื่อสร้างความคงตัวทางความร้อนของนมตามการทดสอบแอลกอฮอล์ในการผลิตผลิตภัณฑ์นมที่ผ่านการฆ่าเชื้อ
คุณสมบัติทางแสงโปรตีนคุณสมบัติทางแสงของสารละลายโปรตีนใช้เพื่อกำหนดความเข้มข้นของโปรตีนแต่ละชนิดหรือส่วนผสมของโปรตีนอย่างรวดเร็ว:
การดูดกลืนสเปกตรัมอัลตราไวโอเลตหรือการดูดกลืนแสง (วิธีสเปกโตรโฟโตเมตริก)
ค่าที่แน่นอนของดัชนีการหักเหของแสง (วิธีหักเหของแสง)
กิจกรรมทางแสงของโปรตีนหรือความสามารถในการหมุนระนาบของโพลาไรซ์ (การเปลี่ยนแปลงในการหมุนเฉพาะของระนาบโพลาไรซ์เกิดขึ้นในระหว่างการทำให้โปรตีนเสื่อมสภาพ โดยการวัดการเปลี่ยนแปลงเหล่านี้ทำให้สามารถตรวจสอบการเสื่อมสภาพของโปรตีนได้)
การเสื่อมสภาพของโปรตีนนี่เป็นหนึ่งในคุณสมบัติที่สำคัญที่สุดของโปรตีน การเสื่อมสภาพเป็นผลมาจากการเปลี่ยนแปลงที่ไม่สามารถย้อนกลับได้
การเปลี่ยนสภาพเป็นการเปลี่ยนแปลงโครงสร้างของโปรตีนเมื่อเปรียบเทียบกับสภาพดั้งเดิม เมื่อโครงสร้างเปลี่ยนไป (การปรับใช้โครงสร้างรองและโครงสร้างตติยภูมิ) กลุ่มการทำงานที่อยู่ภายในการกำหนดค่าทรงกลมจะถูกปล่อย การคลี่คลายของโครงสร้างเกิดขึ้นเนื่องจากการหยุดชะงักของพันธะไฮโดรเจนและพันธะที่ไม่ชอบน้ำเนื่องจากพลังงานที่ค่อนข้างต่ำของพันธะเหล่านี้ โครงสร้างหลักมันไม่เปลี่ยนแปลงเนื่องจากพันธะเปปไทด์ถูกเก็บรักษาไว้
อาจทำให้เสียสภาพได้ อิทธิพลทางกายภาพ: ความร้อน, ความดัน, การแผ่รังสีพลังงานสูง (อัลตราไวโอเลตหรือไอออไนซ์), พลังงานเสียง, หรืออิทธิพลทางเคมี: ตัวทำละลายอินทรีย์ (แอลกอฮอล์, อะซิโตน), สารละลายยูเรีย, สารประกอบทางเคมีที่ทำปฏิกิริยากับหมู่ฟังก์ชันบนผิวของโปรตีน
ในระหว่างการแปลงสภาพ พันธะที่รองรับโครงสร้างก่อนหน้านี้จะถูกปลดปล่อยและสามารถปรับทิศทางใหม่ได้ ในเวลาเดียวกัน กลุ่มฟังก์ชันที่ทำงานอยู่ซึ่งเดิมอยู่ภายในโครงสร้างทรงกลมสามารถโต้ตอบกับโมเลกุลโปรตีนอื่นๆ
เวย์โปรตีนเปลี่ยนสภาพอย่างสมบูรณ์เมื่อถูกความร้อนถึง 90°C (5 นาที) หรือ 76°C (60 นาที) เศษส่วนของเวย์โปรตีนมีความคงตัวทางความร้อนต่างกันดังนั้นβ-lactoglobulin เริ่มเสื่อมสภาพที่ 70 ° C, α-lactalbumin - 72, อัลบูมินในเลือด - 64, อิมมูโนโกลบูลิน - 60 ° C ระดับของการทำให้เสียสภาพนั้นไม่เพียงขึ้นอยู่กับอุณหภูมิเท่านั้น เกี่ยวกับระยะเวลาของการสัมผัส
เวย์โปรตีนหลัก - β-lactoglobulin และ α-lactalbumin มีลักษณะเฉพาะด้วยความสามารถของโมเลกุลที่แปลงสภาพบางส่วนเพื่อฟื้นฟูโครงสร้างดั้งเดิมของพวกเขา (หลังจากทำให้นมเย็นลง) ปรากฏการณ์นี้เรียกว่าการปรับสภาพใหม่ ความสามารถในการเปลี่ยนสภาพของ α-lactalbumin นั้นสูงเป็นพิเศษ การผันกลับของการเปลี่ยนสภาพ (ที่ pH ของนมสด) อยู่ที่ประมาณ 90% α-lactalbumin ที่เปลี่ยนสภาพด้วยความร้อนในระดับสูงเช่นนี้อธิบายโดยความสามารถของโปรตีนในการรักษาเสถียรภาพของโครงสร้างด้วยความช่วยเหลือของแคลเซียม ตามที่นักวิทยาศาสตร์ชาวญี่ปุ่นกล่าวว่าเศษโปรตีนในสภาพดั้งเดิมสามารถจับแคลเซียมไอออนซึ่งการกำจัดออกในระหว่างการให้ความร้อนจะมาพร้อมกับการเปลี่ยนแปลงโครงสร้างในโครงสร้างโปรตีน แต่ด้วยการเย็นตัวที่ตามมา แคลเซียมจะเกาะติดกับโปรตีนอีกครั้งและมีส่วนช่วยในการฟื้นฟูโครงสร้างระดับอุดมศึกษา
การกลับตัวของ β-lactoglobulin denaturation นั้นต่ำกว่ามาก หลังจากให้ความร้อนที่อุณหภูมิ 70 ถึง 80 ° C โมเลกุลเพียงเล็กน้อยเท่านั้นที่จะฟื้นฟูโครงสร้างดั้งเดิม
เนื่องจากการเปลี่ยนแปลงโครงสร้างของเวย์โปรตีนหลังการให้ความร้อน พวกมันสามารถสร้างสารเชิงซ้อนระหว่างกัน (β-lactoglobulin - α-lactalbumin) ซึ่งสามารถโต้ตอบกับ χ-เคซีนได้ ผลของปฏิกิริยานี้คือการเพิ่มพื้นผิวที่มีประจุของเคซีนไมเซลล์และคุณสมบัติในการให้ความชุ่มชื้นเพิ่มขึ้น
การละเมิดโครงสร้างของเคซีนในระหว่างการพาสเจอร์ไรส์ของนม (สูงถึง 100 ° C) จะไม่เกิดขึ้น การเปลี่ยนแปลงโครงสร้างและการสลายตัวของเคซีนเป็นไปได้เมื่อถูกความร้อนถึง 120 ° C เป็นเวลา 5 ชั่วโมง ในระหว่างการทำให้เป็นเนื้อเดียวกัน เคซีน ไมเซลล์จะถูกย่อยสลายเป็น submicelles
การเสื่อมสภาพของโปรตีนไม่ได้ลดลง คุณค่าทางโภชนาการในทางตรงกันข้าม โปรตีนที่แปลงสภาพจะย่อยได้ง่ายกว่า เนื่องจากถูกโจมตีโดยเอนไซม์ย่อยโปรตีนได้ง่ายขึ้น
ปรากฏการณ์ของการเปลี่ยนสภาพของโปรตีนนมที่เกิดจากการให้ความร้อน การทำงานของเอนไซม์ และสภาวะในการเก็บรักษาทำให้เกิดปัญหาหลายประการในการปฏิบัติงานของอุตสาหกรรมผลิตภัณฑ์นม ในการผลิต สินค้าแต่ละชิ้น(เครื่องดื่มนมหมัก, ชีสกระท่อม, ชีสบางชนิด) ในทางกลับกันจงใจทำให้เกิดการเสียสภาพของโปรตีน (โดยอิทธิพลของความร้อน) การเปลี่ยนสภาพของโปรตีนมักจะมาพร้อมกับการสลายตัวของโปรตีน สิ่งเหล่านี้เป็นการเปลี่ยนแปลงที่ซับซ้อนและไม่สามารถแยกออกได้อย่างชัดเจนเสมอไป