Білки їх склад будова функції. Урок біології "Білки як високомолекулярні речовини. Склад, будова, структура та функції білків"
Класифікація білків.
Склад та будова
пептидний зв'язок
елементарний склад
молекулярна маса
амінокислоти
Хімічні та фізичні властивості.
Значення білків.
Список використаної литературы.
Вступ
Білкі -високомолекулярні азотисті органічні речовини, побудовані з амінокислоти, що грають фундаментальну роль у структурі та життєдіяльності організмів. Білки – основна та необхідна складова частина всіх організмів. Саме Білки здійснюють обмін речовин і енергетичні перетворення, нерозривно пов'язані з активними біологічними функціями. Суха речовина більшості органів і тканин людини і тварин, а також більшість мікроорганізмів складаються головним чином з білків (40-50%), причому рослинному світу властиво відхилення від цієї середньої величини у бік зниження, а тварині - підвищення. Мікроорганізми зазвичай багатші на білок (деякі ж віруси є майже чистими білками). Таким чином, в середньому можна прийняти, що 10% біомаси на Землі представлено білком, тобто його кількість вимірюється величиною близько 1012 - 1013 тонн. Білкові речовинилежать основу найважливіших процесів життєдіяльності. Так, наприклад, процеси обміну речовин (травлення, дихання, виділення та інші) забезпечуються діяльністю ферментів, що є за своєю природою білками. До білків відносяться і скорочувальні структури, що лежать в основі руху, наприклад скорочувальний білок м'язів (актоміозин), опорні тканини організму (колаген кісток, хрящів, сухожиль), покриви організму (шкіра, волосся, нігті тощо), що складаються головним чином з колагенів, еластинів, кератинів, а також токсини, антигени та антитіла, багато гормонів та інші біологічно важливі речовини. Роль білків у живому організмі підкреслюється вже їх назвою «протеїни» (у перекладі з грецької protos – перший, первинний) , запропонованим у 1840 голландським хіміком Р. Мульдером, який виявив, що у тканинах тварин і рослин містяться речовини, що нагадують за своїми властивостями яєчний білок. Поступово було встановлено, що білки є великим класом різноманітних речовин, побудованих за однаковим планом. Наголошуючи на першорядному значенні білків для процесів життєдіяльності, Енгельс визначив, що життя є спосіб існування білкових тіл, що полягає в постійному самооновленні хімічних складових частин цих тіл.
Класифікація білків.
Через відносно великих розмірівбілкових молекул, складності їх будови та відсутності досить точних даних про структуру більшості білків ще немає раціональної хімічної класифікації білків. Існуюча класифікація значною мірою умовна і побудована головним чином на підставі фізико-хімічних властивостей білків, джерел їх одержання, біологічної активності та інших нерідко випадкових ознак. Так, за фізико-хімічними властивостями білки ділять на фібрилярні та глобулярні, на гідрофільні (розчинні) та гідрофобні (нерозчинні) тощо. За джерелом отримання білки поділяють на тварини, рослинні та бактеріальні; на білки м'язові, нервової тканини, кров'яної сироватки тощо; з біологічної активності – на білки-ферменти, білки-гормони, структурні білки, скорочувальні білки, антитіла тощо. Слід, однак, мати на увазі, що через недосконалість самої класифікації, а також внаслідок виняткового різноманіття білків багато окремих білків не можуть бути віднесені до жодної з описаних тут груп.
Всі білки прийнято ділити на прості білки, або протеїни, і складні білки, або протеїди (комплекси білків з небілковими сполуками). Прості білки є полімерами тільки амінокислот; складні, крім залишків амінокислот, містять також небілкові, звані простетичні групи.
Гістони
Мають порівняно низьку молекулярну масу (12-13 тис.) з переважанням лужних властивостей. Локалізовані переважно у ядрах клітин. Розчинні у слабких кислотах, осаджуються аміаком та спиртом. Мають лише третинну структуру. У природних умовах міцно пов'язані з ДНК та входять до складу нуклеопротеїдів. Основна функція - регуляція передачі генетичної інформації з ДНК і РНК (можливе блокування передачі).
Протаміни
Найнижча молекулярна маса (до 12 тис.). Виявляє виражені основні властивості. Добре розчинні у воді та слабких кислотах. Містяться в статевих клітинах і становлять основну масу білка хроматину. Як і гістони утворюють комплекс із ДНК, функція - надають ДНК хімічної стійкості.
Глютелини
Рослинні білки, що містяться в клейковині насіння злакових та деяких інших, у зелених частинах рослин. Нерозчинні у воді, розчинах солей та етанолу, але добре розчиняються у слабких розчинах лугів. Містять усі незамінні амінокислоти, є повноцінними продуктами харчування.
Проламіни
Рослинні білки. Містяться в клейковині злакових рослин. Розчинні тільки в 70% спирті (це пояснюється високим вмістом проліну і неполярних амінокислот).
Протеїноїди
Білки опорних тканин (кістка, хрящ, зв'язки, сухожилля, нігті, волосся). Нерозчинні або важко розчинні у воді, сольових та водно-спиртових сумішах білки з високим вмістом сірки. До протеїноїдів належать кератин, колаген, фіброїн.
Альбуміни
Невисокою молекулярною масою (15-17 тис.). Характерні кислі властивості. Розчинні у воді та слабких сольових розчинах. Облягаються нейтральними солями при 100% насиченні. Беруть участь у підтримці осмотичного тиску крові, транспортують із кров'ю різні речовини. Містяться в сироватці крові, молоці, яєчному білку.
Глобуліни
Молекулярна маса до 100 тис.. У воді нерозчинні, але розчиняються в слабких сольових розчинах і осаджуються в менш концентрованих розчинах (вже при 50% насичення). Містяться в насінні рослин, особливо в бобових і масляних; у плазмі крові та в деяких інших біологічних рідинах. Виконують функцію імунного захисту, забезпечують стійкість організму до вірусних інфекційних захворювань.
Складні білки ділять ряд класів залежно від характеру простетичної групи.
Фосфопротеїни
Мають як небілковий компонент фосфорну кислоту. Представниками цих білків є казеїноген молока, вітелін (білок жовтків яєць). Така локалізація фосфопротеїдів свідчить про важливе їх значення для організму, що розвивається. У дорослих форм ці білки присутні в кістковій та нервової тканини.
Ліпопротеїни
Складні білки, простетична група яких утворена ліпідами. За будовою це невеликого розміру (150-200 нм) сферичні частинки, зовнішня оболонка яких утворена білками (що дозволяє їм пересуватися по крові), а внутрішня частина - ліпідами та їх похідними. Основна функція ліпопротеїнів – транспорт по крові ліпідів. Залежно від кількості білка та ліпідів, ліпопротеїди поділяються на хіломікрони, ліпопротеїди низької щільності (ЛПНЩ) та високої щільності (ЛПЗЩ), які іноді позначаються як - та -ліпопротеїди.
Металопротеїни
Глікопротеїни
Простетична група представлена вуглеводами та їх похідними. Виходячи з хімічної будови вуглеводного компонента, виділяють 2 групи:
Справжні- як вуглеводний компонент найчастіше зустрічаються моносахариди. Протеоглікани- побудовані з дуже великої кількості одиниць, що повторюються, мають дисахаридний характер (гіалуронова кислота, гіпорин, хондроїтин, каротинсульфати).
Функції: структурно-механічну (є у шкірі, хрящі, сухожиллях); каталітичну (ферменти); захисну; участь у регуляції клітинного поділу.
Хромопротеїни
Виконують ряд функцій: участь у процесі фотосинтезу та окисно-відновних реакціях, транспорт С та СО 2 . Є складними білками, простетична група яких представлена забарвленими сполуками.
Нуклеопротеїни
Роль протеїстичної групи виконує ДНК чи РНК. Білкова частина представлена в основному гістонами та протамінами. Такі комплекси ДНК з протамінами виявлені в сперматозоїдах, а з гістонами - у соматичних клітинах, де молекула ДНК намотана навколо молекул білка-гістона. Нуклепротеїни за своєю природою є поза клітиною віруси - це комплекси вірусної нуклеїнової кислоти та білкової оболонки - капсиду.
Склад та будова
Пептидна зв'язок
Білки є нерегулярними полімерами, побудованими з залишків -амінокислот, загальну формулуяких у водному розчині при значеннях pH, близьких до нейтральних, можна записати як NH 3 + CHRCOO – . Залишки амінокислот в білках з'єднані амідним зв'язком між -аміно-і -карбоксильними групами. Зв'язок між двома -амінокислотними залишками зазвичай називається пептидним зв'язком, А полімери, побудовані з залишків -амінокислот, з'єднаних пептидними зв'язками, називають поліпептидами.Білок як біологічно значуща структура може бути як один поліпептид, так і кілька поліпептидів, що утворюють в результаті нековалентних взаємодій єдиний комплекс.
Всі атоми, що входять у пептидний зв'язок, розташовуються в одній площині (планарна конфігурація).
Відстань між атомами С і N (в-СО-NH-зв'язку) дорівнює 0,1325 нм, тобто менше нормальної відстані між -вуглецевим атомом і атомом N того ж ланцюга, що виражається величиною 0,146 нм. Водночас воно перевищує відстань між атомами С і N, з'єднаними подвійним зв'язком (0,127 нм). Таким чином, зв'язок С і N -СО-NH -угрупованні може розглядатися як проміжна між простим і подвійним внаслідок сполучення π-електронів карбонільної групи з вільними електронами атома азоту. Це певним чином позначається на властивостях поліпептидів і білків: за місцем пептидних зв'язків легко здійснюється таутомерне перегрупування, що призводить до утворення енольної форми пептидного зв'язку, що відрізняється підвищеною реакційною здатністю.
Елементний склад білків
Для вивчення амінокислотного складу білків використовується головним чином метод гідролізу, тобто нагрівання білка з 6-10 моль/літр соляною кислотою при температурі 100-110 0 С отримують суміш -амінокислот, з яких можна виділити індивідуальні амінокислоти. Для кількісного аналізу цієї суміші в даний час застосовують іонообмінну та паперову хроматографію. Сконструйовано спеціальні автоматичні аналізатори амінокислот.
Розроблено також ферментативні методи ступінчастого розщеплення білка. Деякі ферменти розщеплюють макромолекулу білка специфічно лише у місцях знаходження певної амінокислоти. Так отримують продукти ступінчастого розщеплення - пептони та пептиди, подальшим аналізом яких встановлюють їхній амінокислотний залишок.
В результаті гідролізу різних білків виділено не більше 30-амінокислот. Двадцять із них зустрічаються частіше за інших.
При утворенні молекули білка або поліпептиду амінокислоти можуть з'єднуватися в різній послідовності. Можливо величезна кількість різних комбінацій, наприклад, з 20 -амінокислот можна утворити більше 10 18 комбінацій. Існування різного типу поліпептидів практично необмежене.
Послідовність сполуки амінокислот у тому чи іншому білку встановлюють шляхом ступінчастого розщеплення або рентгеноструктурним аналізом.
Для ідентифікації білків та поліпептидів використовують специфічні реакції на білки. Наприклад:
а) ксантопротеїнова реакція (поява жовтого фарбування при взаємодії з концентрованою азотною кислотою, яка в присутності аміаку стає помаранчевою; реакція пов'язана з нітруванням залишків фенілаланіну та тирозину);
б) біуретова реакція на пептидні зв'язки– дія розбавленого сульфату міді (II) на слаболужний розчин білка, що супроводжується появою фіолетово-синього забарвлення розчину, що обумовлено комплексоутворенням між міддю та поліпептидами.
в) реакція Міллона (освіта жовто-коричневого фарбування при взаємодії з Hg(NO 3) 2 + HNO 3 + HNO 2;
Молекулярна маса
Білки є високомолекулярними сполуками. Це полімери, що складаються із сотень та тисяч амінокислотних залишків - мономерів. Відповідно і молекулярна маса білків знаходиться в межах 10000-1000000. Так, у складі рибонуклеази (ферменту, що розщеплює РНК) міститься 124 амінокислотних залишків і її молекулярна маса становить приблизно 14000. Міоглобін (білок м'язів), що складається з 153 амінокислотних залишків, має молекулярну масу 17000, а гемоглобіном. Молекулярні маси інших білків вищі: -глобулін (утворює антитіла) складається з 1250 амінокислот і має молекулярну масу близько 150 000, а молекулярна маса білка вірусу грипу - 320 000 000.
Амінокислоти
Нині у різних об'єктах живої природи виявлено до 200 різних амінокислот. В організмі людини їх, наприклад, близько 60. Однак до складу білків входять лише 20 амінокислот, які називаються іноді природними.
Амінокислоти - органічні кислоти, у яких атом водню-вуглецевого атома заміщений на аміногрупу -NH2. З формули видно, що до складу всіх амінокислот входять такі загальні угруповання: -C-, -NH 2, -COOH. Бічні ж ланцюга (радикали -R) амінокислот різняться. Природа радикалів різноманітна: від атома водню до циклічних сполук. Саме радикали визначають структурні та функціональні особливості амінокислот.
Всі амінокислоти, крім найпростішої амінооцтової кислоти - гліцину (NH 3 + CH 2 COO) мають хіральний атом - C * - і можуть існувати у вигляді двох енантіомерів (оптичних ізомерів): L-ізомер і D-ізомер.
До складу всіх вивчених в даний час білків входять тільки амінокислоти L-ряду, у яких, якщо розглядати хіральний атом з боку атома H, групи NH 3 + COO і радикал -R розташовані за годинниковою стрілкою. Необхідність при побудові біологічно значущої полімерної молекули будувати її з певного енантіомеру очевидна - з рацемічної суміші двох енантіомерів вийшла б неймовірно складна суміш діастереоізомерів. Питання, чому життя на Землі засноване на білках, побудованих саме з L-, а не D-амінокислот, досі залишається загадкою, що інтригує. Слід зазначити, що D-амінокислоти досить поширені в живої природі і, більше того, входять до складу біологічно значущих олігопептидів.
Хімічні та фізичні властивості
Незважаючи на зовнішню відмінність, різні представники білків мають деякі загальними властивостями.
Так, оскільки всі білки є колоїдними частинками (розмір молекул лежить у межах 1 мкм до 1 нм), у воді вони утворюють колоїдні розчини. Ці розчини характеризуються високою в'язкістю, здатністю розсіювати промені видимого світла, не проходять через напівпроникні мембрани.
В'язкість розчину залежить від молекулярної маси та концентрації розчиненої речовини. Чим вище молекулярна маса, тим більш в'язкий розчин. Білки як високомолекулярні сполуки утворюють в'язкі розчини. Наприклад, розчин яєчного білкау воді.
Колоїдні частинки не проходять через напівпроникні мембрани (целофан, колоїдну плівку), так як їх пори менші від колоїдних частинок. Непроникними для білка є біологічні мембрани. Ця властивість білкових розчинів широко використовується в медицині та хімії для очищення білкових препаратів від сторонніх домішок. Такий процес поділу називається діалізом. Явище діалізу є основою дії апарату “штучна нирка”, який широко використовують у медицині на лікування гострої ниркової недостатності.
Білки здатні до набухання, характеризуються оптичною активністю та рухливістю в електричному полі, деякі розчинні у воді. Білки мають ізоелектричну точку.
Найважливішим властивістю білків є їхня здатність виявляти як кислі, так і основні властивості, тобто виступати в ролі амфотерних електролітів. Це забезпечується за рахунок різних угруповань, що входять до складу радикалів амінокислот. Наприклад, кислотні властивості білку надають карбоксильні групи аспарагінової та глутамінової амінокислот, а лужні – радикали аргініну, лізину та гістидину. Чим більше дикарбонових амінокислот міститься в білку, тим більше виявляються його кислотні властивості і навпаки.
Ці ж угруповання мають електричні заряди, що формують загальний заряд білкової молекули. У білках, де переважають аспарагінова та глутамінова амінокислоти, заряд білка буде негативним, надлишок основних амінокислот надає позитивного заряду білковій молекулі. Внаслідок цього в електричному полі білки пересуватимуться до катода або анода в залежності від їх загального заряду. Так, у лужному середовищі (рН 7–14) білок віддає протон і заряджається негативно (рух до аноду), тоді як у кислому середовищі (рН 1–7) пригнічується дисоціація кислотних груп та білок стає катіоном.
Таким чином, фактором, що визначає поведінку білка як катіону або аніону, є реакція середовища, яке визначається концентрацією водневих іонів і виражається величиною рН. Однак при певних значеннях рН число позитивних і негативних зарядів урівнюється і молекула стає електронейтральною, тобто вона не переміщатиметься в електричному полі. Таке значення рН середовища визначається як ізоелектрична точкабілків. При цьому білок знаходиться в найменш стійкому стані і при незначних змінах рН у кислу або лужну сторону легко випадає в осад. Для більшості природних білків ізоелектрична точка знаходиться в слабокислому середовищі (рН 4,8-5,4), що свідчить про переважання їх складу дикарбонових амінокислот.
Властивість амфотерності лежить в основі буферних властивостей білків та їх участі у регуляції рН крові. Величина рН крові людини відрізняється сталістю і знаходиться в межах 7,36-7,4, незважаючи на різні речовини кислого або основного характеру, що регулярно надходять з їжею або утворюються в обмінних процесах, отже, існують спеціальні механізми регуляції кислотно-лужної рівноваги внутрішнього середовища організму .
Білки активно вступають у хімічні реакції. Ця властивість пов'язана з тим, що амінокислоти, що входять до складу білків, містять різні функціональні групи, здатні реагувати на інші речовини. Важливо, що такі взаємодії відбуваються і всередині білкової молекули, у результаті утворюється пептидна, воднева, дисульфідна та інші види зв'язків. До радикалів амінокислот, а отже, і білків, можуть приєднуватися різні сполуки та іони.
Білки мають велику спорідненість до води, тобто вони гідрофільні. Це означає, що молекули білка, як заряджені частинки, притягують до себе диполі води, що розташовуються навколо білкової молекули та утворюють водну чи гідратну оболонку. Ця оболонка захищає молекули білка від склеювання та випадання в осад. Розмір гідратної оболонки залежить від структури білка. Наприклад, альбуміни легше зв'язуються з молекулами води і мають відносно велику водну оболонку, тоді як глобуліни, фібриноген приєднують воду гірше, і гідратна оболонка та їх менше. Таким чином, стійкість водного розчину білка визначається двома факторами: наявністю заряду білкової молекули і водної оболонки, що знаходиться навколо неї. При видаленні цих факторів білок випадає в осад. Цей процес може бути оборотним і необоротним.
Значення білків
Функції білків дуже різноманітні. Кожен даний білок як речовина з певною хімічною будовою виконує одну вузькоспеціалізовану функцію і лише в окремих випадках - кілька взаємопов'язаних. Наприклад, гормон мозкового шару надниркових залоз адреналін, надходячи в кров, підвищує споживання кисню та артеріальний тиск, вміст цукру в крові, стимулює обмін речовин, а також є медіатором нервової системиу холоднокровних тварин.
Численні біохімічні реакції в живих організмах протікають у м'яких умовпри температурах, близьких до 40С, і значення рН близьких до нейтральних. У цих умовах швидкості перебігу більшості реакцій мізерно малі, тому їх прийнятного здійснення необхідні спеціальні біологічні каталізатори - ферменти . Навіть така проста реакція, як дегідратація вугільної кислоти:
CO 2 + H 2 O HCO 3 - + H +
каталізується ферментом карбоангідразою . Взагалі всі реакції, за винятком реакції фотолізу води 2H 2 O4H + + 4e - + O 2 в живих організмах каталізуються ферментами (реакції синтезу, здійснюються за допомогою ферментів синтетаз, реакції гідролізу - за допомогою гідролаз, окислення - за допомогою оксидаз, відновлення з приєднанням – за допомогою гідрогеназ тощо). Як правило, ферменти - це або білки, або комплекси білків з кофактором - іоном металу або спеціальною органічною молекулою. Ферменти мають високу, іноді унікальну, вибірковість дії. Наприклад, ферменти, що каталізують приєднання -амінокислот до відповідних т-РНК у процесі біосинтезу білка, каталізують приєднання тільки L-амінокислот і не каталізують приєднання D-амінокислот.
Транспортна функція білків
Всередину клітини повинні надходити численні речовини, що забезпечують її будівельним матеріалом та енергією. У той же час всі біологічні мембрани побудовані за єдиним принципом - подвійний шар ліпідів, в який занурені різні білки, причому гідрофільні ділянки макромолекул зосереджені на поверхні мембран, а гідрофобні хвости - в товщі мембрани. Ця структура непроникна для таких важливих компонентів, як цукор, амінокислоти, іони лужних металів. Їхнє проникнення всередину клітини здійснюється за допомогою спеціальних транспортних білків, вмонтованих у мембрану клітин. Наприклад, бактерії мають спеціальний білок, що забезпечує перенесення через зовнішню мембрану молочного цукру - лактози. Лактоза міжнародної номенклатури позначається -галаткозид, тому транспортний білок називають -галактозидпермеазой.
Важливим прикладом транспорту речовин через біологічні мембрани проти градієнта концентрації є К/Na насос. У його роботи відбувається перенесення трьох позитивних іонів Na + з клітини кожні два позитивних іона K + в клітину. Ця робота супроводжується накопиченням електричної різниці потенціалів на мембрані клітини. У цьому розщеплюється АТФ, даючи енергію. Молекулярна основа натрій-калієвого насоса була відкрита нещодавно, це виявився фермент, що розщеплює АТФ - калій-натрійзалежна АТФ-аза.
p align="justify"> У багатоклітинних організмів існує система транспорту речовин від одних органів до інших. Насамперед це гемоглобін. Крім того, у плазмі крові постійно знаходиться транспортний білок – сироватковий альбумін. Цей білок має унікальну здатність утворювати міцні комплекси з жирними кислотами, що утворюються при перетравленні жирів, з деякими гідрофобними амінокислотами зі стероїдними гормонами, а також з багатьма лікарськими препаратами, такими як аспірин, сульфаніламіди, деякі пеніциліни.
Рецепторна функція
Велике значення, особливо для функціонування багатоклітинних організмів, мають білки-рецептори, вмонтовані в плазматичну мембрану клітин і службовці для сприйняття та перетворення різних сигналів, що надходять у клітину, як від навколишнього середовища, і від інших клітин. Як найбільш досліджені можна навести рецептори ацетилхоліну, що знаходяться на мембрані клітин у ряді міжнейронних контактів, у тому числі в корі головного мозку, та у нервово-м'язових сполук. Ці білки специфічно взаємодіють з ацетилхоліном CH 3 C(O) - OCH 2 CH 2 N + (CH 3) 3 і відповідає на це передачею сигналу всередину клітини. Після отримання та перетворення сигналу нейромедіатор має бути видалений, щоб клітина підготувалася до сприйняття наступного сигналу. Для цього служить спеціальний фермент - ацетилхолінестераза, що каталізує гідроліз ацетилхоліну до ацетату та холіну.
Багато гормонів не проникають усередину клітин-мішеней, а зв'язуються зі специфічними рецепторами лежить на поверхні цих клітин. Таке зв'язування є сигналом, що запускає у клітині фізіологічні процеси.
Захисна функція
Імунна система має здатність відповідати на появу чужорідних частинок виробленням величезної кількості лімфоцитів, здатних специфічно пошкоджувати саме ці частинки, якими можуть бути чужорідні клітини, наприклад, патогенні бактерії, ракові клітини, надмолекулярні частинки, такі як віруси, макромолекули, включаючи чужорідні. Одна з груп лімфоцитів - В-лімфоцити, що виробляє особливі білки, що виділяються в кровоносну систему, які пізнають чужорідні частинки, утворюючи при цьому високоспецифічний комплекс на цій стадії знищення. Ці білки називаються імуноглобулінами. Чужорідні речовини, що викликають імунну відповідь, називають антигенами, а відповідні до них імуноглобуліни - антитілами.
Білки та їх будова.
Серед органічних компонентів клітининайважливішими є білки. Вони дуже різноманітні і за будовою, і за функціями. Вміст білків у різних клітинах може коливатися від 50 до 80%. Білки є високомолекулярними (молекулярна маса до 1,5 млн вуглецевих одиниць) органічні сполуки. Крім, О, Н, N, до складу білків можуть входити S, Р, Fe. Білки побудовані із мономерів, якими є амінокислоти. Оскільки до складу молекул білківможе входити велика кількість амінокислот, їх молекулярна маса буває дуже великий.
У клітинах різних живих організмів зустрічається понад 170 різних амінокислот, але нескінченна різноманітність білків створюється за рахунок різного поєднання лише 20 амінокислот. З них може бути утворено 2432902008176640000 комбінацій, тобто різних білків, які будуть володіти абсолютно однаковим складом, але різною будовою. Але і це величезна кількість не межа - білок може складатися і з більшої кількості амінокислотних залишків, і, крім того, кожна амінокислота може зустрічатися в білку кілька разів.
Молекула амінокислоти складається з двох однакових всім амінокислот частин, одна з яких є аміногрупою (-NH2) з основними властивостями, інша - карбоксильною групою (-СООН) з кислотними властивостями. Частина молекули, звана радикалом (R), у різних амінокислотмає різну будову (рис. 12).
Наявність в одній молекулі амінокислоти і основної, і кислотної груп зумовлює їхню амфотерність і високу реактивність. Через ці групи відбуваються сполуки амінокислот під час утворення білка. В ході реакції полімеризації виділяється молекула води, а електрони, що звільнилися, утворюють ковалентний зв'язок, який отримав назву пептидної - утворюється пептид (грец. peptos - зварений). До вільних карбоксильної та аміногрупи можуть приєднуватися інші амінокислоти, подовжуючи «ланцюг», що називається поліпептидною. На одному кінці такого ланцюга завжди буде група МН2 (цей кінець називається N-кінцем), а на іншому кінці - група СООН (цей кінець отримав назву С-кінця) (рис. 13).
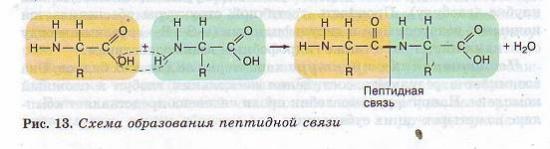
Поліпептидні ланцюги білків бувають дуже довгими і включають різні комбінації амінокислот. До складу білка може входити не одна, а два поліпептидні ланцюги і більше. Так, у молекулі інсуліну – два ланцюги, а імуноглобуліни складаються з чотирьох ланцюгів.
Бактеріїі рослини можуть синтезувати всі необхідні їм амінокислоти з простих речовин. Багато тварин, у тому числі і людина, здатні синтезувати не всі амінокислоти, тому так звані незамінні амінокислоти (лізин, валін, лейцин, ізолейцин, треонін, фенілаланін, триптофан, тирозин, метіонін) вони повинні отримувати з їжею у готовому вигляді.
Класифікація білків.
Серед білків розрізняють протеїни, що складаються тільки з білків, протеїди - містять небілкову частину (наприклад, гемоглобін).
Крім простих білків, що складаються тільки з амінокислот, є ще й складні, до складу яких можуть входити вуглеводи (глікопротеїди), жири (ліпопротеїди), нуклеїнові кислоти(нуклеопротеїди) та ін.
рівні організації білкової молекули.
Молекули білків можуть приймати різні просторові форми - конформації, які є чотири рівня їх організації (рис. 14).
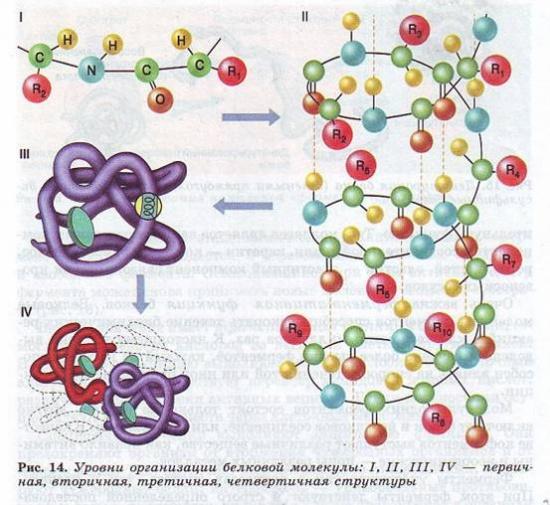
Лінійна послідовність амінокислот у складі поліпептидного ланцюгапредставляє первинну структуру білка. Вона унікальна для будь-якого білка та визначає його форму, властивості та функції.
Вторинна структура білків виникає внаслідок утворення водневих зв'язківміж групами -СООН та -NH2 -різних амінокислотних залишків поліпептидного ланцюга. Хоча водневі зв'язки маломіцні, але завдяки їх значній кількості у комплексі вони забезпечують досить міцну структуру.
Третинна структура є химерну, але кожного білка специфічну конфігурацію, має вигляд клубка (глобулу). Міцність третинної структури забезпечується іонними, водневими та дисульфідними (-S-S-) зв'язками між залишками цистеїну, а також гідрофобною взаємодією.
Четвертична структура характерна задля всіх білків.
Вона виникає в результаті з'єднання кількох глобул у складний комплекс. Наприклад, гемоглобін крові людини представляє комплекс із чотирьох таких субодиниць.
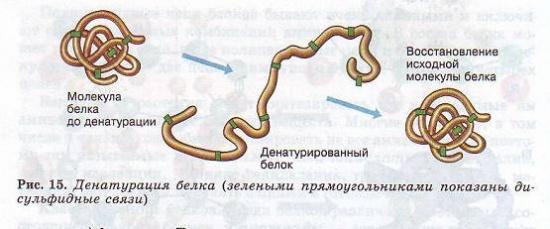
Втрата білкової молекулою власної природної структури називається денатурацією. Вона може виникати під впливом температури, хімічних речовин, зневоднення, опромінення та інших факторів. Якщо при денатурації не порушено первинна структура, то за відновлення нормальних умов білок здатний відтворювати свою структуру (рис. 15). Звідси випливає, що це особливості будови макромолекули білка визначаються його первинної структурою.
Функції білків.
Білки виконують цілий рядфункцій як і кожній клітині, і у цілому організмі. Функції білків різноманітні.
Білки є основою всіх біологічних мембран, всіх органоїдів клітини, таким чином вони виконують структурну (будівельну) функцію. - (Рис. 15.). Так, колаген є важливим складовим компонентом сполучної тканини, кератин – компонент пір'я, волосся, рогів, нігтів, еластин – еластичний компонент зв'язок, стінок кровоносних судин.
Дуже важливою є ферментативна функція білків.
Білкові молекули ферментів здатні прискорювати перебіг біохімічних реакцій у клітині у сотні мільйонів разів. До теперішнього часу виділено та вивчено більше тисячі ферментів, кожен з яких здатний впливати на швидкість перебігу тієї чи іншої біохімічної реакції.
Молекули одних ферментів складаються тільки з білків, інші включають білок і небілкову сполуку, або кофермент. Як коферменти виступають різні речовини, як правило вітамінита неорганічні – іони різних металів.
Ферменти беруть участь як у процесах синтезу, і розпаду. При цьому ферменти діють у строго певній послідовності, вони специфічні для кожної речовини та прискорюють лише певні реакції. Трапляються ферменти, які каталізують кілька реакцій. Вибірковість впливу ферментів різні хімічні речовини пов'язані з їх будовою. Каталітична активність ферменту визначається не всією його молекулою, а певною ділянкою молекули ферменту, яка називається його активним центром.
Субстрат взаємодіє з ферментом, причому зв'язування субстрату здійснюється саме в активному центрі, Форма та хімічна будова активного центру такі, що з ним можуть зв'язуватися лише певні молекули через їхню просторову відповідність, вони підходять один до одного, «як ключ до замку».
На заключному етапі хімічної реакції комплекс «фермент-субстрат» розпадається з утворенням кінцевих продуктів та вільного ферменту. Активний центр ферменту, що звільнився при цьому, може знову приймати нові молекули речовини-субстрату (рис. 16).
Важливе значення має функція білків.
Так, гемоглобін переносить кисень з легень до клітин інших тканин. У м'язах цю функцію виконує міоглобін білок. Сироватковий альбумін крові сприяє перенесенню ліпідів та жирних кислот, різних біологічно активних речовин. Білки-переносники здійснюють перенесення речовин через клітинні мембрани. Специфічні білки виконують захисну функцію. Вони оберігають організм від вторгнення чужорідних організмів та від ушкодження. Так, антитіла, що виробляються лімфоцитами, блокують чужорідні білки; інтерферони – універсальні противірусні білки; фібриноген, тромбін та інші оберігають організм від крововтрати, утворюючи тромб.
Багато живих істот для забезпечення захисту виділяють білки, які називаються токсинами, які в більшості випадків є сильними отрутами. У свою чергу деякі організми здатні виробляти антитоксини, які пригнічують дію цих отрут.
Регуляторна функція притаманна білкам-гормонам (регуляторам). Вони регулюють різноманітні фізіологічні процеси. Наприклад, найбільш відомим гормоном є інсулін, який регулює вміст глюкози у крові. При нестачі інсуліну в організмі виникає захворювання, відоме як цукровий діабет.
Білки можуть виконувати енергетичну функцію, будучи одним із джерел енергії у клітині. При повному розщепленні 1 г білка до кінцевих продуктів виділяється 17,6 кДж енергії. Але як джерело енергії білки використовуються дуже рідко. Амінокислоти, що вивільняються при розщепленні білкових молекул, використовуються для побудови нових білків.
Роль білка у житті клітини величезна. Сучасна біологія показала, що подібність і відмінність організмів визначаються зрештою набором білків. Чим ближче організми один до одного в систематичному становищі, тим подібніші їх білки.
Білки. Протеїни. Протеїди. Пептид. Пептидна зв'язок. Прості та складні білки. Первинна, вторинна, третинна та четвертинна структури білків. Денатурація. 1. Які речовини називають білками? 2. Що таке первинна структура білка? 3. Як утворюються вторинна, третинна та четвертинна структури білка? 4. Що таке денатурація білка? 5. За якою ознакою білки поділяються на прості та складні? 6. Які функції білків вам відомі? 7. Яку роль виконують білки-гормони? 8. Яку функцію виконують білки-ферменти? 9. Чому білки рідко використовуються як джерело енергії?
Білок яйця є типовим протеїном. З'ясуйте, що з ним станеться, якщо на нього вплинути водою, спиртом, ацетоном, кислотою, лугом, олією, високою температуроюі т.д.
1. Подрібніть бульбу сирої картоплі до кашки. Візьміть три пробірки і в кожну покладіть невелику кількість подрібненої картоплі.
Першу пробірку помістіть у морозилку холодильника, другу – на нижню полицю холодильника, а третю – у банку з теплою водою (t = 40 ° С). Через 30 хв дістаньте пробірки і в кожну капніть невелику кількість пероксиду водню. Поспостерігайте, що відбуватиметься у кожній пробірці. Поясніть результати.
Візьміть три пробірки і в кожну з них покладіть невелику кількість подрібненої сирої картоплі. У першу пробірку з картоплею капніть кілька крапель води, у другу - кілька крапель кислоти (столовий оцет), а третю - луги. Поспостерігайте, що відбуватиметься у кожній пробірці. Поясніть результати. Зробіть висновки. Ферменти значно перевершують інші каталізатори за специфічністю, каталітичною активністю та здатні діяти в м'яких умовах (невисокі температури, нормальний тиск тощо). Вони здатні протягом мілісекунд забезпечити перебіг складних багатостадійних реакцій, для проведення яких хіміку в сучасній лабораторії знадобилися б дні, тижні або навіть місяці. Наприклад, одна молекула ферменту каталази розщеплює за 1 хв більше 5 млн молекул пероксиду водню (Н2О2), який утворюється в організмі при окисленні різних сполук. Оскільки молекули білків, побудовані з амінокислот, надзвичайно великі і складні, то їх зображення використовують спеціальну загальноприйняту символіку. Кожна амінокислота позначається трьома латинськими літерами. Багато живих організмів здатні виробляти одні амінокислоти з інших і тому їм не дуже важливо, які амінокислоти містяться в білках їжі. Але деякі тварини, у тому числі людина, повинні отримувати переважну кількість амінокислот з їжею, оскільки ряд амінокислот, Звані незамінними, в їх організмі не виробляється, але вони необхідні для життєдіяльності.






