Скільки різних амінокислот входить до складу білка. §3. Органічні речовини. амінокислоти. Білки
АЗБУКУ ЖИВОЇ МАТЕРІЇ. БІЛКИ
Понад 4 млрд років тому на Землі з невеликих неорганічних молекул незбагненним чином з'явилися білки, що стали будівельними блоками живих організмів. Своєю нескінченною різноманітністю все живе завдячує саме унікальним молекулам білка, та інші форми життя у Всесвіті науці поки невідомі.
Білки, або протеїни(від грец."протос" - "перший"), - це природні органічні сполуки, які забезпечують усі життєві процеси будь-якого організму. З білків побудовано кришталик ока та павутиння, панцир черепахи та отруйні речовини грибів... За допомогою білків ми перетравлюємо їжу та боремося із хворобами. Завдяки особливим білкам ночами світяться світлячки, а в глибинах океану мерехтять таємничим світлом медузи.
Білкових молекул у живій клітці у багато разів більше, ніж решти (крім води, зрозуміло!). Вчені з'ясували, що у більшості організмів білки складають більше половини їхньої сухої маси. І різноманітність видів білків дуже велике - в одній клітці такого маленького організму, як бактерія Escherichiaсій" (див. додатковий нарис "Об'єкт дослідження - прокаріоти"), налічується близько 3 тис. різних білків.
Вперше білок був виділений (у вигляді клейковини) у 1728 р. італійцем Якопо Бартоломео Беккарі (1682-1766) з пшеничного борошна. Цю подію прийнято вважати народженням хімії білка. З того часу майже за три століття з природних джерелотримано тисячі різних білків та досліджено їх властивості.
БІОЛОГІЧНІ «БУСИ»
Молекула білка дуже довга. Хіміки називають такі молекули полімерними(від грец."Полі" - "багато" і "мерос" - "частина", "частка"). Дійсно, довга молекула полімеру складається з безлічі дрібних молекул, пов'язаних один з одним. Так нанизуються на нитку намистинки в намисто. У полімерах роль нитки грають хімічні зв'язки між намистинами-молекулами.Секрет білків захований в особливостях цих бусинок. Більшість полімерів не приймає стійкої форми в просторі, уподібнюючись до тих самих намистин, у яких і не може бути просторової структури: повісиш їх на шию - вони приймуть форму кільця або овалу, покладеш у коробку - згорнуться в клубок невизначеної форми. А тепер уявімо, що деякі намистинки можуть «злипатися» один з одним. Наприклад, червоні притягуються до жовтих. Тоді весь ланцюжок набуде певної форми, зобов'язаної своїм існуванням «сліпання» жовтих і червоних бусинок
Щось подібне відбувається і у білках. Окремі маленькі молекули, що входять до складу білка, мають здатність «злипатися», оскільки між ними діють сили тяжіння. В результаті будь-якого білкового ланцюга є характерна тільки для неї просторова структура. Саме вона визначає чудові властивостібілків. Без такої структури вони не могли б виконувати ті функції, які здійснюють живу клітину.
При тривалому кип'ятінні білків у присутності сильних кислот або лугів білкові ланцюгирозпадаються на складові їх молекули,
звані амінокислотами. Амінокислоти – це і є ті «намистинки», з яких складається білок, і влаштовані вони порівняно просто.
ЯК ВЛАШЕНА АМІНОКИСЛОТА
У кожній молекулі амінокислоти є атом вуглецю, пов'язаний із чотирма замісниками. Один із них - атом водню, другий - карбоксильна група -СООН. Вона легко "відпускає на волю" іон водню Н + ,завдяки чому в назві амінокислот і є слово «кислота». Третій заступник - аміногрупа -NH 2 і, нарешті, четвертий заступник - група атомів, яку в загальному випадку позначають R. У всіх амінокислот R-групи різні, і кожна з них грає свою, дуже важливу роль.
Властивості «намистинок», що відрізняють одну амінокислоту від іншої, приховані в R-групах (їх ще називають бічними ланцюгами). Що ж до групи -СООН, то хіміки-органіки ставляться до неї з великою повагою: всім іншим атомам вуглецю в молекулі даються позначення залежно від ступеня їхньої віддаленості від карбоксильної групи. Найближчий до неї атом називають а-атомом, другий - в-атомом, наступний - у-атомом і т. д. Атом вуглецю в амінокислотах, який знаходиться найближче до карбоксильної групи, тобто. а-атом, пов'язаний також з аміногрупою, тому природні амінокислоти, що входять до складу білка, називають а-амінокислотами.
У природі зустрічаються також амінокислоти, в яких NH-група пов'язана з більш віддаленими від карбоксильної групи атомами вуглецю. Однак для побудови білків природа вибрала саме а-амінокислоти. Це обумовлено насамперед тим, що тільки а-амінокислоти, з'єднані в довгі ланцюги, здатні забезпечити достатню міцність та стійкість структури великих білкових молекул.
Число а-амінокислот, що відрізняються R-групою, велике. Але найчастіше в білках зустрічається всього 20 різних амінокислот. Їх можна як алфавіт «мови» білкової молекули. Хіміки називають ці головні амінокислоти стандартними, основними чи нормальними. Умовно основні амінокислоти ділять на чотири класи.
До першого входять амінокислоти з неполярними бічними ланцюгами. У другій – амінокислоти, що містять полярну групу. Наступні два складають амінокислоти з бічними ланцюгами, які можуть заряджатися позитивно (вони поєднуються в третій клас) або негативно (четвертий). Наприклад, дисоціація карбоксильної групи дає аніон - СОО - а протонування атома азоту - катіон, наприклад -NH 3 + . Бічні ланцюги аспарагінової та глута-мінової кислот мають ще по одній карбоксильній групі -СООН, яка при значеннях рН, характерних для живої клітини (рН = 7), розлучається з іоном водню (Н+) і набуває негативного заряду. Бічні ланцюги амінокислот лізину, аргініну та гістидину заряджені позитивно, оскільки вони мають атоми азоту, які, навпаки, можуть іон водню приєднувати.
Кожна а-амінокислота (крім гліцину) залежно від взаємного розташування чотирьох заступників може існувати у двох формах. Вони відрізняються один від одного як предмет від свого дзеркального відображення або як права рукавід лівої. Такі сполуки отримали назву хоральних(від грін."Хір" - "рука"). Хіральні молекули відкрив у 1848 р. великий французький вчений Луї Пастер. Два типи оптичних ізомерів органічних молекул одержали назви Д-форма (від лат. dexter - «правий») та Z-форма (від лат. laevus – «лівий»). До речі, одна з назв інших хіральних молекул – глюкози та фруктози – декстроза та левулоза. Примітно, що до складу білків входять тільки Z-амінокислоти і вся білкове життяна Землі – «ліва».
Для нормальної життєдіяльності організм потребує повного набору із 20 основних a-Z-амінокислот. Але одні з них можуть бути синтезовані в клітинах самого організму, а інші повинні поступати в готовому виглядіз харчових продуктів. У першому випадку амінокислоти називають замінними,а в другому - незамінними.Набір останніх для різних організміврізний. Наприклад, для білого щура незамінними є 10 амінокислот, а для молочнокислих бактерій - 16. Рослини можуть самостійно синтезувати найрізноманітніші амінокислоти, створювати такі, що не зустрічаються у білках.
Для зручності 20 головних амінокислот позначають символами, використовуючи одну або перші три літери російської чи англійської назви амінокислоти, наприклад, аланін - Ала або А, гліцин - Глі або G.
ЩО ТАКЕ ПЕПТИД
Полімерна молекула білка утворюється при з'єднанні в довгий ланцюжок бусинок-амінокислот. Вони нанизуються на нитку хімічних зв'язків завдяки наявним у всіх амінокислот аміно- і карбоксильним групам, приєднаним до а-тому вуглецю.
З'єднання, що утворюються в результаті такої реакції, називаються пептидами; (-СО-NH-угруповання в них - це пептидна група,а зв'язок між атомами вуглецю та азоту - пептидний зв'язок(її ще називають амідною). З'єднуючи амінокислоти за допомогою пептидних зв'язків, можна отримати пептиди, що складаються з залишків багатьох амінокислот. Такі сполуки отримали назву поліпептиди.Поліпептидну будову білкової молекули довів у 1902 р. німецький хімік Еміль Герман Фішер.
На кінцях амінокислотного ланцюжка знаходяться вільні аміно- та карбоксильні групи; ці кінці ланцюжка називають N-і С-кінцями. Амінокислотні залишки в поліпептидному ланцюжку прийнято нумерувати з N-кінця.
Загальна кількість амінокислотних залишків у білковій молекулі змінюється у дуже широких межах. Так, людський інсулін складається з 51 амінокислотного залишку, а лізо-цим молока матері-годувальниці - зі 130. У гемоглобіні людини 4 амінокислотні ланцюжки, кожна з яких побудована з приблизно 140 амінокислот. Існують білки, що мають майже 3 тис. амінокислотних залишків у єдиному ланцюзі.
Молекулярні маси білків лежать у діапазоні приблизно від 11 тис. для малих білків, що складаються з 100 амінокислотних залишків, до 1 млн і більше для білків з дуже довгими поліпептидними ланцюгами або для білків, що складаються з кількох поліпептидних ланцюгів.
Виникає питання: як же все велике різноманіття білків з різними функціями та властивостями може бути створено лише з 20 молекул? А розгадка цього секрету природи проста – кожен білок має свій неповторний амінокислотний склад та унікальний порядок з'єднання амінокислот, званий первинною структуроюбілка.
СПИРАЛІ І ШАРИ
На початку 50-х років. XX ст. американські хіміки Лайнус Карл Полінг (1901-1994), нагороджений Нобелівською премією за дослідження природи хімічного зв'язку, і Роберт Корі (1897-1971) припустили, що деякі ділянки амінокислотного ланцюжка в білках закручені в спіраль. Завдяки вдосконаленню експериментальних методів (структуру білків вивчають за допомогою рентгенівських променів) через кілька років цей геніальний здогад підтвердився.
Дійсно, поліпептидні ланцюги дуже часто утворюють спіраль, закручену в правий бік. Це перший, самий низький рівеньпросторової організації білкових ланцюжків Тут і починають грати роль слабкі взаємодії «бусинок»-амінокислот: група С=0 та група N-H з різних пептидних зв'язків можуть утворювати між собою водневий зв'язок. Виявилося, що у відкритій Полінгом і Корі спіралі такий зв'язок утворений між групою С=0 кожної г-ї амінокислоти і групою N-H (i + 4)-ї амінокислоти, тобто між собою пов'язані амінокислотні залишки, що віддаляються один від одного на чотири «намистинки». Ці водневі зв'язкита стабілізують таку спіраль загалом. Вона отримала назву a.-спіралі.
Пізніше виявилося, що а-спіраль - не єдиний спосіб укладання амінокислотних ланцюжків. Крім спіралей, вони утворюють ще й шари. Завдяки тим же водневим зв'язкам між групами С=0 і N-H другз одним можуть «злипатися» відразу кілька різних фрагментів однієї поліпептидного ланцюга. В результаті виходить цілий шар – його назвали ^-шаром.
У більшості білків а-спіралі та р-шари перемежуються всілякими вигинами та фрагментами ланцюга без будь-якої певної структури. Коли мають справу із просторовою структурою окремих ділянок білка, кажуть про вторинну структуру білкової молекули.
БІЛОК У ПРОСТОРІ
Щоб отримати повний «портрет» молекули білка, знання первинної і вторинної структури недостатньо. Ці відомості ще не дають уявлення про обсяг, ні про форму молекули, ні тим більше про розташування ділянок ланцюга по відношенню один до одного. Адже всі спіралі та шари якимось чином розміщені у просторі. Загальна просторова структура поліпептидного ланцюга називається третинною структуроюбілка.
Перші просторові моделі молекул білка - міоглобіну та гемоглобіну - побудували наприкінці 50-х рр. XX ст. англійські біохіміки Джон Ко-Удері Кендрю (народився 1917 р.) та Макс Фердинанд Перуц (народився 1914 р.). При цьому вони використовували дані експериментів із рентгенівськими променями. За дослідження в галузі будови білків Кендрю та Перуц у 1962 р. були удостоєні Нобелівської премії. А наприкінці століття було визначено третинну структуру вже кількох тисяч білків.
При утворенні третинної структури білка виявляють активність R-групи - бічні ланцюги амінокислот. Саме завдяки їм «злипаються» між собою більшість «бусинок»-амінокислот, надаючи ланцюгу певної форми у просторі.
У живому організмі білки завжди знаходяться в водному середовищі. А саме велике числоОсновні амінокислоти - вісім - містять неполярні R-групи. Зрозуміло, білок прагне надійно сховати всередину своєї молекули неполярні бічні ланцюги, щоб обмежити контакт з водою. Вчені називають це виникненням гідрофобних взаємодій (див. статтю «Найдрібніша одиниця живого»).
Завдяки гідрофобним взаємодіям весь поліпептидний ланцюжок набуває певної форми в просторі, тобто утворює третинну структуру.
У молекулі білка діють інші сили. Частина бічних ланцюгів основних амінокислот заряджена негативно, а частина – позитивно. Так як негативні заряди притягуються до позитивних, відповідні «намистинки» «злипаються». Електростатичні взаємодії, або, як їх називають інакше, сольові містки, -ще одна важлива сила, що стабілізує третинну структуру.
У семи основних амінокислот є полярні бічні ланцюги. Між ними можуть виникати водневі зв'язки, які теж відіграють чималу роль у підтримці просторової структури білка.
Між двома амінокислотними залишками цистеїну іноді утворюються ковалентні зв'язки (-S-S-), які дуже міцно фіксують розташування різних ділянокбілкового ланцюга по відношенню один до одного. Такі зв'язки називають дисуль-фідними містками.Це нечисленні взаємодії в білках (у деяких випадках вони взагалі відсутні), зате по міцності вони не мають рівних.
ВИЩИЙ РІВЕНЬ ПРОСТОРНОЇ ОРГАНІЗАЦІЇ БІЛКІВ
Молекула білка може складатися не з одного, а з кількох поліпептидних ланцюгів. Кожен такий ланцюг є самостійною просторовою структурою - суб-одиницю.Наприклад, білок гемоглобін складається з чотирьох субодиниць, які утворюють єдину молекулу, розташовуючись у вершинах майже правильного тетраедра. Субодиниці «прилипають» одна до одної завдяки тим самим силам, що стабілізують третинну структуру. Це гідрофобні взаємодії, сольові містки та водневі зв'язки.
Якщо білок складається з декількох субодиниць, кажуть, що він має четвертинною структурою.Така структура є вищий рівеньорганізації білкової молекули. На відміну від перших трьохрівнів четвертинна структура є далеко не у всіх білків. Приблизно половина з відомих на сьогоднішній день білків її не мають.
ЧОМУ БІЛКИ БОЯТЬСЯ ТЕПЛА
Зв'язки, що підтримують просторову структуру білка, легко руйнуються. Ми з дитинства знаємо, що при варінні яєць прозорий яєчний білок перетворюється на пружну білу масу, а молоко при скисанні загусне. Відбувається це через руйнування просторової структури білків альбуміну в яєчному білкута казеїну (огглат. caseus – «сир») у молоці. Такий процес називається денатурацією.У першому випадку її викликає нагрівання, а в другому - значне збільшення кислотності (в результаті життєдіяльності бактерій, що живуть в молоці). При денатурації білок втрачає здатність виконувати властиві йому в організмі функції (звідси назва процесу: від латів. denaturare – «позбавляти природних властивостей»). Денатуровані білки легко засвоюються організмом, тому однією з цілей термічної обробки харчових продуктів є денатурація білків.
НАВІЩО ПОТРІБНА ПРОСТОРА СТРУКТУРА
У природі майже нічого не відбувається випадково. Якщо білок прийняв певну форму у просторі, це має бути досягненню якоїсь мети. Справді, лише білок з «правильною» просторовою структурою може мати певні властивості, т. е. виконувати ті функції в організмі, які йому наказані. А робить він це за допомогою тих самих R-груп амінокислот. Виявляється, бічні ланцюги як підтримують «правильну» форму молекули білка у просторі. R-групи можуть пов'язувати інші органічні та неорганічні молекули, брати участь у хімічних реакціях, виступаючи, наприклад, у ролі каталізатора.
Часто сама просторова організація поліпептидного ланцюга якраз і потрібна для того, щоб зосередити в певних точках простору необхідний для виконання тієї чи іншої функції набір бічних ланцюгів. Мабуть, жоден процес у живому організмі не проходить без участі білків.
У ЧОМУ СЕКРЕТ ФЕРМЕНТІВ
Всі хімічні реакції, що протікають у клітині, відбуваються завдяки особливому класу білків. ферментів.Це білки-каталізатори. У них є свій секрет, який дозволяє їм працювати набагато ефективніше за інших каталізаторів, прискорюючи реакції в мільярди разів.
Припустимо, що кілька друзів не можуть зустрітися. Але варто було одному з них запросити друзів на день народження, як результат не забарився: всі опинилися в одному місці в призначений час.
Щоб зустріч відбулася, потрібно підштовхнути друзів до контакту. Те саме робить і фермент. У його молекулі є так звані цгнтри зв'язування.Вони розташовані привабливі для певного типу хімічних сполук(І тільки для них!) «Затишні крісла» - R-групи, які пов'язують якісь ділянки молекул реагуючих речовин. Наприклад, якщо одна з молекул має неполярну групу, у центрі зв'язування знаходяться гідрофобні бічні ланцюги. Якщо ж у молекулі є негативний заряд, його чекатиме в молекулі ферменту R-група з позитивним зарядом.
В результаті обидві молекули реагентів зв'язуються з ферментом і опиняються в безпосередній близькості одна від одної. Мало того, ті їхні групи, які мають вступити в хімічну реакцію, зорієнтовані у просторі необхідним реакції чином. Тепер за справу приймаються бічні ланцюги ферменту, які грають роль каталізаторів. У ферменті все «продумано» таким чином, що R-групи-каталізатори теж розташовані поблизу місця подій, яке називають активним центром.А після завершення реакції фермент "відпускає на волю" молекули-продукти (див. статтю "Ферменти - на всі руки майстра").
ЗВІДКИ БЕРЕТЬСЯ ІМУНІТЕТ
Білки виконують у організмі безліч функцій; вони, наприклад, захищають клітини від небажаних вторгнень, оберігають від пошкоджень. Спеціальні білки - антитілаволодіють здатністю розпізнавати бактерії, що проникли в клітини, віруси, чужорідні полімерні молекули і нейтралізувати їх.
У вищих хребетних від чужорідних частинок організм захищає імунна система.Вона влаштована так, що організм, в який вторглися такі «агресори» - антигени,починає виробляти антитіла. Молекула антитіла міцно зв'язується з антигеном: антитіла, як і ферменти, теж мають центри зв'язування. Бічні ланцюги амінокислот розташовані в центрах таким чином, що антиген, який потрапив у цю пастку, вже не зможе вирватися з залізних лап антитіла. Після зв'язування з антитілом ворог видворяється межі організму.
Можна ввести в організм невелику кількість деяких полімерних молекул, що входять до складу бактерій або вірусів-збудників будь-якої інфекційної хвороби.
В організмі негайно з'являться відповідні антитіла. Тепер «справжній» хвороботворний мікроб, який потрапив у кров або лімфу, відразу ж піддасться атаці цих антитіл, і хвороба буде переможена. Такий спосіб боротьби з інфекцією є не що інше, як нелюбима багатьма щеплення. Завдяки їй організм набуває імунітету до інфекційних хвороб.
ДЛЯ ЧОГО В ГЕМОГЛОБИНІ ЗАЛІЗО
У природі існують білки, в яких, крім амінокислот, містяться інші хімічні компоненти, такі, як ліпіди, цукру, іони металів. Зазвичай, ці компоненти відіграють важливу роль при виконанні білком його біологічної функції. Так, перенесення молекул та іонів з одного органу в інший здійснюють транспортні білкиплазми. Білок гемоглобін(від грец.«гема» - «кров» і лат. globus - "куля", "кулька"), що міститься в кров'яних клітинах - еритроцитах (від грец.«еритрос» – «червоний» і «кітос» – «клітка»), доставляє кисень від легень до тканин. У молекулі гемоглобіну є комплекс іону заліза Fe 24 "зі складною органічною молекулою, званий гемам.Гемоглобін складається з чотирьох білковихсубодиниць, і кожна містить по одному гему.
У зв'язуванні кисню у легенях бере участь безпосередньо іон заліза. Як тільки до нього хоча б в одній із субодиниць приєднується кисень, сам іон відразу трохи змінює своє розташування в молекулі білка. Рух заліза «провокує» рух всього амінокислотного ланцюжка цієї субодиниці, яка трохи трансформує свою третинну структуру. Інша субодиниця, яка ще не приєднала кисень, «відчує», що сталося із сусідкою. Її структура теж починає змінюватись. У результаті друга субодиниця пов'язує кисень легше, ніж перша. Приєднання кисню до третьої та четвертої субодиниць відбувається з ще меншими труднощами. Як видно, субодиниці допомагають одна одній у роботі. Для цього гемоглобіну і потрібна четвертинна структура. Оксид вуглецю СО (у просторіччі чадний газ) зв'язується із залізом у гемі в сотні разів міцніше кисню. Чадний газ смертельно небезпечний для людини, оскільки позбавляє гемоглобін можливості приєднувати кисень.
А ЩЕ БІЛКИ...
Служать поживними речовинами. У насінні багатьох рослин (пшениці, кукурудзи, рису та ін.) містяться харчові білки. До них відносяться також альбумін - основний компонент яєчного білка та казеїн - головний білокмолока. При перетравленні в організмі людини білкової їжі відбувається гідроліз пептидних зв'язків. Білки "розбираються" на окремі амінокислоти, з яких організм надалі "будує" нові пептиди або використовує для отримання енергії. Звідси й назва:
грецьке слово "пептос" означає "перетравлений". Цікаво, що гідролізом пептидного зв'язку керують також білки - ферменти.
Беруть участь у регуляції клітинної та фізіологічної активності. До подібним білкамставляться багато гормони(від грец."гормао" - "спонукаю"), такі, як інсулін, що регулює обмін глюкози, і гормон росту.
Наділяють організм здатністю змінювати форму та пересуватися. За це відповідають білки актин та міозин, з яких побудовані м'язи.
Виконують опорну та захисну функції, скріплюючи біологічні структуриі надаючи їм міцність. Шкіра є майже чистий білок колаген, а волосся, нігті та пір'я складаються з міцного нерозчинного білка кератину.
ЩО ЗАПИСАНО У ГЕНАХ
Послідовність амінокислот у білках кодується генами, які зберігаються та передаються у спадок за допомогою молекул ДНК (див. статті «Зберігач спадкової інформації. ДНК» та «Експресія генів»). Просторову структуру білка визначає саме порядок розташування амінокислот. Виходить, що як первинна, а й вторинна, третинна і четвертинна структури білків становлять зміст спадкової інформації. Отже, і функції, що виконуються білками, запрограмовані генетично. Величезний список цих функцій дозволяє білкам по праву називатися основними молекулами життя. Тому відомості про білки і є безцінним скарбом, який передається в природі від покоління до покоління.
Інтерес людини до цих органічних сполук з кожним роком лише зростає. Сьогодні вчені вже розшифрували структуру багатьох білкових молекул. Вони з'ясовують функції різних білків, намагаються визначити взаємозв'язок функцій зі структурою. Встановлення подібності та відмінностей у білків, що виконують аналогічні функції у різних живих організмів, дозволяє глибше проникати в таємниці еволюції.
АМІНОКИСЛОТИ - ПОКАЗНИКИ ВІКУ
D- і L-форми амінокислот мають здатність дуже повільно перетворюватися один на одного. За певний (дуже тривалий) період часу чиста D-або I-форма може стати сумішшю рівних кількостей обох форм. Така суміш називається раїємагом,а сам процес - раїємізацією.Швидкість рацемізації залежить від температури та типу амінокислоти. Дана властивість можна використовувати для визначення віку викопних залишків організмів, а при необхідності – і живих істот. Наприклад, у білку дентину (дентин - кісткова тканиназубів) 1-ас-парагінова кислота мимовільно раїємізується зі швидкістю 0,1% на рік. У дітей у період формування зубів у дентині міститься лише 1-аспарагінова кислота. Дентин виділяють із зуба і визначають У ньому вміст 0-форми. Результати тесту досить точні. Так, для 97-річної жінки, вік якої документально засвідчили, тест показав вік 99 років. Дані досліджень, виконаних на викопних залишках доісторичних тварин - слонів, дельфінів, ведмедів - добре узгоджуються з результатами датування, отриманими радіонуклідним методом.
ЗА ЩО СЕНГЕР ОТРИМАВ НОБЕЛІВСЬКІ ПРЕМІЇ
При гідролізі білків до амінокислот (руйнування пептидного зв'язку водою) втрачається інформація про послідовність їх сполуки. Тому довгий часвважали, що визначення первинної структури білка є абсолютно безнадійним завданням. Але в 50-х роках. XX ст. англійський біохімік Фредерік Сенгер (народився 1918 р.) зміг розшифрувати послідовність амінокислот у поліпептидних ланцюгах гормону інсуліну. За цю роботу, на виконання якої пішло кілька років, 1958 р. Сенгер був удостоєний Нобелівської преміїз хімії (двадцятьма роками пізніше він спільно з У. Гілбертом отримав другу премію за внесок у встановлення первинної структури ДНК).
Принципи визначення амінокислотної послідовності, вперше сформульовані Сенгером, використовуються і нині, щоправда, з різними варіаціями та вдосконаленнями. Процедура встановлення первинної структури білка складна та багатоступінчаста: у ній близько десятка різних стадій. Спочатку білок розщеплюють до окремих амінокислот і встановлюють їх тип та кількість у цій речовині. На наступній стадії довгу білкову молекулу розщеплюють не повністю, але в фрагменти. Потім у цих фрагментах визначають порядок з'єднання амінокислот, послідовно відокремлюючи їх одну за одною. Розшеплення білка на фрагменти проводять декількома способами, щоб у різних фрагментах були ділянки, що перекриваються. З'ясувавши порядок розташування амінокислот у всіх фрагментах, отримують повну інформацію про те, як амінокислоти розташовані в білку. До кінця XX ст. створено спеціальні прилади, що визначають послідовність амінокислот у молекулі білка в автоматичному режимі. секвенатори(від англ. sequence – «послідовність»).
І КИСЛОМОЛОЧНІ ПРОДУКТИ
Молоко є колоїдним розчином жиру у воді. Під мікроскопом добре видно, що воно неоднорідне: у безбарвному розчині (сироватці) плавають жирові кульки.
У коров'ячому молоці зазвичай міститься від 3 до 6 % жирів (в основному це складні ефіри гліцерину та насичених) карбонових кислот- пальмітинової, стеаринової), близько 3% білків, а ще вуглеводи, органічні кислоти, вітаміни та мінеральні речовини.
Білок казеїн у молоці присутній у пов'язаному вигляді- ковалентно приєднані до амінокислоти серину фосфатні групи утворюють солі з іонами кальцію. При підкисленні молока ці солі руйнуються і казеїн виділяється у вигляді білої сирної маси. У шлунку людини під дією особливих ферментів відбувається процес, званий "створення казеїну". Створений казеїн випадає в осад і повільніше виводиться з організму, тому повніше засвоюється. Казеїн високо поживний:
в ньому є майже всі амінокислоти, необхідні людинідля побудови власних білків. У чистому вигляді він є безсмачним білим порошком, не розчинним у воді. Крім нього в молоці містяться інші білки, наприклад лактальбумін. При кип'ятінні цей білок перетворюється на нерозчинну форму, утворюючи на поверхні кип'яченого молока характерну білу плівку - пінку.
Цукор лактозу С^НддО, що входить до складу молока, ізомерений сахарозі. В організмі людини під дією ферменту лактази цей цукор розщеплюється на моносахариди глюкозу та галактозу, які легко засвоюються. За рахунок цього, наприклад, немовлята поповнюють запаси вуглеводів. Цікаво, що у багатьох людей (переважно у представників монголоїдної раси) організм у зрілому віцівтрачає здатність розщеплювати лактозу.
Проходячи через травний тракт, лактоза не засвоюється, а стає живильним середовищем для розвитку різних хвороботворних мікроорганізмів, що призводить до загального нездужання. Саме тому народи Далекого Сходу(японці, китайці) мало вживають у пишу молочні продукти.
У промислових умовах молоко піддають тепловій обробці, мета якої – придушити розвиток мікроорганізмів та продовжити термін його зберігання. Для цього молоко пастеризують - витримують 30 хв при 65 °С, а також використовують короткочасну термообробку - нагрівають протягом 10-20 до 71 °С. Порівняно з пастеризацією термообробка краще зберігає поживні речовини, насамперед вітаміни. Щоб молоко не розшаровувалося на вершки та сироватку, його гомогенізують – пропускають під тиском через невеликі отвори. Жирові кульки дробляться, зменшуються в розмірах, а молоко стає більш в'язким.
Значна частина молока йде на переробку - для виробництва вершкового масла, сиру та кисломолочних продуктів (кефіру, ряжанки, кислого молока, сметани).
Щоб отримати кефір, молоко сквашують - витримують протягом 8-10 годин при 20-25 ° С, додаючи травлення молочнокислих бактерій. Під їх дією лактоза розпадається до молочної кислоти:
з„н„про„ + н,о =
4СНзСН(ОН)СООН. молочна (2-гідроксипропанова) кислота
Саме молочна кислота визначає специфічний смак кефіру. У міру того, як вона накопичується в розчині, відбувається коагуляція (згортання) казеїну, який виділяється у вільному вигляді. Тому кефір має густішу консистенцію, ніж молоко. Молочнокисле зброджування лактози супроводжується спиртовим бродінням, через що в кисломолочних продуктах, зокрема у кефірі, є невелика кількість алкоголю (до 0,03%). У кисломолочних продуктах містяться мікроорганізми, які пригнічують розвиток хвороботворних бактерій і тим самим покращують пишіння.
Сир теж отримують сквашування молока молочнокислими бактеріями. Його головною складовою є білок казеїн.
Щоб приготувати вершкове масло, від молочної сироватки необхідно відокремити крапельки жиру, що входять до складу молока. Для цього збивають вершки - верхній, жирніший шар, що утворюється при відстоюванні молока.
Казеїн також входить до складу сирів. Їх роблять, додаючи в молоко бактеріальну закваску та спеціальні ферменти, а потім підігріваючи суміш до певної температури. У згусток, що виділився, знову вводять ферменти і підігрівають. При цьому відбувається часткова зміна структури та складу казеїну. Потім суміш розкладають за формами та тривалий час- до шести місяців - витримують за низької температури (не вище 15 °С). Під час дозрівання казеїн під дією ферментів розпадається на поліпептиди та вільні амінокислоти. Частина амінокислот окислюється киснем повітря, у своїй утворюються аміак, альдегіди, і навіть кетокислоти, надають сиру характерний аромат.
Скисання молока – звичний приклад денатурації білка.
МІДНА КРОВ
У холодних водах Перуанської течії в Тихому океані мешкає кальмар Dosidicus gigas.Його сигароподібне тіло разом із щупальцями досягає завдовжки 3,5 м, а маса гіганта може перевищувати 150 кг. Потужні миші викидають струмінь води з силою, з якою вона б'є з пожежного рукава, завдяки чому кальмар здатний рухатися зі швидкістю до 40 км/год. Дзьобою, дуже міцною і гострим, він може перебити сталевий кабель. За свідченням очевидців, кальмар буквально на шматки роздирає 20-кілограмову рибину. Цей лютий хишник дуже небезпечний і для людини. У книзі Франка Лейна "Царство восьминога" стверджується, що "людина, яка впала за борт у місцях, де мешкає багато кальмарів, не проживе і півхвилини".
Щоб “зарядитись” енергією, цьому мешканцю океану потрібно багато кисню – не менше 50 л на годину. Кисень, що поступає з морської води, розноситься по тілу кальмара за допомогою особливого білка, що містить мідь, - гемоіїаніна (від грец."гема" - "кров" і "кіанос" - "блакитний", "блакитний").
Варто зауважити, що у крові хребетних кисень “транспортують” атоми заліза у складі гема - особливої складної молекулияка входить до складу білка гемоглобіну. Їм буквально нашпиговані червоні кров'яні клітини – еритроцити. Молекула гемоглобіну містить чотири гемові фрагменти, кожен з яких здатний зв'язати молекулу кисню. На відміну від гемоглобіну, в гемоіїаніні атоми міді безпосередньо пов'язані з білковими молекулами, які не включені в жодні клітини, а вільно "плавають" у крові. Зате одна молекула гемоіїані
здатна зв'язати до 200 атомів міді. І ще одна особливість гемоіїаніна - його молекули мають великі навіть для білків розміри. У “звичайних” білків, які входять до складу яєць, молока, миші, молекулярна маса коливається не більше від б тис. до 1 млн, а молекулярна маса гемоиианина може сягати 10 млн! Це один із найбільших білків; більше за розміром та масою тільки білкові комплекси у вірусів.
Гемоіїанін - дуже давній білок. Він влаштований простіше, ніж гемоглобін і не такий ефективний. Проте при малому вмісті кисню в морській водігемоіїанін досить успішно забезпечує їм тканини холоднокровних тварин. Так, тиск кисню в зябрах лангуста становить лише 7 мм рт. ст. (930 Па), а тканинах - 3 мм рт. ст.; причому концентрація цього газу крові лангуста в 20 разів вище, ніж у морській воді.
Крім кальмарів, кисень переноситься "блакитною кров'ю" також у десятиногих ракоподібних (омари, краби, креветки). Гемоіїанін знайдено у всіх головоногих молюсків (восьминоги, кальмари, каракатиці), різноманітних равликів, павуків та ін. А ось у морських гребінців, устриць та інших двостулкових молюсків його немає.
Кількість гемоіїаніну в крові може бути різною. Так, у спритних восьминога та мечехвоста (морська тварина типу членистоногих) концентрація цього незвичайного білка доходить до 10 г у 100 мл крові – майже стільки ж гемоглобіну в крові людини. Водночас, у малорухливого їстівного молюска морське вушко Hatiotis tuberculataв 100 мл крові всього 0,03 г гемоіїаніну. Це і зрозуміло: чим активніша тварина,
Чим більше кисню необхідно йому для поповнення енергетичних витрат, тим вище в крові концентрація білка, що переносить кисень.
Гемоіїанін був відкритий у 60-х роках. XIX ст., коли біологи помітили, що кров головоногих молюсків при проходженні через зябра забарвлюється у блакитний колір. А в 1878 р. бельгійський фізіолог Леон Фредерік довів, що блакитний колір викликаний реакцією кисню з білком, що містить мідь, який він назвав гемоіїаніном. Коли останній втрачає кисень, він, на відміну гемоглобіну, стає безбарвним. Примітно, що всю роботу щодо вивчення нового білка Фредерік виконав протягом одного дня.
З гемоіїаніну неважко повністю витягти мідь. Для цього достатньо обробити білок без кисню реактивом, який міцно зв'язується з іонами одновалентної міді. У такий же спосіб можна визначити вміст міді в гемоіїаніні. Позбавлений цього металу, він втрачає здатність переносити кисень. Але якщо потім ввести в розчин білка іони Сі "1", гемоіїанін відновлює свою фізіологічну активність. Так було доведено, що відсутність кисню мідь гемоиианина перебуває у ступені окислення +1. При надлишку цього газу відбувається часткове окислення металу. При цьому завжди на одну зв'язану гемоіїаніном молекулу кисню припадає два атоми міді. Таким чином, кисень окислює рівно половину атомів міді. Це ще одна відмінність гемоіїаніну від значно більш поширеного в тваринному світі гемоглобіну, в якому всі атоми заліза рівноцінні і мають заряд +2 як у вільному стані, так і в комплексі з киснем.
Список використаної литературы:
1) Енциклопедія для дітей "Аванта +". Том17. Хімія. Москва 2000. (Стор480-293)
Моноаміномонокарбонові амінокислоти.
Гліцин- глікокол, α-амінооцтова кислота
Єдина оптично неактивна амінокислота. Має солодкий присмак і є одним із найпоширеніших. Особливо багато її у желатині. Є попередником при біосинтезі пуринів, порфіринової частини гемоглобіну, хлорофілу, гемінових ферментів. Бере участь у освіті клітинних стінок бактерій. Функціонує як гальмівний медіатор у спинному мозкута у більшості структур стовбура мозку, де знаходиться у високих концентраціях.
L-Аланін-α-амінопропіонова кислота
Н 3 С-С-СООН
Міститься практично у всіх білках. Грає велику рольв обміні азотистих сполук. Може бути вихідним продуктом для синтезу каротиноїдів, каучуку, жирів та вуглеводів.
L-Валін- α-аміноізовалеріанова кислота
H 3 C-CH-С-СООН
Має здатність до гідрофобних взаємодій, що важливо при створенні та стабілізації структури білкової молекули. Міститься в багатьох білках, але зазвичай не великих кількостях. Бере участь у синтезі алкалоїдів, деяких циклопептидів, пантотенової кислоти, пеніциліну.
L-Лейцин- α-аміноізокапронова кислота
Н 3 С-СН-СН 2 -C-СООН
L-Ізолейцин- α~аміно-β-етил~β-метилпропіонова кислота
Н 3 С-СН2-СН-С-СООН
Обидві амінокислоти погано розчиняються у воді. У білках містяться у незначних кількостях, здатні до гідрофобних взаємодій. Є джерелом сивушних масел при бродінні.
L-Серін- α-аміно-β-оксипропіонова кислота
АЛЕ-СН2-С-СООН
Грає велику роль обміні речовин будь-якого організму. Входить до складу фосфоліпідів (фосфатидилсерини), поліпептидів брадикініну та каллідину, бере участь у побудові активного центру деяких протеолітичних ферментів, синтезі аміноспирту сфінгозину (компонент сфінголіпідів). У деяких білках, таких, як казеїн молока або вителлін яєчного жовтка, міститься у вигляді складного ефіру - так званої серинфосфорної кислоти, яка відіграє важливу роль у метаболізмі молодого тваринного організму, що росте. У рослин утворюється під час фотодихання з гліцину.
L-Треонін- α-аміно-β-оксимасляна кислота
Н3С-СН-С-СООН
Бере участь у синтезі вітаміну B 12 антибіотика актиноміцину D.
L-Цистеїн- α-аміно-β-меркаптопропіонова кислота
HS-СН 2 -С-COOH
Бере участь в обміні речовин рослин і тварин як джерело сірки, а також у зв'язку з наявністю сульфгідрильної SH-групи, що є агентом, що відновлює. Входить до складу трипептиду глютатіону, у вигляді аміну в коферменті А, присутній в активному центрі багатьох ферментів. У молекулах білків та пептидів (інсулін, АКТГ та ін.) бере участь в утворенні дисульфідних зв'язків між поліпептидними ланцюгами або всередині одного ланцюга, звідси його важлива роль в утворенні третинної структури білкової молекули. Є тією сполукою, як якої деякі мікроорганізми і рослини метаболізують сірководень. З двох молекул цистеїну за її окисленні виходить цистин. Так само легко відбувається і зворотний перехід. Таким шляхом утворюється одна з найважливіших окисно-відновних систем живих організмів.
У білках цистин переважає цистеїн. У великих кількостях він міститься у білках волосся, рогів, копит.
L-Метіонін- α-аміно-γ-метилтіомасляна кислота
Н 3 С-S-СН 2 -СН 2 -С-СООН
Один з основних донорів метильних груп при синтезі вуглеводів клітинної стінки рослин, холіну, адреналіну, креатину, стерину та джерелом сірки при утворенні тіаміну. Багато метіоніну в білку молока – казеїні. Як ліпотропний фактор, є лікувальним препаратомпри атеросклерозі.
Діаміномонокарбонові амінокислоти.
L-Лізін- α, ε-діамінокапронова кислота
H 2 N-CH 2 -СН 2 -СН 2 -СН 2 -С-СООН
Знаходиться майже у всіх білках, особливо багато в білках молок риб, що належать до протамінів та гістонів. Є вихідним продуктом при синтезі алкалоїдів (анабазин, нікотин, лупанін, коніїн). Бере участь у своїй ε-аміногрупі в утворенні комплексу між білковою частиною ферменту та коферментом, наприклад, у біотин-залежних ферментах.
Міститься у незначних кількостях у білках насіння злакових, особливо кукурудзи, що суттєво знецінює кормові властивості останньої.
L-Аргінін- α-аміно-δ~гуанідил-n~валеріанова кислота.
H 2 N-С-NH-СН 2 -СН 2 -СН 2 -С-СООН
Міститься у всіх білках. Входить до велику кількістьдо складу основних білків-гістонів та протамінів, у зв'язку з чим його багато в білках риб'ячих молок. Відіграє велику роль у білковому обміні, беручи участь у синтезі сечовини, креатину. У вигляді фосфоаргініну в м'язах безхребетних виконує функцію, аналогічну до функції фосфокреатину у вищих тварин.
Моноамінодикарбонові амінокислоти.
L-Acnaрагінова кислота, аспартат- α-амінобурштинова кислота
НООС-СН 2 -С-СООН
Погано розчинна у воді, розчин має кислу реакцію. Міститься у великих кількостях у всіх рослинних білках та відіграє важливу роль в обміні речовин у рослин та тварин, зокрема, беручи участь у реакціях переамінування, утворенні сечовини, креатину, циклопептидів. При її декарбоксилюванні утворюється α- або β-аланін, необхідний для синтезу карнозину, ансерину та коензиму А (КоА). Амід аспарагінової кислоти - аспарагін накопичується в дуже великих кількостях при проростанні насіння бобових рослин, особливо в темряві, через відсутність вуглеводів або при надлишку аміаку. Аспарагін виявлений у плазмі крові та у складі деяких тварин білків (інсулін, гемоглобін, міоглобін та ін.). У людини і тварин аспарагін, як і аспарагінова кислота, бере активну участь у реакціях переамінування, служить попередником при синтезі пуринових і піримідинових основ, нікотинової кислоти, у рослин є запасний і транспортною формою азоту.
L-Глутамінова кислота- глутамат, α-аміноглутарова кислота
НООС-СН 2 -СН 2 -С-СООН
У водяних розчинах дає кислу реакцію. Міститься у великих кількостях у всіх білках. Входить до складу фолієвої кислоти, глутатіону. Поряд з аспарагіновою кислотоюграє першорядну роль в амінокислотному обміні, беручи активну участь у реакціях переамінування, дезамінування, прямого амінування. При декарбоксилюванні глутамінової кислоти утворюється γ-аміномасляна кислота, що має велике значенняу метаболізмі мозку, що підсилює, зокрема, процеси гальмування, та δ-амінолевулінова кислота, що бере участь у синтезі порфіринів. Амід глутамінової кислоти - глутамін, є транспортною формою азоту у тварин і рослин, вихідною сполукою при синтезі пуринових та піримідинових основ, нікотинової кислоти. Мононатрієва сіль глутамінової кислоти служить смаковою приправою, маючи смак і запах курячого бульйону.
Циклічні амінокислоти.
L-Фенілаланін- α-аміно-β-фенілпропіонова кислота
Міститься у всіх білках. Бере участь у біосинтезі флавоноїдів, алкалоїдів. Має здатність до гідрофобних взаємодій. Зумовлює ксантопротеїнову реакцію на білки. До складу молекули граміцидину та антибіотика тироцидину входить D-фенілаланін, який у вільному вигляді у природі не виявлений.
L-Тірозін- α-аміно-β-гідроксифенілпропіонова кислота
Одна з найпоширеніших у природі амінокислот; міститься у всіх білках, крім деяких протамінів. Є вихідним субстратом для синтезу гормонів (тироксин, норадреналін, адреналін), алкалоїдів (морфін, кодеїн, папаверин). Окислення тирозину під впливом тирозинази призводить до утворення меланінів (пігмент шкіри, волосся, пір'я).
L-Триптофан- α-аміно-β-індолілпропіонова кислота
Знаходиться майже у всіх білках. Бідні триптофаном насіння злаків. При кислотному гідролізі розпадається білків. Триптофан є вихідним продуктом для синтезу нікотинової кислоти (вітамін РР), гетероауксину.
L-гістидин- α-аміно-β-імідазолпропіонова кислота
Належить до групи основних амінокислот – у водних розчинах дає лужну реакцію. Значна кількість гістидину міститься в глобіні. білковому компонентігемоглобіну крові. Входить до активних центрів деяких протеолітичних ферментів.
L-Пролін- піролідин-α-карбонова кислота
Є амінокислотою. Добре розчинний у спирті. Особливо велике вміст проліну в білках насіння злаків (проламіни), в колагені, еластині та білку емалі зубів. Входить до складу низки антибіотиків циклопептидів – граміцидину, ліхеніформіну, актиноміцину D.
L-Оксипролін
Є похідним L-проліну. Значні його кількості виявлено у білках клітинних оболонок, желатині, колагені.
Білками, або протеїнами, називають високомолекулярні азотовмісні сполуки, що складаються з амінокислот, з'єднаних у ланцюжок пептидним зв'язком. Білки синтезуються з амінокислот і перетворюються на амінокислоти при перетравленні в шлунково-кишковому трактічи катаболізмі в організмі. Функції білків у клітинах живих організмів дуже різноманітні – вони так чи інакше беруть участь практично у всіх аспектах життєдіяльності організму.
Природних амінокислот налічується близько 150, але при синтезі живих організмів, у більшості випадків, використовується 20 стандартних амінокислот.
З погляду харчування амінокислоти ділять на незамінні та замінні.
Незамінні амінокислотине синтезуються в організмі людини та обов'язково повинні надходити з їжею. До них відносяться дев'ять амінокислот: валін, лейцин, ізолейцин, треонін, метіонін, лізин, фенілаланін, триптофан, гістидин. Гістидин відносять до незамінних амінокислот тільки для новонароджених. Якщо кількість цих амінокислот у їжі недостатньо, нормальний розвиток та функціонування організму людини порушується.
Замінниминазиваються амінокислоти, які організм здатний синтезувати з інших замінних амінокислотчи азоту незамінних амінокислот. До них відносяться решта 11 амінокислот.
Певна кількість замінних амінокислот також має надходити з їжею, інакше на їх освіту витрачатимуться незамінні амінокислоти. Цілком метаболічно замінними вважаються тільки глутамінова кислота та серин.
Класифікація амінокислот на замінні та незамінні також не позбавлена недоліків, наприклад, тирозин є замінною амінокислотою тільки за умови достатнього надходження фенілаланіну. Аргінін синтезується в організмі людини і вважається замінною амінокислотою, але у зв'язку з деякими особливостями його метаболізму при певних фізіологічних станах організму може бути прирівняний до незамінних. Гістидин також синтезується в організмі людини, але не завжди в достатніх кількостяхтому повинен чинити з їжею.
Сучасні дані свідчать про те, що біосинтез замінних амінокислот у кількостях, що забезпечують повністю потреби організму найчастіше неможливий, тому слід пам'ятати, що незамінні та замінні амінокислоти однаково важливі для побудови білків організму.
Амінокислоти, складові білки тіла та їжі
Властивості білків визначаються набором амінокислот, з яких вони складаються, загальним числом амінокислот та послідовністю, в якій вони поєднуються один з одним. Комбінація з 20 амінокислот, кожна з яких може зустрічатися в білку скільки завгодно разів, дозволяє створювати практично необмежену кількістьунікальні білкові молекули. Організм людини містить щонайменше 30 000 різних білків, тільки в печінці налічується понад 1000 білків-ферментів.
Функції білка
Білки є обов'язковими компонентамивсіх живих клітин. Одна п'ята частина тіла людини складається із білка. Білок міститься практично у всіх органах та тканинах. Тільки сеча та жовч у нормі не містять білка. Половина всього білка знаходиться у м'язах, 1/5 – у кістках та хрящах, 1/10 – у шкірі. Волосся, шкіра, нігті також містять кератин білок. Цей білок не перетравлюється та не засвоюється в кишечнику.Біологічні функції білків дуже різноманітні. За участю білків здійснюються зростання та розмноження клітин. Вони виконують каталітичні (ферменти), регуляторні (гормони), структурні (колаген), скорочувальні (міозин), транспортні (гемоглобін, міоглобін), захисні (імуноглобуліни, інтерферон), запасні (альбумін) та інші функції. Білки становлять основу біологічних клітинних мембран- найважливішої складової частини клітини та клітинних органел.
За участю білків регулюється та підтримується нормальний водний балансорганізму зберігаються нормальні рН середовища. Білки крові створюють онкотичний тиск, який утримує рідину в кровоносних судинахта перешкоджає накопиченню рідини у позаклітинному просторі. При зниженому рівні білків у плазмі онкотичний тиск не врівноважує осмотичний тиск, який виштовхує рідину з судин. Це призводить до розвитку набряків (т.зв. «голодні набряки»).
Оцінка якості харчових білків
У травному трактібілки розщеплюються до амінокислот, які всмоктуються і використовуються для утворення нових білків організму або витрачаються отримання енергії, або амінокислоти є попередниками освіти нових замінних амінокислот. Якість харчового білка визначається наявністю у ньому повного наборунезамінних амінокислот у певній кількості та у певному співвідношенні із замінними амінокислотами.Якість харчового білка оцінюється рядом біологічних та хімічних методів:
- Оцінка біологічної цінності білка
Під біологічною цінністю білка (або містить білок їжі) мають на увазі частку засвоєного організмом азоту від всього азоту, що всмоктався в ШКТ. Вимірювання біологічної цінності білка полягає в тому, що засвоювання азоту організмом вище при адекватному вмісті незамінних амінокислот у харчовому білку, достатньому підтримки зростання організму. - Коефіцієнт ефективності білка
Показник коефіцієнта ефективності білка заснований на припущенні, що приріст маси тіла тварин, що ростуть, пропорційний кількості спожитого білка. - Амінокислотний білок
Амінокислотний скор - це показник відношення певної незамінної амінокислоти в якомусь продукті до такої ж амінокислоти в "ідеальному" білку. Розраховується амінокислотний скор шляхом розподілу кількості певної незамінної амінокислоти в продукті на кількість такої ж амінокислоти в ідеальному білку. Отримані дані потім множать на 100 і отримують амінокислотний скор досліджуваної амінокислоти.Поняття «ідеальний» білок включає уявлення про гіпотетичний білок високий харчової цінності, що повністю задовольняє потребу організму людини в незамінних амінокислотах. Для дорослої людини як «ідеальний» білок застосовують амінокислотну шкалу Комітету ФАО/ВООЗ. Амінокислотна шкала показує вміст кожної із незамінних амінокислот у 100 г стандартного білка.
Найбільш близькі до «ідеального» білка тваринні білки м'яса, яєць та молока. Більшість рослинних білків містять недостатня кількістьоднієї чи кількох незамінних амінокислот. Наприклад, білки злакових культур, і навіть отримані їх продукти неповноцінні (лімітовані) по лізину і треонину. Білки ряду бобових культур (соя та квасоля виняток) лімітовані за метіоніном та цистеїном (60-70% оптимальної кількості).
У процесі теплової обробки або тривалого зберіганняпродуктів деяких амінокислот можуть утворитися не засвоювані організмом сполуки, тобто. амінокислоти стають "недоступними". Це знижує цінність білка.
Харчова цінність білків може бути покращена (тобто збільшена біологічна цінністьабо амінокислотний скор по лімітуючих кислот) шляхом додавання лімітуючої амінокислоти або внесення компонента з її підвищеним вмістом, або шляхом змішування білків з різними амінокислотами, що лімітують. Так, біологічна цінність білка пшениці може бути підвищена додаванням 0,3-0,4% лізину, білка кукурудзи – 0,4% личина та 0,7% триптофану. Приготування змішаних страв, що містять тварини та рослинні продуктисприяє отриманню повноцінних харчових білкових композицій.
Перетравлення білків та всмоктування амінокислот
Всі харчові білки, що складаються з довгого ланцюга амінокислот, не здатні всмоктуватись у шлунково-кишковому тракті. Вони розщеплюються на вільні амінокислоти або фрагменти, що складаються з двох або трьох амінокислот. Розщеплення білків каталізують специфічні травні ферменти – протеази. Ступінь перетравлюваності білків коливається від 65% деяких рослинних білків до 97% для білка яєць.Вільні амінокислоти всмоктуються в кровотік і транспортуються в органи та тканини, насамперед печінку. Найбільша кількістьамінокислот захоплюється печінкою, де синтезуються білки плазми крові та специфічні білки-ферменти. Амінокислоти, які беруть участь у біосинтезі нових білкових молекул, піддаються печінки процесу дезамінування, тобто. відщепленню аміногрупи. У процесах дезамінування беруть участь активні формивітаміну В6.
Потреба організму у білку
В організмі людини немає великого депо для запасання білків. Частково функцію депо виконують білки плазми та печінки. Альбумін плазми служить лабільним резервом білка, і для забезпечення життєво необхідної потреби в амінокислотах відбувається його розщеплення. Глобуліни плазми крові не піддаються розщепленню навіть при виснаженні запасів альбуміну.
Тварини та рослинні білкизасвоюються організмом неоднаково. Якщо білки молока, молочних продуктів, яєць засвоюються на 96%, м'яса та риби – на 93-95%, то білки хліба – на 62-86%, овочів – на 80%, картоплі та деяких бобових – на 70%.
Однак суміш цих продуктів може бути біологічно більш повноцінною через взаємне збагачення одних білків амінокислотами інших.
На ступінь засвоєння організмом білків впливають технології отримання харчових продуктів та їх кулінарна обробка. Аналізуючи вплив різних видівобробки харчової сировини та продуктів (подрібнення, дія температури, бродіння і т.д.) на засвоюваність білків, що містяться в них, слід зазначити, що в більшості харчових виробництв при дотриманні технології не відбувається деструкції амінокислот. При помірній тепловій обробці харчових продуктів, особливо рослинного походження, Засвоюваність білків дещо зростає, так як часткова денатурація білків полегшує доступ протеаз до пептидних зв'язків. При інтенсивній тепловій обробці засвоюваність знижується. При глибокому смаженні з утворенням скоринки та обвуглювання частина амінокислот руйнується або знижується засвоєння білка з цих частин страви або продукту.
Потреба білка - це кількість білка, що забезпечує всі метаболічні потреби організму. При цьому обов'язково враховується, з одного боку, фізіологічний станорганізму, а з іншого - властивості самих харчових білків і харчового раціонув цілому. Від властивостей компонентів харчового раціону залежить перетравлення, всмоктування та метаболічна утилізація амінокислот.
Потреба білку і двох компонентів. Перший повинен задовольнити потребу в загальному азоті, що забезпечує біосинтез замінних амінокислот та інших азотовмісних ендогенних біологічно активних речовин. Власне потреба у загальному азоті і є потреба у білку. Другий компонент потреби у білку визначається потребою організму людини у незамінних амінокислотах, які не синтезуються в організмі. Це специфічна частина потреби у білку, яка кількісно входить у перший компонент, але передбачає споживання білка певної якості, тобто. носієм загального азоту повинні бути білки, що містять незамінні амінокислоти у певній кількості.
Потреба в незамінних амінокислотах різному віцімг/кг на добу
| Амінокислота | Діти раннього віку
(3-4 міс.) | Діти (від двох років) | Підлітки (10 років та старше) |
Дорослі |
| Гістідін | 28 | - | - | 8-12 |
| Ізолейцин | 70 | 31 | 28 | 10 |
| Лейцин | 161 | 73 | 44 | 14 |
| Лізін | 103 | 64 | 44 | 14 |
| Метіонін + цистеїн | 58 | 27 | 22 | 13 |
| Фенілаланін + тирозин | 125 | 69 | 22 | 14 |
| Треонін | 87 | 37 | 28 | 7 |
| Триптофан | 17 | 12,5 | 3,3 | 3,5 |
| Валін | 93 | 38 | 25 | 10 |
| Усього незамінних амінокислот | 714 | 352 | 216 | 84 |
1. Які речовини є біологічними полімерами? Які речовини є мономерами для побудови молекул біополімерів?
Біологічними полімерами є: б) нуклеїнові кислоти; в) полісахариди; д) білки.
Мономерами для побудови молекул біополімерів є: а) амінокислоти; г) нуклеотиди; е) моносахариди.
2. Які функціональні групи характерні всім амінокислот? Які властивості мають ці групи?
Для всіх амінокислот характерна наявність аміногрупи (-NH 2), що володіє основними властивостями, і карбоксильної групи (-СООН) з кислотними властивостями.
3. Скільки амінокислот бере участь у освіті природних білків? Назвіть загальні риси будови цих амінокислот. Чим вони різняться?
У освіті природних білків беруть участь 20 амінокислот. Такі амінокислоти називаються білоктворними. В їх молекулах карбоксильна група і аміногрупа пов'язані з одним і тим самим атомом вуглецю. За цією ознакою білоктворюючі амінокислоти подібні між собою.
Білокутворюючі амінокислоти розрізняються складом та будовою бічної групи (радикала). Вона може бути неполярною або полярною (нейтральною, кислою, основною), гідрофобною або гідрофільною, що і надає кожній амінокислоті особливих властивостей.
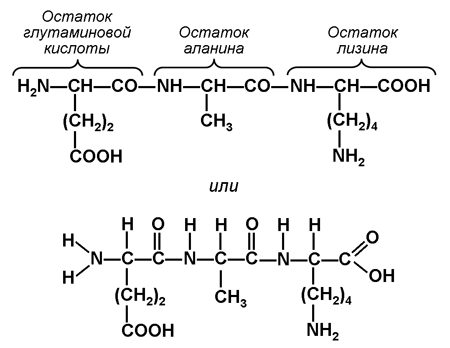
4. Яким чином амінокислоти з'єднуються в поліпептидний ланцюг? Побудуйте дипептид та трипептид. Для виконання завдання використовуйте структурні формулиамінокислот, показані малюнку 6.
Аміногрупа (-NH 2) однієї амінокислоти здатна взаємодіяти з карбоксильною групою (-СООН) іншої амінокислоти. При цьому виділяється молекула води, а між атомом азоту аміногрупи та атомом вуглецю карбоксильної групи виникає пептидна зв'язок. Утворена молекула є дипептид, на одному кінці молекули якого знаходиться вільна аміногрупа, а на іншому – вільна карбоксильна група. Завдяки цьому дипептид може приєднувати інші амінокислоти, утворюючи олігопептиди. Якщо таким чином з'єднується більше 10 залишків амінокислот, утворюється поліпептид.
Структурну формулу дипептиду (наприклад, Ала-Глу) можна представити так:
Структурну формулу трипептиду (наприклад, Глу-Ала-Ліз) можна представити так:
5. Охарактеризуйте рівні структурної організаціїбілків. Які хімічні зв'язки зумовлюють різні рівніструктурної організації білкових молекул
Молекули білків можуть набувати різних просторових форм, які є чотири рівня їх структурної організації.
Ланцюжок (лінійна послідовність) амінокислотних залишків, з'єднаних пептидними зв'язками, є первинною структурою білкової молекули. Кожен білок організму має унікальну первинну структуру. На основі первинної структури створюються інші види структур, тому саме первинна структуравизначає форму, властивості та функції білка.
Вторинна структура виникає в результаті утворення водневих зв'язків між атомами водню NH-груп та атомами кисню CO-груп різних амінокислотних залишків поліпептидного ланцюга.
Третинна структура формується за рахунок утворення водневих, іонних, дисульфідних (S-S зв'язків між залишками амінокислоти цистеїну) та інших зв'язків, що виникають між різними групамиатомів білкової молекули у водному середовищі. При цьому поліпептидна спіраль укладається в своєрідний клубок (глобулу) таким чином, що амінокислотні гідрофобні радикали занурюються всередину глобули, а гідрофільні розташовуються на поверхні і взаємодіють з молекулами води.
До складу молекул деяких білків входить не один, а кілька поліпептидів, що утворюють єдиний комплекс. Так формується четвертинна структура. Поліпептиди не зв'язуються ковалентними зв'язками, міцність четвертинної структури забезпечується взаємодією слабких міжмолекулярних сил.
Отже, первинна структура білкової молекули обумовлена наявністю пептидних зв'язків між залишками амінокислот. Вторинну структурустабілізують водневі зв'язки, третинну – водневі, іонні, дисульфідні та ін., четвертинну – слабкі міжмолекулярні взаємодії.
6. Людина та тварини отримують амінокислоти з їжі. Із чого можуть синтезуватися амінокислоти у рослин?
Рослини – автотрофні організми. Вони синтезують амінокислоти з первинних продуктів фотосинтезу (які, у свою чергу, утворюються з Вуглекислий газі води) і азотовмісних неорганічних сполук (іонів амонію, нітрат-іонів). Таким чином, рослин вихідними речовинами для синтезу амінокислот є СО 2 , Н 2 О, NH 4 + (NH 3), NO 3 - .
7. Скільки різних трипептидів можна побудувати із трьох молекул амінокислот (наприклад, аланіну, лізину та глутамінової кислоти), якщо кожну амінокислоту можна використовувати лише один раз? Чи будуть ці пептиди мати однакові властивості?
Можна побудувати шість трипептидів: Ала-Ліз-Глу, Ала-Глу-Ліз, Ліз-Ала-Глу, Ліз-Глу-Ала, Глу-Ала-Ліз і Глу-Ліз-Ала. Всі отримані пептиди будуть мати різні властивості.
8. Для поділу суміші білків на компоненти використовується метод електрофорезу: в електричному полі окремі білкові молекули з певною швидкістю переміщуються до одного з електродів. При цьому одні білки рухаються у бік катода, інші переміщуються до аноду. Як будова молекули білка пов'язана з його здатністю рухатися в електричному полі? Від чого залежить напрямок руху білкових молекул? Від чого залежить їхня швидкість?
У водних розчинах радикали кислих амінокислот, що входять до складу білка, негативно заряджені внаслідок дисоціації карбоксильних груп:
-СООН → -СОО - + Н +
Радикали основних амінокислот мають позитивний заряд за рахунок приєднання іонів водню (Н+) до атомів азоту, що входять до складу цих радикалів:
-NH 2 + Н + → NH 3 +
Карбоксильна група і аміногрупа, що знаходяться на кінцях поліпептидного ланцюга, також набувають заряду (негативний і позитивний відповідно). Таким чином, у розчині білкова молекуламає певний сумарний заряд, як і зумовлює її рух у електричному полі.
Заряд молекули білка залежить від співвідношення залишків кислих та основних амінокислот. Якщо у складі білка переважають залишки кислих амінокислот, то сумарний заряд молекули буде негативним і переміщатиметься до анода (позитивно зарядженому електроду). Якщо переважають залишки основних амінокислот, то сумарний заряд молекули буде позитивним, і білок буде рухатися у бік катода (негативно зарядженого електрода).
Швидкість руху залежить насамперед від величини заряду білкової молекули, її маси та просторової конфігурації.