Просторова будова білків та пептидів. Просторова організація білкової молекули
Виконання білками певних специфічних функцій залежить від просторової конфігурації їх молекул, крім того, клітині енергетично невигідно тримати білки у розгорнутій формі, у вигляді ланцюжка, тому поліпептидні ланцюги піддаються укладання, набуваючи певної тривимірної структури, або конформації. Виділяють 4 рівні просторової організаціїбілків.
Первинна структура білка- послідовність розташування амінокислотних залишків у полі пептидного ланцюга, Що становить молекулу білка. Зв'язок між амінокислотами – пептидна.
Якщо молекула білка складається з 10 амінокислотних залишків, то число теоретично можливих варіантівбілкових молекул, що відрізняються порядком чергування амінокислот, - 10 20 . Маючи 20 амінокислот, можна скласти з них ще більша кількістьрізноманітних комбінацій. В людини виявлено близько десяти тисяч різних білків, які відрізняються як один від одного, так і від білків інших організмів.
Саме первинна структура білкової молекули визначає властивості молекул білка та її просторову конфігурацію. Заміна лише однієї амінокислоти на іншу в поліпептидному ланцюжку призводить до зміни властивостей і функцій білка. Наприклад, заміна в β-субодиниці гемоглобіну шостої глутамінової амінокислоти на валін призводить до того, що молекула гемоглобіну в цілому не може виконувати свою основну функцію - транспорт кисню; у таких випадках у людини розвивається захворювання – серповидноклітинна анемія.
Вторинна структура- упорядковане згортання поліпептидного ланцюга в спіраль (має вигляд розтягнутої пружини). Витки спіралі зміцнюються водневими зв'язками, що виникають між карбоксильними групами та аміногрупами. Практично всі СО- та NН-групи беруть участь в утворенні водневих зв'язків. Вони слабші пептидних, але, повторюючись багаторазово, надають цієї зміни стійкість і жорсткість. на рівні вторинної структуриіснують білки: фіброїн (шовк, павутина), кератин (волосся, нігті), колаген (сухожилля).
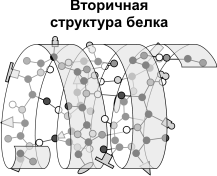

Третинна структура- укладання поліпептидних ланцюгів у глобули, що виникає внаслідок виникнення хімічних зв'язків (водневих, іонних, дисульфідних) та встановлення гідрофобних взаємодій між радикалами амінокислотних залишків. Основну роль освіті третинної структури грають гидрофильно-гидрофобные взаємодії. У водних розчинах гідрофобні радикали прагнуть сховатися від води, групуючись усередині глобули, тоді як гідрофільні радикали в результаті гідратації (взаємодії з диполями води) прагнуть опинитися на поверхні молекули. У деяких білків третинна структура стабілізується дисульфідними ковалентними зв'язками, що виникають між атомами сірки двох залишків цистеїну. На рівні третинної структури є ферменти, антитіла, деякі гормони.
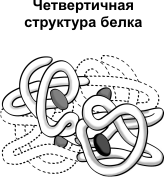
Четвертична структурахарактерна для складних білків, молекули яких утворені двома та більше глобулами. Субодиниці утримуються в молекулі завдяки іонним, гідрофобним та електростатичним взаємодіям. Іноді при утворенні четвертинної структури між субодиницями виникають дисульфідні зв'язки. Найбільш вивченим білком, що має четвертинну структуру, є гемоглобін. Він утворений двома α-субодиницями (141 амінокислотний залишок) і двома β-субодиницями (146 амінокислотних залишків). З кожною субодиницею пов'язана молекула гема, що містить залізо.
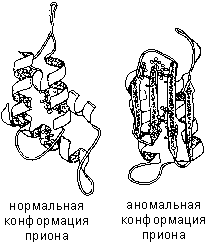
Якщо з будь-яких причин просторова конформація білків відхиляється від нормальної, білок не може виконувати своїх функцій. Наприклад, причиною «коров'ячого сказу» (губкоподібної енцефалопатії) є аномальна конформація пріонів – поверхневих білків нервових клітин.
Тестові питання
1. Який зв'язок формує вторинну структуру білків?
а) водневий зв'язок;
б) ковалентний зв'язок;
в) складноефірна;
г) пептидна зв'язок.
Ковалентний скелет білків складається із сотень індивідуальних зв'язків. Якби можливе вільне обертання навколо навіть частини цих зв'язків, білки мали майже безмежне число тривимірних структур. Однак кожен білок має специфічну функцію, що припускає для нього унікальну просторову структуру. Те, що білки кристалізуються, дає переконливий доказ наявності таких структур. Суворий молекулярний порядок у кристалі може бути реалізований у тому випадку, якщо всі молекули мають ідентичну форму у кристалі. Фермент уреазу з ММ 483кДа був серед перших закристалізованих білків.
Просторове розташуванняатомів в молекулі білка називають його конформацією. Зміни конформації зустрічаються при обертанні навколо одинарних зв'язків без їхнього руйнування. У білках реалізуються чотири рівніархітектури.
Первинна структурапов'язана з ковалентними зв'язками між амінокислотними залишками (амінокислотна послідовність). Відносне просторове розташування пов'язаних амінокислот не є специфічним. Поліпептидні ланцюги не можуть мати будь-які просторові структури на вибір. Стеричні обмеження, і навіть безліч слабких невалентних взаємодій призводять до того що, що окремі просторові форми стійкіші ніж інші.
Вторинна структуравідноситься до регулярних розташування сусідніх амінокислотних залишків в поліпептидному ланцюгу (регулярні конформації). Для вторинної структури поліпептидних ланцюгів найбільш характерні a-спіральі b-конформація.
Третинна структуравідноситься до просторового розташування всіх амінокислот поліпептиду. Зв'язок між вторинною і третинною структурою нині мало зрозуміла. Декілька різних типіввторинної структури часто виявляються у третинній структурі великого білка.
Білки з кількома пептидними ланцюгами мають ще один більше високий рівеньорганізації: четвертинну структуруяка відноситься до просторового розташування поліпептидних ланцюгів або субодиниць у білку. Можна виділити проміжні рівні між вторинною та третинною структурою. Стійкий кластер з кількох елементів вторинної структури відносять до супервторинноїструктуру. Ще вищий рівень структури представляє домен. Його відносять до компактної структури, що включає можливо від 40 до 400 амінокислот, домен представляє виразну одиницю у великому поліпептидному ланцюзі. Багато доменів складаються незалежно від термодинамічно стійких структур. Великий поліпептидний ланцюг може містити кілька доменів, які легко помітні. У деяких випадках індивідуальні домени мають окремі функції.
Конформація білка стабілізується великою кількістю слабких невалентних взаємодій. Стійкість нативної конформації білка невелика, тому різниця у вільній енергії складених і нескладених станів у типових білках у фізіологічних умовах знаходиться в інтервалі від 20 до 65 кДж/моль. Ентропія та водневе зв'язування багатьох груп поліпептидного ланцюга з розчинником (водою) призводять до розкритих форм. До складчастих форм наводять хімічні взаємодії у вигляді дисульфідних містків, а також невалентні взаємодії: водневі зв'язки, гідрофобні, іонні та ван-дер-ваальсові взаємодії
Найбільш загальною вторинною структурою білків є a-спіраль. У цій структурі поліпептидний кістяк закручений відносно довгий осі молекули, а R-групи амінокислотних залишків розташовані з зовнішньої сторониспіралі. Крок спіралі складає 0,56 нм. Другим типом регулярної структури в білках є b-конформація, яка сприяє укладанню поліпептидних ланцюгів у шари, при цьому можливе як паралельне, так і антипаралельне розташування ланцюгів. У деяких білках (наприклад, у колагені) крім цих регулярних конформацій зустрічаються й інші типи вторинної структури: b-складка і b-виток. Хоча фібрилярні білки мають лише один тип вторинної структури, глобулярні білки можуть містити декілька типів вторинної структури для однієї молекули. Глобулярні білки, включаючи ферменти, транспортні білки, деякі гормони та імуноглобуліни, утворюють складчасті структури, більш компактні ніж a- та b-конформації.
Третинна структура представляє тривимірне розташування всіх атомів у білку, вона має справу з дальнодіючими взаємодіями амінокислотних залишків. Свинячий альбумін має 584 залишки в одному ланцюгу.
Нижче показані відносні розміри ланцюга в b-конформації, у формі a-спіралі та нативної глобулярної форми.
b -конформація: 200 х 0.5 нм
a -спіраль: 90 х 1.1 нм нативна глобулярна форма: 13х3 нм
Просторове розташування атомів у кристалічній решітці білка визначають методом рентгеноструктурного аналізу виходячи з кутів та інтенсивності дифракцій від електронних оболонок атомів. На цей час цим методом встановлено третинні структури сотень глобулярних білків (міоглобін, інсулін, цитохром с, лізоцим, рибонуклеаза і т.д.).
Частка a- спіралейі b- форму деяких білках.
Білки можуть денатурувати при нагріванні, різкій зміні рН, обробці органічними розчинниками, солями важких металів із руйнуванням третинної структури та втратою функціональної активності.
Третичні структури є жорсткими, у процесі синтезу білка вони формуються досить швидко, не випадковим чином. Існує кілька типів третинних структур досить загальних багатьом білків (a/b баррел, b-b сендвічта інші).
Деякі білки містять два і більше окремі пептидні ланцюги, які можуть бути ідентичними або різними структурою. Просторове розташування білків та його субодиниць у тривимірному комплексі представляє четвертинну структуру, яку визначають практично методом рентгеноструктурного аналізу монокристалу білка. Таким чином встановлено четвертинну структуру гемоглобіну, який містить чотири поліпептидні ланцюги та чотири гемпростетичні групи.
Деякі білки утворюють надмолекулярні комплекси, які зберігають принципи, властиві всім рівням організацій білків. З цих надмолекулярних комплексів побудовано біологічні машини, які здійснюють функціонування клітини (скорочення м'язів, синтез білків у рибосомах, упаковка ДНК, переміщення органел тощо).
Запитання для самоконтролю
1. Властивості пептидного зв'язку.
2. Вплив рН на конформаційну структуру білків.
3. Роль дисульфідних зв'язків.
4. Чим визначається термічна стійкість нативної структури білків?
5. Локалізація специфічних амінокислот лежить на поверхні глобулярних білків.
6. Чим визначається молекулярна маса гемоглобіну?
Первинна структура білка - послідовність амінокислотних фрагментів, міцно (і протягом усього періоду існування білка) з'єднаних пептидними зв'язками. Існує період напівжиття білкових молекул – для більшості білків близько 2-х тижнів. Якщо стався розрив хоча б одного пептидного зв'язку, утворюється вже інший білок.Вторинна структура - Це просторова організація стрижня поліпептидного ланцюга. Існують 3 найголовнішого типувторинної структури:
1) Альфа-спіраль - Має певні характеристики: ширину, відстань між двома витками спіралі. Для білків характерна правозакручена спіраль. У цій спіралі на 10 витків припадає 36 амінокислотних залишків. У всіх пептидів, покладених у таку спіраль, ця спіраль абсолютно однакова. Фіксується альфа-спіраль за допомогою водневих зв'язків між NH-групами одного витка спіралі та С=Про групи сусіднього витка. Ці водневі зв'язки розташовані паралельно до осі спіралі і багаторазово повторюються, тому міцно утримують спіралеподібну структуру. Більше того, утримують у дещо напруженому стані (як стиснуту пружину).
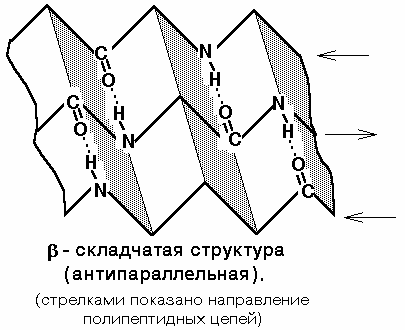
2) Бета-складчаста структура- чи структура складчастого листа. Фіксується також водневими зв'язками між С=О та NH-групами. Фіксує дві ділянки поліпептидного ланцюга. Ці ланцюги можуть бути паралельними або антипаралельними. Якщо такі зв'язки утворюються в межах одного пептиду, то вони завжди є антипаралельними, а якщо між різними поліпептидами, то паралельними.
3) ^ Нерегулярна структура - тип вторинної структури, в якому розташування різних ділянок поліпептидного ланцюга щодо один одного не має регулярного (постійного) характеру, тому нерегулярні структури можуть мати різну конформацію.
^ Третинна структура - це тривимірна архітектура поліпептидного ланцюга – особливе взаємне розташування у просторі спіралеподібних, складчастих та нерегулярних ділянок поліпептидного ланцюга. У різних білків третинної структури різна. У формуванні третинної структури беруть участь дисульфідні зв'язки та всі слабкі типи зв'язків.
Виділяють два загальних типутретинної структури:1) У фібрилярних білках (наприклад, колаген, еластин) молекули яких мають витягнуту форму і зазвичай формують волокнисті структури тканин, третинна структура представлена або потрійний альфа-спіраллю(наприклад, у колагені), або бета-складчастими структурами.
2) У глобулярних білків,молекули яких мають форму кулі або еліпса (латинська назва: GLOBULA- куля), зустрічається поєднання всіх трьох типів структур: завжди є нерегулярні ділянки, є бета-складчасті структури та альфа-спіралі.
Зазвичай у глобулярних білках гідрофобні ділянки молекули перебувають у глибині молекули. З'єднуючись між собою, гідрофобні радикали утворюють гідрофобні кластери(Центри). Формування гідрофобного кластера змушує молекулу відповідним чином згинатися у просторі. Зазвичай у молекулі глобулярного білка буває кілька гідрофобних кластерів у глибині молекули. Це є проявом двоїстості властивостей білкової молекули: на поверхні молекули – гідрофільні угруповання, тому молекула загалом – гідрофільна, а у глибині молекули – заховані гідрофобні радикали.
Четвертична структура зустрічається не у всіх білків, а лише у тих, що складаються з двох або більше поліпептидних ланцюгів. Кожен такий ланцюг називається СУБ'ЄДИНИЦЮ цієї молекули (або ПРОТОМІРОМ). Тому білки, що мають четвертинну структуру, називають олігомерними білками. До складу білкової молекули можуть входити однакові або різні субодиниці. Наприклад, молекула гемоглобіну «А» складається з двох субодиниць одного типу та двох субодиниць іншого типу, тобто є тетрамером. Фіксуються четвертинні структури білків усіма типами слабких зв'язків, котрий іноді ще й дисульфидными зв'язками.
^ Фізико- хімічні властивостібілків
Амінокислотний склад білкової молекули, тобто. особливості первинної структури визначаються не тільки структурну організацію, біологічні функції, а й фізико-хімічні властивості білків. Особливості фізико-хімічних властивостейвикористовують для виділення та поділу індивідуальних білків з білкових сумішей. Розглядаючи фізико – хімічні властивості, говорять про молекулярну масу білкових молекул, про амфотерність, наявність заряду, ізоелектричної точки, здатність білків до руху в електричному полі, про розчинність білків і властивості розчинів, про денатурацію білків.
^ Молекулярна маса білків
"Білки - високомолекулярні сполуки", так починається визначення цього класу речовин. Молекулярна маса білків коливається від 6 т. Дальтон до кількох мільйонів. Наприклад: інсулін – 5733, гемоглобін – 6450, – глобулін людини – 160000, глутаматдегідрогіназа – 1 млн, вірус тютюнової мозайки – 40 млн. дальтон.
Найбільш точний метод визначення молекулярної маси білків розрахунковий, але для цього треба знати амінокислотний склад (тобто у білка має бути розшифрована первинна структура); має бути відомо наявність або відсутність четвертинної структури, а оскільки з величезної різноманітності природних білків (10 10 - 10 12) все це відомо тільки у тисячі білків, то основними методами визначення молекулярної маси залишаються:
віскозиметричні;
осмометричні;
гравіметричні;
гельфільтрація;
електрофорез (особливо останні три методи).
Розчинність білків
Розчинність білків коливається в широких межах та визначається:
- амінокислотним складом(що більше полярних угруповань, то краще розчинність);
особливостями організації білкової молекули (глобулярні розчинні краще, ніж фібрилярні);
властивості розчинника ( рослинні білкикраще розчиняються в 60 – 80° спирті, альбуміни – у воді та сольових розчинах, глобуліни – у слабких сольових розчинах).
Фактори середовища, що впливають на розчинність:
залежить від природи та концентрації розчинів солей, що знаходить відображення у понятті – іонна сила розчину, яка визначається за формулою:
Де з – концентрація солі;
B – валентність (тобто природа солі).
Солі солей лужних та лужноземельних металів низької іонної сили підвищують розчинність, т.к. збільшується можливість формування гідратної оболонки, зі збільшенням іонної сили – розчинність зменшується, причому кожен білок втрачає свою розчинність, тобто. осаджується з розчину за цілком певної іонної сили. Осадження білків із розчинів солями лужних та лужноземельних металів називається висолюванням. Облягаюча здатність солі залежить як від катіону, так і від аніону. Катіони і аніони можна розмістити в два ряди по зменшується зліва направо облогу здатності:
Катіони: Cs, Rb, K, Na, Li, Ba, Sc, Ca, Mg
Аніони:SO 4 , Cl, Br, NO 3 , J , CNS
Ці ряди звуться ліотропних рядів. Висолення широко застосовується для поділу (наприклад альбумінів від глобулінів) та отримання в очищеному вигляді білків та ферментів. Оскільки висолення впливає на гідратну оболонку, цей процес оборотний. Зняти гідратну оболонку і цим осадити білок з розчину можна і водоотнимающими речовинами – спиртом, ацетоном (використовуються спосіб фракционирования білків спиртами різної концентрації – по Кону). Це своєрідне висолювання і, якщо вплив не дуже тривалий, процес оборотний.
Розчинність білка залежить від температури, причому зі збільшенням температури до 40°С вона збільшується, а при подальшому наростанні – зменшується внаслідок зміни третинної та четвертинної (за її наявності) структур, що можна виразити графіком

Розчинність білків залежить від рН середовища. В ізоелектричному стані, коли сумарний заряд молекули дорівнює 0) і гідратна оболонка не формується, білки випадають в осад. На цій властивості засновано визначення ізоелектричної точки білка, ізоелектричне осадження та поділ білків (при зміні рН середовища таким чином, щоб воно відповідало точці ізоелектричної білка, він буде випадати в осад).
Методи фракціонування (розділу) білків по розчинності:
ізоелектричне осадження;
висолення;
поділ з використанням водовіднімних засобів.
Білкові структури дуже чутливі до змін середовища, особливо третинна та четвертинна. Білки з незміненими структурами та властивостями, властивими природним молекулам, називаються нативними білками. Будь-яка негідролітична зміна структури білка, що призводить до зміни його біологічних і фізико-хімічних властивостей – називається денатурацією (негідролітична, тобто не торкається пептидний зв'язок, первинну структуру).
Чинники денатурації:
фізичні: температура, тиск, ультразвук:
хімічні: кислоти, луги, детергенти, важкі метали, сечовина;
біологічні: протеолітичні ферменти.
Ознаки денатурації:
Втрата біологічної активності, нездатність виконувати свою функцію.
Зміна конформації молекули білка.
Збільшення числа функціональних груп (з'являються гідрофобні угруповання, що у нативному білку перебувають усередині молекули).
Зменшення розчинності білка та осадження його через втрату гідрофобної оболонки.
Зміна в'язкості, оптичної активності, прозорості білкових розчинів.
Зміна фарбування, що знаходить застосування в гістології.
Внаслідок зміни структури молекули білка, появі лежить на поверхні молекули нових угруповань, внутрішні зв'язку в білку стають доступнішими дії протеолітичних ферментів, тобто. такий білок краще перетравлюється.
Денатурація - процес оборотний, якщо вплив короткочасно і агент, що денатурує, видалений раніше, ніж виявилася порушеною вторинна структура.
Денатурація знаходить широке застосування в медицині, промисловості, лабораторній практиці, побуті.
^ Виділення та очищення білків
Виділення та очищення білків складається з низки етапів:
Подрібнення тканини до руйнування клітинних стінок – гомогенізація.
Екстракція - вилучення білків різними розчинниками; водою, слабкими сольовими розчинами, буферними сольовими розчинами і т.д.
Поділ екстракту спочатку на фракції, а потім на індивідуальні білки комбінацією різних методівосадження (висолювання, ІЕТ осадження, диференціальне центрифугування), електрофорез, гельфільтрація, хроматографія.
Очищення білка (діаліз, гельфільтрація, переосадження, дискелектрофорез).
Кристалізація (висалювання, ліофілізація).
Встановлення гомогенності.
Надіслати свою гарну роботу до бази знань просто. Використовуйте форму нижче
Студенти, аспіранти, молоді вчені, які використовують базу знань у своєму навчанні та роботі, будуть вам дуже вдячні.
Розміщено на http://www.allbest.ru/
Просторова будова білків та пептидів
Кожен білок або пептид специфічним чином згорнуть у просторі, і ця конформація визначає його фізико-хімічні та біологічні властивості. Просторова структура білка (пептиду) загалом кодується його первинною структурою. Цей взаємозв'язок створює передумови для теоретичних розрахунків та передбачень вторинної структури білків на основі їхньої амінокислотної послідовності. Просторова структура досить рухлива, т. е. здатна змінюватися під впливом зовнішніх умовабо різних агентів, і в цьому сенсі правильніше говорити про кращу конформацію білка або пептиду, одну з багатьох, енергетично найбільш вигідну просторову структуру. Середовище, навіть найбільш природне, не може не викликати реакції білкової молекули, і особливо тих її угруповань, які розташовані на поверхні глобули і беруть участь у численних взаємодіях. У живій клітині білок перебуває у постійно мінливому оточенні і змушений якось перебудовуватися, коли йому доводиться вступати в контакт із сусідніми білками, рецепторами або такими постійними партнерами, як нуклеїнові кислоти, ліпіди, полісахариди, іони металів та інші низькомолекулярні сполуки. Тому природне прагнення дослідника отримати більш повну інформацію про динамічні характеристики білкової молекули. Образно кажучи, він хоче бачити не фотографію, а кольоровий фільм про всі пригоди та перетворення функціонуючої молекули білка.
p align="justify"> Першорядне значення має з'ясування конформації нативного білка, яка визначає специфічність біологічної дії. Оскільки умови експерименту при аналізі просторової будови пептидно-білкових речовин зазвичай відрізняються від умов, у яких вони функціонують in vivo, у кожному випадку необхідно суворо доводити, що досліджувана переважна конформація в цілому зберігається в широкому діапазоні параметрів середовища (наприклад, розчин або кристал) .
Таким чином, з'ясування просторової будови пептидів і білків є достатньо складне завдання. У деяких випадках тривимірна структура конкретної сполуки може бути з'ясована на основі одного методу (наприклад, за допомогою рентгеноструктурного аналізу кристалічного білка). При дослідженні пептидів та невеликих білків у розчинах хороші результатидає поєднання низки фізико-хімічних методів. Іноді цінну інформацію можна отримати на основі застосування поряд з експериментальними підходами теоретичних розрахункових методів.
У білках, як зазначалося, розрізняють кілька рівнів просторової організації, т. е. вторинну, третинну і четвертинну структури. Хоча ці поняття дещо застаріли для білків, а для пептидів не застосовуються взагалі, ними користуються задля спадкоємності, оскільки в кінцевому рахунку цікавий повний описпросторової будови даного білка або пептиду з точними координатами атомів, з усіма конформаційними переходами - у безпосередньому зв'язку з біологічною функцією, що виконується.
Стереохімія амінокислот
білок пептид амінокислота
Усі амінокислоти, що зустрічаються в білках (крім проліну) можуть бути зображені формулою NH2CHRCOOH, де R - радикали різної природи. У загальному випадку це сполуки з асиметричним атомом вуглецю, і, отже, кожна амінокислота може існувати у просторі у вигляді двох форм - з L- та D-конфігурацією асиметричного центру.
Приналежність амінокислот до L- або D-ряду у разі найпростіших представників (аланін, серин) доводиться прямою зведенням їх до відповідного гліцеринового альдегіду за допомогою стереоспецифічних перетворень.
До складу всіх білків входять тільки L-амінокислоти (виняток становить оптично неактивний гліцин), які можуть бути представлені у вигляді проекційних формул Фішера:
Приналежність до L-ряду не обов'язково пов'язана з певним напрямом обертання площини поляризованого світла: L-амінокислоти мають як позитивне, так і негативне обертання залежно від радикалу R та умов дослідження.
Протилежну конфігурацію мають D-амінокислоти:
Залишки D-амінокислот входять до складу багатьох природних пептидів, насамперед антибіотиків. Зокрема, граміцидин 8 входить Б-фенілаланін, граміцидин А -D-валін, D-лейцин, D-триптофан, актиноміцин D - D-ізолейцин, поліміксин - D-серин, D-Пролін зустрічається в ергоалкалоїдах.
Деякі амінокислоти мають два асиметричні вуглецеві атоми, що обумовлює можливість існування чотирьох оптично активних стереомерних форм (2n, де n - число асиметричних атомів). Ці форми проілюстровані на схемі для треоніну та ізолейцину.
Поява заступника в піролідиновому кільці проліну також призводить до утворення алло-форм, в яких заступник (гідроксигрупа) та карбоксильна група знаходяться в цис-положенні.
При кислотному гідролізі білків виходить суміш L-амінокислот, які за допомогою дробової кристалізації або хроматографії можуть бути виділені в чистому вигляді. Аналогічно при гідроліз ряду природних пептидів (граміцидини А і S, актиноміцин і т. п.) можна отримати і відповідні чисті D-амінокислоти.
Часто амінокислоти для дослідницьких цілей та практичних потреб отримують за допомогою мікробіологічного синтезу (лізин та ін) - тоді продуктами є L-ізомери. Якщо ж користуються хімічним синтезом, зазвичай утворюються суміші L- і D-ізомерів амінокислот, т. е. рацемати. Для їхнього поділу використовуються різні прийоми. Одним з найбільш поширених є вибірковий гідроліз ферментами (ацилазами, естеразами тощо) N-ацетил-D, L-амінокислот або відповідних складних ефірів D, L-амінокислот; у цьому випадку розщепленню піддається лише L-форма і, таким чином, у розчині утворюються вільні L-амінокислоти, які легко відокремлюються від стабільних по відношенню до ферментативного гідролізу похідних D-амінокислот.
Іншим прийомом є утворення солей D, L-амінокислот з оптично активними агентами, наприклад алкалоїдами бруцином і стрихніном, а також іншими оптично активними амінами, що виробляються в промислових масштабах (амфетамін та ін.). В силу різної розчинності відповідних діастереомерних солей (D,L і L,L) вони поділяються шляхом кристалізації або дробового осадження і при подальшому розкладанні кислотами утворюють оптично чисті L-і D-амінокислоти. Ці методи, які раніше широко застосовувалися в лабораторії, поступово втрачають своє значення. У виробничих умовах для поділу рацемічних амінокислот все ширше використовуються хроматографія на оптично активних адсорбентах та іммобілізовані ферменти.
Пептидна зв'язок
Головною структурною одиницеюбілків і пептидів є пептидна (амідна) зв'язок --СО--NH--. Згідно сучасним уявленням, пептидна зв'язок у білках є практично плоскою, її основні параметри наведені малюнку. У звичайних умовахспостерігаються лише невеликі відхилення від плоскої системи (до 5 - 10 °); великі деформації можливі у напружених циклічних системах. Пептидна зв'язок приблизно на 10% коротше звичайної, простий С--Nі має характер «частково подвійного» зв'язку --С=N--. При вивченні цієї проблеми Л. Полінг та Р. Корі, що аналізували методом рентгеноструктурного аналізу ряд модельних ді- та трипептидів, запропонували в 1948 - 1955 рр.. пояснювати особливу природу зв'язку С-N «резонансом» між двома формами пептидного зв'язку а і б.
Іншими словами, в білках і пептидах зв'язок С-N є частково кратним (як це показано структурою в) через взаємодію неподіленої пари електронів атома азоту з р-електронною системоюкарбонільної групи, що призводить до утрудненого обертання навколо зв'язку С-N (бар'єр обертання становить 63 - 84 кДж/моль).
Зазвичай пептидна зв'язок має транс-конфігурацію, тобто транспланарної (рис. 33, а). У напружених циклічних системах (деякі циклопептиди, похідні проліну тощо), а також при великому розмірізаступників у атома азоту в N-алкілованих похідних пептидний зв'язок може існувати в плоскій цис-формі (рис. 33,б). Цис-і транс-пептидні зв'язки можна розрізнити за допомогою фізичних методів(ІЧ-, ЯМР-спектроскопії та ін). У білках пептидний зв'язок майже завжди має транс-конфігурацію.
Валентні кути і довжини зв'язків (в нм) транс-і цис-пептидних зв'язках (а і бвідповідно)
Розглянемо тепер фрагмент пептидного ланцюга, що включає два плоскі пептидні зв'язки з рухомим (своєрідним шарнірним) зчленуванням у точці, де знаходиться асиметричний вуглецевий атом (рис. 34).
Визначення двогранних кутів у поліпептидному ланцюгу
У цій ланці пептидного ланцюга повороти можливі навколо двох простих зв'язків N-Сб і Сб-С, що примикають до асиметричного атома. Згідно з прийнятою номенклатурою, такі повороти вимірюються двогранними кутами ц(N-Сб) і ш(Сб-С "); нерідко використовуються також кути щ (обертання навколо пептидних зв'язківС"--N), а також ч1 і ч2 ін. (Обертання навколо зв'язків Сб--Св, Св--Сг і т. д.). В якості нульової точки відліку приймається конформація (рис. 35), в якій ц = ш = щ = 0° (заслонене розташування залишків основного пептидного ланцюга).
Легко зрозуміти, що будь-які конформації пептидного ланцюга можуть бути описані набором значень кутів ц і ш у кожного зі Сб-атомів (зазвичай щ = 180 °); іншими словами, знання таких значень для всіх пептидних ланок еквівалентне повної інформаціїо просторовій будовіосновний ланцюг білка і пептиду.
Графічно конформаційні параметри поліпептидного ланцюга зручно зображати за допомогою карт, запропонованих Г. Рамачандраном у 1963 р. («карти Рамачандрану») та відображають залежність енергії залишку від параметрів циш (рис. 36). Значення кутів циш відкладаються по осях координат від -180 ° до +180 °. В силу взаємодії між заступниками в пептидному ланцюгу кути циш не можуть приймати будь-які значення - для них дозволеними виявляються лише деякі дискретні області (виділені на карті темним кольором), які відповідають енергетично вигідним конформаціям пептидного ланцюга, тобто по суті є областями мінімуму енергії. Їх досить компактна локалізація свідчить про те, що кути ціш взаємопов'язані, зміна одного з них тягне зміну другого. Наприклад, якщо кут ш набуває значення в інтервалі 60 - 120 °, то для кута ц енергетично вигідним виявляється значення, що не перевищує - 60 °.
Конформації пептидного ланцюга, що відповідають нульовим значеннямкутів ц, ш і щ (чорні стрілки вказують напрям погляду спостерігача)
Невалентні взаємодії у пептидному ланцюгу
Просторова структура білків і пептидів в основному визначається невалентними взаємодіями між різними атомами.
Дозволені області для двогранних кутів основного ланцюга.
Водневі зв'язки, як правило, утворюються між рухомим атомом водню (-ОН, - NН, - SН) і гетероатомом, найчастіше атомом кисню. Водневий зв'язок має донорно-акцепторну природу, тобто він утворюється за участю неподіленої електронної пари гетероатома (донор електронів); акцептором електронів є атом водню. Найбільше значеннядля формування просторової структури білків мають водневі зв'язки між СО - і NН-групами пептидного кістяка.
У неполярному оточенні енергія водневого зв'язку СНН становить близько 16,7 кДж/моль, а підвищення полярності середовища знижує цю енергію.
Крім зазначених, можливі водневі зв'язки за участю функціональних груп бічних ланцюгів, наприклад:
Важче пояснити гідрофобні взаємодії. По суті, такі взаємодії, що мають ентропійну природу, пов'язані з тим, що неполярні замісники виштовхуються з води та прагнуть обмежити свій контакт із водою; навпаки, вода прагне відновити свій структурований стан і примусово групує заступники в кластери, які мають мінімум енергії. У такого роду «взаємодії» вступають переважно неполярні бічні групи амінокислотних залишків.
Ван-дер-ваальсові взаємодії, що описуються потенціалом Ленард-Джонса, складаються з дисперсійних сил тяжіння атомів та сил взаємного відштовхування їх електронних оболонок. Як видно з малюнка, найбільш вигідною є відстань Rm, що дорівнює або близька до суми ефективних радіусів взаємодіючих атомів.
Потенціал Ленард-Джонса (мінімуму потенціалу відповідає відстані Rm та енергія тяжіння Еm)
Енергетичний вклад кожного контакту невеликий (<0,42 кДж/моль), но ввиду их большого числа ван-дер-ваальсовые взаимодействия дают основной вклад в суммарную энергию внутримолекулярных невалентных взаимодействий.
Іонні, чи електростатичні, взаємодії є взаємодії заряджених груп. При цьому, як відомо, однойменно заряджені групи відштовхуються, а різноіменно заряджені притягуються. До них відносяться, зокрема, взаємодії іоногенних груп, що утворюють сольові зв'язки.
Енергія сольових зв'язків у гідрофобному оточенні може досягати 41,9 кДж/моль, але їх кількість у білках порівняно невелика. Підвищення діелектричного постійного середовища знижує енергію сольових зв'язків. Багато в чому аналогічні електростатичні іон-дипольні та диполь-дипольні взаємодії.
Нарешті, торсіонні взаємодії характеризують скрученість ординарного зв'язку. Зокрема, поворот будь-якого угруповання навколо ординарного зв'язку може порушувати електронну структуру зв'язку і викликати свого роду «гальмівну» реакцію. Торсіонні сили відносно слабкі, але при аналізі поворотів навколо зв'язків С-С, С-N у бічних ланцюгах амінокислотних залишків їх не можна не враховувати.
Конформація білка і пептиду, що реалізується в даних умовах, визначається сумою всіх перерахованих взаємодій і є енергетично найбільш вигідною, що і відображається «попаданням» відповідних кутів у дозволені області конформаційних «карт Рамачандрана».
Розміщено на Allbest.ru
Подібні документи
Амінокислоти, що входять до складу пептидів та білків. Моноамінодикарбонові кислоти та їх аміди. Енантіомерія амінокислот, утворення солей. Мезомерія та будова пептидного зв'язку. Методи виділення та аналізу білків. Електрофорез у поліакриламідному гелі.
презентація , доданий 16.12.2013
Роль у живій природі. Склад та властивості білків. Класифікація білків. Визначення будови білків. Визначення наявності білка. Ідентифікація білків та поліпептидів. Синтез пептидів. Штучне одержання білка. амінокислоти.
реферат, доданий 01.12.2006
Загальна характеристика, класифікація, будова та синтез білків. Гідроліз білків із розведеними кислотами, кольорові реакції на білки. Значення білків у приготуванні їжі та харчових продуктів. Потреба та засвоюваність організму людини в білку.
курсова робота , доданий 27.10.2010
Оцінка сформованого адміністративно-територіального устрою Росії. Вивчення білків. Класифікація білків. Склад та будова. Хімічні та фізичні властивості. Хімічний синтез білків. Значення білків.
реферат, доданий 13.04.2003
Класифікація біополімерів. Амінокислоти, що входять до складу пептидів та білків, будова та властивості. Моноамінодикарбонові кислоти та їх аміди. Утворення солей. Пептидна зв'язок. рівні структурної організації білка. Нуклеїнові кислоти та їх похідні.
презентація , доданий 28.02.2012
Білки як полімери з пептидним зв'язком. Освіта макрокомплексу (олігопротеїну), що складається з кількох повноцінних білкових субодиниць. Фібрилярні та глобулярні групи. Аналіз та синтез білків. Метод Мерріфілд - твердофазний синтез пептидів.
реферат, доданий 21.02.2009
Характеристика білків як високомолекулярних сполук, їх структура та освіта, фізико-хімічні властивості. Ферменти травлення білків у травному тракті. Всмоктування продуктів розпаду білків та використання амінокислот у тканинах організму.
реферат, доданий 22.06.2010
Білки як високомолекулярні природні сполуки, що складаються із залишків амінокислот, які з'єднані пептидним зв'язком. Якісний склад білків, їх структура та функції. Процеси гідролізу (кислотно-основного, ферментативного) та денатурація білків.
презентація , додано 11.02.2015
Дослідження властивостей білків для вивчення їх хімічного складу та будови. Амінокислота – основна структурна одиниця білка. Білкові резерви. Етапи синтезу білка. Регулювання біосинтезу амінокислот. Перетравлення білків. Патологія білкового обміну.
реферат, доданий 17.01.2009
Загальні шляхи обміну амінокислот. Значення та функції білків в організмі. Норми білка та його біологічна цінність. Джерела та шляхи використання амінокислот. Азотний баланс. Панкреатичний сік Перетравлення складних білків. Поняття трансамінування.






