Елементний склад білків. Застосування вітаміну е. Опорні конспекти лекцій
ферменти - біокаталізатори білкової природи, що регулюють швидкість хімічних реакцій організму;
гормони білкової природи – регулятори обміну речовин організму;
специфічні білки регулятори, наприклад, білки тропонінового комплексу – регулятори м'язового скорочення.
Пластична, будівельна функція: білки – будівельний матеріал живого, основа будь-якої клітини, мембрани, субклітинних частинок.
Регуляторна функція:
опорно-механічна (білок – колаген)
скорочувальна (мірозин, актин)
білки пам'яті
білки смаку
токсикогенна функція (токсин ботулінуса є білком)
генно-регуляторна – регуляція матричної активності та перенесення генетичної інформації
рецепторна (становить основу структури мембранних та цитозольних рецепторів)
Транспортна функція: білки плазми транспортують ліпіди крові, типовим прикладом білка транспортера є гемоглобін, ацилпереносний білок і т.д.
Захисна функція: прикладами є імуноглобуліни, білки системи згортання крові, інтерферон і т.д.
білки забезпечують видову та індивідуальну специфічність (наприклад: білки груп крові)
інші специфічні функції:
Резервна (овальбулін яйця – запасний матеріал для клітин, що розвиваються)
енергетична (неспецифічна функція: при розпаді 1г. білка виділяється 17,1 кДж енергії)
За кількісним вмістом в організмі білки посідають друге місце після води, за значимістю – перше місце. У середньому приймають, що у сухій речовині організму міститься до 40-50% білка.
Тільки детально вивчивши будову білків та його властивості можна зрозуміти як перелічені особливості білків, і їх функції.
Елементарний склад білків
Білками називають високомолекулярні азотовмісні органічні сполуки, що складаються з амінокислот, з'єднаних пептидним зв'язком у поліпептид, і мають складну структурну організацію. Це визначення включає характерні особливостібілків, зокрема, особливості елементарного складу.
Елементарний склад білка був вивчений у минулому столітті і може бути представлений в % наступним чином: -50-55, -21-24, -15-18, -6,5-7, - до 2,5, зола – до 0,5. звертає увагу досить стала частка азоту – 16%. Це знаходить практичне застосуванняпри визначенні кількості білка: знайдену шляхом аналізу кількість амінного азоту множать на коефіцієнт 6,25 (знаходять із пропорції 100 г. білка – 16 г. N = х р. білка – 1 г. N).
Мономерами – структурною одиницею білка є α-амінокислоти, куди розпадаються білки при гидролизе.(прийом, що використовується щодо складу білків).
Властивостей протеїногенних амінокислот
Протеїногенні амінокислоти відносяться α-амінокислот (аміногрупа розташована в α положенні по відношенню до карбоксильної групи). Розрізняються амінокислоти своїми радикалами:
H 2 N – CH – COOH
Усі амінокислоти, крім гліцину, мають асиметричний атом вуглецю.
Всі амінокислоти є оптично активними: IO з них - лівообертальні (-), 7 - правообертальні (+).
протеїнові амінокислоти відносяться до L-ряду.
Амінокислотам властиві як властивості кислот, і лугів, тобто. вони мають амфотерність. В інтервалі pH від 4.0 до 9.0 майже всі амінокислоти існують переважно у формі цвіттеріонів з протонованою аміногрупою та дисоційованою карбоксильною групою.
кожна амінокислота поряд з загальними властивостями, має низку специфічних властивостей.
основний метод виявлення амінокислот у гідролізатах – хроматографія (іонообмінна), використання амінокислотного аналізатора; менш специфічними є кольорові реакції.
МІНІСТЕРСТВО ОСВІТИ І НАУКИ
РЕСПУБЛІКИ КАЗАХСТАН
ІННОВАЦІЙНИЙ ЄВРАЗІЙСЬКИЙ УНІВЕРСИТЕТ
ОПОРНІ КОНСПЕКТИ ЛЕКЦІЙ
з дисципліни
«БІОХІМІЯ»
для студентів спеціальності
050727 "Технологія продовольчих продуктів"
ПАВЛОДАР 2009 рік
ЗАТВЕРДЖЕНО
Директор Інженерної АкадеміїДок. віт. наук, проф. _________ Є.Б. Нікітін
«___» _______________ 200 р.
Укладач: к.т.н., доцент К.М. Омарова
Кафедра «Прикладна біотехнологія»
^ ОПОРНІ КОНСПЕКТИ ЛЕКЦІЙ
з дисципліни «Біохімія»
Для студентів спеціальності 050727 «Технологія продовольчих продуктів»
Розроблено на підставі Державного загальнообов'язкового стандарту вищої освіти 050727 – «Технологія продовольчих продуктів», ГОСО РК 3.08.353-2006 «Освіта вища професійна. Бакалаврат», Типової навчальної програми з дисципліни «Біохімія» та Робочої навчальної програми з дисципліни «Біохімія» (2009 р.).
Розглянуто на засіданні кафедри «Прикладна біотехнологія»
Протокол № __ від «__» _____________ 200__ р.
Зам.зав. кафедрою «Прикладна біотехнологія»
Канд. техн. наук, професор М.С. Омаров
Затверджено на засіданні науково-методичної ради факультету очного навчання Інженерної Академії та рекомендовано до видання
Протокол №___ від ________200__р.
Голова НМС факультету очного навчання Інженерної Академії
Канд. техн. наук, професор ______________ Є.К. Ордабаєв
Узгоджено:
Начальник ІМВ
Канд. пед. наук, професор ___________ Н.М. Ушакова
Здано до бібліотеки _____________________
^ ТЕМАТИЧНИЙ ПЛАН ЛЕКЦІЙ
| № | Теми лекцій | Кількість Годинник |
| 1 | Вступна | 1 |
| 2 | Біохімія білка та нуклеїнових кислот | 2 |
| 3 | Біохімія вуглеводів | 2 |
| 4 | Біохімія ліпідів | 2 |
| 5 | Структурна організація клітини та систем органів, пов'язаних з харчуванням. Хімічний складорганізму | 2 |
| 6 | Загальні поняття про обмін речовин та енергії в організмі | 2 |
| 7 | Біологічне окиснення | 2 |
| 8 | Взаємозв'язок обміну білків, нуклеїнових кислот, вуглеводів та ліпідів | 2 |
| Разом: | 15 |
|
^ Лекція №1 (1 год)
Вступна
Біохіміяможе бути визначена як хімія живих об'єктів (клітин та організмів). Живі об'єкти відрізняються від неживих своєю здатністю до метаболізму та відтворення (з передачею генетичної інформації). При цьому живі істоти є складовоюприроди і підпорядковуються всім основним законам природи, таким, як закони збереження маси та енергії та закони термодинаміки.
^ Живі об'єктиє відкриті системи(з точки зору термодинаміки) або щодо ізольовані системи(З погляду кібернетики). В обох випадках це означає, що живі системи беруть участь в обміні із навколишнім середовищем. Цей обмін із середовищем здійснюється за допомогою субстратів (джерел вільної енергії) та інформації, що приходить ззовні (що призводить до зниження ентропії та підвищення рівня організації живих систем). Такого роду обмін із середовищем підпорядковується в основному принципу Ле Шательє і призводить до стаціонарного стану системи. Воно може бути охарактеризовано як динамічний стан, при якому в кожен даний проміжок часу система отримує від навколишнього середовищаті ж кількості речовини та енергії, що і повертає до неї, і, таким чином, концентрація їх усередині системи залишається незмінною. Це є однією з характерних рисживих об'єктів, що відрізняє їхню відмінність від неживих ізольованих систем, що у незалежному від часу рівновазі. У таких неживих системах усі кількості речовини та енергії залишаються незмінними та всі процеси припиняються.
Реакції живих систем протікають таким чином, у часі та просторі. Відповідно до ступеня розвитку ці системи відрізняються ступенем складності структури.
^ Структури живих об'єктів зазвичай утворюються з простих неорганічних і органічних речовині мають певну просторову конфігурацією, яка не відображається їх найпростішими хімічними формулами. Цю особливість потрібно пам'ятати під час розгляду реакційної можливості, найчастіше залежить від зміни. Відносно прості сполуки об'єднуються в макромолекули і, нарешті, надмолекулярні структури, що лежать в основі головних будівельних блоків, з яких складаються живі системи, - клітинита їх органели. Молекули живих систем мають певні розмірита форму, пов'язані з їх функціями в організмах.
Функціонування живих систем засноване на біохімічних реакціях, що протікають як у вже згаданих клітинних та субклітинних структурах, так і в розчині цитоплазми або міжклітинних рідинах.
^ Біохімічні реакції протікають у порівняно вузькому інтервалі фізичних та хімічних параметрів, Крім обмежень у температурах і тисках це стосується також інтервалу концентрацій, або активностей водневих іонів ( величини рН). Значення рН підтримуються на рівні буферними системами, що підпорядковуються рівнянню Гендерсона-Хассельбалха. Відносна сталість значень рН дуже істотна для того, щоб запобігти дисоціаціюбіологічно активних з'єднаньоскільки в результаті може відбутися зміна форми та реакційної здатності молекул білків і відповідно зміна їх структурної стабільності або ферментативної активності. Деякі біохімічні реакції протікають з оптимальною швидкістюлише за певного осмотичний тиск та іонна силау середовищі, де зберігається суворо постійним співвідношення певних іонів. Всі ці чинники істотно впливають на властивості та функції молекул і ступінь дисперсності систем. Залежно від природи розчину та розміру розчинених частинок ми розрізняємо справжні розчини, колоїдні розчини та суспензії.
Біохімічні реакції можуть протікати лише за дотримання певних енергетичних вимог. Первинним джерелом енергіїна планеті є випромінювання Сонця. Частина цієї енергії запасається у формі хімічної енергіїу хімічних зв'язках різних речовин. Нині Землі істотно переважають аеробні умови, і більшу частину енергії живі системи одержують за рахунок окисно-відновних процесів(і насамперед з допомогою окислення органічних сполук атмосферним киснем). Реакції, що протікають в організмах, є або екзергонічними(вони протікають спонтанно), або ендергонічними(Вони вимагають для свого здійснення зовнішнє джерелоенергії). Багато ендергонічних реакцій можуть протікати лише тому, що вони пов'язаніз екзергонічними реакціями. Найбільш поширеним переносником енергії є молекула аденозинтрифосфату(АТР).
Біохімічні реакції протікають зі швидкостями, що залежать від концентраційреагуючих молекул і констант швидкостей, характерних для цього типу реакції. Ці швидкості істотно можуть бути змінені (зазвичай підвищені) у присутності каталізаторів(Ферментів). Шкідливі впливинавколишнього середовища проявляються насамперед на ферментативному рівні, інгібуючи відповідні реакції.
Окремі реакції у живих об'єктах контролюютьсянайрізноманітнішими шляхами. Цей контроль здійснюється за рахунок зміни просторових чинників (зміни ентропії живих систем), і за рахунок зміни швидкостей реакцій.
^ Лекція №2 (2 години)
Тема: Біохімія білка та нуклеїнових кислот
Біохімія білка
Макромолекули: білки та нуклеїнові кислоти відіграють визначну роль у побудові живої матерії та здійсненні процесів життєдіяльності, оскільки білки – це структура та функціонування живої матерії, а нуклеїнові кислоти – потенційні можливостіорганізму (спадкова інформація та її реалізація за допомогою РНК та білків).
Особливості, властиві білкам та невластиві іншим органічним сполукам:
Гігантські білкові молекули відрізняються невичерпною різноманітністю структури за суворої її специфічності у даного конкретного видубілки.
Білкам властива здатність до внутрішньо молекулярних взаємодій, що забезпечує динамічність структури їх молекули, мінливість та пластичність їх форми, оборотність переходів з глобулярного до фібрилярного стану;
Маючи багатоликі по хімічним властивостямрадикалам амінокислотних залишків у структурі поліпептидного ланцюга, білкові молекули в цілому та окремі їх частини здатні вступати в різноманітні хімічні та фізичні взаємодії як один з одним, так і з нуклеїновими кислотами, полісахаридами, ліпідами тощо, утворюючи надмолекулярні комплекси, що становлять субклітинних структур;
Найважливішою особливістюмеханізмом виникнення зазначених комплексів є безпомилкове “впізнавання” інгредієнтами один одного та протікання самого процесу асоціації за принципом самоскладання;
Молекули білка закономірно змінюють свою структуру під впливом зовнішньої взаємодії та відновлюють вихідний стан при його знятті, причому це може бути пов'язане з акцептуванням та перетворенням енергії;
Багато білків мають унікальну здатність прискорювати хімічні реакції організму, тобто. виконувати каталітичну функцію. Білки виконують і багато інших функцій.
Біологічні функції білків
Пластична, будівельна функція: білки – будівельний матеріал живого, основа будь-якої клітини, мембрани, субклітинних частинок.
Регуляторна функція:
Б) гормони білкової природи – регулятори обміну речовин організму;
В) специфічні білки регулятори, наприклад, білки тропонінового комплексу – регулятори м'язового скорочення.
Транспортна функція: білки плазми транспортують ліпіди крові, типовим прикладом білка транспортера є гемоглобін, ацилпереносний білок і т.д.
Захисна функція: прикладами є імуноглобуліни, білки системи згортання крові, інтерферони і т.д.
Білки забезпечують видову та індивідуальну специфічність (наприклад: білки груп крові).
Інші специфічні функції:
Б) скорочувальна (міозин, актин);
в) білки пам'яті;
г) білки смаку;
Д) токсикогенна функція (ботулінічний токсин є білком);
Е) генно-регуляторна – регуляція матричної активності та перенесення генетичної інформації;
Ж) рецепторна (становить основу структури мембранних та цитозольних рецепторів);
Резервна (альбумін яйця - запасний матеріал для клітин, що розвиваються).
Енергетична (неспецифічна функція: при розпаді 1 р. білка виділяється 17,1 кДж енергії).
Тільки детально вивчивши будову білків та його властивості можна зрозуміти як перелічені особливості білків, і їх функції.
^ Елементарний склад білків
Білками називають високомолекулярні азотовмісні органічні сполуки, що складаються з амінокислот, з'єднаних пептидним зв'язком поліпептид, і мають складну структурну організацію. Це визначення включає характерні особливості білків, зокрема особливості елементарного складу.
Елементарний склад білка був вивчений у минулому столітті і може бути представлений у % наступним чином: С-50-55, Про - 21-24, N - 15-18, Н-6,5-7, зола - до 0,5. Звертає увагу досить постійна частка азоту – 16%. Це знаходить практичне застосування щодо кількості білка: знайдене шляхом аналізу кількість амінного азоту множать на коефіцієнт 6,25 (знаходять із пропорції 100 р. білка – 16 р. N = Х р. білка – 1 г. N).
Мономерами – структурною одиницею білка є -амінокислоти, куди розпадаються білки при гидролизе (прийом, що використовується щодо складу білків).
^ Властивості протеїногенних амінокислот
Протеїногенні амінокислоти відносяться до -амінокислот (аміногрупа розташована в -положенні щодо карбоксильної групи). Розрізняються амінокислоти своїми радикалами:
Н2N - CH - COOH
Усі амінокислоти, крім гліцину, мають асиметричний атом вуглецю.
Усі амінокислоти є оптично активними: 10 з них – лівообертаючі (-), 7 – правообертальні (+).
Протеїногенні амінокислоти відносяться до L-ряду.
Амінокислотам властиві як властивості кислот, і лугів, тобто. вони мають амфотерність. В інтервалі рН від 4,0 до 9,0 майже всі амінокислоти існують переважно у формі цвіттеріонів з протонованою аміногрупою та дисоційованою карбоксильною групою.
Кожна амінокислота поряд із загальними властивостями, має низку специфічних властивостей.
Основний метод виявлення амінокислот у гідролізатах – хроматографія (частіше іонообмінна), використання амінокислотного аналізатора; менш специфічними є кольорові реакції.
Класифікація амінокислот
У природі існує близько 200 амінокислот, 60 з них зустрічаються в організмі, але в структурі білків постійно зустрічаються - 18, які і називаються протеїногенними (іноді зустрічаються оксилизин, оксипролін, карбоксиглютамінова кислота).
Існує ряд хімічних класифікацій, в основу їх покладено будову амінокислот (ациклічні та циклічні), число аміно- та карбоксильних груп (моноаміномонокарбонові, діаміномонокарбонові, моноамінодикарбонові), властивості радикалів (гідрофобні, гідрофільні, позитивно. якими можна докладніше познайомитися за підручником. Слід звернути особлива увагана біологічну класифікацію: розподіл амінокислот на незамінні (які не можуть синтезуватися в організмі і повинні надходити з їжею) та замінні (здатні синтезуватися з незамінних амінокислотабо утворюватись у реакціях метаболізму). Для полегшення запам'ятовування назв незамінних амінокислот із перших літер їх складено граматично не зовсім вірна фраза:
Слід лише пам'ятати, що у букву “ А ” є три амінокислоти: аланин, аспарагінова кислотаі аргінін, але тільки остання, як і друга з діаміно карбонових кислот- Лізин є незамінною. Подібним чином на букву "Т" починається три амінокислоти, але третя - тирозин, може бути легко синтезована в організмі з фенілаланіну і не є незамінною.
У білках міститься до 55% - З; 20-25% – Про; 16% – N, а також S, P, Mgта ін Частка азоту на відміну від інших елементів приблизно однакова і становить 16% і вміст білка в матеріалі часто визначають за кількістю азоту ( спалювання по К'єльдалю). Виняток становить білки-протаміни, які містять ~30% N.
Mr- Відносна молекулярна маса білків. Вона дуже велика: від ≈ 6000Так до декількох мільйонів Так.
Наприклад, Mr інсуліну = 5733 Так, а вірусу тютюнової мозаїки - 40 млн.
Мономери або структурні ланки білків.
Їх можна визначити шляхом кислотного гідролізу білків. Мономерами білків є α-АК L-ряду. З'єднання АК поліпептидний ланцюг (ППЦ) відбувається за допомогою ковалентних пептидних зв'язків -CO-NH-.
Складна структурна організація.
Деякі природні, а також штучно одержані поліпептиди можуть мати велику Mr, але віднести їх до білків не можна. Відрізняє їх від білків унікальна ознака, властива лише білкам. денатурація. При дії певних речовин, так званих детергентів, відбувається втрата білком фізико-хімічних властивостей, а головне – біологічної активності , при цьому пептидні зв'язкине розриваються. Таким чином, білки мають складну просторову організацію.
Такі характерні ознакибілків.
Форма білкових молекул.
У природі білки зустрічаються як у вигляді ниток. фібрил, так і у вигляді кульок – глобул. Іноді глобулярні та фібрилярні форми зустрічаються у вигляді комплексів (у м'язової тканиникомплекс актину з міозином; у плазмі крові міститься фібрил білка – фібриноген, а також глобули білка – альбуміни та глобуліни).
Функції білків.
1. Каталітична– понад 99% ферментів чи біологічних каталізаторів є білками; наприклад каталаза, аспартат-амінотрансфераза. До 90-х років 20 ст. ідентифіковано понад 2000 ферментів білкової природи.
2. Поживна(Або резервна) - казеїн - білок молока, овальбуміни - білки яйця.
3. Транспортна – дихальна функціякрові, зокрема, перенесення Про 2 здійснюється гемоглобіном (Нв) – білком еритроцитів.
4. Захисна- Специфічні захисні білки-антитіла нейтралізують дію чужорідних білків-антигенів.
5. Скорочувальна– специфічні білки м'язової тканини актин та міозин забезпечують м'язові скороченнята розслаблення, тобто. рух.
6. Структурна– таку функцію виконують білки – колаген сполучної тканини, Кератин - у волоссі, нігтях, шкірі.
7. Гормональна– регуляція обміну речовин здійснюється за рахунок гормонів – білків чи поліпептидів гіпофізу, підшлункової залози.
Фізико-хімічні властивості амінокислот
α-АК є будівельними блоками, з яких утворюються білкові поліпептидні ланцюги (ППЦ)і, власне, самі білки. Амінокислоти – це похідні карбонових кислот, в яких один із водень вуглецевого ланцюга заміщений на R.
Шляхом гідролізу з тварин білків виділяють 19-25 -АК, але зазвичай їх отримують 20. Загальна формула амінокислот:
Амінокислоти- Це безбарвні кристалічні речовини, що плавляться при високих температурах (> 250 ° С). Легко розчинні у воді та нерозчинні в органічних розчинниках. Маючи у своєму складі NH 2 -групу основного характеру і COOH - з кислими властивостями, АК мають амфотерність. У водних розчинах α-АК переважно існують у вигляді біполярних іонівабо цвіттер-іонівз дисоційованою COO – –групою та протонованою NH 3 + –групою.
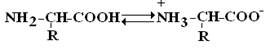
Цвіттер-іон
Залежно від рН-середовища АК можуть бути у вигляді аніонів, катіонів, нейтральних біполярних іонів або у вигляді суміші їх форм.
У сильнокислому середовищіАК присутні у вигляді катіонів (q+)

в сильнолужному середовищі– у вигляді аніонів (–q)

Розмір рН, коли він у водному розчині переважає цвиттер-ион, тобто. рівноважна концентрація "+" і "-" q амінокислот, а також білків, називається ізоелектричною точкою (pI). При досягненні такого рН білок стає нерухомим в електричному полі і випадає в осад, що використовується в електрофоретичнихметоди аналізу білків та амінокислот.
Стереохімія амінокислот.
Важливою властивістю АК є їх оптична активністьу водних розчинах. Ця властивість АК обумовлена наявністю в їх структурі хірального атома С. Хіральним атомомабо хіральним центром називається атом, у якого всі зв'язки заміщені різними радикалами(R):
Стереоізомери– це ізомери з однаковою послідовністю з'єднання атомів, але з різним їх розташуванням у просторі.
 |  |
Якщо 2 стереоізомери ставляться один до одного як предмет та його дзеркальне відображення, їх називають енантіомерами.
Енантіомери завжди виявляють однакові хімічні та фізичні властивості за винятком одного – напрямки обертання площини поляризованого променя. Енантіомер, що обертає площину поляризації за годинниковою стрілкою, називається правообертальним (« + »), а проти годинникової стрілки – л невирішеним (« – »). Природні амінокислоти є як "+", так і "-".
Суміш рівної кількості молекул правого та лівого енантіомерів називається рацемічноїсумішшю.
Рацемати не мають оптичної активності. за просторовому розташуваннюатомів і радикалів навколо хірального центру розрізняють амінокислоти Д-і L-ряду. Для визначення належності АК до Д-або L-ряду порівнюють конфігурацію її хірального центру з енантіомером гліцеральдегіду (ГА).
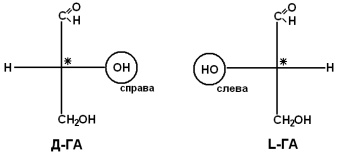
За аналогією, в амінокислотах якщо NH 2 -група розташована праворуч від осі СООН-R, то це Д-АК, а якщо зліва - L-АК.
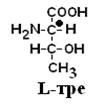 |
Усі амінокислоти природних білків є α-АК.
Білки молока містять усі органічні природні речовини: вуглець, водень, кисень і притаманний білків елемент – азот.
Крім цього до їх складу входять сірка та фосфор.
Для характеристики білків служить насамперед наявність у яких азоту, сірки і фосфору. На результатах елементарного аналізу, зокрема азоту, ґрунтуються методи визначення білків у молоці. Для визначення вмісту азоту в органічних сполуках був розроблений метод К'єльдаля (1883), який і в даний час служить надійним способом визначення білків в молоці та молочних продуктах. Кількість білків встановлюється за вмістом азоту в аналізованій пробі молока з урахуванням коефіцієнта переведення. Шляхом спалювання проби та наступної фіксації азоту визначають його вміст. p align="justify"> Коефіцієнт перерахунку приймають рівним 6,38, виходячи з того, що в 100 г чистого казеїну міститься 15,65% азоту (за результатами аналізу елементарного складу казеїну - (100:15,65 = 6,38). Середній елементарний склад казеїну в % : азоту – 15,65; вуглецю – 53,00; кисню – 22,60; водню – 7,10;
Елементарні склади казеїну та сироваткових білків значно різняться вмістом фосфору. За вмістом фосфору різняться між собою компоненти казеїну.
Казеїн - це яскраво виражений фосфопротеїд, а сироваткові білки або зовсім не містять фосфору, або його дуже мало.
Фосфор присутній у формі складних фосфорнокислих ефірів оксиамінокислот серину і треоніну. Тип зв'язку фосфору в казеїні відіграє певну роль в утворенні кальцій-фосфатних містків у казеїновому комплексі та між субміцелами казеїну:
СН 2 - О - Р = О - моноефірний зв'язок;
СН 2 - О - Р - О - СН 2 - - Діефірний зв'язок
СН 2 – О – Р – О – Р – О – СН 2 – - пірофосфатефірний зв'язок
У сироваткових білкахсірки більше, ніж у казеїнах. β-лактоглобулін містить SH-групи і може діяти як антиокислювач. Наявність сірки обумовлено присутністю в сироваткових білках сірковмісних амінокислот – метіоніну, цистину та цистеїну. Вони впливають зміни смаку молока при теплової обробці. Велику рольу визначенні властивостей білків, їх структури відіграє їхній амінокислотний склад.
Знання амінокислотного складу білків дозволяє встановити послідовність розташування амінокислот у молекулі білка та виявити його структуру. За кількістю та видами амінокислот можна судити про наявність функціональних груп, тобто про їх можливі реакції, а від вмісту незамінних амінокислот залежить живильна та біологічна цінністьбілків.
Білки молока містять майже всі амінокислоти, які зазвичай зустрічаються в білках: аліфатичні, оксиамінокислоти, дикарбонові, діамінокислоти, ароматичні, сірковмісні. Основні білки молока, порівняно з іншими глобулярними білками харчових продуктівмістять порівняно багато лейцину, ізолейцину, лізину, глутамінової кислоти. За вмістом та співвідношенням незамінних амінокислот білки молока відносяться до біологічно повноцінних білків.
Порівняння амінокислотного складу основних білків молока дозволяє зробити наступні висновки:
Сироваткові білки містять більше незамінних амінокислот (ізойлецину, лейцину, лізину, метіоніну, фенілаланіну, триптофану, треоніну, валіну), ніж казеїни;
Казеїни характеризуються більш високим змістомдикарбонових амінокислот – глутамінової та аспарагінової;
Фізико-хімічні властивості білків
Казеїн як казеїнаткальційфасфатний комплекс.Важливим фізико-хімічним властивостями казеїну є те, що в молоці казеїн міститься у вигляді казеїнатів кальцію, з'єднаних із колоїдним фосфатом кальцію.
Іони кальцію можуть приєднуватися до карбоксильних груп казеїну:
R – COOH + Ca 2+ → R – COOCa +
2R – COOH + Ca 2+ → Ca
Але, мабуть, насамперед вони взаємодіють із залишками фосфорної кислоти казеїну. При цьому кальцій може з'єднуватися з однією або двома ОН-групами кислоти:
R - CH 2 - O - P = O + Ca 2+ → R - CH 2 - O - P = O
Казеїн Казеїнат кальцію
R - CH 2 - O - P = O + Ca 2+ → R - CH 2 - O - P Са ВОН
Казеїн Казеїнат кальцію
У першому випадку кальцій має вільну валентність і може утворювати кальцієвий місток між серинфосфатними групами двох молекул казеїну:
R - CH 2 - O - P = O O = P - O - CН 2 - R
До серинфосфатних груп казеїнових молекул поряд з іонами кальцію може приєднуватися колоїдний фосфат кальцію молока у вигляді n або n (точний склад колоїдного фосфату кальцію не з'ясовано).
Ca – O – P – O – Ca
R - CH 2 - O - P = O O = P - O - CH 2 - R
Органич Неорган
Отже, казеїн у молоці міститься у вигляді складного комплексуказеїнату кальцію з колоїдним фосфатом кальцію, так званого казеїнаткальційфосфатного комплексу - ККФК.
До фізико-хімічних властивостей білків відносяться також електричні властивості та розчинність, оптичні властивості, денатурація.
Електричні властивості та розчинність . p align="justify"> При формуванні структури білків на поверхні їх частинок залишаються вільні функціональні групи, які у водній фазі дисоціюють і утворюють іони. Іонізовані групи та надають молекулам білка свої електричні властивості. Наприклад, карбоксильні та фосфатні групи віддають протони і переходять у форму аніонів:
R - COOH ↔ R - COO - + H +;
R - O - P = O ↔ R - O - P = O + 2H +;
Аміногрупи можуть приєднувати протони і перетворюються на форму катіонів: R – NH 2 + H + ↔ R – N + H 3 .
Цим пояснюється певний заряд нативних білків та його електроорієнтація (на поверхні нативних білків переважає негативний заряд, що зумовлює їх кислі властивості).
Від числа електричних зарядів та їх співвідношення на поверхні білкових частинок залежать важливі властивості білків:
Здатність до гідратації та розчинення, з утворенням колоїдних розчинів;
Здатність пересуватися в електричному полі;
Їх кислий чи основний характер;
Здатність до утворення солей.
Білки характеризуються високим ступенем гідратації за рахунок сил електростатичної взаємодії між їх полярними групами та дипольними силами молекул води. Гідрата оболонка, що утворилася навколо білкових частинок, перешкоджає агрегації молекул білка в нативному стані і коагуляції. Наявність її та міцність є одним із факторів стійкого колоїдного стану білків. Білки через наявність на поверхні великої кількостііонізованих груп відносяться до найактивніших водозв'язувальних компонентів багатьох біологічних систем. Чим більше зарядів несуть білки, тим більше більше водивони можуть приєднати і тим стабільнішими вони в розчині.
Здатність білків зв'язувати воду необхідно враховувати під час виробництва кисломолочних продуктів, сухих молочних продуктів, а також при виборі режимів вологості зберігання останніх.
Число зарядів та їх співвідношення на поверхні білкових частинок визначає їх розчинність, швидкість пересування в електричному полі та є основою електрофоретичного поділу білків та їх ідентифікації.
Кількість зарядів, а отже розчинність залежить від ряду факторів, в першу чергу, від рН водного середовища, В якій знаходиться частка білка. Іонізовані функціональні групи підпорядковуються закономірностям рівноважних реакцій та визначаються величиною К D (константою дисоціації):
![]()
З підвищенням концентрації водневих іонів серед дисоціація карбоксильних груп задля збереження рівноваги дещо сповільнюється. R - COOH ↔ R - COO - + H +. При дуже низькому рН карбоксильні групи присутні у недисоційованій формі. У лужній ділянці рН вони, навпаки, повністю дисоційовані.
При зниженні рН в молоці іони водню відповідно до умов рівноваги будуть зв'язуватися з іонізованими карбоксильними групами і кількість негативних зарядів на поверхні білкових частинок буде зменшуватися. Внаслідок втрати заряду (негативного) порушуватиметься і гідратна оболонка, а відтак погіршуватиметься розчинність білка. При досягненні величини рН, що дорівнює 4,6 (ізоелектрична точка білка), білок випадає в осад.
При подальшому підвищенні концентрації іонів водню в середовищі поверхні білкових частинок відбувається протонізація аміногруп, сумарний заряд знову підвищується, але переважним зарядом є вже позитивний заряд. За таких умов білок знову розчиняється. Зміни співвідношення зарядів лежить на поверхні білкової частки схематично представлені на рис. 5.6.
Таким чином, в ізоелектричній точці (рН 4,6) кількість зарядів на поверхні білкових частинок виявляється незначною і тому гідратація білка в таких умовах проявляється найбільш слабко і стабільність білка найнижча. В ізоелектричної точці білки мають різко виражену здатність до осадження, тобто величина рН обумовлює певний стан білків: у розчинній формі або в осаді.
Мал. 5.6. Зміни співвідношення зарядів на поверхні білкової частки при зниженні рН величини (схематично):
а – зниження рН до ізоелектричної точки;
б - зниження рН за межі ізоелектричної точки
Властивість білків змінювати розчинність при зниженні рН середовища до ізоелектричної точки становить суть кислотної коагуляції білків, покладеної в основу виробництва всіх кисломолочних продуктів: напоїв, сиру, сметани, окремих видівсирів.
У лужній ділянці рН карбоксильні групи повністю дисоціюють і білок знаходиться у розчиненому стані.
Другим фактором, що впливає на розчинність білків є концентрація солей кальцію та магнію в системі. При невисокій концентрації солей (рівень, що відповідає такому в молоці), розчинність білків хороша. Білки адсорбують іони кальцію та магнію на своїй поверхні, за рахунок чого підвищується їхній сумарний заряд і зміцнюються гідратні оболонки. Дуже високі концентрації солей мають протилежну дію. Іони кальцію та магнію конкурують з білковими частинками і внаслідок підвищеної щільності заряду забирають у них гідратну воду. Позбавлені гідратної оболонки білки утворюють агломерати та випадають в осад.
Розчинність білків змінюється (знижується) та під дією органічних розчинників (спирт, ацетон). У їх присутності знижується постійна діелетрична водного розчину, а від цього зменшується гідратація. Взаємодія між білком та спиртом тим сильніша, чим у більш нестійкій формі білок присутній у розчині. Цю властивість використовують для встановлення термостабільності молока по алкогольній пробі при виробленні стерилізованих молочних продуктів.
Оптичні властивостібілків.Оптичні властивості білкових розчинів використовують для швидкого визначення концентрації окремих білків або суміші білків:
поглинання ультрафіолетового спектру або абсорбція світла (спектрофотометричний метод);
Певна величина показника заломлення світла (рефрактометричний метод);
Оптична активність білків або здатність обертати площину поляризації (зміна питомого обертання площини поляризації відбувається при денатурації білка, вимірюючи ці зміни можна стежити за денатурацією білка).
Денатурація білка- це одна з найбільш істотних властивостей білків. Денатурація є наслідком незворотних змін.
Денатурація – це зміна структури білка проти його нативним станом. При зміні структури (розгортанні вторинної та третинної структури) вивільняються розташовані всередині сферичних змін функціональні групи. Розгортання структур відбувається внаслідок порушення водневих та гідрофобних зв'язків через відносно малу енергію цих зв'язків. Первинна структурапри цьому не змінюється, оскільки пептидні зв'язки зберігаються.
Денатурація може бути наслідком фізичних впливів: висока температура, тиск, високоенергетичне випромінювання (ультрафіолетове або іонізуюче), звукова енергія або хімічних впливів: органічний розчинник (спирт, ацетон), розчин сечовини, хімічні сполуки, що реагують з функціональними групами на поверхні білка.
При денатурації зв'язку, які раніше підтримують структуру, вивільняються і можуть по-новому орієнтуватися. У цьому активні функціональні групи, які спочатку розміщувалися всередині сферичних змін, можуть взаємодіяти коїться з іншими молекулами білка.
Сироваткові білки повністю денатурують при нагріванні до 90 про С (5 хв) або 76 про С (60 хв). Фракції сироваткових білків мають різну термостійкість, так β-лактоглобулін починає денатурувати при 70 о С, α-лактальбумін – 72, альбумін сироватки крові – 64, імуноглобуліни – 60 про С. .
Для основних сироваткових білків - β-лактоглобуліну та α-лактальбуміну характерна здатність частини денатурованих молекул відновлювати свою нативну структуру (після охолодження молока). Це називають ренатурацією. Особливо висока здатність до ренатурації у α-лактальбуміну. Оборотність денатурації його (при рН свіжого молока) становить близько 90%. Такий високий рівень ренатурації термічно денатурованого α-лактальбуміну пояснюють здатністю білка стабілізувати свою структуру за допомогою кальцію. На думку японських учених, ця фракція білка в нативному стані здатна пов'язувати іони кальцію, видалення якого при нагріванні супроводжується конформаційними змінами структури білка. Але при подальшому охолодженні кальцій знову приєднується до білка та сприяє відновленню його третинної структури.
Оборотність денатурації β-лактоглобуліну значно нижча. Після нагрівання до температури від 70 до 80 про лише невелика частина його молекул відновлює свою нативну структуру.
Внаслідок конформаційних змін у сироваткових білках після теплової обробки вони можуть утворювати комплекси один з одним (β-лактоглобулін – α-лактальбумін), які здатні взаємодіяти з χ-казеїном. Результатом такої взаємодії є збільшення зарядженої поверхні казеїнових міцел та посилення їх гідратаційних властивостей.
Порушення структури казеїну при пастеризації молока (до 100 о С) немає. Зміна структури та розпад казеїну можливий при нагріванні до 120 про С протягом 5 год. При гомогенізації відбувається розпад міцел казеїну на субміцели.
Денатурація білків не знижує їх харчової цінності, Навпаки, денатуровані білки легше перетравлюються, так як легше атакуються протеолитическими ферментами.
Явлення денатурації білків молока, викликані нагріванням, дією ферментів, умовами зберігання, створюють низку проблем практично молочної промисловості. При виробництві окремих продуктів(кисломолочні напої, сир, сири окремих видів), навпаки, свідомо викликають денатурацію білків (тепловими впливами). Денатурація білків часто супроводжується розпадом білків. Це комплексні зміни та їх не завжди можна чітко розділити.






