Переваривание белков в жкт. Переваривание белков в желудочно-кишечном тракте
ВВЕДЕНИЕ
Белковому обмену принадлежит особое место среди других видов обмена веществ. Это объясняется специфическими функциями белков (пластической, каталитической, иммунной), которые не могут выполнять ни углеводы, ни липиды.
В организме человека ежесуточно распадается до аминокислот (АМК) около 400 г белков и столько же синтезируется. Основным источником АМК для человека являются пищевые белки. Суточная норма потребления белков составляет около 100 г. Все 20 АМК, которые входят в состав белков организма, можно разделить на заменимые (синтезируемые самим организмом) и незаменимые (не синтезируются и должны поступать с пищей). Присутствие в пищевых белках всех незаменимых АМК определяет полноценность белкового питания человека.
Поскольку белки всех организмов отличаются строгой видовой и тканевой специфичностью, организм человека использует белки пищи только после их полного гидролиза до АМК в желудочно-кишечном тракте под действием ряда протеолитических ферментов - пептидаз. Все пептидазы в зависимости от места расположения гидролизуемой пептидной связи подразделяют на (1) эндопептидазы, гидролизующие пептидные связи, удаленные от концов пептидной цепи (пепсин, трипсин, химотрипсин, эластаза) и (2) экзопептидазы, гидролизующие пептидые связи, образованные N- и С-концевыми аминокислотами (аминопептидаза, карбоксипептидаза, дипептидаза).
Желудочные и панкреатические пептидазы вырабатываются в неактивной форме, секретируются в месте действия, где активируются путем частичного протеолиза. Такой механизм образования активных ферментов необходим для защиты секреторных клеток желудка и поджелудочной железы от самопереваривания.
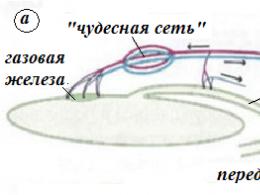
Переваривание белков в желудке происходит под действием пепсина. Профермент пепсиноген вырабатывается главными клетками желудочных желез и при поступлении пищи секретируется в полость желудка. Пепсиноген активируется двумя способами:
1) соляной кислотой (медленно);
2) аутокаталитически (быстро) уже имеющимся пепсином.
Желудочный сок содержит соляную кислоту, которая вырабатывается обкладочными клетками желудка и выполняет следующие функции:
1) оказывает бактерицидное действие;
2) денатурирует белки пищи;
3) создает оптимум рН для пепсина;
4) активирует пепсиноген путем частичного протеолиза. Переваривание белков в кишечнике происходит под действием:
1) ферментов поджелудочной железы (трипсина, химотрипсина, эластазы, карбоксипептидаз);
2) ферментов тонкой кишки (аминопептидаз, дипептидаз, трипептидаз).
Активная форма трипсина образуется в кишечнике при участии энтеропептидазы, которая отщепляет от N-конца трипсиногена гексапептид, что приводит к изменению конформации молекулы и формированию активного центра трипсина. Остальные протеазы панкреатического сока (химотрипсиноген, прокарбоксипептидаза, проэластаза) активируются трипсином.
Активация панкреатических пептидаз происходит по каскадному механизму. Кишечные пептидазы синтезируются в энтероцитах сразу в активной форме.
Конечным результатом переваривания белков является образование свободных АМК, поступающих в клетки слизистой оболочки кишечника путем активного транспорта. Большая часть образовавшихся свободных АМК используется для синтеза собственных белков организма; оставшиеся АМК используются для синтеза биологически активных молекул: гормонов, биогенных аминов, а также нуклеотидов, гема, креатинфосфата и многих других соединений, в том числе для синтеза глюкозы в процессе глюконеогенеза.
Важнейший путь превращений АМК в организме - это реакции трансаминирования с α-кетокислотами с образованием новых (за- менимых) АМК.
Еще один путь метаболизма АМК - декарбоксилирование с образованием биологически активных молекул - биогенных аминов. Основным коферментом обмена АМК является пиридоксальфосфат (ПФ).
Деградация АМК происходит путем их дезаминирования: безазотистые остатки могут использоваться для синтеза глюкозы (глюконеогенез) или, превращаясь в ацетил-КоА, окисляться до углекислого газа и воды с образованием энергии (различают гликогенные и кетогенные АМК).
В данном разделе приводится лабораторная работа по количественному анализу кислотности желудочного сока, позволяющая оценить содержание свободной, связанной, общей соляной кислоты, а также общей кислотности желудочного сока.
Процесс трансаминирования представлен двумя работами:
1) количественное определение аспартатаминотрансферазы (АсАТ) и аланинаминотрансферазы (АлАТ) в сыворотке крови, имеющее диагностическое значение при поражениях сердца и для диф- ференциальной диагностики болезней печени;
2) хроматографическое доказательство активности АлАТ. Ранней диагностике наследственного заболевания - фенилпиро-
виноградной олигофрении (фенилкетонурии) - посвящена работа по количественному определению фенилаланина в сыворотке крови.
Количественное определение конечных продуктов обмена белков представлено двумя лабораторными работами:
1) количественное определение мочевины в моче ферментативным (уреазным) методом;
2) колориметрический метод количественного определения креатинина в моче.
6.1. КОЛИЧЕСТВЕННЫЙ АНАЛИЗ ЖЕЛУДОЧНОГО СОКА. ОПРЕДЕЛЕНИЕ СВОБОДНОЙ, СВЯЗАННОЙ, ОБЩЕЙ СОЛЯНОЙ КИСЛОТЫ И ОБЩЕЙ КИСЛОТНОСТИ ЖЕЛУДОЧНОГО СОКА
Желудочный сок представляет собой бесцветную жидкость с сильнокислой реакцией (рН 1,5-2,0). За сутки у человека выделяется около 1,5 л желудочного сока; в его состав входят вода, неферментативные белки, ферменты (пепсин, гастриксин), муцин, фактор Касла, соляная кислота, гидрофосфаты и некоторые другие соединения.
Кислая реакция желудочного сока обусловлена присутствием соляной кислоты, гидрофосфатов, а при патологических процессах - молочной кислоты и жирных кислот. Совокупность всех веществ желудочного сока, способных быть донорами протонов, составляют общую кислотность. Соляную кислоту, связанную с белками и продуктами их переваривания, называют связанной соляной кислотой, а находящуюся в несвязанном виде - свободной соляной кислотой. Содержание последней подвержено значительным колебаниям, тогда как количество связанной соляной кислоты достаточно постоянно.
В характере секреции желудочного сока различают следующие патологические изменения: 1) гиперхлоргидрию - увеличение содержания свободной соляной кислоты и общей кислотности. Такое состояние преимущественно наблюдается при язвенной болезни желудка; 2) гипохлоргидрию - уменьшение количества свободной соляной кислоты и общей кислотности; 3) ахлоргидрию - полное отсутствие соляной кислоты, общая кислотность при этом значительно снижена; 4) ахилию - отсутствие секреции желудочного сока.
Уменьшение или отсутствие соляной кислоты в желудке может наблюдаться при хроническом гастрите, раке желудка, злокачествен- ном малокровии.
В клинике используют рН-метрию желудочного сока, однако полезную информацию можно получить простым, изящным способом, предложенным ниже.
Цель работы
Последовательно оттитровать один из трех образцов желудочного сока раствором NaOH в присутствии двух индикаторов и на основании расчетов сделать вывод о кислотности желудочного сока: нормальная, повышенная или пониженная. Сравнить с другими образцами и отметить характер изменения общей кислотности, а также общей, свободной и связанной соляной кислоты.
Принцип метода
Пользуясь различными индикаторами (диметиламиноазобензол и фенолфталеин), в одной и той же пробе желудочного сока определяют как общую кислотность, так и содержание общей, свободной и связанной соляной кислоты.
Общую кислотность желудочного сока выражают количеством миллилитров 0,1 М раствора NaOH, пошедших на титрование 100 мл желудочного сока в присутствии индикатора фенолфталеина (интервал перехода окраски pH 8,2-10). В норме общая кислотность составляет 40-60 титрационных единиц (ед.).
Свободную соляную кислоту выражают количеством миллилитров 0,1 М раствора NaOH, пошедших на титрование 100 мл желудочного сока в присутствии индикатора диметиламиноазобензола (интервал перехода окраски рН 1,0-3,0). В норме содержание свободной соляной кислоты составляет 20-40 ед.
Общая соляная кислота - это сумма свободной и связанной с белками соляной кислоты (последнюю находят по разности между общей и свободной соляной кислотой).
Выполнение работы
В колбу для титрования вносят из бюретки 5 мл исследуемого желудочного сока. Добавляют 1 каплю раствора диметиламиноа- зобензола и 2 капли раствора фенолфталеина. Появляется розовомалиновое окрашивание. Пробу титруют 0,1 М раствором NaOH до оранжевого окрашивания и отмечают количество миллилитров щелочи, пошедших на титрование свободной соляной кислоты (I пункт титрования).
Далее титрование продолжают до появления лимонно-желтой окраски и отмечают общее количество миллилитров NaOH, пошедших на титрование от начала общего титрования (II пункт титрования). Затем титрование продолжают до появления малинового окрашивания и отмечают количество миллилитров щелочи, пошедших на титрование вновь от начала общего титрования (III пункт титрования).
Расчеты
Допустим, что на титрование 5 мл желудочного сока до пункта I пошло от 0 до 1,5 мл 0,1 М раствора NaOH, до пункта II - от 0 до 2 мл и до пункта III - от 0 до 3 мл. Тогда общая кислотность составит 3 ? 100/5 = 60 ед., количество свободной соляной кислоты - 1,5*100/5 = 30 ед., количество общей соляной кислоты (среднее арифметическое между пунктами титрования II и III) - (2+3)/2? 100/5 = 50 ед., а количество связанной соляной кислоты находят по разнице между содержанием общей и свободной соляной кислоты: 50 - 30 = 20 ед.
Данные титрования и расчета вносят в таблицу (см. ниже).
Тестовые задания по теме «Превращение белков и дезаминирование аминокислот»
1. Протеиназы, амилазы и липазы относят к классу гидролаз.
2. Таурин является продуктом превращения цистеина.
3. Скатол и индол образуются в кишечнике из аминокислоты тирозина.
4. Соляная кислота в желудке способствует активации пепсиногена.
5. При дезаминировании аминокислот в организме образуются биогенные амины.
6. Пепсин относят к эндопептидазам.
7. В качестве кофермента глутаматдегидрогеназы НАД+ можно заменить на ФАД.
8. У человека происходит неокислительное дезаминирование цистеина.
9. Трипсин участвует в активации химотрипсиногена.
10. Возможно самопереваривание пепсина в желудке.
11. Карбокси- и аминопептидазы относят к эндопептидазам.
12. Уридиндифосфоглюкуроновая кислота участвует в обезвреживании индола.
Коферментом дезаминирования Заменимой аминокислотой
аминокислот не может быть для человека является
1) НАД+ 1) фенилаланин
2) ФАД 2) тирозин
3) ФМН 3) триптофан
4) ТПФ 4) треонин
5) ПФ 5) метионин
3. Установите соответствие между проферментом и соответствующим катализатором.
6.2. КОЛИЧЕСТВЕННОЕ ОПРЕДЕЛЕНИЕ АСПАРТАТАМИНОТРАНСФЕРАЗЫ И АЛАНИНАМИНОТРАНСФЕРАЗЫ
В СЫВОРОТКЕ КРОВИ
Аспартатаминотрансфераза (АсАТ, КФ: 2.6.1.1) и аланинаминотрансфераза (АлАТ, КФ: 2.6.1.2) - пиридоксальфосфатсодержащие ферменты.
АсАТ катализирует обратимый перенос аминогруппы от аспартата на α-кетоглутарат с образованием глутамата и оксалоацетата.
АлАТ катализирует обратимую реакцию переноса аминогруппы от аланина на α-кетоглутарат с образованием глутамата и пирувата (ПВК).
АлАТ содержится в цитозоле, тогда как для АсАТ известны две формы: цитоплазматическая и митохондриальная.
При поражении тканей аминотрансферазы «вымываются» из поврежденных клеток в кровоток, поэтому определение активности аминотрансфераз в сыворотке крови имеет важное значение, особенно для диагностики поражений сердца и дифференциальной диагностики болезней печени. Так, при неосложненном инфаркте миокарда уровень АсАТ в сыворотке крови начинает повышаться уже через 4-6 ч после наступления инфаркта, максимум активности приходится на вторые сутки и лишь на 5-8-й день активность фермента снижается до нормы. Изменение активности сывороточной АлАТ при этом незначительно.
При инфекционном гепатите (болезни Боткина) и обострении хронического гепатита активности обеих аминотрансфераз в сыворотке
крови повышаются (активность АлАТ повышается сильнее). Цирроз печени не сопровождается значительной гиперферментемией.
Цель работы
Определить активности обеих аминотрансфераз в сыворотке крови колориметрическим методом и сравнить полученные результаты с нормой.
Принцип метода
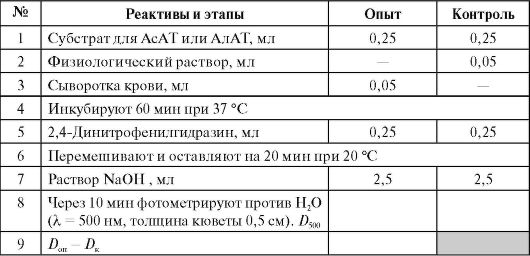
Определение активности обеих аминотрансфераз основано на колориметрическом обнаружении пирувата, образующегося за 1 ч инкубации, по цветной реакции с 2,4-динитрофенилгидразином в щелочной среде (см. работу 4.3Б). В случае АлАТ пируват образуется непосредственно из аланина, а в случае АсАТ пируват образуется из оксалоацетата после декарбоксилирования последнего в щелочной среде:
Активность обоих ферментов определяют по калибровочному графику.
Выполнение работы* (см. Приложение 9.2)
* Одна половина студенческой группы определяет активность АлАТ, другая - активность АсАТ, затем группы обмениваются результатами.
Расчеты
Расчет активности производят в мккат/л по калибровочному графику (данные для его построения приведены в таблице).

Норма: АлАТ = 0,05-0,12 мккат/л; АсАТ = 0,06-0,14 мккат/л. Верхний предел - 0,42 мккат/л.
Самостоятельное формулирование выводов
Тестовые задания по теме
«Переваривание белков и обмен аминокислот»
1. Определите, верно ли утверждение.
1. Тирозин является незаменимой аминокислотой для человека.
2. В окислительном дезаминировании аминокислот могут участвовать разные коферменты.
3. Реакции трансаминирования аминокислот необратимы.
4. В процессах трансдезаминирования и трансреаминирования аминокислот участвует α-кетоглутаровая кислота.
5. Коферентом аминотрансфераз служит ФАД.
6. В процессе трансаминирования выделяется аммиак.
7. В организме человека возможно превращение пировиноградной кислоты в аланин.
8. Фенилаланин является предшественником серотонина.
9. Для диагностики инфаркта миокарда используют определение активности аспартатаминотрансферазы в сыворотке крови человека.
10. Витамин В 1 нужен для реакций трансаминирования.
11. Глюконеогенез усиливается при сахарном диабете.
12. Лизин и треонин участвуют в реакциях трансаминирования.
2. Выберите правильный ответ.
Метаболит ЦТК, участвующий в Гликогенной аминокислотой
реакциях трансаминирования, - это не является 1) цитрат 1) аргинин
2) изоцитрат 2) глутамин
3) сукцинат 3) гистидин
4) фумарат 4) лейцин
5) оксалоацетат 5) метионин
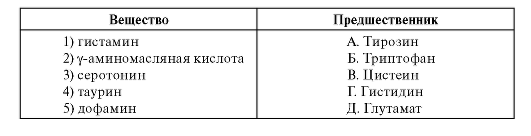
3. Установите соответствие между веществом и его предшественником.
6.3. ОБНАРУЖЕНИЕ АКТИВНОСТИ АЛАНИНАМИНОТРАНСФЕРАЗЫ МЕТОДОМ БУМАЖНОЙ ХРОМАТОГРАФИИ
Аланинаминотрансфераза (АлАТ), как и другие аминотрансферазы, участвует во взаимном превращении α-аминокислот и α-кетокислот в цитозоле клетки:
Аланин + α-Кетоглутарат ↔ Пируват + Глутамат.
Поэтому активность АлАТ можно определить качественно по появлению в реакционной смеси новой аминокислоты, образовавшейся в результате переноса аминогруппы от аланина или глутамата на α-кетоглутарат или пируват соответственно (в зависимости от того, в каком направлении проводится реакция).
Цель работы
Методом бумажной хроматографии показать наличие активности АлАТ и определить, какая аминокислота (аланин или глутамат) присутствовала в исходной субстратной смеси, т. е. в каком направлении проводилась ферментативная реакция.
Принцип метода
Поскольку в результате ферментативной реакции образуется новая аминокислота, осуществляют идентификацию исходной и обра- зующейся под действием АлАТ аминокислоты методом радиальной
бумажной хроматографии (см. работу 1.4Б «Бумажная хроматография аминокислот»). Идентификацию проводят после окраски нингидрином по сравнению величин R f исследуемых АМК со стандартными, которые разделяют одновременно в тех же условиях. Для решения задачи необходимо провести три независимых хроматографических разделения: 1) субстратной смеси (одна аминокислота); 2) субстратной смеси + АлАТ (образуется вторая аминокислота); 3) стандартного раствора «свидетелей» аланина и глутамата для идентификации.
Выполнение работы
Берут три диска хроматографической бумаги диаметром 12 см. Простым карандашом сверху обозначают фамилию студента и номер диска. В центре каждого диска обводят круг диаметром 0,3- 0,4 см. Микропипеткой в центр дисков наносят реактивы, как указано в таблице.
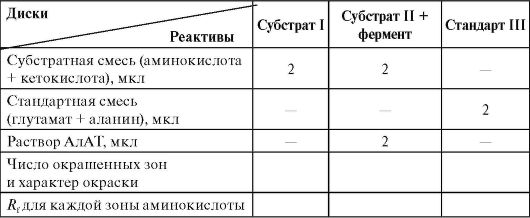
Через 10 мин после нанесения последнего реагента (время инкубации) все три диска подсушивают на воздухе. На каждом диске от края к центру делают ножницами два параллельных разреза (ширина раз- реза равна диаметру кружочка в центре диска). Вырезанную полоску отгибают перпендикулярно диску так, чтобы линия сгиба проходила через середину зоны нанесения растворов. «Ножку» укорачивают до 2-3 см и помещают диск между нижней и верхней половинками чашки Петри, содержащей смесь бутанол + уксусная кислота + Н 2 О в соотношении 5:1:4. Проводят хроматографическое разделение под тягой приблизительно в течение 1 ч. Диски извлекают из хроматографической камеры и обводят фронт растворителя простым карандашом.
Высушивают* в сушильном шкафу при 100 ?С, смачивают раствором нингидрина* и снова высушивают*.
Рассчитывают величину R f для каждой окрашенной зоны и проводят идентификацию аминокислот. Делают вывод о том, какая аминокислота находилась в субстратной смеси. Затем вырезают сегменты из каждого диска и складывают их вместе рядом, совмещая центральные зоны нанесения вещества.
![]()
Самостоятельное формулирование выводов
6.4. ЭКСПРЕСС-МЕТОД ОПРЕДЕЛЕНИЯ ПОВЫШЕННОГО СОДЕРЖАНИЯ ФЕНИЛАЛАНИНА В ПЛАЗМЕ КРОВИ
Превращение незаменимой аминокислоты фенилаланина в заменимую - тирозин в организме человека осуществляется реакцией гидроксилирования, которую катализирует фермент фенилаланин- 4-монооксигеназа (косубстратом служит тетрагидробиоптерин).
Клинико-диагностическое значение
Врожденное отсутствие фенилаланин-4-монооксигеназы приводит к развитию тяжелого наследственного заболевания - фенилпировиноградной олигофрении (фенилкетонурии). При этом вследствие уменьшения потребления фенилаланина тканями его концентрация в плазме крови резко возрастает (в норме содержание 0,1 ммоль/л, что соответствует 0,015 г/л). Одновременно, в результате усиления
* Операции, отмеченные звездочкой, выполняются под тягой лаборантами.
реакции трансаминирования фенилаланина, в тканях повышается концентрация фенилпирувата - конкурентного ингибитора фермен- тов, участвующих в метаболизме пирувата. У ребенка наблюдается замедление умственного развития и развивается фенилпировиноградная олигофрения. В связи с этим чрезвычайно важно провести как можно более раннюю диагностику данной патологии (на 1-3-й день рождения ребенка) и ввести строгую диету, исключающую фенилаланин из питания. Для раннего выявления отсутствия фенилаланин- 4-монооксигеназы проводят определение повышенного содержания фенилаланина в плазме крови, которое довольно просто осуществить методом бумажной хроматографии.
Цель работы
Оценить методом бумажной хроматографии содержание фенилаланина в плазме крови обследуемого ребенка по сравнению с его содержанием у заведомо здорового ребенка.
Принцип метода
Хроматографическое разделение образцов плазмы крови обследуемого ребенка и заведомо здорового в сравнении со стандартом, содержащим предельно допустимое количество фенилаланина (полуколичественное определение).
Выполнение работы
Берут три диска хроматографической бумаги диаметром 12 см. На диск I наносят 2 мкл плазмы крови обследуемого ребенка, на диск II - 2 мкл плазмы крови заведомо здорового ребенка (концентрация фенилаланина 0,015 г/л). На диск III наносят 2 мкл стандартного раствора фенилаланина (концентрация 0,06 г/л) и 2 мкл плазмы крови здорового ребенка. Общая кон- центрация фенилаланина 0,075 г/л.
Нанесение растворов на хроматографические диски, проведение хроматографии и проявление хроматограмм осуществляют так же, как в предыдущей работе.
Сравнивают полученные хроматограммы по интенсивности окраски фенилаланина на всех трех дисках и делают вывод о содержании фенилаланина в плазме крови обследуемого ребенка.
Самостоятельное формулирование выводов
Тестовые задания по теме «Обмен аминокислот»
I. Определите, верно ли утверждение.
1. Гистидин в печени способен дезаминироваться по внутримолекулярному типу.
2. Восстановленные коферменты оксидаз аминокислот могут непосредственно окисляться молекулярным кислородом.
3. Дезаминирование глутаминовой кислоты сопровождается промежуточным образованием иминокислоты.
4. Коферментом моноаминоксидаз (МАО) служит ФАД.
6. Аммиак образуется при любом типе дезаминирования аминокислот.
7. Гистамин обладает сосудосуживающим действием.
8. Дофамин является предшественником норадреналина.
9. В организме человека возможно декарбоксилирование 5-окситрип- тофана.
10. Все природные аминокислоты могут «сгорать» в ЦТК.
II. В организме человека из аланина может образоваться глюкоза. 12. Лейцин относят к кетогенным аминокислотам.
2. Выберите правильный ответ.
Коферментом большинства Декарбоксилирование
декарбоксилаз аминокислот аминокислот приводит
является к образованию
1) ФАД 1) спирта
2) ФМН 2) альдегида
3) ПФ 3) амина
4) ТПФ 4) амида
5) НАДФ+ 5) кетона
3. Установите соответствие между ферментом, участвующего в обмене АМК, и его коферментом.

6.5. КОЛИЧЕСТВЕННОЕ ОПРЕДЕЛЕНИЕ МОЧЕВИНЫ В МОЧЕ ФЕРМЕНТАТИВНЫМ УРЕАЗНЫМ/ФЕНОЛ-ГИПОХЛОРИТНЫМ МЕТОДОМ
Мочевина - основной конечный продукт обмена белков в организме человека. На долю мочевины приходится 80-90% выделяемого с мочой азота.
Биологическая роль синтеза мочевины в печени (орнитиновый цикл мочевинообразования) заключается в связывании образующегося при дезаминировании аминокислот аммиака в относительно малотоксичную молекулу мочевины, которая затем экскретируется с мочой.
Зная количество экскретируемой за сутки мочевины и количество азота, поступающего с пищей, можно вычислить азотистый баланс, который является важным показателем состояния белкового и аминокислотного обмена. Азотистый баланс может быть:
1) положительным - у детей, у выздоравливающих после тяжелой болезни;
2) отрицательным - при тяжелых заболеваниях, в том числе онкологических, при голодании и в старческом возрасте;
3) равным нулю (азотистое равновесие) - у здоровых взрослых людей (при нормальном питании).
Всякое повышение белкового обмена, процессы интенсивного распада белка (опухоли, гипертиреоз, диабет) сопровождаются усилением мочевинообразования и увеличением количества мочевины, выделяемой с мочой за стуки. Патологические изменения печени, приводящие к ее функциональной недостаточности, а следовательно, нарушению синтеза мочевины, сопровождаются снижением количества мочевины в крови и моче. Функциональная недостаточность почек ведет к понижению количества мочевины в моче и одновременному повышению ее содержания в крови (уремия). Некоторые формы диабета, характеризующиеся повышенным аппетитом и прогрессирующим исхуданием больного, сопровождаются повышением выделения мочевины с мочой за счет усиленного распада белков.
Цель работы
Определить содержание мочевины в суточной моче и сравнить полученный результат с нормой.
Принцип метода
Данный метод - ферментативный, он основан на реакции расщепления молекулы мочевины под действием высокоспецифического фермента (уреазы) до аммиака и углекислого газа, которые в водном растворе образуют карбонат аммония:
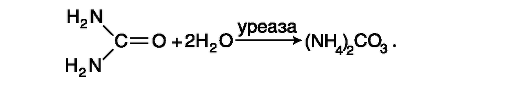
Ионы аммония в присутствии нитропруссида натрия реагируют с фенолом и гипохлоритом натрия. В результате реакции образуется индофенол (синего цвета), интенсивность окрашивания которого пропорциональна концентрации ионов аммония (и соответственно мочевины).
Выполнение работы (см. Приложение 9.2)
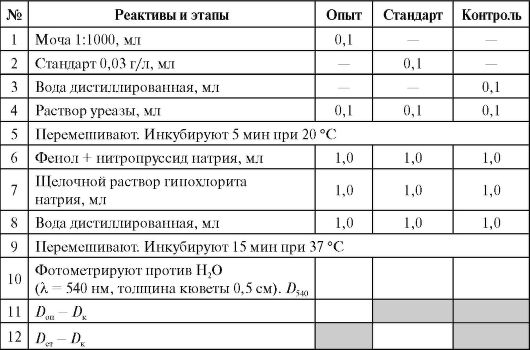
Для исследования берут следующие пробы (три маркированные пробирки): опыт (разведенная моча), стандарт (стандартный раствор мочевины 0,03 г/л) и контроль (вода). Все реактивы вносят согласно описанию в таблице.
На студенческую группу ставят два контроля и два стандарта. Остальные студенты делают опытные пробы.
Расчеты
Массу мочевины рассчитывают по стандарту мочевины*:

Самостоятельное формулирование выводов.
Тестовые задания по теме «Пути обезвреживания аммиака в организме человека и животных»
1. Определите, верно ли утверждение.
1. Глутаминсинтетазу относят к лигазам.
2. Выведение мочевины с мочой в количестве 20-35 мг/сут является нормой.
3. Образование карбамоилфосфата в синтезе мочевины требует затраты двух молекул АТФ.
4. Креатин в норме выводится с мочой.
5. Аргиназа катализирует образование оксида азота(11).
6. Аминогруппа аспартата служит одним из источников азота в молекуле мочевины.
7. Аминокислоты - единственный источник аммиака в организме.
8. Азот амидной группы глутамина может включаться в молекулу мочевины.
9. В глутаминсинтетазной реакции расходуется АТФ. * Считая суточное количество мочи равным 1,5 л.
10. Для человека выделение 1 г креатинина за сутки является нормой.
11. Метионин участвует в синтезе креатина.
12. Ион аммония выводится с мочой.
2. Выберите правильный ответ.
Аммиак в клетках мозга Цикл мочевинообразования
обезвреживается путем происходит
1) синтеза мочевины 1) в почках
2) образования солей аммония 2) в печени
3) превращения глутамата в глутамин 3) в надпочечниках
4) синтеза креатина 4) в мочевом пузыре
5) всеми перечисленными способами 5) в поджелудочной железе
3. Установите соответствие между Х и Y в реакции:

6.6. КОЛИЧЕСТВЕННОЕ ОПРЕДЕЛЕНИЕ
КРЕАТИНИНА В МОЧЕ
Креатинин является одним из конечных продуктов азотистого обмена (5% от общего азота мочи). Он образуется в мышечной ткани из креатинфосфата:
Креатинфосфат → Креатинин + Ф н.
В свою очередь, креатинфосфат синтезируется из креатина в реакции, катализируемой креатинкиназой (креатинфосфокиназой, КФК) с участием АТФ:
Креатин + АТФ ↔ Креатин~Ф + АДФ.
Эта реакция обратима, и образование АТФ в обратной реакции является экстренным механизмом обеспечения энергией мышечного сокращения.
В норме с мочой выделяется только креатинин. Появление креатина в моче (креатинурия) свидетельствует о заболеваниях печени, почек, сахарном диабете, эндокринных расстройствах (гипертиреоз, аддисонова болезнь, акромегалия и др.), инфекционных заболеваниях. Исключением является появление креатина в моче у подростков и беременных женщин.
Гиперкреатининурия с одновременной креатинурией имеет место при патологии поперечно-полосатых мышц: миозит, миастения, дистрофия. Гипокреатининурия наблюдается при хроническом нефрите, мышечной атрофии после перенесенных инфекций, в старческом возрасте.
Цель работы
Определить содержание креатинина в суточной моче и сравнить полученный результат с нормой.
Принцип метода
Метод количественного определения креатинина в моче (по Фолину) основан на цветной реакции с пикриновой кислотой. Интенсивность оранжевой окраски пикрата креатинина, измеряемой на фотоэлектроколориметре с зеленым светофильтром (540 нм), прямо пропорциональна концентрации креатинина, которую определяют по калибровочному графику.
Выполнение работы
В 2 мерные колбы на 50 мл помещают реактивы, как указано в таблице

Для построения калибровочного графика используют стандартный раствор дихромата калия (K 2 Cr 2 O 7).
Опытным путем найдено, что оптическая плотность 0,17 М раствора K 2 Cr 2 O 7 соответствует оптической плотности продукта, образующегося в результате реакции взаимодействия креатинина (концентрация 2 мг/мл) с пикриновой кислотой в щелочной среде. Поэтому калибровочную кривую легко можно построить, используя дешевый и легкодоступный дихромат калия.
Из исходного раствора 0,17 М дихромата калия готовят ряд разведений: в 4 мерные пробирки отбирают соответственно 1, 2, 3 и 5 мл исходного раствора и все пробы доводят водой до конечного объема 5 мл. Определяют оптическую плотность полученных растворов при 540 нм в кювете толщиной 1 см против воды. Из полученных значений оптической плотности калибровочных раст- воров вычитают Д к, определенную в работе ранее, и на основании полученных результатов строят график зависимости оптической плотности от концентрации креатинина. Для этого на оси абсцисс откладывают количество миллилитров дихромата калия, соответствующее концентрации креатинина (0,4; 0,8; 1,2 и 2 мг/мл соответственно), на оси ординат - величину оптической плотности (D 540 - Д к). Полученную в работе величину (Д оп - Д к) откладывают на графике и находят концентрацию креатинина в моче (С, мг/мл). Затем рассчитывают массу креатинина в суточной моче:
Норма: мужчины: 1-2 г/сут (8,8-17,6 ммоль/сут);
женщины: 0,6- 1,5 г/сут (5,3-13,2 ммоль/сут).
Самостоятельное формулирование выводов Тестовые задания по теме
«Особенности обмена отдельных аминокислот»
1. Определите, верно ли утверждение.
1. Глицин участвует в синтезе пуриновых оснований.
2. В состав КоА входит β-аланин.
3. Азот гуанидиновой группы аргинина служит источником образования оксида азота.
4. Монооксигеназы участвуют в образовании катехоламинов.
5. Триптофан может служить предшественником образования рибонуклеотида никотиновой кислоты (витамина РР).
6. Серотонин образуется из серина.
7. Глутаминовая кислота входит в состав глутатиона.
8. Гомогентизиновая кислота является промежуточным продуктом превращения фенилаланина.
9. Возможно превращение гистидина в глутаминовую кислоту.
10. Креатинфосфат является макроэргическим соединением.
11. Цистеин подвергается процессу декарбоксилирования.
12. Возможны превращения глицина в серин и треонин.
2. Выберите правильный ответ.
Молекула глицина не участвует Соединение, которое
в синтезе не образуется из тирозина, - это
1) гема 1) гомогентизиновая
2) пуриновых оснований кислота
3) пиримидиновых оснований 2) адреналин
4) парных желчных кислот 3) норадреналин
5) креатина 4) дофамин
5) фенилаланин
3. Установите соответствие между Х и Yв реакции

Тестовые задания по теме
«Регуляция и патология аминокислотного обмена»
1. Определите, верно ли утверждение.
1. Фенилкетонурия возникает в результате врожденного нарушения синтеза фенилаланин-4-монооксигеназы.
2. Моча с запахом кленового сиропа появляется при нарушении обмена разветвленных аминокислот.
3. Квашиоркор наблюдается у детей при недостатке в пище белков.
4. Алкаптонурия - врожденный дефект обмена триптофана.
5. Фенилкетонурию можно выявить по повышенному содержанию фенилаланина в сыворотке крови.
6. Квашиоркор сопровождается снижением сопротивляемости организма инфекциям.
7. Повышение концентрации аминокислот в крови сопровождается ацидемией.
8. При фенилкетонурии исключение из пищи тирозина приводит к положительному эффекту.
9. Ингибиторы моноаминоксидаз используют при лечении депрессивных состояний.
10. Болезнь Хартнупа связана с нарушением всасывания триптофана.
11. Недостаток витамина В 6 вызывает нарушение обмена отдельных аминокислот.
12. Недостаток метионина может привести к жировому перерождению печени.
2. Выберите правильный ответ.
Фенилпировиноградная олигофрения Альбинизм связан
развивается в результате врожденного с нарушением обмена
отсутствия фермента класса 1) метионина
1) оксидоредуктаз 2) серина
2) трансфераз 3) цистеина
3) гидролаз 4) тирозина
4) лиаз 5) триптофана
5) изомераз
3. Установите соответствие между патологией и АМК, нарушение обмена или всасывания которой в кишечнике имеет место при данной патологии.

6.7. КОЛЛОКВИУМ ПО ТЕМЕ «ПЕРЕВАРИВАНИЕ БЕЛКОВ И ОБМЕН АМИНОКИСЛОТ»
Вопросы для самостоятельной подготовки
1. Понятие о биологической ценности белков. Роль белков в питании. Заменимые и незаменимые аминокислоты.
2. Общие пути превращения аминокислот в тканях.
3. Дезаминирование аминокислот. Механизмы окислительного дезаминирования.
4. Пути превращения безазотистого остатка аминокислот. Гликогенные и кетогенные аминокислоты.
5. Трансаминирование аминокислот. Ферменты и коферменты трансаминирования. Трансдезаминирование и трансреаминирование. Диагностическое значение определения аминотрансфераз в сыворотке крови.
6. Реакции гидроксилирования и декарбоксилирования ароматических аминокислот.
7. Декарбоксилирование аминокислот. Образование биогенных аминов и их биологическая роль. Распад биогенных аминов. Моноаминоксидазы.
8. Пути образования аммиака в организме. Биосинтез мочевины.
9. Образование ядовитых продуктов гниения белков в кишечнике и механизм их обезвреживания в печени.
10. Особенности обмена глицина и серина.
11. Особенности обмена серосодержащих аминокислот.
12. Особенности обмена аргинина.
13. Особенности обмена дикарбоновых аминокислот.
14. Особенности обмена фенилаланина и тирозина. Фенилпировиноградная олигофрения. Алкаптонурия. Экспресс-метод определения повышенного содержания фенилаланина в сыворотке крови.
15. Синтез креатина. Креатинфосфат. Количественное определение креатинина в моче.
16. Связь обмена белков, жиров и углеводов.
Варианты письменной части коллоквиума
1. Укажите механизм активации
1) пепсиногена
2) трипсиногена
3) химотрипсиногена
4) проэластазы
2. Напишите реакции обезвреживания в печени
1) фенолов
2) индола
3) бензойной кислоты
4) аммиака
3. Рассмотрите механизм реакций и участие коферментов в процессах
1) гидроксилирования
2) трансдезаминирования
3) трансреаминирования
4) метилирования
4. Наиболее полно укажите фармакологические эффекты
1) дофамина
2) гистамина
3) серотонина
4) норадреналина
5. Разберите случаи нарушения обмена
1) триптофана
2) тирозина
3) серосодержащих аминокислот
4) аминокислот с разветвленной цепью
6. Укажите, в биосинтезе каких соединений участвует
1) метионин
2) аргинин
3) глутамин
4) глицин
Варианты заданий компьютерного тестирования
1. В обезвреживании аммиака участвуют аминокислоты
1) гистидин
2) аспарагиновая кислота
3) аланин
4) глутаминовая кислота
5) триптофан
2. Кофермент глутаматдегидрогеназы в реакции образования α- кетоглутаровой кислоты
1) НАД+
2) ПФ
3) ФАД
4) ФМН
5) КоQ(убихинон)
3. Больным со стойким увеличением содержания аммиака в крови может помочь прием аминокислоты
1) гистидина
2) аспарагина
3) глутамина
4) глутаминовой кислоты
5) лизина
4. Врожденный дефект синтеза фермента гомогентизинат-1,2-диок- сигеназы вызывает
1) фенилкетонурию
2) болезнь Паркинсона
3) алкаптонурию
4) альбинизм
5) гомоцистинурию
5. В синтезе креатина участвуют
1) аргинин
2) лейцин
3) метионин
4) серин
5) глицин
6. Суточное выделение креатинина с мочой составляет
1) 0,1-0,2 г/сут
2) 1,0-2,0 г/сут
3) 10-20 г/сут
4) 1,0-2,0 мг/сут
5) 10-20 мг/сут
7. Процесс трансаминирования аминокислот
1) обеспечивает синтез биогенных аминов
2) происходит при участии пиридоксальфосфата
3) обеспечивает образование заменимых аминокислот
4) сопровождается образованием аммиака
5) приводит к увеличению общего количества аминокислот
8. В орнитиновом цикле участвуют
1) цитруллин
2) лизин
3) аланин
4) аргинин
5) аспарагин
9. К смешанным (гликогенным и кетогенным) аминокислотам относят
1) триптофан
2) тирозин
3) фенилаланин
4) серин
5) лейцин
10. ТГФК участвует в синтезе
1) серина из глицина
2) цистеина из метионина
3) тирозина из фенилаланина
4) глутаминовой кислоты из гистидина
5) глутамина из глутамата
11. Процессу трансаминирования не подвергаются
1) глутамин и аспарагин
2) лизин и треонин
3) изолейцин и аспартат
4) фенилаланин и тирозин
5) аланин и валин
12. Аммиак в клетках мозга обезвреживается путем
1) синтеза мочевины
2) образования солей аммония
3) превращения глутамата в глутамин
4) образования аланина
5) синтеза креатина
13. Кофермент большинства декарбоксилаз аминокислот - это
1) ФАД
2) ФМН
3) ПФ
4) ТПФ
5) биотин
14. Гистидазу относят к классу
1) оксидоредуктаз
2) трансфераз
3) гидролаз
4) лиаз
5) изомераз
15. Скатол и индол обезвреживаются в печени с помощью
1) глицина
2) глутамата
3) α-кетоглутарата
4) уридиндифосфоглюкуроновой кислоты
5) пролина
16. Пиридоксальфосфат (ПФ) - кофермент
1) аланинаминотрансферазы
2) амилазы
3) аспартатаминотрансферазы
4) моноаминоксидазы
5) глутаматдегидрогеназы
17. Метаболит ЦТК, участвующий в реакциях трансаминирования, - это
1) цитрат
2) α-кетоглутарат
3) сукцинат
4) фумарат
5) малат
18. γ-аминомасляная кислота образуется
1) из гистидина
2) из аспарагиновой кислоты
3) из глутаминовой кислоты
4) из глутамина
5) из аспарагина
19. Суточное выведение мочевины с мочой в норме составляет
1) 25-35 мг
2) 0,25-0,35 г
3) 2,5-3,5 г
4) 25-35 г
5) 250-350 г
20. Глицин может образоваться
1) из метионина
2) из лизина
3) из валина
4) из тирозина
5) из серина
21. Альбинизм связан с нарушением обмена
1) метионина
2) серина
3) цистеина
4) тирозина
5) триптофана
22. Оксид азота(11) NO образуется из азота
1) аргинина
2) цистеина
3) валина
4) гистидина
5) серина
23. Коферментом оксидаз L-аминокислот может быть
1) ФМН
2) ПФ
3) НАД +
4) НАДФ +
5) КоА
24. Активность аспартатаминотрансферазы в сыворотке крови резко повышается
1) при заболеваниях почек
2) при панкреатитах
3) при простатитах
4) при нефритах
5) при инфаркте миокарда
25. Соляная кислота в желудке
1) денатурирует белки
2) оказывает бактерицидное действие
3) активирует пепсиноген
4) создает оптимум рН для пепсина
5) ингибирует пепсиноген
26. Кофермент моноаминоксидазы (МАО) - это
1) НАД+
2) ФАД
3) НАДН(Н +)
4) ТПФ
5) ПФ
27. Квашиоркор наблюдается у детей при недостатке в пище
1) углеводов
2) липидов
3) белков
4) витаминов
5) минеральных веществ
28. Источником образования таурина является
1) метионин
2) цистеин
3) глицин
4) серин
5) треонин
29.
1) лейцин
2) аланин
3) серин
4) глутамин
5) лизин
30. При гнилостном распаде фенилаланина в кишечнике образуются
1) фенол
2) скатол
3) индол
4) крезол
5) лейцин
31. Алкаптонурия - врожденный дефект обмена
1) триптофана
2) гистидина
3) метионина
4) тирозина
5) глицина
32. Биосинтез мочевины происходит
1) в мозге
2) в мочевом пузыре
3) в поджелудочной железе
4) в надпочечниках
5) в печени
33. Суточная потребность в белках у человека составляет примерно
1) 100 г
2) 100 мг
3) 10 г
4) 1000 мг
5) 1000 г
34. Коферментами дезаминирования аминокислот могут быть
1) НАД+
2) ФАД
3) ФМН
4) ТПФ
5) КоА
35. В процессе восстановительного аминирования α-кетоглутаровой кислоты участвует
1) НАДФ +
2) НАДФН(Н +)
3) ФАДН 2
4) ФМНН 2
5) НАД+
36. Серотонин - продукт декарбоксилирования
1) гистидина
2) тирозина
3) пролина
4) фенилаланина
5) 5-окситриптофана
37. Строго кетогенная аминокислота - это
1) аланин
2) валин
3) триптофан
4) лейцин
5) метионин
38. Аргиназа участвует в синтезе
1) оксида азота(11)
2) креатина
3) мочевины
4) серина
5) белка
39. Монооксигеназы участвуют в образовании
1) тирозина
2) диоксифенилаланина
3) норадреналина
4) аспарагина
5) глутамина
40. Внутримолекулярному дезаминированию в организме человека подвергается
1) глицин
2) глутамин
3) гистидин
4) тирозин
5) триптофан
41. Соединения, образующиеся из тирозина, - это
1) γ-аминомасляная кислота
2) адреналин
3) норадреналин
4) дофамин
5) фенилаланин
42. Основной кофермент обмена аминокислот - это
1) КоА
2) ТПФ
3) НАД +
4) биоцитин
5) ПФ
43. Фенилпировиноградная олигофрения развивается в результате врожденного отсутствия фермента класса
1) лиаз
2) лигаз
3) гидролаз
4) изомераз
5) оксидоредуктаз
44. Из аминокислоты тирозина образуются
1) серотонин
2) диоксифенилаланин
3) дофамин
4) норадреналин
5) индол
45. Активация пепсиногена в пепсин осуществляется
1) трипсином
2) химотрипсином
3) пепсином
4) энтерокиназой
5) амилазой
46. Скатол и индол образуются при гнилостном распаде в кишечнике
1) тирозина
2) фенилаланина
3) триптофана
4) гистидина
5) пролина
47. Врожденный недостаток фермента фенилаланин-4-монооксиге- назы (фенилаланингидроксилазы) вызывает
1) фенилпировиноградную олигофрению
2) болезнь Паркинсона
3) алкаптонурию
4) альбинизм
5) гомоцистинурию
48. Фермент секрета поджелудочной железы, не проявляющий протеолитической активности, - это
1) трипсин
2) химотрипсин
3) амилаза
4) карбоксипептидаза
5) аминопептидаза
49. Диоксифенилэтиламин (дофамин) является
1) биогенным амином
2) предшественником синтеза норадреналина
3) сосудорасширяющим агентом
4) производным триптофана
5) предшественником γ-аминомасляной кислоты (ГАМК)
50. Биологическая ценность белка определяется
1) аминокислотным составом
2) наличием заряда
3) возможностью расщепления в желудочно-кишечном тракте
5) молекулярной массой
51. Ферменты, участвующие в цикле мочевинообразования, - это
1) аргиназа
2) креатинкиназа
3) карбамоилфосфатсинтетаза
4) уреаза
5) фумараза
52. В моче пациента обнаружено значительное количество гомогентизиновой кислоты. Возможная патология - это
1) альбинизм
2) болезнь Паркинсона
3) цистинурия
4) алкаптонурия
5) фенилкетонурия
53. Наиболее интенсивному дезаминированию в печени подвергается
1) сер
2) гис
3) цис
4) асп
5) глу
54. Общий метаболит процессов синтеза мочевины и ЦТК - это
1) сукцинил-КоА
2) сукцинат
3) аспартат
4) фумарат
5) малат
55. Гистидаза (гистидинаммиаклиаза) катализирует реакцию
2) окислительного дезаминирования
3) карбоксилирования
4) внутримолекулярного дезаминирования
5) метилирования
56. Метионин участвует в синтезе
1) адреналина
2) цистеина
3) мочевины
4) фосфатидилхолина
5) норадреналина
Правильные ответы
1. 2, 4
2. 1
3. 4
4. 3
5. 1, 3, 5
6. 2
7. 2, 3
8. 1, 4
9. 1, 2, 3
10. 1
11. 2
12. 3
13. 3
14. 4
15. 4
16. 1, 3
17. 2
18. 3
19. 4
20. 5
21. 4
22. 1
23. 1
24. 5
25. 1, 2, 3, 4
26. 2
27. 3
28. 2
29. 1
30. 1, 4
31. 4
32. 5
33. 1
34. 1, 2, 3
35. 2
36. 5
37. 4
38. 3
39. 1, 2, 3
40. 3
41. 2, 3, 4
42. 5
43. 5
44. 2, 3, 4
45. 3
46. 3
47. 1
48. 3
49. 1, 2
50. 1, 3, 4
51. 1, 3
52. 4
53. 5
54. 4
55. 4
56. 1, 2, 4
Питание является сложным процессом, в результате которого поступают, перевариваются и всасываются необходимые организму вещества. Последние десять лет активно развивается специальная наука, посвященная питанию — нутрициология. В данной статье мы рассмотрим процесс пищеварения в организме человека, сколько по времени он длится и как обходится без желчного пузыря.
Строение пищеварительной системы
Пищеварительная система представлена совокупностью органов, которые обеспечивают усвояемость питательных веществ организмом, являющихся для него источником энергии, необходимой при обновлении клеток и для роста.
Пищеварительная система состоит из: полости рта, глотки, тонкой, толстой и прямой кишки.
Пищеварение в ротовой полости человека
Процесс пищеварения в полости рта заключается в измельчении пищи. В данном процессе происходит энергичная обработка пищи слюной, взаимодействие между микроорганизмами и ферментами. После обработки слюной часть веществ растворяется и проявляется их вкус. Физиологический процесс пищеварения в полости рта заключается в расщеплении крахмала до сахаров ферментом амилаза, содержащимся в слюне.
Проследим действие амилазы на примере: во время минутного жевания хлеба можно ощутить сладкий вкус. Расщепление белков и жиров во рту не происходит. В среднем, процесс пищеварения в организме человека по времени занимает примерно 15-20 с.
Отдел пищеварения - желудок
Желудок является самой широкой частью пищеварительного тракта, имеющий способность к увеличению в размерах, и вмещает огромное количество пищи. В результате ритмического сокращения мышц его стенок процесс пищеварения в организме человека начинается с тщательного смешивания пищи с желудочным соком, имеющим кислую среду.
Попавший в желудок комок пищи находится в нем на протяжении 3-5 ч, подвергаясь за это время механической и химической обработке. Пищеварение в желудке начинается с подвергания пищи воздействию желудочного сока и соляной кислоты, которая присутствует в нем, а также пепсина.
В результате пищеварения в желудке человека белки с помощью ферментов перевариваются до низкомолекулярных пептидов и аминокислот. Начавшееся во рту переваривание углеводов в желудке останавливается, что объясняется потерей амилазам своей активности в кислой среде.
Пищеварения в полости желудка
Процесс пищеварения в организме человека происходит под действием желудочного сока, содержащего липазу, которая способна расщеплять жиры. При этом большое значение отдается соляной кислоте желудочного сока. Под воздействием соляной кислоты повышается активность ферментов, вызывается денатурация и набухание белков, оказывается бактерицидное действие.
Физиология пищеварения в желудке заключается в том, что обогащенная углеводами пища, находящаяся в желудке примерно два часа, процесс эвакуации проходит быстрее, чем пища, содержащая белки или жиры, задерживающаяся в желудке на 8-10 ч.
В тонкий кишечник пища, которая перемешана с желудочным соком и частично переварена, находясь в жидкой или полужидкой консистенции, переходит через одновременные промежутки небольшими порциями. В каком отделе еще проходит процесс пищеварения в организме человека?
Отдел пищеварения - тонкий кишечник
Пищеварению в тонком кишечнике, в который из желудка попадает пищевой комок, отводится наиболее важное, с точки зрения биохимии усвоения веществ, место.
В этом отделе кишечный сок состоит из щелочной среды из-за прибытия в тонкий кишечник желчи, сока поджелудочной железы и выделений стенок кишечника. Пищеварительный процесс в тонком кишечнике не у всех проходит быстро. Этому способствует наличие недостаточного количества фермента лактазы, который гидролизует молочный сахар, связанный с неусвояемостью цельного молока. В процессе пищеварения в данном отделе человека расходуется больше 20 ферментов, например, пептидазы, нуклеазы, амилаза, лактаза, сахароза и др.
Деятельность данного процесса в тонком кишечнике зависит от трех переходящих друг в друга отделов, из которых он состоит -двенадцатиперстная, тощая и подвздошная кишки. В двенадцатиперстную кишку поступает образовавшаяся в печени желчь. Здесь пища переваривается благодаря поджелудочному соку и желчи, которые воздействуют на нее. В поджелудочном соке, представляющем собой жидкость, не имеющую цвета, содержатся ферменты, которые способствуют расщеплению белков и полипептидов: трипсина, химотрипсина, эластаза, карбоксипептидаза и аминопептидаза.
Роль печени
Немаловажная роль в процессе пищеварения в организме человека (кратко упомянем об этом) отводится печени, в которой образовывается желчь. Особенность пищеварительного процесса в тонком кишечнике обусловлена содействием желчи в эмульгировании жиров, всасывании триглицеридов, активировании липазы, также способствует стимулированию перистальтики, инактивированию пепсина в двенадцатиперстной кишке, обладает бактерицидным и бактериостатическим действием, увеличивает гидролиз и всасывание белков и углеводов.
Желчь не состоит из ферментов пищеварения, но важна при растворении и всасывании жиров и жирорастворимых витаминов. Если желчь вырабатывается недостаточно или выделяется в кишечник, то происходит нарушение процессов переваривания и всасывания жиров, а также увеличение их выделения в изначальном виде с калом.
Что происходит в отсутствии желчного пузыря?
Человек остается без, так называемого, небольшого мешочка, в который раньше откладывалась желчь «про запас».
Желчь необходима в двенадцатиперстной кишке только при наличии в ней пищи. А это не является процессом постоянным, только в период после приема пищи. По истечении некоторого времени двенадцатиперстная кишка опустошается. Соответственно, исчезает необходимость в желчи.
Тем не менее, работа печени не останавливается на этом, она продолжает выработку желчи. Именно для этого природой был создан желчный пузырь, чтобы выделенная в промежутках между приемом пищи желчь не испортилась и хранилась до появления потребности в ней.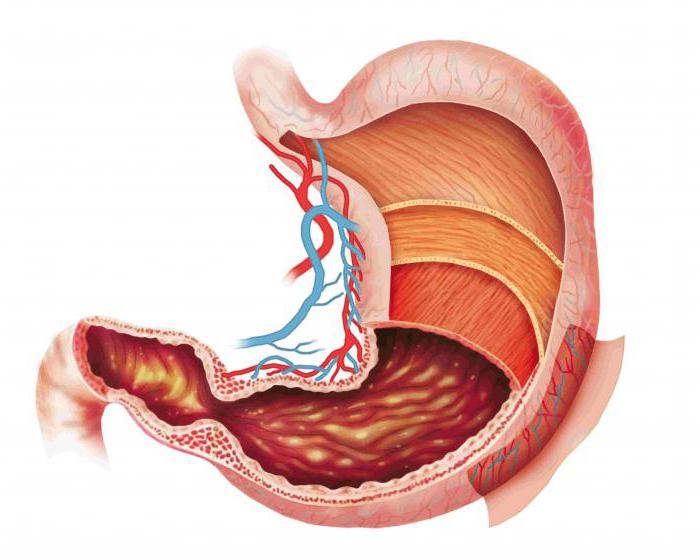
И тут встает вопрос об отсутствии этого «хранилища желчи». Как оказывается, человек может обходиться без желчного пузыря. Если вовремя сделать операцию и не спровоцировать другие болезни, связанные с органами пищеварения, то отсутствие в организме желчного пузыря переносится легко. Время процесса пищеварения в организме человека интересует многих.
После операции желчь может храниться только в желчных протоках. После выработки желчи клетками печени она выбрасывается в протоки, откуда легко и непрерывно направляется в двенадцатиперстную кишку. Причем это не зависит от того, принята ли пища или нет. Отсюда следует, что после удаленного желчного пузыря пищу первое время необходимо принимать часто и маленькими порциями. Это объясняется тем, что для обработки больших порций желчи не хватит. Ведь места ее накопления больше нет, а попадает она в кишку непрерывно, хотя и в небольших количествах.
Зачастую организм требует время, чтобы научиться функционировать без желчного пузыря, найти необходимое место для хранения желчи. Вот как проходит процесс пищеварения в организме человека без желчного пузыря.
Отдел пищеварения - толстый кишечник
Остатки непереваренной пищи продвигаются в толстый кишечник и находятся в нем примерно от 10 до 15 часов. Здесь происходят следующие процессы пищеварения в кишечнике: всасывание воды и микробная метаболизация питательных веществ.
В пищеварении, происходящем в отделе толстого кишечника, огромную роль имеют балластные вещества пищи, к которым относят неперевариваемые биохимические компоненты: клетчатка, гемицеллюлоза, лигнин, камеди, смолы, воски.
Структура пищи воздействует на быстроту всасывания в тонкой кишке и время передвижения сквозь ЖКТ.
Часть пищевых волокон, которые не расщепляются ферментами, принадлежащими желудочно-кишечному тракту, разрушается микрофлорой.
Толстая кишка является местом формирования каловых масс, в которые входят: непереваренные остатки пищи, слизи, отмершие клетки слизистой оболочки и микробы, непрерывно размножающиеся в кишечнике, и которые вызывают процессы брожения и газообразования. Сколько процесс пищеварения в организме человека длится? Это частый вопрос.
Расщепление и всасывание веществ
Процесс всасывания питательных веществ осуществляется на протяжении всего пищеварительного тракта, покрытого волосками. На 1 квадратном миллиметре слизистой находится около 30-40 ворсинок.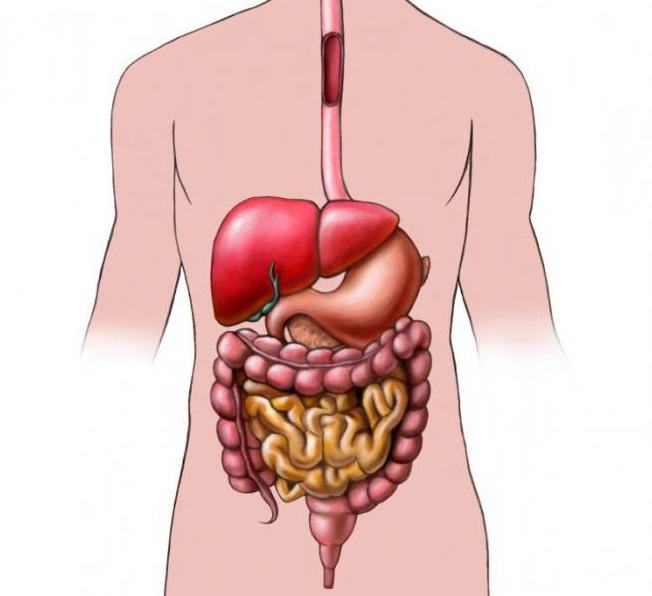
Чтобы происходил процесс всасывания веществ, которые растворяются жирами, а точнее жирорастворимых витаминов, в кишечнике должны присутствовать жиры и желчь.
Всасывание водорастворимых продуктов таких, как аминокислоты, моносахариды, минеральные ионы, происходит при участии кровеносных капилляров.
У здорового человека весь процесс пищеварения занимает от 24 до 36 ч.
Вот сколько по времени процесс пищеварения в организме человека длится.
Которые не способны к всасыванию в кровь и лимфу из-за больших размеров своих молекул. Химическая переработка пищи в желудочно-кишечном тракте представляет собой последовательное ступенчатое ферментативное гидролитическое расщепление крупномолекулярных белков, углеводов и липидов до простых веществ , способных к всасыванию. Ферменты, катализирующие эти реакции гидролиза называют гидролазами. Все пищеварительные ферменты синтезируются , резервируются и выделяются в неактивной форме, в виде проферментов и активируются непосредственно перед началом гидролиза.
Переваривание белков пищи предназначено для их денатурации, лишения видовой и тканевой специфичности и расщепления на простые компоненты способные всасываться в тонкой кишке в кровь. Почти все белки пищи (~95 ÷ 97%) всасываются в виде свободных аминокислот . Расщепление белков пищи представляет собой гидролиз с участием катализаторов - протеолитических ферментов
(протеазы
, протеиназы
, пептидазы
). Каждый фермент из протеиназ разрывает вполне определенные пептидные связи белков. Специфичность действия зависит от размера полипептида , его структуры , разновидности аминокислот участвующих в образовании пептидных связей. Главные протеиназы, катализирующие гидролиз белков и пептидов пищи показаны в таблице.
Таблица 1. Протеолитические ферменты желудочно-кишечного тракта
. Модификация
: Березов Т. Т., Коровкин Б. Ф. Биологическая химия. 3-е изд., |
||
| Секрет | Ферменты | Особенности действия |
| Желудочный сок | Пепсин | Протеиназа |
| Реннин | Створаживание молока | |
| Гастриксин | Подобен пепсину | |
| Сок поджелудочной железы | Трипсин | Протеиназа |
| Химотрипсин | Протеиназа | |
| Коллагеназа | Протеиназа | |
| Карбоксипептидаза | Пептидаза | |
| Эластаза | Пептидаза | |
| Кишечный сок | Аминопептидаза | Пептидаза |
| Лейцинаминопептидаза | Пептидаза | |
| Аланинаминопептидаза | Пептидаза | |
| Энтеропептидаза | Гликопротеин | |
| Трипептидазы | Пептидазы | |
| Дипептидазы | Пептидазы | |
| Пролил-дипептидаза | Пептидаза | |
| Пролин-дипептидаза | Пептидаза | |
|
|
Процесс переваривания животной белковой пищи совершенно отличен от переваривания пищи крахмалистой. Если вы посмотрите, как поедают пищу хищные животные, то заметите – они вырывают из туши куски мяса и, не пережевывая, глотают их. Зубы им нуж ны только для того, чтобы оторвать кусок плоти, но не жевать. Таким образом, никакого пищеварения в ротовой полости у них нет, а переваривание животных белков начинается в желудке. Для этого в полость желудка выделяется соляная кислота и фермент пепсин, и там создается резко кислая среда – наилучшая для переваривания животных белков.
Знаете, что делает соляная кислота с мясом и зачем нужна резко кислая среда? Это выяснил опытным путем академик А. М. Уголев. Оказывается, соляная кислота желудочного сока проникает в клетки куска мяса и вызывает разрушение лизосом (особые клеточные органы). В лизосомах клетки находятся ферменты – гидролазы, которые при создавшейся в ней рН-среды от 3,5 до 5,5 (очень кислой) разрушают все клеточные структуры. Следовательно, желудочный сок индуцирует (активирует) самопереваривание животной пищи ее же ферментами. Этот механизм существует как у хищных, так и у растительноядных животных. В принципе, он может совершаться и у человека, но для этого надо есть сырое мясо.
Индуцированный автолиз усиливается при температуре 37-40 °С. Под влиянием кислого желудочного сока происходит, во-первых, повышение проницаемости мембран; во-вторых, изменение активности протеолитических и других ферментов; в-третьих, изменяется состояние белковых клеток и тканей, в частности их чувствительность к действию ферментов.
В отличие от поверхностного действия пищеварительных соков на пищевой объект, в случае индуцированного автолиза имеет место «пищеварительный взрыв» тканей куска съеденного мяса изнутри, поскольку автолиз индуцируется по всей толщине пищевого объекта. В этом случае происходит гидролитическое расщепление всех клеточных структур.
Индуктор, то есть соляная кислота желудочного сока, проникает внутрь клеток сырой пищи и разрушает ее лизосомы-органеллы, содержащие множество гидролитических ферментов. Вышедшие в цитоплазму (полость клетки) ферменты расщепляют (гидролизируют) структуры клетки и ее оболочку. Следовател ьно, сырая пища (животная и растительная) переваривается собственными ферментами и затем усваивается организмом.
Оказалось, что около 50% гидролиза (расщепления) определяется ферментами не желудочного сока, а самой автолизированной ткани!
Все животные используют аутолическое пищеварение, потребляя живые объекты (животные или растения), и только человек подвергает пищу термической обработке, «улучшая» ее.
Собственные ферменты пищеварительных соков особенно важны для утилизации структур, лишенных лизосом (например, белка соединительной ткани), с высокой скоростью. Для этой цели и нужен пепсин.
Биохимик А. Паргетти обнаружил, что при приготовлении пищи на огне свыше 54 °С в течение любого количества времени активность ферментов пропадает и автолиз становится невозможным.
Вышеописанный процесс относится только к перевариванию белков. Обработанная белковая масса порциями поступает в двенадцатиперстную кишку и далее в тонкий кишечник, где идут заключит ельные процессы пищеварения и всасывания белковых продуктов в кровь.
Оказывается, кислое содержимое должно нейтрализоваться и приобрести нейтральную или слабощелочную реакцию. Это необходимо для того, чтобы ферменты поджелудочной железы начали окончательное расщепление подготовленных в желудке белковых структур.
Таким образом, получается, что если животная белковая пища убита термической обработкой, то процессы автолиза становятся невозможными ни в желудке, ни в тонком кишечнике, и вся пищеварительная нагрузка падает на организм (желудок и поджелудочную железу, вырабатывающую ферменты, которые расщепляют животный белок).
Павлов своими экспериментами показал, что на разные белковые продукты животного происхождения (мясо и сыр, яйца и мясо, молоко и рыба и т. п.) активность желудка в выработке соляной кислоты, пепсина и их активности совершенно различная (на одни продукты она начинается раньше, на другие позже, различна и крепость соков). Отсюда возникают неудобов аримые сочетания белка с белком.
Еще сильнее различаются условия для нормального переваривания при одновременном приеме продуктов, богатых белком (мяса, рыбы), продуктов, богатых крахмалами (например, картофель, каши, хлеб). Пищеварение не может проходить нормально. Оба фермента (амилаза и пепсин) мешают друг другу, поскольку им нужна различная среда: амилазе – слабощелочная, а пепсину – резко кислая. Таким образом, для организма чрезмерно затруднена работа по перевариванию одновременно крахмалистой и белковой пищи (это дает и внешний эффект – чувство усталости). И к тому же оба указанных продукта не могут нормально перевариться и, вместо питания организма, наносят ему вред, готовя почву для развития многих хронических заболеваний самой различной природы. Вот почему раздельное употребление белковой и крахмалистой пищи положено в основу раздельного и лечебного питания.
Помимо вышеизложенных причин, белковая пища является крайне обременительной для организма. А в основе в редного действия лежит понятие «специфического динамического действия пищи».
Под специфическим динамическим действием пищи (СДДП) подразумевается усиление обмена веществ после приема пищи по сравнению с уровнем основного обмена. Примерно через 15-30 мин после приема пищи происходит повышение обмена энергии, достигая максимума через 3-6 часов, и сохраняется в течение 10-12 часов. Причем различные виды пищи по-разному влияют на это повышение. Жиры незначительно повышают обмен, а иногда и тормозят его. Углеводистая пища повышает на 10-20%, а белковая еще больше – до 40%.
Чем вызвано такое сильное повышение обмена энергии после приема белковой пищи? Для этого необходимо знать, сколько у взрослого человека расходуется пищевого белка на построение и замену изношенных тканей организма и сколько – на потребление энергии.
Давным-давно Рубнер опытным путем показал, что только 4% общего обмена энергии идет на построение или прирост белка. В среднем это 30 г белка в день на человека (а в 100 г мяса его 20 г). Прежде чем ответить на вопрос, куда же идет лишний белок, дадим ответ на другой: что у нас используется в качестве основного «топлива»?
Основной поставщик энергии у нас углевод. При окислении кислородом мы получаем свободную энергию, которую используем, а также углекислый газ и воду, которые легко выводятся из организма.
Если белок использовать в качестве энергетического материала, то от него сначала надо отщепить азот, а затем использовать углевод как топливо.
В отличие от углеводов и жиров, азот в организме не может откладываться про запас и усиленно выводится из организма (а для этого нужна свободная вода и энергия). Так, после белкового завтрака выводится до 50% поступившего с пищей азота, а вместе с ним и вода, в которой он находится! В этом случае энергозатраты достигают таких размеров, что до 30-40% калорийности пищи уходит на расщепление азота и выведение его из организма. Как нам известно, основной орган, выводящий а зот из организма, – это почки. Поэтому «сверхплановая» работа быстро изнашивает их.
В результате реакций СДДП происходит не только интенсификация энергообмена и распада аминокислот (белка), но и изменение уровня глюкозы в крови, сдвиги водно-солевого баланса, изменение тонуса сосудов, вовлекаются гормональные системы.
Биохимик А. Е. Браунштейн обратил внимание, что усвоение и обмен аминокислот (белка) требует значительного количества свободной энергии. На пути прохождения через организм каждый атом азота вызывает распад многих молекул АТФ и неорганического фосфата.
При сопоставлении скоростей синтеза и распада белка, а также кругооборота азота при диетах с низким и высоким содержанием белка, установлено, что при низкобелковой диете интенсивность кругооборота азота снижается на 18%. Отсюда видна роль СДДП для построения рациональных диет в случаях лечения, самооздоровления, а заодно дан ответ любителям мясной пищи, считающим ее основным поставщиком энергии.
Важно понимать, что сэкономленная организмом энергия при переходе на малобелковый рацион пойдет на укрепление и исцеление вашего организма.
Постоянное поддержание в организме кислотно-щелочного равновесия.
Жизненные процессы, внешним проявлением которых является здоровье или болезнь, протекают в виде биологических реакций. Биологические реакции лучше всего протекают в той или иной водной среде и при определенной температуре. Оптималь ная водная среда характеризуется соотношением кислотных и щелочных элементов, что составляет величину рН.
Организм человека на поддержание у себя наилучшей величины рН затрачивает большие усилия, имея определенные механизмы, которые его регулируют и поддерживают. Отклонение внутренней среды организма от оптимальных значений рН приводит к недомоганиям, а потом и к болезням. По этой причине для осуществления процесса выздоровления, а в дальнейшем поддержания крепкого здоровья важно отрегулировать и восстановить данный показатель.
В организме человека кислоты и щелочи образуются сами, путем обмена веществ, а также вносятся с пищей, которая может иметь преимущественное содержание кислот либо щелочей или быть нейтральной (то и другое содержится в ней в равных количествах). Таким образом, при переваривании одних продуктов в организме преимущественно образуются кислоты, и поэтому их называют кислотообразующими продуктами, при переваривании других – щелочи, и поэтому их называю т щелочеобразующими продуктами.
На кислотные и щелочные свойства продуктов большое влияние оказывает термическая обработка. Большинство свежих продуктов при потреблении вызывают сдвиг рН внутренней среды организма в щелочную сторону. Но те же продукты, прошедшие термическую обработку (варку, запекание и т. п.), уже насыщают внутреннюю среду кислотами, сдвигая ее в кислую сторону. Причем одни продукты могут существенно влиять на внутреннюю среду, а другие не очень. Отсюда пошло деление продуктов питания на сильнокислотообразующие и слабокислотообразующие, а также слабо– и сильнощелочеобразующие.
К сильнокислотообразующим продуктам относятся: мясо и продукты из него (колбаса, ветчина, буженина и т. п.), рыба, яйца, сыр, сладости, продукты из белой муки, алкоголь и кофе.
К слабокислотообразующим продуктам относятся: творог, сметана, орехи, цельные крупы и продукты из муки грубого помола.
К слабощелочеобразующим продуктам относятся: разн ого рода сухофрукты, не пастеризованное молоко и грибы.
К сильнощелочеобразующим продуктам относятся: овощи (корнеплоды и в особенности листовые овощи), свежие фрукты, картофель и зеленый салат.
В целом продукты животного происхождения вызывают сдвиг внутренней среды организма в кислую сторону, а растительного – в щелочную.
Щелочеобразующее воздействие свежей растительной пищи объясняется высоким содержанием в ней минеральных веществ: калия, кальция, магния и натрия.
Важно понять, что происходит с кислотами, образующимися в организме, и как они могут влиять на здоровье.
В процессе переваривания продуктов, богатых углеводами, накапливается много угольной кислоты (Н2СОЗ). Сама по себе угольная кислота является нестойкой и существует только в растворах, легко распадаясь на воду и углекислый газ. Отсюда получается, что из углеводистой пищи внутри клеток образуется вода (среда жизни), а угольная кислота и углекислый газ являются регуляторами pH среды, от которой зависит активность ферментов внутри клетки. Естественно, углеводистая пища дает организму и энергию.
Что касается особенностей углеводистой пищи, то следует особое внимание обратить на минеральные вещества, входящие в ее состав. Так, калий, находящийся в углеводистой пище, способствует выведению воды из организма, а натрий, наоборот, – задержке. Фрукты и овощи относятся в основном к калиевой пище, а крупы – к натриевой. Поэтому при употреблении вышеуказанных продуктов должно сохраняться равновесие: по 50% на овощи с фруктами и зерновые с бобовыми.
Относительно переваривания богатой белком пищи надо знать, что белок есть соединение углевода с азотом. В процессе пищеварения происходит разделение белка на углеводистую и азотную часть. Углеводистая часть далее переваривается как углевод, а азотистая используется для построения тканей. Однако организм способен усваивать для своих нужд лишь небольшую часть азота, поступающего из пищи, и выводить ограниченно е количество азотистых веществ в виде мочевины и мочевой кислоты. Отсюда, мочевина и мочевая кислота, остающиеся в организме до момента их выделения через почки, сдвигают кислотно-щелочное равновесие в сторону кислоты. Если человек потребляет много белковой пищи, то мочевина и мочевая кислота накапливаются в его организме, вызывая закисление.
В белковых продуктах животного происхождения также содержится много серы и фосфора, которые образуют другую группу кислот, подлежащих выделению.
В итоге получается, что при потреблении в основном кислотообразующих продуктов организм чрезмерно закисляется. Внутренняя среда организма, его рН смещаются с нормальных, правильных показателей и больше не могут нормально осуществлять биологические реакции – жизненные процессы нарушаются. По мнению врачей-натуропатов, именно это является основной причиной возникновения многочисленных болезней.
Итак, мы с вами разобрали, в чем заключается лечебная ценность раздельного питания.
1. Разделение продуктов в одном приеме пищи позволяет им легче и лучше перевариваться и усваиваться. Это экономит жизненные силы организма и направляет их на самовосстановление. А саму болезнь лишает подпитки, путем устранения предпосылок для ее возникновения и течения.
2. Уменьшение количественного приема белковой пищи до физиологически нужных норм снимает ненужную нагрузку на организм в виде реакций СДДП, уменьшает нагрузку на органы выделения, особенно почки.
3. Преобладание в пище продуктов со щелочными свойствами позволяет выровнять и нормализовать внутреннюю среду организма и тем самым создать правильные условия для излечения и стабильного здоровья.
4. Употребление в пищу продуктов с высоким энергетическим потенциалом (рекомендованных Бирхером-Беннером как аккумуляторы 1-го порядка) и сокращение общего количества потребляемой пищи создает хорошие предпосылки для увеличения энергии в организме и успешного избавлении от болезней, связанных с ее нехваткой.
Клинические доказательства эффективности системы раздельного питания.
После того как основоположники правильного питания М. Бирхер-Беннер, Г. Хей, М. Герзон и Н. Уокер выяснили опытным путем, как можно лечить и укреплять здоровье людей с помощью питания, появилась масса последователей, успешно продолживших их дело. Доктор Герберт Шелтон распространил раздельное питание в Америке и успешно лечил, опираясь на него и другие способы натуропатии. В Европе это же сделал доктор Людвиг Вальб. Им и многими другими врачами были проведены клинические исследования, подтвердившие эффективность лечебного раздельного питания.
В 1935 году к доктору Вальбу поступил на лечение 11-летний ребенок с диагнозом «сморщенная почка». До этого его лечил очень известный тогда специалист по заболеваниям почек профессор Вольгард. Все попытки лечения, включая климатическое лечение в Египте, были безуспешны, и профессор отказался от пациента, считая данный случай безнадежным.
Доктор Вальб перевел мальчика на раздельное питание, от которого он абсолютно выздоровел и впоследствии стал спортивным летчиком!
Всего к Вальбу обратилось 120 человек с «неизлечимыми» заболеванями почек. После лечения правильным питанием 80% из них улучшили свое состояние, а некоторые излечились полностью.
Чем можно объяснить эффективность метода раздельного питания при лечении почек? Применение определенных продуктов питания приводит к тому, что из организма выделяются ненужная вода и соль. Эти два фактора сильно влияют на работоспособность сердца и почек. Уменьшение нагрузки позволяет им начать процесс самовосстановления. Поэтому для лиц с хронической почечной недостаточностью систему раздельного питания изменяют так, чтобы они в основном употребляли пищу, бедную солями и белками. Дополнительно для выведения излишка воды и соли на первом этапе лечебного питания назначают продукты, обладающие естественным мочегонным действием (богатые калием).
В итоге такого питания в крови уменьшается количество веществ, которые должны выделяться в моче. Мочевыделение увеличивается. Выделение белка в моче протекает в обратном направлении; повышенное кровяное давление, обусловленное почечной болезнью, снижается. Облегчается работа сердца, и восстанавливаются почки. Важно не запустить заболевание, когда организм теряет способность к самовосстановлению.
Раздельное питание является основной лечения для пациентов с больным сердцем. Было установлено, что все тяжелые заболевания сердца, в том числе инфаркт и инсульт, сопровождаются скрытым закислением организма. Применение раздельного питания уменьшает свертываемость крови, измеряемой значением «ртутной величины».
Доктор Вальб выяснил, что при всех болезнях кровообращения и сердца следует отдавать предпочтение небольшим приемам пищи, избегать денатурированных пищевых продуктов, поскольку они меньше и медленнее насыщают человека и потому поедаются в слишком большом количестве, что вредно для кровообращения и сердца.
Применение раздельного питания более чем у 90% пациентов с повышенным уровнем холестерина в крови приводит к снижению его уровня и последующей нормализации. Таким образом, существенно уменьшается риск возникновения атеросклероза и такого его осложнения, как обызвествление венечных сосудов сердца.
54-летний мужчина, больной диабетом, вынужден был прекратить работу. Из-за болезни он ослеп на один глаз, второй глаз видел на 50%. В качестве основного лечения использовали раздельное питание. Через 6 недель зрение улучшилось. Доза инсулина снизилась наполовину. Через некоторое время он смог начать работать.
Доктор Вальб рассказал о 55-летнем мужчине, который 6 лет страдал сахарным диабетом. При лабораторном исследовании обнаружили резко повышенное количество сахара в моче, уровень сахара в крови этого пациента составлял о коло 350 мг (норма составляет 110 мг). Ежедневное количество мочи у него составляло более 6 л, и он должен был каждый день колоть 50 ед. инсулина. После перехода на раздельное питание потребность в инсулине в течение 4 месяцев сократилась до нуля, а количество мочи составило 1,6 л в день (норму). Уровень сахара в крови составлял в среднем 150 мг, а в моче не обнаруживался.
Больные сахарным диабетом должны пользоваться системой раздельного питания в модифицированной форме. Тем, кому нужен инсулин, следует принимать пищу, богатую углеводами (каши, картофель), после утреннего и вечернего инсулинового укола. В промежутке рекомендуется принимать небольшие порции пищи, состоящие из свежих овощей, фруктов, зелени. Подобная пища ощелачивает организм.
Доктор Вальб показал, что у 200 диабетиков, лечившихся в его клинике раздельным питанием, примерно через 4-6 недель уровень сахара в моче снизился на 98%, а уровень сахара в крови – на 90%. Потребление инсулина сократилось в средне м на 37%. Кроме того, отступили недуги, связанные с нарушением кровообращения. При этом отмечалось, что диабетики, впрыскивающие более высокие стандартные единицы инсулина, могут добиться более ощутимых результатов, чем другие больные диабетом.
Применение раздельного питания больным сахарным диабетом позволяет излечить диабетическое поражения кровеносных сосудов. Для этого устраняют закисление организма употреблением щелочной пищи (свежей, растительной). Затем следует понижение уровня сахара в крови до нормальной величины. Изобилие при раздельном питании балластных веществ ведет к тому, что некоторые составные части углеводов (глюкоза) медленнее попадают в кровь. Уровень сахара в крови меньше и изменяется плавно, вместо того чтобы колебаться вверх и вниз, как это происходит при употреблении рафинированных углеводистых продуктов (очищенных круп, картофеле, хлебобулочных изделиях, не говоря уже о сахаре).
В 1978 году доктор Вальб обследовал 82 женщины и 51 мужчину, средни й возраст которых составлял 53 года. Пациенты страдали от различных болезней: опухолей, аллергий, болезней почек, ревматизма, диабета, заболеваний системы кровообращения и пищеварительных органов. Исследование крови за четыре недели применения раздельного питания показало, что ее данные нормализовались в среднем на 80%! И это всего за четыре недели!
Практика раздельного питания.
Когда организм освободился от шлаков, которыми раньше был наполнен, поднимается настроение и человеку открывается новый, счастливый мир.
Говард Хей
При раздельном питании необходимо соблюдать три важных условия.
1. Правильный выбор продуктов питания.
Здесь надо придерживаться рекомендаций доктора Бирхера-Беннера – больше использовать продукты, являющиеся аккумуляторами 1?го порядка. Это в основном свежая растительная пища: овощи (листовые и корнеплоды), фрукты, орехи. Особое внимание надо уделять употреблению свежих соков, особенно на первом этапе, чтобы быстрее вымыть шлаки и токсины из организма.
2. Ощелачивание организма в течение дня.
Щелочеобразователями являются продукты, в которых преобладают такие минералы, как натрий, калий, кальций и магний. Это в основном свежие овощи и фрукты, а также свежие соки из них.
Кислотообразователями являются продукты, в которых преобладают фосфор, хлор и сера. Это в основном крупы, мясные продукты, а также продукты, прошедшие термическую обработку (даже те же овощи, термически обработанные, становятся кислотообразующими).
Для того чтобы надежно ощелачивать организм, что особенно ценно при ряде заболеваний, нужно около 80% дневного рациона употреблять в сыром виде (свежие соки, овощи, фрукты, салаты, слегка тушенные овощи). И всего лишь 20% отводится на белковые продукты животного происхождения (мясо, рыба, сыр) и зерновые (каши, хлеб). Практика показала, что соотношение 70: 30 является очень хорошим показателем.
Какие продукты питания являются более «щелочными» и какие «кислыми», видно из нижеследующей таблицы.
Чтобы сохранить щелочной избыток в организме, а значит, создать лечебные предпосылки, следует употреблять в пищу большее количество продуктов, указанных в левой части таблицы. Для кислотного избытка годятся продукты, указанные в правой части таблицы.
Таблица 1
3. Соблюдение принципа раздельного употребления продуктов питания.
Ранее уже указывалось, почему некоторые продукты необходимо принимать отдельно от других. Кратко повторю, что это правило способствует лучшему течению пищеварительного процесса, усвоению переваренного, экономии жизненной энергии организма, которая используется на лечебные процессы или укрепление организма.
Главный секрет раздельного питания состоит в том, чтобы знать, какие пищевые продукты можно совмещать в одном приеме пищи и какие нельзя.
Запрещается в одном приеме смешивать щелочеизбыточные продукты с кислотоизбыточными.
Ява-скрипт отключен — поиск недоступен…
Переваривание белков в желудочно-кишечном тракте
Переваривание белков начинается в желудке под действием ферментов желудочного сока. За сутки его выделяется до 2,5 литров и он отличается от других пищеварительных соков сильно кислой реакцией, благодаря присутствию свободной соляной кислоты, секретируемой обкладочными клетками слизистой желудка.
Секреция соляной кислоты представляет активный транспорт, осуществляемый протонной АТФ-азой с затратой АТФ.
Роль соляной кислоты:
1. денатурирует белки;
2. стерилизует пищу;
3. вызывает набухание труднорастворимых белков;
4. активирует пепсиноген;
5. создает рН-оптимум для действия пепсина;
6. способствует всасыванию железа;
7. вызывает секрецию секретина в двенадцатиперстной кишке.
В желудочном соке содержатся протеолитические ферменты пепсин, гастриксин и реннин. Главным из них является пепсин. Он вырабатывается главными клетками слизистой желудка в виде профермента пепсиногена. Активация его осуществляется соляной кислотой (медленная) и аутокаталитически пепсином (быстрая) путем отщепления фрагмента полипептидной цепи с N-конца (частичный протеолиз). При этом происходит изменение конформации молекулы и формирование активного центра. Пепсин действует при значениях рН 1,5–2,5 и является эндопептидазой с относительной специфичностью действия, расщепляющей пептидные связи внутри белковой молекулы.
Кроме пепсина в желудочном соке содержится фермент гастриксин, проявляющий протеолитическую активность при рН 3,0–4,0. По-видимому, именно он начинает переваривание белков.
В желудочном соке грудных детей содержится фермент реннин, который имеет большое значение для переваривания белков у грудных детей, т.к. катализирует створаживание молока (превращение растворимого казеиногена в нерастворимый казеин), в результате чего замедляется продвижение нерастворимого казеина в двенадцатиперстную кишку и он дольше подвергается действию протеаз.
Образовавшиеся в результате действия пепсина в желудке полипептиды поступают в двенадцатиперстную кишку, куда выделяется сок поджелудочной железы. Панкреатический сок имеет щелочную реакцию (рН 7,5–8,2), что обусловлено высоким содержанием бикарбонатов. Кислое содержимое, поступающее из желудка нейтрализуется, и пепсин теряет свою активность.
В панкреатическом соке содержатся протеолитические ферменты трипсин, химотрипсин, карбоксипептидаза и эластаза, которые вырабатываются также в виде проферментов. Трипсиноген активируется энтерокиназой (вырабатывается клетками слизистой двенадцатиперстной кишки), переходит в активный трипсин, который активирует все остальные ферменты поджелудочного и кишечного сока. Клетки поджелудочной железы защищены от действия протеаз тем, что ферменты желудочного сока образуются в виде неактивных предшественников, а в панкреас синтезируется особый белок-ингибитор трипсина. В полости ЖКТ протеазы не контактируют с белками клеток, поскольку слизистая оболочка покрыта слоем слизи, а каждая клетка содержит на наружной поверхности плазматической мембраны полисахариды, которые не расщепляются протеазами. Разрушение клеточных белков ферментами желудочного или кишечного сока происходит при язвенной болезни.
Переваривание продуктов протеолиза пищевых белков в тонком кишечнике осуществляется с помощью амино-, ди-, и трипептидаз, которые функционируют преимущественно пристеночно.
Таким образом, конечными продуктами переваривания белков в ЖКТ являются свободные аминокислоты, которые всасываются.