Лекция белковые вещества
При денатурации пространственные изменения белка состоят в развертывании пептидной цепочки молекулы, которая проходит стадию рыхлого клубка до образования нити, при которой атомные группы демаскируются. В последующем полипептидные цепи все больше и больше переходят в стадию так называемого случайного клубка, при котором случайные связи образуются не только между различными отрезками одной и той же полипептидной цепочки, но также между различными, до этого разъединенными цепочками(происходит агрегация). В конце концов, это ведет к образованию таких больших агрегатов, что они выпадают в осадок.
Биологически важным является большая доступность денатурированных белков для многих расщепляющих белки энзимов, получающихся вследствие разрыхления молекулярного строения и как бы раскрытия функциональных групп белка при взаимодействии их с энзимом.
При определенных условиях денатурированный белок можно частично или полностью вернуть к исходному нативному состоянию. Такой белок называют ренатурированным. В качестве примера можно привести ренатурацию фермента рибонуклеазы, состоящую из единственной полипептидной цепи, соединенной четырьмя дисульфидными мостиками. После тепловой денатурации рибонуклеазы, связанной с разрывом дисульфидных мостиков, активность фермента после стояния может восстановиться. При стоянии вследствие воздействия кислорода воздуха происходит окисление и дисульфидные мостики восстанавливаются вновь, в результате почти полностью восстанавливается первоначальное строение молекулы и энзимная активность. Это говорит о том, что нативная структура является наиболее вероятной, наиболее стабильней структурой.
1.6. Классификация белковых веществ
Из всех веществ живого организма белки в отношении классификации представляют наибольшие трудности. Классификация белков на основании их химического строения в настоящее время затруднена из-за недостаточности наших знаний их строения. Наиболее распространенная классификация белков учитывает некоторые их физико-химические свойства, особенности в химическом строении, происхождение и роль в организме. Согласно этой классификации все белковые вещества подразделяются на две большие группы:
1) простые белки (протеины, протос – первый, главный);
2) сложные белки (протеиды, т.е. производные протеинов).
Простыми называют белки, которые при гидролизе распадаются исключительно на аминокислоты. Сложные белки – белки, которые при гидролизе, наряду с аминокислотами, дают другие вещества: углеводы, фосфорную кислоту, нуклеиновые кислоты, липиды и пр.
1.6.1. Протеины
Простые белки (протеины) по поведению в некоторых растворителях и по аминокислотному составу в свою очередь делятся на следующие подгруппы:
1) протамины,
2) гистоны,
3) альбумины,
4) глобулины,
5) проламины,
6) глютелины,
7) протеиноиды.
Рассмотрим эти группы в отдельности.
Протамины и гистоны являются наиболее простыми белками с молекулярной массой 10000-20000. Протамины обладают выраженными щелочными свойствами, так как до 80 % содержат основные кислоты (лизин, аргинин, гистидин). В их составе отсутствуют ароматические и серусодержащие аминокислоты. Гистоны обладают менее щелочным характером, так как содержат лишь до 30% основных кислот. Протамины содержатся в большом количестве в веществе клеточных ядер, в сперме позвоночных и молоках рыб; в зависимости от источника получения носят название сальмин, скумбрин, клупеин и др. Гистоны также содержатся в большом количестве в ядерном веществе, в зобной железе, в белках эритроцитов. Их представителем является белок глобин, который входит в состав гемоглобина.
Альбумины и глобулины – протеины, встречающиеся во всех животных и растительных тканях; составляют основную массу белков крови и других биологических жидкостей.
Альбумины (М=35000-70000) осаждаются насыщенным раствором сернокислого аммония, растворяются в дистиллированной воде, обладают наибольшей подвижностью в электрическом поле, принимают участие в поддержании осмотического давления крови и транспортировке различных веществ(кальций, билирубин, жирные кислоты).
Глобулины (М=150000) высаливаются полунасыщенным раствором сернокислого аммония, осаждаются в дистиллированной воде, растворяются в физиологическом растворе, что позволяет их отделять от альбуминов диализом. При электрофорезе движутся с различной скоростью и поэтому разделяются на подфракции: (α-, β-, γ-глобулины). При инфекционных болезнях увеличение количества глобулинов в крови связано с образованием иммунных веществ: антител и антитоксинов, в состав которых они входят.
Глютелины и проламины– белки растительного происхождения. Глютелины не растворимы ни в воде, ни в разбавленном нейтральном солевом растворе, растворяются в разведенных щелочах. Входят в состав клейковины. К
глютелинам относится оризенин, получаемый из риса, глютенин, получаемый из пшеницы.
Проламины нерастворимы в воде и солевых растворах, но, в отличие от других белков, растворяются в 70% спирте. В проламины входит в большом количестве иминокислота пролин. К проламинам относятся глиадин(из пшеничных ядер), гордеин (из ячменя) и зеин (из кукурузы).
Протеиноиды, т.е. белковоподобные вещества, включают белки опорных тканей (костной ткани, хрящей, сухожилий, волос, шерсти, ногтей, кожи, шелка и др.). Отличительной особенностью этих белков является их полная нерастворимость в воде, солевых растворах, разведенных кислотах и щелочах, неперевариваемость пищеварительными ферментами. Обычно протеиноиды относятся к фибриллярным белкам. Из отдельных представители этой группы белков следует назвать коллаген(входит в состав соединительной ткани), кератины (входят в состав волос, ногтей, копыт), фиброин (вырабатывается железами пауков, гусениц и др.).
1.6.2. Протеиды
Сложные белки – (протеиды) состоят из белковой части и небелковой части (ее называют еще при небольшой молекулярной массе простетической группой). Белковые и небелковые компоненты в сложных белках связаны нековалентными связями.
Протеиды в свою очередь подразделяются на:
1) хромопротеины (содержат в качестве простетической группы производные порфирина, изоаллоксазина, β-каротина);
2) фосфопротеины (содержат фосфорную кислоту);
3) гликопротеины или углеводсодержащие белки (содержат углеводы);
4) липопротеины (содержат липиды);
5) металлопротеины (содержат различные атомы металлов);
6) нуклеопротеины (содержат нуклеиновые кислоты).
Рассмотрим группы сложных белков в отдельности.
Хромопротеиды (от греческого слова – хрома – краска) состоят из простого белка и связанного с ним окрашенного небелкового соединения, которое может относиться к различным классам органических соединений. Важнейшей
особенностью хромопротеидов является их высокая биологическая -актив ность. Они играют важную роль в процессах жизнедеятельности, так как, в основном, являются биокатализаторами, ускоряющими протекание в организме таких важнейших биохимических процессов как фотосинтез и окислительновосстановительные реакции.
В качестве простетических групп в молекулах хромопротеидов могут быть производные порфирина, изоаллоксазина и бета-каротина.
1. Химия белков | |||||
H3 C CH3 |
|||||
бета-каротин | |||||
NH N O |
|||||
изоаллоксазин |
|||||
порфирин
Изоаллоксазин служит исходным соединением для синтеза флавиновых группировок, образующих в сочетании со специфическими белками ряд флавопротеидов, участвующих в окислительно-восстановительных реакциях в организме в качестве биокатализаторов-ферментов.
Производные каротина, связываясь с белком, дают начало хромопротеидам зрительного пурпура.
Производные порфирина с магнием образуют хлорофилл, комплекс которого с белком обеспечивает фотосинтетическую деятельность растений. Производные порфирина с железом образует гем и служат основой в комплексе с белком для образования гемоглобина и ряда дыхательных ферментов(цитохромов, каталазы, пероксидазы).
Среди выделенных из клеток цитохромов наиболее изучен цитохром С (М=13000), который содержит одну молекулу гема. Гем связан с белковым компонентом одной основной связью, идущей от железа к гистидину и двумя связями между винильными группами гема и остатками цистеина белка. В тканях животных и некоторых бактерий распространен фермент каталаза (М=22500), имеющий в составе своей молекулы четыре гема. В растительных организмах широко распространен другой, содержащий одну молекулу гема,

фермент – пероксидаза (М=44000). Встречается этот фермент также и в тканях животных.
Наиболее изученным представителем хромопротеидов является гемоглобин. Гемоглобин крови позвоночных животных и человека сосредоточен в эритроцитах. Гемоглобин легко разлагается уксусной кислотой и хлористым натрием на две составные части: белковую – глобин и на красящее вещество (простетическую группу) – гем.
Глобины гемоглобинов крови разных животных различны по составу и расположению аминокислот. Глобины по содержанию в них диаминомонокарбоновых кислот относятся к гистонам. Состоят из четырех полипептидных цепей (две a - и две b -цепи). В a -цепи содержится 141 аминокислота, в b -цепи – 146 аминокислот.
Молекулярная масса гемоглобина равна67-70 тысячам и в его молекуле содержатся четыре молекулы гема. Молекула гема включает один атом двухвалентного железа. Полагают, что присоединение гема к глобину осуществляется нековалентной связью между атомами железа гема и гистидином глобина.
Гем по своей химической структуре один и тот же у различных позвоночных животных. Строение гема было выяснено главным образом исследованиями М.Д. Ненцкого и Г. Фишера. Каждый гем содержит четыре пиррольные кольца, связанных четырьмя метиновыми группами(=СH-) и представляющих таким образом порфирин. Наличие четырех метильных (СН3 ) и двух винильных групп (-CH=CH2 ), а также двух остатков пропионовой кислоты(СН2 -СН2 - СООН) характерно для протопорфирина.
По своей химической структуре протопорфирин является1,3,5,8- тетраметил-2,4-дивинил"-6,7-дипропионовокислым порфином. И, наконец, присутствие одного атома двухвалентного железа придает соединению окончательный вид простетической группы гемоглобина – гема.

1. Химия белков | |||||||||
гемоглобин | оксигемоглобин | ||||||||
метгемоглобин | карбоксигемоглобин |
||||||||
Самая интересная биологическая особенность гема заключается в его способности соединяться с газами (кислородом, окисью углерода, окислами азота и др.). При присоединении к гемоглобину(Нв) кислорода образуется оксигемоглобин (НвО2 ). Кислород присоединяется к железу за счет дополнительных связей.
НвО2 настолько нестоек, что уже при уменьшении парциального давления кислорода он распадается с образованием Нв и2 .ОПрисоединение О2 к Нв крови происходит в легких, распад же НвО2 на О2 и Hв имеет место в крови,
притекающей к тканям, где парциальное давление О понижается за счет его
поглощения тканями.
К железу гемоглобина легко присоединяется окись углерода(СО) с образованием карбоксигемоглобина (НвСО). При вдыхании воздуха, в котором содержится СО, последний образует более прочное соединение с Нв, чем оксигемоглобин, что ведет к вытеснению О2 из НвО2 . В результате нарушается доставка кислорода от легких к тканям.
Важным производным гемоглобина является метгемоглобин, в молекуле которого атом железа трехвалентен.
Метгемоглобин образуется из НвО при воздействии на него окислителей
(железосинеродистого калия, окислов азота, метиленовой сини и т.д.). Метгемоглобин может образоваться при продолжительном вдыхании окислов азота, паров нитробензола при профессиональном заболевании. Образование инертного, прочно связывающего кислород метгемоглобина в крови уменьшает ко-
личество в ней функционально важного НвО, нарушает доставку О к тканям,
что ведет к тяжелым патологическим состояниям.
Веществом, близким к гемоглобину, является хромопротеид мышц– миоглобин. Он образует такие же производные, как и гемоглобин крови (оксимиоглобин, карбоксимиоглобин и метмиоглобин). Миоглобин и гемоглобин очень близки по своему элементарному составу. Различия состоят прежде всего в строении белкового компонента, а также в том, что миоглобин содержит одну молекулу гема. Миоглобин рассматривают как дыхательный пигмент, обеспечивающий в мышцах кратковременный резерв кислорода, используе-
мый мышечными волокнами. Сродство к кислороду у миоглобина более выражено, чем у гемоглобина.
Большой группой сложных белков являются гликопротеиды(углеводсодержащие белки).
Углеводсодержащие белки– обширный класс соединений, единая классификация которых до сих пор не установлена и которые рядом авторов подразделяются на две большие группы: мукопротеиды (протеогликаны) и гликопротеиды. Мукопротеиды представляют собой белки, простетической группой которых служат глюкозаминогликаны(или кислые мукополисахариды): гиалуроновая кислота, хондроитинсульфаты А, В, С, Д, гепарин и др., и обладают сильно выраженными кислотными свойствами. Эти кислотные свойства связаны с наличием в составе глюкозаминогликанов большого числа остатков серной и глюкуроновой кислот. Связь между белками и глюкозаминогликанами в мукопротеидах непрочна, с чем связывают их участие в регуляции тканевой проницаемости. Кроме того, им присуща защитная и структурная функции. Главными представителями мукопротеидов (протеогликанов) являются муцины и мукоиды. Муцин входит в состав слюны, защищает от механических и химических повреждений слизистые оболочки пищеварительного тракта. Мукоиды входят в состав хрящей, костей, связок, сухожилий, яичного белка.
В отличие от мукопротеидов(протеогликанов) гликопротеиды являются белками, у которых белковая часть прочно соединена с аминополисахаридами. Аминополисахариды не содержат уроновых кислот и сульфатов, а содержат гексозы, гексозамины, фукозы и сиаловые кислоты илиN-ацетилнейра- миновые кислоты. Поэтому эта группа полисахаридов теряет выраженные кислотные свойства, почему ее иногда называют нейтральными мукополисахаридами. Отсюда гликопротеиды обладают слабо выраженными кислотными свойствами. Представителями гликопротеидов являются различные ферменты (холинэстераза, церулоплазмин), гормоны (гонадотропин, эритропоэтин), группоспецифические субстанции крови, протромбин, фибриноген, интерфероны, обладающие антивирусным, противоопухолевым и иммунорегуляторным действием, а также иммуноглобулины (антитела).
К числу сложных белков (протеидов) относятся фосфопротеиды, при гидролизе которых, наряду с аминокислотами, получаются более или менее значительное количество фосфорной кислоты. В молекуле фосфопротеида остатки фосфорной кислоты сложноэфирными связями присоединяются к молекуле белка по месту гидроксильных групп оксиаминокислот(серина и треонина), входящих в состав полипептидной цепи.
Наиболее часто остатки фосфорной кислоты соединены в фосфопротеидах с остатками серина. Поэтому после гидролиза фосфопротеидов обнаруживают обычно больше серин-фосфорной кислоты, чем треонинфосфорной кислоты.
В фосфопротеидах выявлены пирофосфатные и фосфодиэфирные остатки. Наличие фосфодиэфирных остатков указывает на то, что пептидные цепи в молекулах фосфопротеидов соединены друг с другом не только дисульфидными мостиками, но и с помощью остатков фосфорной кислоты. Фосфопротеиды с биологической точки зрения являются питательным материалом для растущего организма. Вместе с необходимыми для развития молодого организма аминокислотами фосфопротеиды доставляют также и необходимую организмам фосфорную кислоту. Фосфорная кислота особенно важна для развития скелета.
Типичным представителем фосфопротеидов является казеин– белок молока. Казеин имеет молекулярную массу в пределах75-100 тыс. Казеин существует в нескольких формах, различающихся по содержанию фосфора и аминокислотному составу. Несколько различных фосфопротеидов найдено среди белков яиц: овальбумин (фосфопротеид яичного белка) и вителлин, вителлинин, фосвитин (фосфопротеиды яичного желтка).
Из других белков к фосфопротеидам относится пепсин, содержащий один остаток фосфорной кислоты на молекулу белка. Фосфатная группа и здесь присоединена к радикалу серина, находящемуся в пептидной цепи рядом с глутаминовой кислотой. Фосфопротеидами являются также ферменты фосфоглюкомутаза и фосфорилаза.
Липопротеиды – другая группа сложных белков, состоящая из белков и липидов (холестерина, фосфолипидов, триглицеридов). В отличие от липидов, липопротеиды растворимы в воде и нерастворимы в органических растворителях (эфире, бензоле, хлороформе и др.).
Прочность связи белков с липидами в липопротеидах неодинакова. В зависимости от того, есть ли в молекуле липида ионизированные группы атомов (как у полярных липидов– фосфатидов) или их нет(как у триацилглицеридов), между белковой и липидной компонентами липопротеида возникают различного типа связи. В первом случае между белком и липидом возникают лабильные нековалентные связи. Во втором случае белковая составляющая обволакивает липидную часть, которая становится центром мицеллы.
Липопротеиды широко представлены в нервной ткани, плазме крови, молоке, образуют биологические мембраны.
Наиболее изучены так называемые транспортные липопротеиды, присутствующие в плазме крови млекопитающих. Эти липопротеиды содержат обычно как полярные, так и нейтральные липиды, а также холестерин и его эфиры. Они служат той формой, в которой липиды из тонкого кишечника транспортируются кровью в печень и далее в жировую ткань. Липопротеиды плазмы классифицируются по своей плотности на четыре группы. Самыми легкими липопротеидами являются хиломикроны– крупные структуры, содержащие около 98% липидов и 2% белков (главными липидными компонен-
тами являются экзогенные триацилглицериды). Среди других основных липопротеидов липопротеиды очень низкой плотности(ЛПОНП или пребеталипопротеиды) содержат около 90% липидов и 10% белков (главными липидными компонентами служат эндогенные триацилглицериды), липопротеиды низкой плотности (ЛПНП или бета-липопротеиды) содержат около 78% липидов и 22% белков (главными липидными компонентами являются холестерол и его эфиры), липопротеиды высокой плотности(ЛПВП или альфалипопротеиды) содержат около 50% липидов и 50% белков (главными липидными компонентами являются фосфолипиды и эфиры холестерола). Высокое содержание холестерола и оптимальный размер молекул(15-25 нм) для инфильтрации интимы артерий обусловило ведущую роль бета-липопротеидов в патогенезе атеросклероза.
Полагают, что липопротеиды участвуют в транспорте гормонов стероидной природы и витамина А.
Липопротеиды участвуют также в построении биологических мембран. Строение и функции мембран в силу их роли в жизнедеятельности заслуживают специального изложения, более подробного.
Биологические мембраны представляют собой плоские структуры толщиной порядка 6-9 нм, которые состоят из молекул белков и липидов, удерживаемых вместе нековалентными связями. В различных мембранных структурах клетки (плазматической мембране, эндоплазматическом ретикулуме, аппарате Гольджи, митохондриальной и ядерной мембране и др.) на долю белков и липидов приходится от 20 до 80% обеих составляющих. Основными классами мембранных липидов служат:
1) фосфолипиды (фосфоацилглицеролы: фосфатидилхолин, фосфатидилсерин и фосфатидилэтаноламин и сфингомиэлины);
2) гликолипиды – производные сфингозина;
3) холестерол.
Именно липидами определяется пластинчатая форма мембран и их основные физико-химические свойства. Характерной особенностью молекул фосфолипидов и гликолипидов является их амфифильность: один конец молекулы гидрофильный, другой – гидрофобный. Гидрофобный конец составляют углеводородные радикалы жирных кислот и сфингозина. Гидрофильный конец в гликолипидах образован углеводной частью, в фосфолипидах– фосфатным остатком, связанным с холином, этаноламином или серином. Благодаря амфифильности эти липиды в водной среде образуют многомолекулярные структуры с упорядоченным расположением молекул: гидрофобные части вытесняются из водной среды и взаимодействуют друг с другом, а гидрофильные части контактируют с водой и гидратируются. Именно этим определяется построение бимолекулярного липидного слоя мембран, состоящего из гидрофильной и
гидрофобной фаз. Холестерин находится практически целиком в гидрофобной части бимолекулярного слоя. При этом гидроксильная группа примыкает к гидрофильным головкам фосфолипидных молекул, а кольцо стерана уходит в толщу углеводородных цепей фосфолипидов. Благодаря такой компоновке, холестерин регулирует образование кристаллических структур мембраны. Состояние, в котором находятся липиды мембраны, называется жидкокристаллическим, поскольку в целом липидная прослойка жидкая, но в ней есть плотные участки, похожие на кристаллические структуры. Холестерин, разъединяя неполярные цепи фосфолипидов, мешает излишнему «затвердеванию» жидкого слоя и в то же время в участках с большим количеством «жидких» ненасыщенных цепей жирных кислот фосфолипидов способствует их уплотнению. Благодаря жидкокристаллической структуре липидного бислоя, молекулы липидов, несмотря на упорядоченность положения, сохраняют способность к диффузии в направлении, параллельном поверхности мембраны (латеральная диффузия) без выхода за пределы слоя. Эту способность мембран охарактеризовывают как их текучесть. Текучесть зависит как от содержания холестерина, так и состава жирных кислот. Наличие насыщенных жирнокислотных остатков в фосфолипидах приводит к жесткому состоянию, так как прямые углеводородные цепи легче взаимодействуют между собой. Присутствие ненасыщенных связей в ацильных остатках, ведет к появлению изгибов в цепях, что затрудняет их взаимодействие и способствует дезорганизации и переходу в жидкое состояние. Холестерин, как указывалось выше, также влияет на процесс кристаллизации и, следовательно, на текучесть мембран. Что касается поперечной диффузии липидов (флин – флоп), то она крайне ограничена.
Липидные бислои характеризуются крайне низкой проницаемостью для заряженных ионов типа Na+ , Cl- , или Н+ и для большинства полярных соединений, (например, сахаров), но легко проницаемы для воды, благодаря наличию пронизывающих мембрану пор. Полярные молекулы проникают через мембрану только при наличии для них специфических транспортных систем (переносчиков). В то же время растворимые в липидах молекулы легко проходят через биомембраны благодаря своей способности растворяться в углеводородном слое мембран.
Мембраны обладают высоким электрическим сопротивлением и потому являются хорошими изоляторами.
Как говорилось выше, липидный слой жидкий, что позволяет ему служить как бы растворителем для мембранных белков.
виями, которые легко разрушаются при изменении рН и концентрации солей. Интегральные белки погружены внутрь мембраны и даже могут пронизывать ее насквозь. Трансмембранные белки могут служить ионными каналами. Интегральные белки образуют многочисленные связи с углеводородными цепями мембранных липидов, и отделить их можно только с помощью детергентов или органических растворителей.
Состав белков разных мембран неодинаков и определяет их функции. В плазматических мембранах выделяются следующие группы белков:
1. антигенные белки, представленные обычно гликопротеидами или гликопротеолипидами, определяют специфику поверхности клетки и взаимодействие с антителами;
2. структурные белки, находящиеся в толще мембраны;
3. рецепторные белки, расположенные снаружи мембраны, определяют биохимический ответ клетки на внешние регуляторы(гормоны, медиаторы и др.);
4. ферментные белки, расположенные в разных фазах(слоях) определяют функции мембраны;
5. транспортные белки, осуществляющие перенос веществ через мембра-
Представление о молекулярной архитектуре мембран сформулировано на основании результатов их химического анализа и электронной микроскопии. Все мембраны имеют общий план строения, но различаются в деталях химического состава и структуры.
Первоначально Даниелли и Даусон 1931в году предложили модель строения биомембраны в виде сандвича(бутерброда), которая впоследствии была модифицирована Робертсоном. В 1972 году С. Джонатан Сингер и Гарт Николсон сформулировали теорию строения мембран, получившую название жидкостно-мозаичной модели. Согласно этой модели основной непрерывной частью мембраны служит полярный липидный бислой, находящийся в жидком состоянии, что обеспечивается определенным соотношением насыщенных и ненасыщенных жирных кислот в полярных липидах(фосфолипидах). На поверхности расположенных в мембране интегральных белков имеются гидрофобные радикалы аминокислотных остатков, за счет которых белки как бы растворяются в гидрофобной части бислоя. На поверхности периферических белков имеются, в основном, гидрофильные радикалы, которые притягиваются к гидрофильным заряженным полярным головкам липидов за счет электростатических сил. Интегральные белки, а к ним относятся ферменты и транспортные белки, обладают активностью только в том случае, если находятся внутри гидрофобной части бислоя, где они приобретают необходимую для проявления активности пространственную конфигурацию. Периферические белки бу-
квально плавают на поверхности бислойного«моря», а интегральные белки, подобно айсбергам, почти полностью погружены в углеводородный срединный слой. Согласно жидкостно-мозаичной модели мембранные белки могут свободно перемещаться в латеральной плоскости. Поперечная диффузия невозможна. Однако и продольная диффузия может быть ограничена вследствие притяжения между функционально связанными белками и образования ими кластеров, что, в конечном итоге, приводит к мозаичному распределению белков в липидном бислое. Модель Сингера – Николсона получила признание как наиболее вероятный способ молекулярной упаковки липидов и белков в мембранах, способной объяснить многие физические, химические и биологические свойства мембран.
Мембраны асимметричны структурно и функционально. Это проявляется как в направлении действия систем транспорта ионов, расположения гормональных рецепторов, и т.д., так и в преобладании фосфатидилхолинов и локализации углеводных остатков только на наружной стороне плазматических мембран млекопитающих (поперечная асимметрия мембран).
Некоторые из располагающихся на поверхности мембран олигосахаридных групп гликопротеинов и гликолипидов играют важную роль в процессах узнавания клетками друг друга и адгезии (контакте друг с другом), а также определяют тканевую специфичность (тканевую совместимость) и входят в состав рецепторных участков для гормонов (рецепторная функция или коммуникационная).
Организация мембранных структур, наличие в мембранах ферментных белков обеспечивает, наряду с выполнением ими разделительной функции (барьеры проницаемости с высокой избирательностью), также:
1. метаболическую (превращение природных и чужеродных веществ);
2. регуляторную (участие в образовании 3",5"-АМФ и 3",5"-ГМФ);
3. энерготрансформирующую (образование АТФ путем окислительного фосфорилирования);
4. транспортную (трансмембранный перенос веществ, регулирующий молекулярный и ионный состав компартментов) функции.
Следует сказать, что поверхность мембран несет электрически заряженные группы, которые помогают поддерживать разность электрических потенциалов на мембране, что имеет особое значение для передачи нервных -им пульсов.
Одна из главных функций мембран– регуляция переноса веществ. Через мембраны клетки в одно и то же время в обоих направлениях в клетку и из клетки проходят сотни разных веществ, без чего невозможна ее жизнедеятельность. Различают следующие способы переноса веществ через мембраны: простую диффузию, облегченную диффузию и активный транспорт. Диффузия
возникает из-за разницы концентраций диффундируемого вещества по обе стороны мембраны. Простая диффузия происходит без затраты энергии по градиенту концентрации (т.е. из зоны с большой концентрацией в зону с меньшей концентрацией) и определяется растворимостью в веществе мембран (особенно его липидного слоя). За счет диффузии через мембрану могут перемещаться небольшие нейтральные молекулы– вода, СО2 , О2 , а также гидрофобные низкомолекулярные органические вещества; в том числе лекарственные вещества.
Более распространена в природе облегченная диффузия, которая также осуществляется по градиенту концентрации, но при участии специальных мембранных белков-переносчиков (транслоказ, пермиаз). О наличии переносчиков свидетельствует эффект насыщения: при некоторой значительной концентрации диффундирующего вещества дальнейшее увеличение его концентрации не ускоряет более диффузию.
Для облегченной диффузии характерна высокая избирательность к переносимому веществу. Транспорт путем облегченной диффузии используется для переноса органических кислот, моносахаридов, жирорастворимых витаминов, стероидных гормонов и.т.дПолагают, что при помощи белковпереносчиков осуществляется перенос гидрофильного вещества через гидрофобный слой мембраны.
Активный транспорт, в отличие от диффузионного, происходит против градиента концентрации переносимого вещества и сопряжен с расходованием энергии. Источником энергии может быть или гидролиз АТФ(первичноактивный транспорт) или одновременный перенос другого вещества, который движется по градиенту своей концентрации (вторично-активный транспорт). С помощью активного транспорта происходит перенос многих минеральных ионов (Nа+ , К+ , Мg2+ , Н+ и др.), аминокислот, перенос глюкозы из первичной мочи через мембраны клеток канальцев почки в кровь.
Примером первично-активного транспорта может служить так называемый натриевый насос. Натриевый насос переносит ионы натрия и калия через мембрану против градиента концентрации за счет энергии АТФ. Натриевый насос – это белковый комплекс (Nа+ , К+ , АТФ-аза), вмонтированный поперечно в мембрану, который за один цикл из клетки выводит три иона натрия и вносит в клетку два иона калия. Это ведет к появлению электрического потенциала, называемого трансмембранным электрохимическим потенциалом. Сходный механизм присущ транспортированию ионов кальция. Этот процесс осуществляется Са2+ -АТФ-азой за счет энергии АТФ (перенос двух Сa2+ на одну молекулу АТФ).
Созданный на мембране электрохимический градиент натрия может быть использован для транспорта другого вещества, например, глюкозы. При этом вторично-активном транспорте, если оба вещества переносятся в одном -на
правлении (например, Nа+ и глюкоза), то такой совместный транспорт называется симпорт. Если же вещества пересекают мембрану в противоположных направлениях, то такой транспорт называется антипорт. Для переноса углеводов, аминокислот и других метаболитов вторично-активный транспорт имеет, по-видимому, наибольшее значение по сравнению с другими механизмами.
Помимо диффузионного и активного транспорта, существенную роль в транспорте веществ в клетку играет еще один вид транспорта– эндоцитоз, при котором плазматическая мембрана в участке контакта с веществом впячивается, образуя пузырек. Пузырек, оказавшись внутри клетки, вместе с транспортируемым веществом и участком мембраны, отшнуровываются. Механизм отшнуровывания пузырька и выход содержимого в цитозоль не изучены. Поступление этим способом в клетку растворенных веществ называется пиноцитозом, а нерастворимых веществ (частиц) – фагоцитозом. Образование эндоцитозного пузырька происходит при участии специальных белков. Предполагают, что в мембране имеется особый гликопротеид– клатрин, накапливающийся на цитозольной поверхности мембраны и участвующий в образовании пузырька и его втягивании внутрь клетки при участии сократительных структур клетки – микрофиламентов. Считают, что для этого процесса используется энергия АТФ. Потери частиц мембраны непрерывно компенсируются ее образованием в аппарате Гольджи.
Таким образом, мембраны представляют собой сложные структуры, обладающие характерными биологическими свойствами и выполняющие многочисленные динамические функции, без которых немыслима жизнедеятельность клетки и организма в целом.
Структура и функции мембран нарушаются при ряде заболеваний, что нередко составляет существенный этап патогенеза болезни.
Мембраноподобные структуры возможно создать искусственным путем, поскольку на поверхности раздела двух фаз(воды – жира) полярные липиды легко и самопроизвольно формируют очень тонкие бислои. В лабораторных условиях такие бислои нетрудно получить путем сильного встряхивания водных суспензий фосфолипидов. При этом образуются замкнутые пузырьки, окруженные непрерывным липидным бислоем, получившие название липосомы. Возможно также создание искусственных мембранных пузырьков– протеолипосом – с заданным составом. Для этого выбранные липиды и белки растворяют в растворе детергента, а затем детергент удаляют диализом.
Липосомы с успехом используются в качестве моделей для изучения свойств клеточных мембран и органелл.
При введении непосредственно в кровоток или при попадании в кровь после введения в желудочно-кишечный тракт липосомы захватываются клетками ретикуло-эндотелиальной системы, локализованными, главным образом, в костном мозге, селезенке и печени, где подвергаются метаболическим превра-
щениям. Это обстоятельство позволяет использовать липосомы для доставки лекарств в ретикуло-эндотелиальную систему и, таким образом, направленно воздействовать именно на эту ткань и орган, ее содержащий. С этой целью липосомы «нагружают» специальными методами раствором лекарственного препарата и затем вводят в кровь или в желудочно-кишечный тракт. В экспериментах на животных было доказано, что использование липосом в качестве переносчиков (контейнеров) лекарств значительно уменьшает токсичность и увеличивает эффективность препаратов. Путем подбора мембранных компонентов можно получить липосомы, избирательно задерживающиеся в том или ином органе. В качестве таких компонентов-векторов, обладающих сродством к определенным мишеням, используют молекулы гормонов, ферментов, иммуноглобулинов (антител). С помощью таких липосом можно направить -ле карство точно в пораженный орган. При определенных условиях липосомы могут сливаться с плазматическими мембранами клеток. Это позволяет в экс-
периментальных условиях изменять липидный состав клеточных мембран и изучать значение таких изменений.
Среди сложных белков имеется группа белков, содержащая в своем составе металлы (Fе, Сu, Мg и др.), связанные с белковой частью посредством комплексной связи без каких-то специальных группировок атомов, и получившая название металлопротеиды. С точки зрения функции– это частично транспортные белки для металлов (например, трансферрин), частично депонирующие белки (например, ферритин, гемосидерин). У транспортных белков содержание металла составляет десятые доли процента, у депонирующих белков этот процент гораздо выше. Так, содержание железа в ферритине достигает 20%. Этот металлопротеид содержится в селезенке и может быть получен в кристаллическом виде.
К числу металлопротеидов относятся некоторые ферменты:
Ø дипептидаза (Мо 2+ ),
Ø ксантиноксидаза (Мо 2+ ),
Ø тирозиназа (Сu 2+ ),
Ø полифенолоксидаза (Сu 2+ ),
Ø цитохромоксидаза (Fе 2+ , Сu2+ ),
Ø карбоксипептидаза (Fe 2+ , Cu2+ ),
Ø пероксидаза (Fе 2+ ),
Ø аргиназа (Мn 2+ ) и др.
В протеиназах металлы часто встречаются совместно с другими небелковыми группами сложных белков(примером могут служить металлофлавопротеиды).
Чрезвычайно важную группу сложных белков составляют нуклеопротеиды. Нуклеопротеиды входят в состав любой клетки, так как являются непре-
менными компонентами ядерного материала и цитоплазмы. Некоторые нуклеопротеиды существуют в природе в виде особых частиц, обладающих патогенной активностью и получивших название вирусов.
Нуклеопротеиды играют большую биологическую роль. Они являются не только структурными элементами клетки, ее ядра и протоплазмы, но выполняют важнейшие специфические функции в живом организме. Деление клеток, биосинтез белка, передача наследственных свойств и многообразные коферментные и энергетические функции тесно связаны с нуклеопротеидами и их составными частями – нуклеиновыми кислотами и нуклеотидами.
Нуклеопротеиды имеют молекулярную массу от нескольких десятков тысяч до десятков и даже сотен миллионов дальтон. Растворы их обладают высокой вязкостью и обнаруживают в ряде случаев двойное лучепреломление. Форма молекул у нуклеопротеидов широко варьирует от глобулярной до нитевидной. При неполном гидролизе нуклеопротеида, например, под влиянием ферментов, нуклеопротеид распадается на белок и нуклеиновую кислоту. Белок можно удалить, переводя его в осадок путем тепловой денатурации или путем высаливания. Соотношение белка и нуклеиновой кислоты в нуклеопротеидах отличается разнообразием (часто от 30 до 60% обеих составляющих). Тип связи между белком и нуклеиновой кислотой, как полагают, ионный, так как белки нуклеопротеидов, как правило, содержат много катионных групп, а нуклеиновые кислоты обладают большим числом анионных группировок.
У большинства организмов белковой составляющей нуклеопротеидов являются гистоны и протамины. Однако, нуклеопротеиды из растительных тканей, бактерий, вирусов, а также некоторых тканей животных характеризуются содержанием других простых белков (альбуминов или глобулинов).
По составу нуклеиновых кислот нуклеопротеиды могут быть дезоксирибонуклеопротеидами и рибонуклеопротеидами. Дезоксирибонуклеопротеиды (ДРНП) и рибонуклеопротеиды (РНП) представляют собой сложные агрегаты, построенные из 1-2 молекул нуклеиновой кислоты(соответственно ДНК и РНК) и большого числа прикрепленных к ней белковых субъединиц. Классическим примером рибонуклеопротеида является вирус табачной мозаики, содержащий 1 молекулу РНК с молекулярной массой 2 млн. и около 2000 белковых субъединиц. Из рибонуклеопротеидов построены рибосомы– особые органеллы клетки, в которых происходит синтез белка. ДРНП входят в состав мононуклеосом, являющихся составной частью хромосомы.
В дезоксирибонуклеопротеиде особую роль во взаимодействии ДНК и протамина или гистона, входящих в состав ДРНП, приписывают остаткам фосфорной кислоты ДНК и радикалам остатков аргинина в полипептидной цепи белковой молекулы. При этом замыкается большое число электровалентных связей между ионизированными фосфатными и гуанидиновыми группировками.
Нуклеиновая кислота и белок в нуклеопротеидах взаимно стабилизируют друг друга. Важно подчеркнуть, что подавляющая часть нуклеиновых кислот клетки существует в виде нуклеопротеидов. Сочетание в единую молекулу нуклеиновой кислоты и большого числа белковых субъединиц приводит к появлению уникальных функциональных свойств у такого рода образований. В частности, РНП-частицы играют совершенно исключительную роль в биосинтезе белка, а ДРНП-частицы – в формировании и функционировании хромосомного аппарата клетки, хранящего генетическую информацию. Ведущее значение в этих функциях нуклеопротеидов принадлежит нуклеиновым кислотам.
БЕЛКОВЫЕ ВЕЩЕСТВА
ЛЕКЦИЯ
Белковые вещества.
Белки в питании человека.
Проблема белкового дефицита на планете.
Белково-калорийная недостаточность и ее последствия. Пищевые аллергии.
Белки или протеины - высокомолекулярные азотсодержащие органические соединения, молекулы которых построены из остатков аминокислот. Названием белки (или белковые вещества) принято обозначать класс соединений, которые по аналогии с белком куриного яйца при кипячении (денатурации) приобретают белый цвет.
Термин «протеины», введенный Барцелиусом в 1838 г., происходит от греческого слова proteios , означающего «первостепенный». Оно достаточно точно отражает главенствующее биологическое значение важнейшего класса соединений, которое заключается в обеспечении сложной иерархии молекулярной структуры и специфических функций живых организмов.
В природе существует примерно от 10 10 до 10 12 различных белков, составляющих основу 1,2 10 6 видов живых организмов , начиная от вирусов и заканчивая человеком. Огромное разнообразие белков обусловлено способностью 20 протеиногенных α-аминокислот взаимодействовать друг с другом с образованием полимерных молекул с молекулярной массой от 5 тыс. до 1 млн. (и более) дальтон. К примеру, включение в состав белка остатков только 15 аминокислот приводит к получению приблизительно 1,3 10 12 изомеров. Поэтому нетрудно представить, какое многообразие белков со всеми особенностями структурной организации возможно в природе при условии включения в полимерную цепь около сотни и более протеиногенных аминокислот.
Каждый вид живых организмов характеризуется индивидуальным набором белков , определяемым наследственной информацией, закодированной в ДНК. Информация о линейной последовательности нуклеотидов ДНК переписывается в линейную последовательность аминокислотных остатков, которая, в свою очередь, обеспечивает самопроизвольное формирование трехмерной устойчивой структуры индивидуального белка. Расположение белковых молекул в пространстве определяет их биологические функции, главными из которых являются структурная (кератин волос, ногтей, коллаген соединительной ткани, эластин, муцины слизистых выделений), каталитическая (ферменты), транспортная (гемоглобин, миоглобин, альбумины сыворотки), защитная (антитела, фибриноген крови), сократительная (актин, миозин мышечной ткани), гормональная (инсулин поджелудочной железы, гормон роста, гастрин желудка) и резервная (овальбумин яйца, казеин молока, ферритин селезенки).
Резервная, или питательная, функция - это использование белков в качестве источника аминокислот, расходующихся на синтез белков и других активных соединений, регулирующих процессы обмена, например, в развивающемся плоде или проростках растений. Подобного рода белки откладываются про запас в процессах созревания семян и жизнедеятельности животных. Поэтому их еще называют запасными. Запасные белки растительного происхождения , в соответствии с классификацией Осборна, относятся к классам проламинов (глиадин пшеницы, гордеин ячменя, зеин кукурузы) и глютелинов (оризенин риса, глютенин пшеницы). Такие белки достаточно широко распространены в природе и в относительно большом количестве входят в состав пищи и кормов животных.
Белковые вещества участвуют в осуществлении множества и других важнейших процессов в организме, таких, например, как возбудимость, координация движений, дифференцировка клеток.
БЕЛКИ В ПИТАНИИ ЧЕЛОВЕКА.
ПРОБЛЕМА БЕЛКОВОГО ДЕФИЦИТА НА ЗЕМЛЕ
Белковые вещества наделяют организм пластическими свойствами, заключающимися в построении структур субклеточных включений (рибосом, митохондрий и т. Д.), и обеспечивают обмен между организмом и окружающей внешней средой. В обмене веществ участвуют как структурные белки клеток и тканей, так и ферментные и гормональные системы. Белки координируют и регулируют все то многообразие химических превращений в организме, которое обеспечивает функционирование его как единого целого.
Все элементы клеток находятся в процессе обновления, при котором распад уравновешивается ресинтезом, то есть имеет место стационарное состояние фиксации равновесия. О стационарном состоянии и целостности организма свидетельствует равновесие между скоростью синтеза и распада белков тела. Белки в организме человека обновляются постоянно независимо от его возраста. В молодом растущем организме скорость синтеза белков превышает скорость распада; при тяжелых заболеваниях или голодании – наоборот. Наиболее быстрому обновлению подвергаются белки печени и слизистой оболочки кишечника (до 10 дней), наиболее медленному (до 180 дней) – белки мышц (миозин), соединительной ткани (коллаген) и мозга (миелин). Период обновления гормонов измеряется часами или даже минутами (инсулин). Скорость обновления белков выражается временем, необходимым для обмена половины всех молекул. Эта величина носит название периода полужизни (Т1/2). Средняя величина Т1/2 для белков всего организма составляет примерно 3 недели. Общая скорость синтеза белков у человека достигает 500 г в день, что почти в 5 раз превосходит потребление их с пищей.
Клетки организма человека не могут синтезировать необходимые белки, если в составе пищи отсутствует хотя бы одна незаменимая аминокислота. Синтез белков также нарушается, если часть аминокислот в кишечнике разрушается патогенной микрофлорой, аминокислоты плохо всасываются, а протеолитические ферменты желудочно-кишечного тракта мало активны. Удаление части аминокислот из организма с продуктами обмена веществ обуславливает его отрицательный азотистый баланс.
Показатель азотистого баланса используется для оценки степени обеспеченности человека белковой пищей. Положительный баланс азота (г/сут) характерен для молодого организма и беременных женщин, отрицательный - для людей, пища которых бедна белком, для больных с нарушениями процессов переваривания пищи и людей пожилого возраста.
Состояние, при котором количество азота, поступающего с пищей, равно количеству азота, выводимого из организма, характерно для азотистого равновесия. Им обладает здоровый взрослый человек, потребляющий полноценные белки в необходимом количестве. Азотистый баланс у такого организма равен нулю.
В соответствии с рекомендациями ВОЗ и ФАО величина оптимальной потребности в белке составляет 60-100 г в сутки или 12-15% от общей калорийности пищи. В общем количестве энергии на долю белка животного и растительного происхождения приходится по 6-8%. В пересчете на 1 кг массы тела потребность белка в сутки у взрослого человека в среднем равняется около 1 г, тогда как для детей, в зависимости от возраста, она колеблется от 1,05 до 4,00 г.
Рекомендуемые нормы потребления основных пищевых веществ для основных групп населения, выработанные российской научной школой питания, включают 73-120 г белка в сутки для мужчин и 60-90 г для женщин, в том числе белка животного происхождения 43-65 и 43-49 г, соответственно. Нижняя граница относится к тем, чья деятельность не связана с физическим трудом, верхняя - к людям, испытывающим тяжелые физические нагрузки. В среднем, для взрослого мужчины в возрасте 30 лет необходимый уровень потребления белка в пересчете на азот равен 9,0-9,2 г в сутки на 1 кг массы тела. Потребность в белке для лиц, перенесших тяжелые инфекции, хирургические вмешательства, имеющих заболевания органов пищеварения, дыхания, увеличивается в среднем до 110-120 г в день, а в высокобелковой диете, например, у диабетиков его количество может достигать 135-140 г. Белок ограничивается до 20-40 г в сутки при заболеваниях, связанных с почечной недостаточностью, подагре и некоторых других.
Традиционным путем увеличения ресурсов пищевого белка является повышение производительности растениеводства и животноводства на основе технологий возделывания зернобобовых, масличных и злаковых культур, употребляемых как непосредственно в пищу, так и на корм скоту. Наибольшие количества белка, и особенно лизина, обеспечивают посевы зернобобовых культур: сои, нута, чечевицы, гороха, люпина. Однако, бобовые культуры, используемые непосредственно в пищу, не являются традиционными для многих народов, к тому же трудно достичь высоких урожаев и расширения площадей посева любой культуры в силу особенностей почвенно-климатических условий выращивания и применения агротехнических мероприятий.
Растительный рацион, содержащий полноценный белок в необходимом количестве, может быть создан на основе использования пищевых продуктов, полученных из разных источников.
В последние годы все большее внимание уделяется получению новых видов белковой пищи, производство которых основано на использовании полноценных по аминокислотному составу растительных белков. Научные и практические основы производства пищевых изделий с применением белкового сырья растительного происхождения для замены продуктов из натурального мяса, рыбы и птицы в нашей стране заложены А. Несмеяновым с сотрудниками еще в 1971 г. Однако, учитывая сложность и высокую стоимость отдельных стадий производства, данное направление пищевой промышленности только зарождается.
Увеличение количества пищевого белка за счет животноводства является менее перспективным путем, по сравнению с растениеводством. На получение 1 кг животного белка, содержащегося в молоке, мясе и яйцах, требуется израсходовать 5-8 кг кормового белка. При этом коэффициенты трансформации растительных белков в белки высокопродуктивных животных и птиц очень низкие (25-39%). В процессе трофической (пищевой) цепи теряется 60-75% белка в непереваренных остатках корма, неутилизированных в организме аминокислотах, выделяемых с мочой в виде продуктов распада, в процессах обмена (движении, обновлении белков тканей и т. д.) и через кожно-волосяные покровы. Особенно большие потери белков происходят за счет затрат на их биосинтез, так как животные белки значительно отличаются по аминокислотному составу от белков растений. Отсутствие у животных способности синтезировать ряд аминокислот приводит к тому, что свои потребности в последних они удовлетворяют за счет повышенного количества растительных белков. Организм животного может синтезировать ряд недостающих аминокислот, но только в ущерб деятельности гормональной и ферментативной систем. Отсюда актуальным является сбалансированное кормление животных (отходы мясомолочной, рыбной промышленности, соевый шрот и т.д.) в целях повышения коэффициента трансформации белков в животноводческую продукцию .
В ближайшие годы растениеводство и животноводство, вероятно, будут основными источниками пищевого белка, однако важное место в решении белковой проблемы отводится и рыболовству . В то же время запасы морепродуктов ограничены.
Так, в недавнем прошлом Россия была единственной страной, производящей микробиологический белок для кормления животных - БВК. Из объема свыше 1 млн. т/год 60% продукции выпускалось на основе парафинов нефти, а 40% - на основе гидролизатов древесины. Организация производства белка осуществлялась и с использованием спирта и природного газа. Такие технологические процессы экономически выгодны при отсутствии соевого белка для кормления животных. По содержанию незаменимых аминокислот и витаминов дрожжевая масса не уступает, а иногда даже и превосходит соевые белки. Добавка БВК в корма экономит фуражное зерно (5 т на 1 т БВК) и увеличивает привесы животных.
В решении проблемы дефицита белка за последние два десятилетия определилось новое биотехнологическое направление - получение пищевых объектов с повышенным содержанием и улучшенным качеством белка методами генетической инженерии . Сущность генетической инженерии заключается в переносе генов любого организма в клетку реципиента для получения растений, животных или микроорганизмов с рекомбинированными генами, а, следовательно, и с новыми полезными свойствами. Растения, животные и микроорганизмы, полученные генетической инженерией, называются генетически измененными, а продукты их переработки - трансгенными пищевыми продуктами .
Генетическая инженерия, или рекомбинация in vitro, включает выделение чужеродного гена ДНК, получение гибридных (рекомбинированных) молекул ДНК и введение их в живые клетки модифицируемого, например, растения для получения новых признаков организма.
Наиболее интенсивно проводятся работы с такими сельскохозяйственными культурами как соя, пшеница, кукуруза, томаты, сахарная свекла, картофель, хлопчатник, рапс.
Продукты, полученные с использованием генов микроорганизмов и растений, по сравнению с традиционными продуктами, содержат меньше пестицидов, консервантов, остаточного количества тяжелых металлов, они не требуют обработки химическими препаратами от вредителей. Трансгенная соя и кукуруза устойчивее к сорнякам и насекомым, трансгенные томаты невосприимчивы к вирусным заболеваниям, а ботва картофеля несъедобна для колорадского жука. Соя, содержащая ген пшеницы, к примеру, имеет биологическую ценность 1,0 против 0,92 у традиционной, а картофель, полученный с пересаженным геном фасоли, содержит повышенное количество белка (на 6%).
Одним из способов интенсификации производства продуктов питания с повышенным содержанием качественного белка является внедрение урожайных сортов растений , не подверженных влиянию пестицидов, гербицидов, инсектицидов, но обладающих рядом других полезных свойств (морозоустойчивость, засухоустойчивость, отсутствие способности к полеганию, определенные размеры семян и повышенная биологическая ценность).
С помощью генетически измененных бактерий получают ферменты, которые применяются при производстве глюкозного сиропа из крахмала, при производстве кондитерских, хлебобулочных изделий (амилазы), соков и вин (пектиназы). При этом улучшаются физико-химические и органолептические показатели качества пищевых продуктов.
Потребление генетически модифицированных продуктов находится под контролем специальных органов, так как введение в организм растений генов, ответственных за синтез белков, например, альбуминов молока, яиц и т.д., заключает в себе опасность употребления в пищу продуктов питания, непереносимых определенной группой людей (пищевая аллергия).
Подходы к оценке безопасности и качества генетически модифицированных объектов разные и по содержанию и объему, но во всех странах разрабатываются специальные методы и критерии. В России принят закон «О государственном регулировании в области генной инженерной деятельности » и создана специальная Комиссия во главе с главным санитарным врачом РФ, задача которой состоит в разработке подзаконных актов и методик контроля общей безопасности трансгенных продуктов. С учетом выполненных комплексных мер, в РФ разрешена для использования в питании населения соя линии 40-3-2 («Монсанто Ко», США) и белковый концентрат из нее.
БЕЛКОВО-КАЛОРИИНАЯ НЕДОСТАТОЧНОСТЬ И ЕЕ ПОСЛЕДСТВИЯ.
ПИЩЕВЫЕ АЛЛЕРГИИ
Белковая недостаточность является важнейшей проблемой питания. Бедно живущие семьи на фоне недостаточно калорийной пищи потребляют мало белка, при этом возникает синдром дистрофии, который называется квашиоркором . Богатая белком пища дорого стоит, поэтому не все слои населения могут ею постоянно питаться. Квашиоркор у человека развивается при частичном (или полном) голодании и при потреблении неполноценных белков. Заболевание сопровождается нарушением функции кишечника, так как с надлежащей скоростью не синтезируются ферменты поджелудочной железы и не обновляются клетки его слизистой оболочки. Возникает порочный круг квашиоркора, характеризующийся прекращением процесса усвоения белка пищи. В организме развивается отрицательный азотистый баланс, нарушается водно-солевой обмен, появляется атония мышц и остановка роста. Пищевая дистрофия особенно опасна для младенцев. Квашиоркор может сопровождаться их гибелью от диареи, острых инфекций, заболеваний печени и отставанием в физическом и умственном развитии. Резкое снижение синтеза белка в печени на фоне недостаточного поступления его в организм уменьшает количество сывороточного альбумина, липопротеидов низкой плотности (ЛНП) и гемоглобина.
Нарушения обмена гистидина выражаются в снижении активности фермента гистидинаммиаклиазы и повышении активности гистидиндекарбоксилазы. Это вызывает накопление избытка гистидина в тканях. При недостатке триптофана снижается синтез никотиновой кислоты и накапливается ксантуреновая кислота, которая угнетает β-клетки островков Лангерганса поджелудочной железы, провоцируя тем самым возникновение диабета.
Отрицательную роль для человека играют пищевые аллергии, связанные с непереносимостью организмом отдельных видов белковой пищи (молоко, яйца, орехи, белки некоторых злаков). Термин «аллергия» происходит от двух греческих слов: «аллос» - другой и «эргон» - действие. При нормальном пищеварении белки расщепляются в желудочно-кишечном тракте до аминокислот, не являющихся антигенами (аллергенами) и не вызывают ответной иммунной (защитной) реакции. Если в кровяное русло без предварительного расщепления через эпителий кишечника проникает незначительное количество белков пищи, то в организме поддерживается как бы тренинг иммунной системы для защиты от действия чужеродных компонентов. При значительном поступлении в кровяное русло аллергенов возникает острая реакция , проявляющаяся в зуде, кожных высыпаниях или желудочно-кишечных расстройствах. Природа таких реакций до конца не выяснена. Предотвратить пищевую аллергию у младенцев возможно грудным вскармливанием или нагреванием некоторых белков до 120°С, однако наиболее эффективным способом борьбы является исключение аллергена из диеты.
Cтраница 1
Белковые вещества, попадая в пищеварительные органы человека, не проникают в кровь в виде целых молекул. При помощи пищеварительных ферментов, которые в свою очередь являются белками, пищевой белок расщепляется в органах пищеварения на отдельные аминокислоты. Эти обломки белковых молекул уже не имеют тех характерных признаков, которые присущи отдельным белкам. Они обладают способностью всасываться через стенки тонких кишок в кровь и, попадая в кишечные вены, немедленно разносятся по всему организму. Здесь, с помощью других ферментов-белков, из аминокислот синтезируются новые белки, необходимые для построения протоплазмы живой клетки, специфичной для каждого отдельного органа.
Белковые вещества (протеины) состоят из большого количества различных аминокислот, которые связаны пептидной связью, специфичной для каждого вида белка. Под образованием пептида понимают взаимодействие карбоксильной группы одной молекулы аминокислоты с аминогруппой другой с выделением воды.
Белковые вещества, как и дикетопиперазины, дают при нагревании с пикриновой кислотой оранжевое окрашивание, в то время как полипептиды этой реакции не дают.
Белковые вещества составляют необходимую часть пищи человека и животных, которую нельзя заменить никакими другими веществами, кроме аминокислот - продуктов гидролиза белка.
Белковые вещества объединяют чрезвычайно большую и разнообразную группу азотсодержащих полимеров органического типа. Удельный вес такого рода полимеров в промышленности пластмасс невелик. Галалит - продукт термохимических превращений казеина, имеет ряд недостатков: пониженную водостойкость, которая выражается в склонности к набуханию и потери механических свойств, и малую устойчивость к микологическим поражениям. Это ограничивает применение галалита в машиностроении.
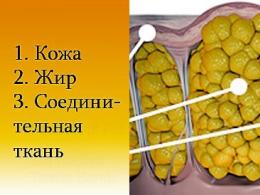
Белковые вещества в мезге уже при температуре 75 - 80 С и влажности 10 % глубоко денатурируются.
Белковые вещества в процессе варки переходят в аминокислоты.
Белковые вещества, или белки, представляют собой высокомолекулярные органические соединения, сложные молекулы которых построены из аминокислот.
Белковые вещества, жиры и эфирные масла являются или продуктами распада отмерших организмов водной микрофлоры и микрофауны, или продуктами их обмена веществ. Эфирные масла обладают интенсивным запахом, по которому они могут быть обнаружены в воде даже в очень малых концентрациях.
Белковые вещества широко распространены в природе, входя в состав всей живой материи и играя доминирующую роль в протоплазме клеток. В живых организмах, по-видимому, содержатся десятки тысяч, а может быть и сотни тысяч различных белков. Все химические процессы в любой из живых клеток осуществляются при помощи биологических катализаторов - белков-ферментов.
Белковые вещества состоят из следующих основных элементов: углерода, водорода, кислорода, азота и серы. Кроме того, во многих протеинах содержатся и иные элементы, например фосфор Р - 0 5 - 0 6 %, некоторые галогены, атомы металлов, в частности, Fe2, Fe3, Co2, Mn2, Са2, Mg2 и другие.
Белковые вещества обладают способностью связывать значительные количества воды - гидратироваться. Важность гидратации белков видна из того, что вода представляет собой универсальную среду биологических реакций. Гидратация состоит в связывании дипольных молекул воды с ионами или ионными группами, а также с диполями или полярными группами; она происходит и в растворах, и в твердых веществах. Значительную гидратацию белков обусловливает наличие на поверхности их молекул большого количества разнообразных полярных, в том числе ионогенных, групп. Количество гидратационной воды, связанной с альбуминами и глобулинами, составляет 0 2 - 0 6 г на 1 г сухого веса белка.
БЕЛКОВЫЕ ВЕЩЕСТВА , белки , протеины , принадлежат к азотистым органическим соединениям; они играют выдающуюся роль в биологических процессах, т. к. полужидкая протоплазма клеток, из которых построены все живые существа, состоит из смеси белкового вещества с другими органическими и неорганическими веществами; животные и растительные соки содержат белковые вещества в растворенном виде; в твердом виде белковые вещества составляют остов и наружные покровы тела животных, и в этом отношении они играют в мире животных такую же роль, какую целлюлоза играет в мире растений. При различных биологических процессах белковые вещества организма постепенно изнашиваются, разрушаются, поэтому живые организмы нуждаются в белковом питании. Растения сами синтезируют нужные им белковые вещества из неорганических материала, животные же лишены этой способности, и поэтому в пищевой режим их должны быть включены белковые вещества, гидролизующиеся их пищеварительным аппаратом до аминокислот, из которых организм животных синтезирует свои собственные белки. Различные пищевые материалы содержат различные количества белковых веществ: в сыром мясе и рыбе 17-21%, в колбасе 25%, в яйцах 12,5%, в молоке около 4%, в твороге 14,7%, в сыре около 25%, в муке 9,5-10,5%, в хлебе 6,8-7,8%, в крупе 12-13%, в сырых овощах 1-2%, в горохе, бобах 23-25%, в сухих грибах 28,5%, в питательных дрожжах 53%. Из технических продуктов много белков в высушенной крови - около 76%, в рыбной муке 74%, в рыбной чешуе 68,5%.
Кристаллизация и молекулярный вес . Белковые вещества кристаллизуются лишь в виде исключения, притом кристаллы их, подобно губке, упорно удерживают посторонние примеси, что сильно затрудняет их очистку. Несмотря на то, что уже давно наблюдали алейроновые кристаллы белковых веществ на микроскопических срезах семян некоторых растений, до самого последнего времени считали белковое вещество веществом аморфным, типичными органическими коллоидами, причем принимали коллоидальные частицы за отдельные молекулы. Вследствие этого приписывали белковым веществам громадный молекулярный вес, тем более, что он не мог быть определен эмпирически обычными физико-химическими методами: белковые вещества нельзя превратить в пар для определения молекулярного веса по плотности пара, нельзя нагревать их растворы до кипения для определения молекулярного веса по эбулиоскопическому способу (при высокой температуре они свертываются); криоскопическое определение тоже ненадежно, так как понижение температуры замерзания растворов ничтожно и зависит не столько от истинного молекулярного веса белков, сколько от степени ассоциации молекул в отдельных дисперсных частичках вещества и, кроме того, оно маскируется гораздо большей депрессией, вызываемой минеральными примесями (золой); в лучшем случае криоскопический способ дает максимальные числа, соответствующие ассоциированным молекулам. По Зеренсену (1918 г.), молекулярный вес кристаллического яичного альбумина, определенный тщательным измерением осмотического давления водного раствора, равен 34000. Химический способ определения молекулярного веса дает меньшие числа; он основан на результатах элементарного анализа белковых веществ, причем принимается во внимание, что содержание входящих в их состав элементов не м. б. меньше целого атома ни для одного из них; в гемоглобине содержится, например, 0,43% S, почему молекулярный вес его не м. б. меньше 7440, и т. д.
Новейший рентгеноскопический метод исследования (способ Дебай-Шерера), будучи применен к белковым веществам (опыты Герцога и Янке 1920 г. и других), показал, что многие из них построены из мельчайших кристаллов, невидимых даже в микроскоп; кристалличными оказались, например, шелк и яичный белок, а шерсть и волосы - аморфными. Рентгенограммы позволяют приблизительно вычислить абсолютные размеры элементарных параллелепипедов, из которых построены кристаллы; оказалось, например, что элементарный параллелепипед фиброина шелка чрезвычайно мал (по исследованиям Поляни, объем его = 680∙10 -24 см 3), из чего можно сделать вывод, что молекулы фиброина не м. б. велики: они несравненно меньше, чем предполагалось раньше. Эти т. н. «элементарные молекулы», кристалличные сами по себе, образуют тем не менее лишь коллоидальные растворы: по-видимому, они обладают в высокой степени способностью ассоциироваться (за счет т. н. остаточного сродства, которое нередко проявляется у целых молекул после насыщения обычного, главного сродства) в громоздкие агрегаты с настолько малой степенью дисперсности, что их размеры переходят границу, отделяющую истинные растворы от коллоидальных. Степень ассоциации в значит, мере зависит от внешних физических условий (температуры, концентрации и т. д.), поэтому определение молекулярного веса белковых веществ теряет обычное значение и дает лишь колеблющиеся результаты, указывающие не на молекулярный вес элементарных молекул, а на степень их ассоциации при условиях данного опыта.
Растворимость . Некоторые белковые вещества растворимы в воде (альбумины , нуклеопротеиды), другие - нерастворимы в чистой воде, но растворяются в разбавленных растворах нейтральных солей (глобулины) или в щелочах (фиброин, муцины), или в кислотах (протамины, спонгин); растворы оптически активны, вращают влево. Почти все (за исключением немногих растительных белков, например, глиадина и гордеина) нерастворимы в спирте, почему осаждаются из водных растворов при прибавлении спирта. Коллоидальные растворы белковых веществ не диффундируют через животные перепонки и коллодионные пленки, чем пользуются при очистке белковых веществ от минеральных примесей путем диализа. Для разделения смеси белков применяют метод дробного высаливания, основанный на том, что отдельные белки осаждаются из своих растворов при прибавлении различного количества насыщенных растворов (NH 4) 2 SO 4 , MgCl 2 и других солей (Гофмейстер). Растворы белковых веществ свертываются или коагулируют от воздействия различных факторов: нагревания (до 60-75°), прибавления электролитов (солей, кислот, щелочей), изменения дисперсионной среды (растворителя), прибавления спирта, ацетона и т. д. При этом наряду с физико-химическим процессом уменьшения степени дисперсности (соединения распыленного в растворителе белкового вещества в большие конгломераты) могут идти и более глубокие химические процессы с изменением строения и свойств молекул белковых веществ (белковые вещества денатурируются); некоторые белки денатурируются под влиянием энзимов (например, казеин - при действии на него сычужным ферментом). Сильная кислотность или щелочность растворов препятствует свертыванию, причем получаются растворимые в кислотах и щелочах продукты - ацидальбумины и щелочные альбуминаты . Для каждого белкового вещества существует определенная концентрация водородных ионов (изоэлектрическая точка ), при которой с особенной легкостью происходит свертывание раствора при нагревании (Михаэлис).
Выделение и очистка белковых веществ ; осаждение их из растворов и очистка от минеральных примесей производится диализом.
Качественные реакции на белковые вещества . Реакции эти основаны или на осаждении белковых веществ в виде нерастворимых соединений или на изменении цвета растворов или осадков. Главнейшие из них следующие: 1) свертывание слабокислых растворов при кипячении (не все белковые вещества показывают эту реакцию); 2) осаждение небольшими количествами солей тяжелых металлов: HgCl 2 , уксуснокислого Рb и др.; 3) осаждение кислотами - фосфорномолибденовой, железистосинеродистоводородной, пикриновой, сульфосалициловой, таннином; 4) образование черного осадка PbS при кипячении раствора белковых веществ со щелочным раствором свинцовой соли; 5) биуретовая реакция - фиолетовое окрашивание при нагревании с NaOH и каплей 2%-ного раствора CuSO 4 (альбумозы и пептоны дают красноватую окраску, аминокислоты совсем не показывают биуретовой реакции); 6) ксантопротеиновая реакция - желтое окрашивание при нагревании с HNO 3 (зависит от присутствия в белковых веществах тирозиновой и триптофановой групп); 7) Милонова реакция - образование красной коагулированной массы при кипячении белковых веществ с раствором Hg 2 (NO 3) 2 , содержащим HNO 2 (эту реакцию дает тирозиновая группа); 8) нингидриновая реакция - синее окрашивание с трикетогидринденгидратом; эту реакцию показывают также и α-аминокислоты.
Белковые вещества имеют двойственный, амфотерный характер - обладают одновременно очень слабыми основными и очень слабыми кислыми свойствами; у протаминов и гистонов ясно выражен основной характер.
Элементарный состав белковых веществ . В состав всех их входят 5 элементов: С, Н, О, N, S; некоторые содержат еще Р (нуклеины, казеин). Содержание этих элементов колеблется: С 50-55%, Н 6,5-7,5%, N 15-17,6%, О 20-24%, S 0,3-2,4%, Р 0,4-0,9%. У глюкопротеидов N меньше: 11,7-12,3%; протамины не содержат S; гемоглобин содержит Fe (0,3-0,5%). Недавно открыты белковые вещества, содержащие J и др. галоиды. Почти неизбежно содержание золы - вследствие трудности отделения диализом последних следов неорганических примесей.
Гидролиз белковых веществ . Процесс этот происходит под влиянием кислот, щелочей, энзимов и при гниении; наиболее энергично действуют кислоты, щелочи - медленнее, но с наибольшей постепенностью протекает гидролиз при действии энзимов.
Шютценберже (1875-80 гг.) нагревал белковые вещества с баритовой водой до 200° под давлением, причем ему удалось выделить из сложной смеси продуктов реакции лишь немногие труднорастворимые кристаллические аминокислоты (лейцин и тирозин). Позднее Э. Фишер нашел более удобный способ расщепления белковых веществ - кипячением с дымящей соляной кислотой или с 25%-ной H 2 SO 4 ; он же выработал способ разделения получающейся смеси аминокислот: смесь эту этерифицируют, пропуская сухой газообразный НСl в раствор в абсолютном спирте, причем образуются хлористоводородные соли эфиров, которые разлагаются на холоде при действии КОН, свободные сложные эфиры извлекают эфиром, который затем отгоняют, и оставшиеся сложные эфиры аминокислот подвергают дробной перегонке под уменьшенным давлением и т. о. изолируют отдельные аминокислоты в виде их эфиров, которые затем омыляют. По этому способу удается получить 60% от веса взятого белкового вещества в виде изолированных аминокислот. Метод был применен к очень большому числу различных белковых веществ (свыше 100), и в результате получались одни и те же аминокислоты, числом около 20 (в различных количественных соотношениях): 1) одноосновные α-моноаминокислоты - гликоколь, аланин, аминомасляная кислота, валин, лейцин, изолейцин, фенилаланин; 2) одноосновные диаминокислоты - орнитин, аргинин, лизин; 3) одноосновные аминооксикислоты - серин, тирозин; 4) двуосновные аминокислоты, аспарагиновая кислота, глутаминовая кислота; 5) содержащие серу аминокислоты цистеин и цистин; 6) гетероциклические аминокислоты - пролин, оксипролин, триптофан, гистидин. При гидролизе некоторых белковых веществ наряду с аминокислотами получаются и другие вещества: углеводы (глюкопротеиды), фосфорная кислота, пуриновые и пиримидиновые основания (нуклеопротеиды). Энзиматический гидролиз белковых веществ при процессах пищеварения осуществляется протеолитическими энзимами: пепсином желудочного сока, трипсином и эрепсином поджелудочной железы и стенок кишок; энтерокиназа , выделяемая слизистой оболочкой кишок в готовой форме, а панкреатической железой - в виде вещества, из которого она образуется, служит активатором трипсина. Пепсин вызывает первые стадии гидролиза белковых веществ (не действует на пептиды); трипсин также гидролизует белки, но б. ч. лишь в присутствии активатора с образованием пептидов (в отсутствии энтерокиназы расщепляет лишь клупеин и пептоны); эрепсин заканчивает гидролиз - расщепляет пептиды на аминокислоты, но не действует на белки и пептоны. Т. о. сложные молекулы белковых веществ при комбинированном действии протеолитических энзимов постепенно расщепляются на вещества, состав которых все более упрощается, в такой последовательности: белковые вещества à альбумозы à пептоны à полипептиды à дипептиды à аминокислоты. Альбумозы ближе всего стоят к белковым веществам, они не свертываются при нагревании, но высаливаются сернокислым аммонием - в отличие от пептонов, которые уже не высаливаются; и те, и другие показывают биуретовую и ксантопротеиновую реакцию. Э. Фишеру и Абдергальдену удалось изолировать из продуктов гидролиза фиброина тетрапептид и трипептид; еще больше число полученных дипептидов, многие из которых оказались идентичными с синтетическими дипептидами. Процессы гидролитического расщепления белковых веществ происходят также и при гниении их, которое начинается уже в кишечнике животных. В результате получаются еще более простые продукты расщепления, так как аминокислоты разлагаются при действии бактерий с отщеплением СО 2 , H 2 S, NH 3 и с образованием фенола, крезола, скатола, индола, птомаинов, жирных кислот и др.
Строение белковых веществ до сих пор еще не выяснено окончательно. По предположению Э. Фишера, белковые молекулы состоят из очень длинных прямых цепей, образованных из амидообразно соединенных между собой остатков аминокислот. Для проверки своей теории Э. Фишер синтезировал полипептиды, в которых осуществляется именно такая связь аминокислот:
RCH(NH2)CO-HNCHR"CO-HNCHR"CO
и т. д., где R", R" и т. д. - одинаковые или различные радикалы. С 2 молекулами аминокислот получаются дипептиды, из 3 молекул - трипептиды, из 4 - тетрапептиды и т. д. Простейший дипептид - глицил-глицин, в состав которого входят 2 остатка гликоколя: NH 2 ∙СН 2 ∙СО∙NH∙СН 2 ∙СООН. Э. Фишер получил полипептид с молекулярным весом 1213 (15 остатков гликоколя и 3 остатка лейцина), а Абдергальден и Фодор - еще более сложный, с молекулярным весом 1326 (15 остатков гликоколя и 4 остатка лейцина). Высшие синтетические полипептиды оказались весьма сходными с альбумозами и пептонами: они тоже обнаруживают амфотерный характер, распадаются на те же продукты гидролиза; при действии кислот и энзимов полипептиды показывают большинство белковых реакций; физические свойства тоже сходны: полипептиды дают коллоидальные растворы, коагулирующиеся, высаливающиеся и осаждающиеся при тех же условиях, что и белковые растворы. Вышеупомянутые полипептиды с 18 и 19 остатками аминокислот так сходны с белковыми веществами, что если бы они были найдены в природе, то их причислили бы, вероятно, к белковым веществам. Несмотря, однако, на такое сходство синтетических полипептидов с альбумозами, пептонами и белковыми веществами, в новейшее время возникают сомнения относительно существования в природных белковых веществах чрезвычайно длинных прямолинейных цепей; такие же длинные открытые цепи принимались раньше также в молекулах высших углеводов (крахмала, целлюлозы), но за последние годы такие воззрения совершенно оставлены в химии углеводов: взамен колоссальных нитевидных молекул принимают небольшие элементарные молекулы циклического строения, ассоциированные в громоздкие агрегаты с кажущимся большим молекулярным весом. На существование циклической связи в молекулах белков указывает факт получения в некоторых случаях при их гидролизе циклических ангидридов аминокислот, т. н. дикетопиперазинов ; простейший дикетопиперазин (из гликоколя) имеет строение:

Но до сих пор не выяснено еще окончательно, являются ли эти дикетопиперазины первичными продуктами расщепления белковых веществ, или же они получаются в результате циклизации первично образовавшихся аминокислот. Кроме того, в результате новейших рентгеноскопических исследований возникает вопрос о самом принципе соединения отдельных составных частей в молекулах белковых веществ: может быть белковые вещества являются продуктами ассоциации индивидуальных, сравнительно простых, притом неоднородных молекул; эта связь должна быть устойчивой и небеспорядочной в смысле пространственного расположения, для того чтобы объяснить высокую специфичность белковых веществ.
Синтезы белковых веществ . О попытках синтетического получения белковых веществ в лабораториях см. выше. Организм животных и человека производит синтез белковых веществ из аминокислот, получающихся при энзиматическом гидролизе белковых веществ в пищеварительном аппарате. По взглядам Абдергальдена, аминокислоты всасываются стенками кишечника, и тут же происходит синтез белков, свойственных крови, которые разносятся кровью по всему организму; отдельные клетки тела снова перестраивают белки крови в нужные им белковые вещества. Механизм синтеза белковых веществ в растениях не выяснен еще окончательно. Новейшие исследования (Бодиша, Боме и др.) указывают на то, что в образовании белковых веществ, вероятно, принимает участие формальдегид СН 2 О, являющийся первым продуктом ассимиляции растениями СО 2 в зернах хлорофилла, который образует с неорганическими азотистыми соединениями формгидроксамовую кислоту НО∙СН:N∙ОН, превращающуюся при дальнейшем действии света в аминокислоты, а эти последние (вероятно при действии энзимов) образуют белковые вещества.
Классификация и номенклатура белковых веществ . Обычно подразделяют белковые вещества на 2 главные группы: настоящие белки, или протеины, и сложные белки, или протеиды. Иногда выделяют в первой группе еще подгруппу альбуминоидов - белковые вещества покровов и скелета.
I. Настоящие белки : 1) альбумины - содержатся в яичном белке, молоке и в кровяной сыворотке; они растворимы в воде, щелочах и кислотах, свертываются при кипячении и высаливаются при насыщении (NH 4) 2 SО 4 ; 2) глобулины - эдестин растительных семян, миозин мускульного сока, фибриноген крови; нерастворимы в чистой воде, растворяются в разбавленных растворах солей и в щелочах; обладают слабокислыми свойствами; высаливаются сернокислым аммонием легче альбуминов, чем и пользуются для их разделения; 3) гистоны - содержатся в лейкоцитах, в красных кровяных шариках, в нуклеопротеидах; обладают ясно выраженным основным характером; 4) протамины - содержатся в сперме рыб, имеют довольно сильные основные свойства; при гидролизе дают очень много аргинина (до 85%). Приводимые далее альбуминоиды - белковые вещества покровов и скелета - отличаются устойчивостью к химическим воздействиям; они растворяются, лишь претерпевая глубокие химические изменения; 5) коллаген - составляет органическую основу костей и хрящей; при кипячении с водой дает животный клей, в чистом, бесцветном виде называемый желатиной; 6) эластин - находится в связках, в волокнах соединительных тканей; 7) фиброин - содержится в шелке (около 53%); 8) кератин - главная составная часть ногтей, копыт, рогов, волос, перьев; 9) спонгин - содержится в губке.
II. Сложные белковые вещества, протеиды , являются соединениями белка с другими б. или м. сложными соединениями, что обнаруживается при их гидролизе: наряду с аминокислотами получаются и другие вещества. Сюда относятся: 1) фосфопротеиды или нуклеоальбумины , содержащие фосфорную кислоту, а именно: казеин молока, вителлин из желтка яиц; 2) нуклеопротеиды , образующие главную составную часть клеточных ядер; они состоят из белковых веществ, соединенных с нуклеиновыми кислотами, в состав которых входят: фосфорная кислота, основание группы пурина или пиримидина и пентозы (d-рибоза); 3) глюкопротеиды - представляют соединения белка с углеводами; сюда относятся животные слизи - муцины, при гидролизе которых наряду с аминокислотами получается d-глюкозамин (или галактозамин); к глюкопротеидам близко стоят хондромукоиды , которые вместе с коллагеном образуют хрящи, 4) хромопротеиды - соединения белков с окрашенными веществами; гемоглобин, главная составная часть красных кровяных шариков, является соединением белкового вещества глобина с гематином С 34 H 32 N 4 О 4 FeОН.
Анализ белковых веществ . Качественные реакции на белковые вещества - см. выше. Методы количественного определения основываются на определении содержания N в исследуемом материале по способу Кьельдаля, причем найденное процентное содержание N умножают на 6,25 (так как в большинстве природных белковых веществах содержится около 16% N). В отдельных случаях пользуются и другими методами, например, при исследованиях патологической мочи о количестве содержащихся в ней белковых веществ судят по объему осадка, образующегося при прибавлении к определенному объему мочи раствора лимонной и пикриновой кислот (метод Эсбаха).
Применение белковых веществ в технике . Белковые вещества находят применение в самых разнообразных отраслях производства.
1. Альбумин яичный употребляется: в текстильной промышленности - в качестве загусток (крашение хлопчатобумажных тканей и шерстяных изделий), в виноделии - для осветления вин, в бумажном производстве - при изготовлении искусственного пергамента Куглера и т. д., в кондитерском деле, в медицине - при приготовлении различных фармацевтических препаратов (например, препарат Liquorferrialbuminati).
2. Альбумин кровяной употребляется в текстильной промышленности в качестве загусток. Он обладает большей способностью сгущать краски, чем альбумин яичный, но для светлых тонов красок менее пригоден. При паточном производстве альбумин кровяной употребляется при подготовке патоки для брожения. Альбумин кровяной обесцвечивает дубильные экстракты. При производстве пластических масс альбумин кровяной идет в большом количестве (например, роговидная масса Бартша или Краузе). Альбумин кровяной применяется в фанерном производстве для замены клея. В пищевой промышленности альбумин кровяной идет для изготовления питательных препаратов (например, мясной экстракт Либиха), в медицине - для фармацевтических препаратов.
Альбуминаты , продукты соединения белков с основаниями, в технике имеют большое применение. Например, калиевый альбуминат (полученный от смешения яичного белка с крепким раствором поташа и затем промытый в воде до потери щелочности) послужил источником, из которого получены были альбуминаты меди, серебра и пр. Широкое применение альбумината серебра в фотографии общеизвестно (фотографические бумаги).
Казеин молока в последние годы получил чрезвычайно широкое применение. Казеин употребляется при изготовлении многочисленных пластических масс, как, например, галалит, масса Бартеля, искусственная слоновая кость, масса Стефана и пр. Во многих изоляционных массах главной составной частью (связующим веществом) является казеин. В текстильной промышленности казеин употребляется как загустка, а также входит как составная часть препарата, употребляемого для пропитывания ткани при изготовлении непромокаемых материй (например, брезентов). Кроме того, казеин употребляется в льняном и шелковом производствах. В кожевенной промышленности казеин идет на изготовление искусственной кожи, различных аппретов, сапожных чернил, вакс, кремов и пр. В бумажной промышленности казеин идет на приготовление некоторых сортов бумаги, картона, папье-маше , асбестобумажного картона и пр. Применение казеина в мыловаренной промышленности давно уже завоевало себе права гражданства. В парфюмерии казеин также нашел себе применение при изготовлении некоторых косметических препаратов (например, крема для кожи). Из казеина в последнее время стали делать искусственный шелк, причем нить получается очень эластичной и блестящей. Казеиновый клей, представляющий собой раствор казеина, разведенного в воде, к которой прибавлено немного буры или какой-либо щелочи (например, нашатырного спирта), является самым дешевым клеем, а по вяжущей способности успешно конкурирует с животным клеем. Применение казеинового клея в технике велико (фанерная промышленность, конторский клей, столярный «белый» клей и пр.). Существует много различных рецептов замазок, мастик и «цементов», где главной составной частью является казеин (казеиновый цемент - чистого песка 20 ч., казеина 16 ч., жженой извести 20 ч. - разводится водой до получения тестообразной массы; обладает высокой вяжущей способностью; употребляется в случаях невозможности спаивания для склейки металлов). В лаковаренной промышленности казеин идет для приготовления бесцветных казеиновых лаков. В большом количестве казеин идет в 3ападной Европе в пищевой промышленности для консервирования яиц, для приготовления искусственного саго, искусственного «яичного порошка», синтетического молока, для переработки маргарина в «сливочное масло» и пр. В строительном деле казеин употребляется для изготовления искусственного мрамора (при внутренней облицовке парадных лестниц, цоколя зданий), при подготовке штукатурки стен под живопись и пр. В живописи казеин употребляется для изготовления красок, например, красок профессора Кейма, отличающихся многими достоинствами перед масляными. В малярном деле казеин идет на приготовление быстро сохнущих замазок и клеевых казеиновых красок, не боящихся атмосферных влияний, на изготовление особых эмульсий-лаков для покрытия окрасок, произведенных простой клеевой краской, и пр.
Клейковина , глютин , белковые вещества хлебных зерен, употребляется в подмесь к альбуминной муке (хлеб диабетиков) и в макаронном производстве. При производстве пшеничного крахмала клейковина - продукт отброса.
Творог употребляется в пищевой промышленности, - продукт питания широкого потребления. В прикладной технике имеет мало применения (например, клей для фарфора). Служит иногда для замены казеина.
Белковые вещества - Белковые вещества вещества составляют громадный класс органических, то есть углеродистых, а именно углеродисто-азотистых соединений, неизбежно встречаемых в каждом организме до того, что каждая клетка растений содержит Белковые вещества вещества, а клетки животных организмов почти нацело состоят из Белковые вещества вещества, и жизненные отправления сосредоточиваются в тканях, содержащих эти вещества. Они, составляя вместе с водой принадлежность жизнедеятельности, отличаются великой изменяемостью своих свойств, непрочностью и легкой способностью ко множеству химических превращений. Эти свойства Белковые вещества веществ служат, с одной стороны, объяснением того непостоянства, которое отличает всякие растительные и животные вещества вне организмов, а с другой стороны - объясняют и то , что жизнедеятельность, сопровождаемая постоянной изменчивостью вещества, сосредоточивается в Белковые вещества веществах, как очень легко подвижной или легко изменяемой материи. Понятно отсюда, что белковые вещества составляют одну из важнейших задач естествознания, но до сих пор, несмотря на массу исследований, сделанных физиологами и химиками для изучения Белковые вещества веществ, они не поддаются тем приемам, которыми удалось овладеть громадной массой других углеродистых и углеродисто-азотистых веществ. Первейшую причину этого составляет чрезвычайная трудность отделения различных Белковые вещества веществ друг от друга и великая сложность их состава и превращений. Поэтому поныне нельзя, не впадая в односторонность, дать сколько-нибудь отчетливое, но краткое химическое описание Белковые вещества веществ. Многие сведения прямо противоречивы, не удовлетворяют современным химическим требованиям и страдают неполнотой. Поэтому для "Энциклопедического Словаря" следует ограничиться лишь общим первым знакомством с Белковые вещества веществами, которые подробнее рассматриваются в курсах физиологической химии. Для первого же знакомства с разнообразием, свойствами и приготовлением Белковые вещества веществ может служить приводимая вслед за сим недавняя (1890 г.) статья а ("Albuminoids"), помещенная в "A Dictionary of applied Chemistry" (by Thorpe, v. I, p. 28), потому что она написана объективно, лишена односторонности, в которую ныне, при неполноте сведений о Белковые вещества веществах, легко впасть в этом предмете. Статья Робинсона составлена преимущественно руководясь взглядами французского химика Бешана и отвечает не только первым химическим сведениям о Белковые вещества веществах, но касается и их заводско-фабричных применений. Некоторые из белковых веществ, вследствие их технического значения, например глютин, будут рассмотрены отдельно, тем более что статья Робинсона имеет в виду почти исключительно Белковые вещества вещества, встречающиеся в животном царстве, так как они наиболее доныне исследованы. В переводе [Переводила доктор медицины С. А. а.] мной произведены лишь немногие изменения. В статье о питательных веществах будет рассмотрено значение Белковые вещества веществ для питания человека и животных.
Белковые вещества вещества относятся к разряду углеродисто-азотистых соединений очень сложного состава; свойства их более или менее различаются друг от друга, как перечислено далее. Белковые вещества вещества встречаются в природе только в растениях и животных и присущи их жизни, в группу этих веществ входят также некоторые вещества, происходящие от действия реагентов на природные растительные и животные Белковые вещества вещества; но до сих пор ни одно белковое вещество не могло быть искусственно приготовлено из веществ не белкового происхождения. Следует заметить, что только растительная жизнь в состоянии синтезировать белковое вещество из неорганизованной (в почве, воде и воздухе находящейся) формы материи и что животная жизнь находится в такой прямой зависимости от растительной жизни, что белковые вещества, вполне необходимые для поддержания жизни животных, должны быть ими получены в готовом виде из растений или от других животных, живущих за счет растений. Животные, однако, могут превращать одно белковое вещество в другое, либо в вещества сходные, каковы клеевые, вещества кожные, те, которые образуют волосы, и т. п. Животные также в состоянии превращать белковые вещества в жир или в более простые продукты окисления. Большая часть азота Белковые вещества веществ, подвергающихся окислению в теле, выделяется почками в виде мочевины; этим путем выделяемая мочевина составляет приблизительно ⅓ веса окисленных белковых веществ. Название Белковые вещества или "альбуминные" дано этим веществам вследствие того, что белок куриных яиц (albumen) содержит белковину или альбумин, который должно считать представителем описываемой группы веществ. Веществам этой группы часто дают еще название "протеиновых" веществ, потому что Мульдер назвал протеином воображаемое вещество (или радикал), которое, по его мнению, в соединении с серой, фосфором и т. д., образует различные белковые вещества: мнение Мульдера ныне нельзя уже считать справедливым.
Общие свойства . Все Белковые вещества вещества состоят из пяти элементов: углерода, водорода, кислорода, азота и серы. их в разных Белковые вещества веществах мало разнится в процентном отношении, а именно - процентный состав колеблется в очень узких пределах: углерода от 50 до 55; водорода - от 6,9 до 7,5; кислорода - от 20 до 24; азота - от 15 до 18; серы - от 3 до 2 и даже до 0. Обыкновенно при сгорании белкового вещества остается зола, содержащая фосфаты и другие соли. При нагревании раствора, при действии реагентов и в различных других условиях, особенно же часто в организмах, многие из них переходят в состояние, известное под именем свертывания, т. е. они превращаются в вещества, не растворимые в обычных растворителях и даже в слабых растворяющих реактивах, каковы соляные растворы, разведенные растворы кислот и щелочей. В некоторых случаях свертывание начинается при 60° и даже при низшей температуре. За м пептонов, белковые вещества чрезвычайно медленно диффундируют (т. е. проникают в растворенном виде, см. растворов) через животную перепонку. Эти признаки заставляют относить Белковые вещества вещества к числу коллоидов (см. это слово). Перечисляем некоторые реактивы для осаждения многих белковых веществ из их растворов: в огромном избытке алкоголь; азотная кислота в достаточном количестве, чтобы сделать раствор очень кислым; и железисто-синеродистый калий; основная уксусно-свинцовая соль; двухлористая ртуть; платиносинеродистый калий; раствор йодистой ртути в йодистом калии, в присутствии свободной соляной кислоты. Одним из лучших способов для открытия белковых веществ служит реактив Миллона. этот приготовляют, обрабатывая ртуть равным ей по весу м азотной кислоты плотностью 1,4; когда реакция ослабевает, смесь слегка подогревают до полного растворения ртути; затем раствор разбавляют двойным объемом воды и оставляют его на несколько часов отстояться; при этом образуется осадок, а жидкость, отделенная от осадка, и будет реактив Миллона. Белковые вещества - как в твердом, так и в растворенном состоянии - при кипячении с упомянутым реактивом окрашиваются в красный цвет и самая жидкость также становится красной, но для этого потребно некоторое время. Не следует забывать, что представители родственных групп желатина и кератина, а равно шелк, также окрашиваются в красный цвет от упомянутого реактива.
Многие из Белковые вещества веществ (также и желатин) изменяют синюю окраску реактива на сахар (Феллингова жидкость в растворе с едким кали, см. Феллингова жидкость) в фиолетовую окраску, напоминающую окраску раствора марганцово-калиевой соли. При продолжительном кипячении с концентрированной азотной кислотой, растворы белковых веществ получают желтую окраску, переходящую в оранжевую от прибавления аммиака в избытке. Эта реакция известна под именем реакции на ксантопротеиновые вещества.
Все Белковые вещества вещества в растворенном состоянии обладают способностью отклонять (вращать) плоскость поляризации влево, и этой способности имеет важное значение для установления их присутствия (см. Поляризация света и Отклоняющая (вращающая) способность.
Химическое строение белковых соединений, т. е. отношение их к другим более простым углеродистым м, малоисследовано и даже существует много спорных мнений относительно тождественности разных представителей этой группы, что зависит от великой сложности химических отношений этих веществ, от трудности их очищения и от того, что они синтетически поныне еще не получены. Бешан (B é champ) в своем труде о белковых веществах ("M é m. sur Albds.", 1884) дает весьма подробное исследование этих веществ, тщательно заботясь отделять одно белковое вещество от другого посредством употребления различных растворителей, осаждающих реактивов и посредством определения отклоняющей способности устанавливает тождество полученных веществ. Он полагает, что слишком много усилий было сделано с целью доказать тождественность белковых веществ различного происхождения; между тем как его метод приводит к заключению, что число различных белковых веществ гораздо значительнее, чем обыкновенно принимают, и что многие из ныне описываемых белковых веществ в действительности суть смеси. Приняв во внимание то громадное количество соединений, которое встречается в группе углеводов, состав коих гораздо проще состава белковых веществ, можно дать много вероятия мнению Бешана, труд которого должен привести к пересмотру белковых веществ. Труды других (например, из русских а, Данилевского, а и др.) исследователей заставляют, в сущности, сделать такое же , хотя многократно признавалось, вслед за Мульдером и др., что число самостоятельных Белковые вещества веществ невелико и что их отличие зависит от подмешанных веществ.
Классификация . Белковые вещества могут быть подразделены на 7 групп.
I. Альбумины . Они растворяются в воде, в нейтральных растворах солей, в разведенных кислотах и щелочах и суть настоящие коллоиды.
II. Глобулины . Они нерастворимы в воде, но растворяются в нейтральных растворах солей, в разбавленных кислотах и щелочах.
III. Измененные альбумины . Они нерастворимы в воде и нейтральных растворах солей, но растворяются в разведенных кислотах и щелочах.
IV. Фибрин . Нерастворим в воде, но растворяется, хотя и с трудом, в нейтральных растворах солей и в разведенных кислотах и щелочах.
V. Свернувшиеся белковые вещества . Они не растворяются ни в воде, ни в нейтральных растворах солей, ни в разбавленных кислотах и щелочах. Вещества эти составляют свертки, образующиеся при нагревании или происходящие от действия крепкого спирта на многие белковые вещества, растворенные в воде или просто в ней висящие (суспензивные). Они распадаются от действия кислот и щелочей и могут переходить в пептоны действием на них желудочного или панкреатического сока.
VI. Амилоид (Лардацеин ) есть белковое вещество, образующееся в больной печени, больной селезенке и др. пораженных органах. Вещество это нерастворимо в воде и в разведенных кислотах, но растворяется в некрепкой аммиачной жидкости. Главнейшие отличительные признаки его заключаются в том, что оно не переходит в пептон под влиянием желудочного сока, а в присутствии крепкой серной кислоты и йода окрашивается в фиолетовый или синий цвет.
VII. Пептоны . имы в воде, в нейтральных растворах солей, в слабых кислотах и щелочах; отличаются от альбуминов способностью диффундировать через животные перепонки и тем, что их растворы не свертываются при нагревании. Пептоны образуются от действия желудочного панкреатического сока на белковые вещества (см. Пептоны).
Альбумины . Яичный альбумин или яичная белковина составляет главную часть органического вещества, заключенного в белке птичьих яиц.
Способ приготовления его . 1) Яичный белок взбивают, выжимают через полотно, фильтруют, прибавляют к фильтрату большое количество воды, а в полученную жидкость осторожно подливают уксусную кислоту для осаждения небольшого количества белкового вещества в виде хлопьев. тровав жидкость, подвергают ее диализу, чтобы насколько возможно полнее удалить из нее соли [В. Михайлов приготовил чистый альбумин из процеженного куриного белка, прибавляя тройной объем насыщенного раствора серно-аммиачной соли и порошка этой же соли. Осадок содержит все белковые вещества, бывшие в белке, но отделенные от многих других подмесей. Осадок растворяется в воде и подвергается диализу. В раствор переходит альбумин, а глобулин и др. остаются в нерастворенном виде, диализом же удаляют минеральные подмеси. - Δ . ]. 2) После разбавления водой и фильтрования к яичному белку прибавляют основной уксусно-свинцовой соли, только не в избытке, иначе образовавшийся осадок растворится. Осадок этот взбалтывают в воде и свинец удаляют, пропуская в жидкость углекислоту; последние следы удаляют, прибавляя небольшое количество серной кислоты и осторожно подогревая смесь, причем осаждается и сернокислая соль свинца. Отфильтровав жидкость, ее выпаривают при 50°. Таким способом полученный альбумин есть только одна из составных частей яичного белка. 3) Для технических целей яичный белок выпаривают досуха на воздухе при умеренной температуре; получаемые при этом роговидные чешуйки светло-желтого цвета составляют яичный альбумин, встречающийся в торговле.
Свойства сухого альбумина . - Сухой альбумин представляет полупрозрачную массу белого или бледно-желтого цвета, твердую и ломкую, которая легко растирается в белый порошок. Масса эта не имеет ни вкуса, ни запаха. Она растворяется в воде, но довольно медленно; впрочем, растворимость ее идет быстрее, когда вода содержит какую-нибудь щелочную соль. Сухой альбумин можно подогревать до 100°, и он все еще будет растворяться в воде; при 140° теряет 4% воды, но по-прежнему сохраняет растворимость.
Свойства водяного раствора альбумина . - При нагревании раствор становится мутным при 60°, а между 60° и 75° альбумин переходит в белое нерастворимое вещество, известное под названием свернувшегося альбумина. Вращающая способность раствора очищенной белковины = 38° (Гаас). Раствор чистого альбумина не изменяет растительных красок. Альбумин не растворяется в спирте и эфире. Крепкий спирт, прибавленный в избытке, осаждает альбумин в свернувшемся состоянии, а небольшое количество разбавленного спирта дает осадок, который вполне растворяется в воде. Если взболтать эфир с раствором альбумина умеренной крепости, то некоторая (малая) часть его свертывается. осаждает альбумин и служит для обнаружения присутствия растворимого альбумина; нагревание способствует быстрейшему осаждению альбумина. Разбавленная дает осадок альбумина только по прошествии некоторого времени. Небольшое количество соляной кислоты не осаждает альбумина, но с большим количеством ее образуется осадок вещества, содержащего эту кислоту. Метафосфорная кислота или раствор ее соли с уксусной кислотой осаждают альбумин. Пирофосфорная, ортофосфорная, уксусная и угольная кислоты не осаждают альбумина. Слабые растворы едкого кали и едкого натра не осаждают альбумина. и щелочи производят изменения в свойствах альбумина; изменения эти будут ниже описаны под заглавием альбуминная кислота и альбуминная щелочь . хлористого натрия и других тому подобных щелочных солей не осаждают альбумина; но если прибавить уксусной кислоты к раствору альбумина, содержащему одну из этих солей, или же прибавить щелочной соли к раствору, содержащему уксусную кислоту, то получается осадок альбумина. Осадок образуют также многие металлические соли, прибавленные в раствор альбумина, например сернокислая соль закиси железа, хлористое железо, серно-медная соль, азотно-серебряная, нейтральные и основные свинца и хлористая ртуть.
Железисто-синеродистый калий осаждает из раствора альбумина, содержащего уксусную кислоту, преципитат, свободный от калия. Хлор, бром и фенол свертывают альбумин. Закваска сычуга не дает осадка при обыкновенных температурах.
Ближайший состав яичного белка . Бешан выделил три различных вещества из белка куриного яйца. Первое (первичный яичный альбумин, primoralbumin ) осаждается основной уксуснокислой солью свинца; отклоняющая способность этого вещества (α)j = -34°. От нагревания свертывается. Второе и третье вещества остаются в фильтрате по удалении первого; оба эти вещества осаждаются аммиачным раствором основной уксуснокислой соли, но каждое из них можно выделить посредством фракционированного осаждения. Одно из них (secondoralbumin , вторичный яичный альбумин) от алкоголя свертывается и тем становится нерастворимым в воде; отклоняющая способность его -53° и от тепла оно свертывается. Другое вещество (leucozymose) осаждается алкоголем, но от этого не теряет своей растворимости в воде; оно обладает отклоняющей способностью -78° и представляет из себя фермент, так как обладает способностью растворять крахмал. Вещества эти содержатся в яичном белке в пропорции 5:4:1, а отклоняющая способность -46°, вычисленная из этих отношений, довольно близко подходит к отклоняющим способностям яичного белка от 40° до 43°, выведенным из наблюдений.
Кровяной альбумин или белковина крови находится в кровяной сыворотке, в мышечной сыворотке, в лимфе, в млечном соке и в большом изобилии в молозиве (colostrum).
Приготовление . 1) В кровяную сыворотку (кровь, лишенную фибрина) наливают воды в количестве, превышающем по объему в двадцать раз объем сыворотки, затем глобулин осаждают, осторожно прибавляя уксусной кислоты. Давши жидкости отстояться, ее фильтруют и фильтрат нейтрализуют содой, выпаривают при 40° и большую часть солей выделяют посредством диализа. 2) Для технических целей его приготовляют, выпуская кровь прямо из животного в неглубокие цинковые чашки емкостью в несколько литров, в них ее оставляют в холодном месте, пока она не сгустится; должно тщательно стараться не взбалтывать свежевыпущенную кровь, поэтому место, где производится операция, следует выбирать поблизости от животного. Когда кровь свернется совершенно, ее переносят в такие же чаши с продырявленными днищами и режут кровяной сгусток на мелкие кусочки, чтобы дать стечь сыворотке. Сыворотку собирают и досуха выпаривают при умеренной температуре, остаток называется альбумином. Следует избегать всякого сотрясения, так как при этом разрываются и цвет продукта портится. Пять быков дают около 20 литров сыворотки и около 2 кг альбумина. Кровь от 20 овец или от 34 телят дает то же количество альбумина.
Свойства кровяного альбумина во многом одинаковы с теми, которые присущи яичному белку; но отклоняющая способность обоих весьма различна: (α) D = -56° до -62° (Гaac), и, в противность яичному альбумину, он не свертывается от взбалтывания с эфиром.
Кристаллин (называемый также глобулином) есть название, даваемое белковому веществу, которое извлекается из хрусталика.
Приготовление . ик растирается и извлекается водой, а профильтрованный экстракт выпаривается; затем, чтобы удалить некоторые примеси, его промывают спиртом и получают желтую массу.
Свойства . Он растворим в воде и свертывается при нагревании, причем образуется зернистая масса. Бешан получил два вещества из водяного экстракта хрусталика. Одно из них (crystalbumin ) осаждается через прибавление спирта; осадок, если тотчас же вслед за его м прибавить к нему воды, растворяется; но постепенно он переходит в нерастворимое состояние и тогда уже вода не растворяет его. Кроме того, кристальбумин отличается от primoralbumin"a тем, что дает осадок с основной уксусной кислой солью свинца, который не разлагается углекислотой. его (α)j = -80°.
Другое вещество (phacozymase ) осаждается алкоголем, но не становится, вследствие этого, нерастворимым в воде. Вещество это - фермент, что доказывается его способностью растворять крахмал хлебного теста. Раствор его свертывается от нагревания. Отклоняющая способность его -41°.
Глобулины . Миозин . Волокна, входящие в состав произвольных мышц, содержат во внешнем слое полужидкое вещество, называемое мышечной плазмой; после смерти, когда в мышечных волокнах наступает rigor mortis (окоченелость), плазма эта выделяет жидкость (мышечную сыворотку) и сгусток, что в обуславливает окоченение. этот и есть миозин. Рассол, в котором было посолено мясо, содержит большое количество миозина.
Для приготовления миозина свежее мясо мелко крошится и хорошенько промывается водой, до тех пор пока промывная вода не перестанет давать кислую реакцию и в ней не окажется больше следов присутствия какого бы то ни было белкового вещества; затем промытую таким образом мясную массу растирают в кашицу с поваренной солью и прибавляют воды настолько, чтобы получился 10% соляной раствор. Дав этому раствору отстояться в продолжение некоторого времени, его выжимают через полотно и фильтруют. Фильтрат, наливаемый по каплям в воду, дает осадок миозина, который можно очистить, растворив его снова в растворе поваренной соли и вновь осаждая.
Свойства миозина . В сыром виде он образует белую массу, а в сухом виде представляется роговым веществом желтого цвета. В химических реакциях нейтрален. Нерастворим в воде, спирте и эфире. От нагревания в воде до 70° он свертывается. Быстро растворяется в слабых кислотах и растворенный таким путем миозин переходит в синтонин. Миозин растворяется в слабых щелочных растворах и в углекислых щелочных солях. Он легко растворяется в растворах, содержащих от 1% до 10% поваренной соли и осаждается в неизменном виде либо прибавлением к раствору воды, либо насыщением раствора солью.
Сывороточный глобулин или просто глобулин или фибрино-пластическое вещество (Шмидт); иначе параглобин (Брюкке), (Кюнэ). Для приготовления его свежую кровяную сыворотку разбавляют водой в объеме, превышающем в 10 раз объем упомянутой жидкости, и пропускают в нее струю углекислоты. Спустя некоторое время в растворе осаждаются хлопья, которые собираются и растворяются в воде прибавлением к ней нескольких капель очень слабого раствора едкого натра. Затем глобулин осаждают, пропуская струю углекислоты.
Свойства . Осадок глобулина представляется в виде микроскопических, бесцветных, бесформенных зернышек. Он нерастворим в воде, алкоголе и эфире; но растворяется в воде, насыщенной кислородом, и осаждается, если пропустить в раствор струю углекислоты. Легко растворяется в слабых кислотах, но под их влиянием переходит в один из дериватов альбумина. Глобулин растворяется в разбавленных едких и углекислых щелочах. Разбавленные растворы едких щелочей заставляют его переходить в производный альбумин; если же растворы эти слишком слабы, то глобулин можно осадить, пропустив струю углекислоты. Глобулин растворяется в растворах фосфорно-щелочных солей, поваренной соли, сернокислой магнезии и др. солей. Он осаждается из названных растворов солей прибавлением воды, и осаждение ускоряют, пропуская струю углекислоты. Из растворов нейтральных солей его осаждают также увеличением находящегося там количества соли до насыщения. Глобулин в воде или растворенный в нейтральных соляных растворах свертывается при нагревании до 70°. Глобулин, будучи растворен в уксусной кислоте, не осаждается железисто-синеродистым калием.
Фибриноген встречается в кровяной плазме, т. е. в жидкой части крови, прежде чем она свернется; а также в жидкостях водяной грыжи и в различных серозных жидкостях полостей.
Приготовление . 1) Кровяную плазму разбавляют ледяной водой в объеме, превышающем в 10 или в 15 раз объем плазмы, и продолжительное время подвергают ее действию струи углекислоты, чтобы осадить глобулин. выделяют и затем снова разбавляют оставшуюся жидкость и осаждают фибриноген, пропустив снова через нее струю углекислоты. Фибриноген может быть выделен из других упомянутых жидкостей тем же способом. 2) Только что выпущенную лошадиную кровь смешивают с насыщенным раствором сернокислой магнезии, который по объему составляет одну треть объема крови. Затем отфильтровывают кровяные тельца, а к фильтрату прибавляют насыщенный раствор поваренной соли, отчего происходит осаждение фибриногена. Осадок удаляют, промывают в большом количестве того же раствора поваренной соли и дважды очищают его, растворяя в более слабом растворе поваренной соли, содержащем от 6% до 8% её, фильтруя и осаждая, как было сказано.
Свойства . Он не растворяется в воде, но растворяется в ней, если она содержит в себе кислород. Растворяется в разбавленных едких щелочах. Подобно глобулину, растворяется в растворе поваренной соли; но если соли будет 12-16%, то фибриноген осаждается и лишь незначительная часть глобулина выделяется, пока процентное отношение соли не повысится до 20; этим объясняется второй способ приготовления его, описанный выше. Растворы фибриногена в поваренной соли свертываются при нагревании раньше, чем растворы глобулина. Когда происходит сгущение крови, то фибриноген плазмы переходит в фибрин (волокнин).
Вителлин . Яичный желток, после обработки его водой, алкоголем и эфиром, дает нерастворимое белковое вещество, которому было дано название вителлина (по-латыни "vitellus" - яичный желток). Было описано много других разнообразных способов выделения вителлина из яичного желтка, и весьма вероятно, что получаемые в этих случаях продукты не тождественны.
Свойства . Вителлин прямо нерастворим в воде, но растворяется в разбавленных кислотах, едких щелочах и в 10% растворе поваренной соли. Бешан получил 5 веществ из желтка куриных яиц. От обработки его водой остается зернистое гранулезное вещество, а в растворе находят тело (lecithoönin ), которое от алкоголя свертывается и становится нерастворимым; отклоняющая способность его, если его растворить в уксусной кислоте, (α)j = -81°; другое тело (lecithozymose ), также осаждается алкоголем, но не делается нерастворимым; это фермент, он растворяет крахмал теста; отклоняющая способность его около -48°. Зернистое вещество, после промывки его эфиром, содержащим немного алкоголя, и водой, становится совершенно белым и в слабом растворе углекислого натрия выделяет тело (lecimicroönin ), которое осаждается прибавлением к раствору уксусной кислоты; отклоняющая способность его в растворе уксусной кислоты от -70° до -75°. Уксуснокислый фильтрат содержит тело (lecimicrozymose ), которое осаждается от прибавления алкоголя; оно растворимо в воде и представляет собой фермент, так как растворяет крахмал теста; отклоняющая способность его около -81°. Раствор соды оставляет часть зернышек нерастворенными; остающееся вещество, по-видимому, неоднородно и, весьма вероятно, оно представляет внешний покров зернышек. Этот-то покров и препятствует извлечению растворимого lecimicrozymose во время первой обработки вещества водой.
Производные альбумины . Альбуминная кислота . Если обрабатывать яичный альбумин слегка разбавленной соляной кислотой, а смесь нагревать постепенно, то даже при 100° не происходит свертывания; если же нейтрализовать раствор на холоде, то образуется осадок, который и есть альбуминная кислота.
Свойства . Препарат этот растворяется в разбавленных едких и углекислых щелочах. Не растворяется в растворе поваренной соли. При нагревании с водой, без присутствия кислот, свертывается.
Синтонин (или мускулин ) - так называется продукт, полученный от действия разбавленной соляной кислоты на миозин; то же название было дано продуктам, получаемым от действия разбавленных кислот на растворимые или свернувшиеся белковые вещества и на фибрин; предполагают также, что синтонин есть первый продукт реакции желудочного сока на белковые вещества. Опыты Бешана привели этого ученого к заключению, что продукты эти суть различные вещества.
Альбуминная щелочь . От реакции едких щелочей на яичный альбумин получаются вещества, которым дали название альбуминной щелочи или альбумината. Весьма вероятно, что продукты эти многочисленны и отличаются один от другого, смотря по крепости употребляемых щелочных растворов. Допустив, что яичный альбумин на самом деле есть смесь трех различных веществ, все-таки потребуется немало труда, прежде чем продукты реакции щелочей будут выделены и описаны.
Вот наиболее заслуживающие внимания факты, касающиеся реакции щелочей на альбумин: 1) если яичный альбумин обрабатывать разбавленной едкой щелочью и постепенно подогревать жидкость, то даже при 100° альбумин не свертывается; если же дать раствору охладиться и нейтрализовать его кислотой, то получится осадок. Осадок этот называется альбуминной щелочью или альбуминатом. 2) Если освобожденный от пленок и затем приведенный к его начальной крепости яичный белок смешать с крепким раствором поташа, то он обращается в желатинообразную массу. Масса эта, промытая в нескольких водах, пока промывная вода не потеряет щелочности (по возможности следует препятствовать притоку воздуха) растворяется в кипящей воде. Ее назвали калиевым альбуминатом и рассматривают этот продукт как соль какой-то "альбуминной кислоты". Из калиевого альбумината были получены альбуминаты меди, серебра и др. металлов. Когда раствор калиевого альбумината нейтрализуют кислотой, то образуется осадок, который считают тождественным с осадком, получаемым при употреблении разбавленной щелочи, как это описано выше.
Казеин находится в молоке млекопитающих и есть характерная составная часть сыра (по-латыни caseus ); отсюда и произошло его название.
Приготовление . Свежее молоко, разбавленное равным по объему его количеством воды, подогревается до 50° и к нему прибавляют настолько уксусной кислоты, чтобы жидкость получила явственно кислый вкус. Творог отделяют и хорошо промывают водой с подмесью уксусной кислоты. Тогда удаляют жир, обрабатывая смесь алкоголем и эфиром, а затем одним лишь эфиром. Массу растворяют в сильно разбавленном аммиаке и раствор отфильтровывают и осаждают уксусной кислотой. Осадок обрабатывают эфиром, снова растворяют его в аммиаке и вновь осаждают уксусной кислотой, промывают водой, затем алкоголем и эфиром и, наконец, высушивают в безвоздушном пространстве над серной кислотой (Бешан). Для технических целей получается препарат из казеина, называемый лактарином (lactarine), посредством створаживания снятого молока прибавлением к нему уксусной кислоты или сычуга. Сгусток собирают, промывают и высушивают и продают в виде желтого зернистого порошка.
Свойства . - Казеин, по-видимому, есть , а не смесь. Приготовленный по первому из вышеописанных способу, он представляет легкое , состоящее из очень мелких зерен; приготовленный другими способами, он имеет вид желтоватой, бесформенной, гигроскопической массы, без вкуса и запаха. Казеин, приготовленный Бешаном, содержал только 2% золы. Казеин, высушенный в безвоздушном пространстве, задерживает в себе воду и чтобы удалить последнюю необходимо продолжительное просушивание при 130-140°. Казеин может находиться в продолжение нескольких часов в 100° температуре, не претерпевая изменений; но после нагревания его при 130- 145°, он становится до известной степени нерастворим в растворе соды. Казеин окрашивает лакмус и относится наподобие кислоты к щелочам и щелочным землям, по отношению же к кислотам казеин является слабым основанием. Он нерастворим в воде, но быстро растворяется в растворах аммиака, едких и углекислых щелочей. Влажный казеин легко растворяется в известковой воде или в баритовой воде. Кислоты, подбавленные к растворам казеина в щелочах, дают осадки, которые суть соединения казеина с кислотой; соединения эти разлагаются водой; совершается легче, если к воде прибавить уксусной кислоты. Казеин быстро растворяется в разбавленной соляной кислоте (содержащей 0,2% дымящейся кислоты); но прибавление кислоты средней крепости к этому раствору дает осадок, содержащий соляную кислоту. Казеин нерастворим в соляной кислоте, содержащей от 2% до 3% дымящейся кислоты. Казеин растворяется в крепкой соляной кислоте, окрашивая ее в прекрасный фиолетовый цвет. Казеин растворим в слабой уксусной кислоте, образуя уксуснокислую соль; при выпаривании раствора и просушивании нельзя удалить сполна уксусную кислоту даже при 140°. Казеин нерастворим в растворе поваренной соли. Свежеприготовленный, еще влажный казеин растворяется в щелочных растворах обыкновенных фосфорно-натровой и борно-натровой солей. Казеин в растворе едкого кали не свертывается при нагревании. Казеин обладает отклоняющей способностью, которая колеблется между (α)j = -94° и (α)j = -133°, сообразно с употребленным раствором.
Свертывание молока . Когда молоко остается на открытом воздухе, то , в молоке содержащийся, отчасти переходит в молочную кислоту от действия одного микроорганизма, называемого Bacterium lactis - молочной бактерией, - и молоко киснет. Это закисание молока обуславливает осаждение казеина и молоко "свертывается или створаживается". В сыроделии употребляется другой способ для осаждения казеина. Закваска, приготовляемая обработкой (вымачиванием) четвертого телячьего желудка 6% раствором поваренной соли, прибавляется к молоку, нагретому приблизительно до 25° и обусловливает осаждение казеина, который увлекает за собой и жирные шарики молока. Это створаживание, по окончании последовательной обработки для удаления жидкой части молока, дает сыр. Было доказано, что осаждение казеина происходит от реагирования фермента, заключающегося в закваске, а не от скисания молока, которым сопровождается его створаживание [Более подробные сведения о створаживании молока даются в статьях: Сыр, и Молоко. Л. Н. Шишков, после многочисленных исследований молока, пришел к своеобразному объяснению створаживания, которое будет приведено в статье о молоке. - Δ . ].
Фибрин (волокнин ). Кровь, по удалении ее из тела живого животного, быстро обращается в студенистую массу, которая постепенно сжимается, выделяя при этом жидкость, так что получается сгусток, окруженный жидкостью (сыворотка, пасока - serum). Сгусток этот состоит из фибрина с включенными в него красными кровяными тельцами. Было предложено многое множество мнений для объяснения образования фибрина; теперь же полагают, что белковый фибриноген, содержащийся в плазме, т. е. в жидкой части живой крови, выделяет фибрин под влиянием фермента, который доставляется белыми кровяными шариками крови и по всей вероятности становится свободным вследствие их разрыва; по-видимому, для образования фибрина необходимо также участие некоторых солей крови.
Приготовление фибрина . Свежую кровь взбивают веничками, к которым пристает фибрин. Последний промывают водой до тех пор, пока вода не сделается бесцветной; затем его обрабатывают алкоголем и эфиром для удаления жира.
Свойства фибрина . Влажный фибрин представляет белую, гибкую, упругую, фиброзную (волокнистую) массу, которая, будучи высушена, становится твердой и хрупкой. Фибрин не имеет ни вкуса, ни запаха. Он нерастворим в воде и в алкоголе. Если фибрин опустить в воду и нагревать, или же оставить его в продолжение некоторого времени в алкоголе, то он претерпевает изменение и не растворяется более в соляных и слабых кислотных растворах, но по-прежнему растворяется в щелочах. Фибрин разбухает и растворяется, если его вываривать в разбавленных растворах щелочей, растворы эти не свертываются от нагревания. Фибрин окрашивается в желтый цвет азотной кислотой, а если его уваривать, то образуется ксантопротеиновая кислота. В разбавленной соляной кислоте фибрин разбухает и растворяется при легком подогревании. В дымящейся соляной кислоте сухой фибрин разбухает и постепенно растворяется в темно-голубую жидкость. Крепкая уксусная кислота обращает фибрин в студень, который легко растворим в горячей воде. В 6-10% растворах нейтральных солей, в таких же растворах азотнокислого кали, поваренной соли и серно-натровой соли фибрин разбухает и жидкость может быть отфильтрована после долгого настаивания; растворы эти свертываются при нагревании. Влажный фибрин обуславливает разложение перекиси водорода, причем выделяется свободный кислород.
Продукты реакции слабой соляной кислоты на фибрин были изучены Бешаном. Часть фибрина остается нерастворенной (так называемый эпидермоз ); эта часть состоит из микроскопических зернышек, которые, после промывки для удаления кислоты, обладают способностью растворять крахмал теста и выделять кислород из перекиси водорода. Бешан рассматривает эти зернышки как и дает им название микрозимов фибрина . Они продолжают выделять свободный кислород из перекиси водорода даже будучи высушены в безвоздушном пространстве, но после кипячения в воде теряют эту способность. Раствор, свободный от микрозимов, обладает отклоняющей способностью (α)j = -72°, которая вычислена на основе содержания вещества, полученного посредством выпаривания и высушивания при 110-120°. Прибавление к раствору аммиака дает осадок, названный Бешаном "фибринин ". Фибринин не растворяется в воде, но легко растворяется в слабом растворе уксусной кислоты и обладает отклоняющей способностью (α)j = -67°. В дымящейся соляной кислоте он растворяется и при нагревании дает прекрасную фиолетовую окраску.
Фильтрат фибринина, будучи смешан с большим количеством алкоголя и с слабым раствором уксуснонатровой соли, дает осадок, который почти весь растворим в воде. Это растворимое вещество Бешан называет фибримином . Он обладает отклоняющей способностью от (α)j = -79° до (α)j = -87°. Будучи высушен, фибримин растворяется в дымящейся соляной кислоте и при нагревании дает красно-лиловую окраску, переходящую в коричнево-красный цвет. Раствор фибримина не свертывается от нагревания и не осаждается нейтральной или основной уксуснокислой солью свинца; впрочем, он осаждается метафосфорной кислотой. Азотной кислотой раствор его окрашивается в желтый цвет; реактив Миллона дает с ним легкий осадок и красную окраску при нагревании. Фибримин обладает только в слабой степени способностью растворять крахмал теста.
Глютин или клейковина (Gluten) - так называются белковые вещества хлебных зерен, особенно пшеницы. у получают в виде смеси веществ, остающихся после того, как из пшеничной муки было приготовлено тесто, которое вымешивалось с водой до тех пор, пока в воде не осталось следов крахмала. Зерно вымачивают в воде, растирают валами, а затем протирают через решето с водой; крахмал проходит сквозь решето, а на решете остается глютин. и вермишель содержат много глютина.
Свойства глютина . В сыром виде он представляет студенистую, полупрозрачную, мягкую, эластичную и липкую массу; в сухом виде он темен, полупрозрачен по краям и хрупок. Влажный глютин от нагревания становится нерастворимым в спирте, в кислотах и в растворе едкого кали. То же самое происходит при высушивании глютина. Если глютин сохранять в сыром виде, то он быстро выделяет углекислоту и распускается в массу, похожую на лак. В кипящей воде растворяются некоторые составные части сырого глютина. Кипящий спирт растворяет только отчасти глютин. В эфире он нерастворим. Разведенная растворяет глютин, причем получается раствор, который при кипячении становится мутным и с которым кислоты дают осадки, растворимые в избытке осаждающего реактива. Разведенная уксусная кислота легко растворяет глютин, в свежем и в сухом виде, без нагревания. Однако же кислоты эти оставляют нерастворенными примеси глютина, каковы: крахмал, жир и проч. Глютин разбухает и распадается на куски в водном растворе аммиака, но не растворяется. Свежий глютин растворяется в растворах едкого кали и едкого натра; растворы эти осаждаются прибавлением к ним кислот; при употреблении фосфорной и уксусной кислот; осадок выделяется, если щелочь вполне нейтрализована; если же прибавить кислоты больше, то он растворяется. Приготовленная описанным способом свежая клейковина содержит некоторое количество крахмальных зерен, жира и др. остатков; остатки эти состоят из нескольких веществ, которые были различно называемы различными авторами. Бешан посредством спирта и 1% раствора соляной кислоты, употребленных как растворители, выделил 4 вещества: 1) глютин, который растворяется в спирте; 2) растительный казеин, который растворяется в воде; 3) глютинофибрин, который растворяется в 1% растворе соляной кислоты и 4) глютинофибрин, который, будучи выделен, нерастворим в кислоте этой крепости, хотя в первоначальном веществе способствует его растворимости в разведенной соляной кислоте.
Техническое применение белковых веществ . Окрашивание . Яичный альбумин и альбумин крови имеют широкое применение в окрашивании и набивке хлопчатобумажных тканей и отчасти в набивке шерстяных изделий (см. ). Альбумин употребляется для укрепления двух родов красок, но в обоих случаях действие его совершенно различно. Те краски, которые употребляются в нерастворимом состоянии, например ультрамарин, смешиваются на холоде с раствором альбумина и набиваются на ткань, которая затем пропускается над паром. Нагревание обуславливает свертывание альбумина, что и закрепляет краску на волокно ткани прочным образом. К другому отделу красок принадлежат те, которые употребляются в растворе, например многие ; они обладают способностью непосредственно соединяться с животными волокнами, шерстью, шелком и образуют соединения, которые не линяют от стирки; однако же, краски эти не образуют таких соединений с растительными волокнами, содержащими клетчатку, и прием крашения состоит в том, чтобы "анимализировать" эти волокна посредством сгущения на них альбумина; после такой обработки краска соединяется с альбумином, как с шерстью и с шелком, и прочно закрепляется на товаре. Раствор альбумина набивается на миткаль или же, если надо окрасить всю ткань, ее всю пропитывают раствором альбумина и высушивают. Затем альбумин свертывается от действия пара и товар опускают в раствор краски, которая фиксируется прочно только там, где пристал альбумин. Другой употребляемый метод состоит в набивке миткаля одновременно альбумином и растворимой краской, а затем обработкой паром. Альбумин крови дешевле яичного альбумина и может быть получен почти таким же бесцветным. Данное количество его имеет большую способность сгущать краски, сравнительно с тем же количеством яичного альбумина; но для светлых красок он не так пригоден и притом он, по-видимому, воспринимает большую окраску от грязной мыльной жидкости, употребляемой в последующей операции, нежели это делает яичный альбумин.
Для замены альбумина в красильном деле иногда служит препарат казеина, называемый лактарином; он был введен Паттисоном в 1848 году для закрепления нерастворимых пигментов, а позднее его стали также употреблять для растворимых красок. Лактарин не растворяется в воде, но с раствором аммиака дает мягкое белое тесто, которое употребляется тем же способом, как и альбумин; действием пара удаляется аммиак и на волокне остается нерастворимый казеин. Другие употребляемые или предлагаемые растворители - едкий натр, борная и уксусная кислоты. Таким образом, оставшийся по удалении аммиака казеин растворим в щелочных растворах; но если аммиачное тесто смешать со свежим известковым молоком и затем наложить его на ткань, то при нагревании образуется на волокне известковое соединение и ткань может противостоять стирке в щелочных жидкостях. Лактарин как протрава стоит ниже альбумина и в фабричном деле может произвести помеху, так как редко описанное выше тесто сохраняет пригодность в течении одних только суток.
Творог снятого молока может быть употреблен вместо лактарина для получения казеина; его подвергают настаиванию с горячей водой, чтобы удалить из него соли и жирные вещества, а затем из него приготовляют тесто с аммиаком или с едким натром, как в описанном способе с лактарином. Другой заместитель альбумина есть глютин, но его употребление невелико. ует много способов, как привести его в растворимое состояние. Один из них состоит в том, что сырой глютин оставляют закиснуть и сделаться жидким; затем его обрабатывают содой, чтобы сделать снова нерастворимым, и после промывки его растворяют в растворе едкого натра, либо совсем не обрабатывают содой, а непосредственно смешивают скисшийся и жидкий глютин с раствором едкого натра.
Фотография . Альбумин имеет широкое применение в различных операциях по фотографии. Одно из важнейших его употреблений есть приготовление чувствительной бумаги, на которой печатают позитивы со стеклянной пластинки негатива. Бумага сперва опускается в раствор, содержащий альбумин и растворимое хлористое соединение, а затем просушивается. Потом она делается чувствительной погружением ее в раствор азотно-серебряной соли; результатом является пленка, содержащая хлористое и азотнокислое серебро и серебряное соединение альбумина, которое темнеет от действия света. ная ванна должна быть достаточной крепости, в противном случае альбумин не остается на бумаге и она не удерживает серебра. Альбумин употребляется также для негативных пластинок в процессе работы с сухими пластинками; иногда пленка альбумина наносится на стекло для образования слоя, связующего коллодиум со стеклом, то есть для того, чтобы коллодиум крепче приставал к стеклу; альбумин вводится также в некоторые предохранительные жидкости, употребляемые после того, как бумагу сделали чувствительной. В фотографии отдают предпочтение яичному альбумину перед альбумином крови; употребляют либо яичный белок, либо высушенный альбумин, встречающийся в продаже.
Рафинирование (очистка ) сахара . При осветлении сахара животным углем сироп, получаемый растворением сахарного песка, содержит в себе мутность и нечистоты; эти примеси в прежнее время были удаляемы прибавлением кровяной сыворотки или свежей крови и подогреванием, чтобы произвести свертывание альбумина, который увлекает за собой все посторонние вещества из сиропа. Метод этот ныне заменили другим и посторонние вещества удаляют фильтрацией сахарного сиропа.