Основні радикали амінокислот. Загальні властивості та будова амінокислот. Класифікація амінокислот. Амінокислотний склад білка
Амінокислоти є компонентами молекул білків. Білки складаються з амінокислот, з'єднаних пептидними зв'язками.
В даний час нараховано 20 амінокислот, які утворюють в нашому організмі понад 50 тисяч різних протеїнів та 20 тисяч ензимів, ферментів ( складні речовинибілкової природи). З цих 28 амінокислот будь-який здоровий людський організмможе синтезувати будь-який потрібний білок.
Поділ амінокислот на замінні та незамінні.
Поділ амінокислот на замінні та незамінні проводиться за їхньою здатністю синтезуватися в організмі. Для різних організмівСписок замінних/незамінних амінокислот різний. Нижче наведено поділ амінокислот, характерний для людини.
Незамінні амінокислоти.
- ізолейцин;
- лейцин;
- лізин;
- метіонін;
- фенлаланін;
- треонін;
- триптофан;
- валін.
Не замінні амінокислоти не можуть синтезуватися в організмі людини з інших амінокислот. Ці амінокислоти обов'язково повинні надходити з їжею.
Умовно незамінні амінокислоти.
- гістидин;
- цистин;
- тирозин.
Умовно- незамінні амінокислоти синтезуються чи ні в організмі за певних умов. Наприклад, синтез аргініну в організмі після 30 років значно знижується.
Замінні амінокислоти.
- аланін
- аспарагін
- аспарагінова кислота
- гліцин.
Замінні амінокислотиможуть синтезуватися в організмі (з інших амінокислот, реакціях переамінування)
Будова амінокислот.
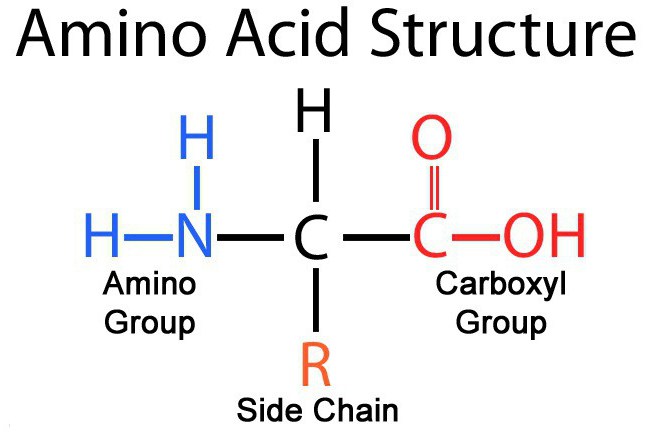
У кожній молекулі амінокислоти присутній атом вуглецю, пов'язаний із чотирма замісниками. Один з них – атом водню, другий – карбоксильна група – СООН. Від карбоксильної групи легко відокремлюється іон водню. Н+, завдяки чому в назві амінокислот і є слово «кислота». Третій заступник - аміногрупа - NH 2 . Четвертий елемент амінокислоти – група атомів, яку в загальному випадку позначають R. У всіх амінокислот R-групи різні, і кожна з них грає свою, дуже важливу роль. R-група також називається бічний ланцюг.
Загальну формулу амінокислоти в нейтральному середовищі (ph=7) можна записати як NH 2 + CHRCOO –
Що ж до групи - СООН, то хіміки-органіки ставляться до неї з великою повагою: всім іншим атомам вуглецю в молекулі даються позначення залежно від ступеня їхньої віддаленості від карбоксильної групи. Найближчий до неї атом називають альфа-атомом, другий - бета-атомом, і т.д. Атом вуглецю в амінокислотах, який знаходиться найближче до карбоксильної групи, тобто альфа-атом, пов'язаний також з аміногрупою, тому природні амінокислоти, що входять до складу білка, називають альфа-амінокислотами .
У природі зустрічаються також амінокислоти, в яких NH 2 -група пов'язана з віддаленими від карбоксильної групи атомами вуглецю. Однак для побудови білків природа обрала саме альфа-амінокислоти. Це зумовлено насамперед тим, що тільки альфа-амінокислоти, з'єднані у довгі ланцюги, здатні забезпечити достатню міцність та стійкість структури великих білкових молекул.
Число альфа-амінокислот, що відрізняються R-групою, велике. Але найчастіше в білках зустрічається всього 20 різних амінокислот. Їх можна як алфавіт «мови» білкової молекули. Хіміки називають ці головні амінокислоти стандартними, основними чи нормальними. Умовно основні амінокислоти ділять на чотири класи.
Перший клас амінокислот – амінокислоти з неполярними бічними ланцюгами.
Другий – амінокислоти, що містять полярну групу.
Наступні два класи складають амінокислоти з бічними ланцюгами, які можуть заряджатися позитивно (вони поєднуються в третій клас) або негативно (четвертий). Наприклад, дисоціація карбоксильної групи дає аніон - СОО-, а протонування атома азоту - катіон, наприклад -NH 3 + . Бічні ланцюги аспарагінової та глютамінової кислот мають ще по одній карбоксильній групі -СООН, яка при значеннях рН, характерних для живої клітини (рН = 7), розлучається з іоном водню (Н+) і набуває негативного заряду. Бічні ланцюги амінокислот лізину, аргініну та гістидину заряджені позитивно, оскільки вони мають атоми азоту, які, навпаки, можуть іон водню приєднувати.
Ізоміри амінокислот. D- та L-форми амінокислот.
Кожна альфа-амінокислота (крім гліцину) в залежності від взаємного розташуванняЧотири заступники можуть існувати у двох формах. Вони відрізняються один від одного, як предмет від свого дзеркального відображення. Такі сполуки отримали назву хіральних(від грін."Хір" - "рука").
Хіральні молекули відкрив у 1848 р. великий французький вчений Луї Пастер. Два типи оптичних ізомерів ( енантіомерів) органічних молекул отримали назви D-форма (від лат. dexter - «правий») та L-форма (від лат. laevus – «лівий»). До речі, одна з назв інших хіральних молекул – глюкози та фруктози – декстроза та левулоза.
До складу всіх вивчених в даний час білків входять тільки амінокислоти L-ряду, у яких, якщо розглядати хіральний атом з боку атома H, групи NH3+, COO-і радикал-R розташовані за годинниковою стрілкою. Необхідність при побудові біологічно значущої полімерної молекули будувати її з певного енантіомеру очевидна - з рацемічної суміші двох енантіомерів вийшла б неймовірно складна суміш діастереоізомерів.
До складу білків входять лише L-амінокислоти.
Слід зазначити, що D-амінокислоти досить поширені в живої природі і, більше того, входять до складу біологічно значущих олігопептидів.
Для нормальної життєдіяльності організм потребує повному наборіз 20 основних альфа-L-амінокислот.
Амінокислоти – похідні жирних чи ароматичних жирних кислот, які містять амінне або карбоксильне угруповання, які відрізняються тільки радикалами.
Усі амінокислоти містять: 1) карбоксильну групу (-СООН); 2) аміногрупу (-NH 2); 3) радикал або R-групу (решта молекули). Будова радикала у різних видівамінокислот – різне. Залежно від кількості аміногруп і карбоксильних груп, що входять до складу амінокислот, розрізняють: нейтральні амінокислоти, що мають одну карбоксильну групу та одну аміногрупу; основні амінокислоти, що мають більше однієї аміногрупи; кислі амінокислоти, що мають більше однієї карбоксильної групи.
Амінокислоти є амфотерними сполуками, Так як у розчині вони можуть виступати як у ролі кислот, так і основ. У водних розчинах амінокислоти існують у різних іонних формах.
Амінокислотний складбілка:
Білки – неперіодичні полімери, мономерами яких є α-амінокислоти. Зазвичай як мономери білків називають 20 видів α-амінокислот, хоча в клітинах і тканинах їх виявлено понад 170.
Залежно від цього, чи можуть амінокислоти синтезуватися в людини і інших тварин, розрізняють: замінні амінокислоти - можуть синтезуватися; незамінні амінокислоти – не можуть синтезуватися. Незамінні амінокислоти повинні надходити в організм разом із їжею. Рослини синтезують усі види амінокислот.
Залежно від амінокислотного складу білки бувають: повноцінними - містять весь набір амінокислот; неповноцінними – якісь амінокислоти у їхньому складі відсутні. Якщо білки складаються лише з амінокислот, їх називають простими. Якщо білки містять, крім амінокислот, ще й неамінокислотний компонент (простетичну групу), їх називають складними. Простетична група може бути представлена металами (металопротеїни), вуглеводами (глікопротеїни), ліпідами (ліпопротеїни), нуклеїновими кислотами (нуклеопротеїни).
Класифікація амінокислот:
Моноаміномонокарбонові
R-CH 3 аланін
R-CH 2 OH серин
R-SH-CH 2 цистеїн
R-CH 3 -S-CH 2 -CH 2 метіонін
Діаміномонокарбонові
CH 2 -NH 2 -CH 2 -CH 2 лівін
Моноамінодикарбонові
COOH-CH 2 аспарагінова амінокислота
COOH-CH 2 -CH 2 глутамінова амінокислота
Діамінодикарбонові
Цистін (два цистеїни)
Циклічні амінокислоти (фенілаланін, тирозин, триптофан)
Незамінні амінокислоти – не здатні синтезуватися в організмі людини та тварин (триптофан, фенілаланін, лізин, валін, треонін, лейцин, ізолейцин, метіонін)
Серед величезної різноманітності природних речовин амінокислоти займають особливе місце. Воно пояснюється їх винятковим значенням як у біології, так і в органічної хімії. Справа в тому, що з амінокислот складаються молекули простих і складних білківє основою всіх без винятку форм життя на Землі. Саме з цієї причини наука приділяє серйозну увагу вивченню таких питань, як будова амінокислот, їх властивості, одержання та застосування. Велике значення цих сполук і в медицині, де вони застосовуються як лікувальних препаратів. Для тих людей, хто серйозно займається власним здоров'ямі веде активний спосіб життя, однією з форм їжі (так зване спортивне харчування). Деякі їх види застосовуються в хімії органічного синтезу як вихідну сировину при виробництві синтетичних волокон - енанта та капрону. Як бачимо, амінокарбонові кислоти відіграють дуже важливу роль як у природі, так і в житті людського суспільства, тому познайомимося з ними докладніше.
Особливості будови амінокислот
Сполуки цього класу відносяться до амфотерних органічних речовин, тобто містять дві функціональні групи, а отже, виявляють подвійні властивості. Зокрема, у складі молекул присутні вуглеводневі радикали, з'єднані з аміногрупами NH 2 та карбоксильними групами СООН. У хімічних реакціях коїться з іншими речовинами амінокислоти виступають як основи, як кислоти. Ізомерія таких сполук проявляється внаслідок зміни або просторової конфігурації вуглецевого скелета, або положення аміногрупи, а класифікація амінокислот визначається виходячи з особливостей будови та властивостей вуглеводневого радикала. Він може мати форму нерозгалуженого або розгалуженого ланцюга, а також містити циклічні структури.
Оптична активність амінокарбонових кислот
Всі мономери поліпептидів, а їх 20 видів, представлених в організмах рослин, тварин та людини, відносяться до L-амінокислот. Більшість їх містять асиметричний атом карбону, повертаючий при обертанні поляризований пучок світла вліво. Два мономери: ізолейцин і треонін - мають два таких атоми вуглецю, а амінооцтова кислота (гліцин) - жодного. Класифікація амінокислот по оптичній активності широко застосовується в біохімії та молекулярній біології щодо процесу трансляції в біосинтезі білка. Цікаво, що D-форми амінокислот ніколи не входять до складу поліпептидних ланцюгівбілків, зате присутні в бактеріальних оболонках і продуктах метаболізму грибів-актиноміцетів, тобто, по суті, їх виявляють у природних антибіотиках, наприклад в граміцидині. У біохімії широко відомі речовини з D-формою просторової будови, як цитрулін, гомосерин, орнітин, які відіграють важливу роль у реакціях клітинного метаболізму
Що таке цвіттер-іони?
Ще раз нагадаємо, що мономери білків мають у своєму складі функціональні групи амінів та карбонових кислот. Частинки -NH 2 і СООН взаємодіють між собою всередині молекули, що призводить до появи внутрішньої солі, яка називається біполярним іоном (цвіттер-іоном). Таке внутрішня будоваамінокислот пояснює їх високу здатністьдо взаємодії з полярними розчинниками, наприклад, з водою. Присутність у розчинах заряджених частинок зумовлює їх електропровідність.
Що являють собою α-амінокислоти
Якщо амінна група розташована в молекулі при першому атомі карбону, рахуючи від місця знаходження карбоксилу, таку амінокислоту відносять до класу -амінокислот. Вони займають провідне місце в класифікації, тому що саме з цих мономерів і збудовано всі біологічно активні білкові молекули, наприклад такі, як ферменти, гемоглобін, актин, колаген і т. д. Будова амінокислот цього класу можна розглянути на прикладі гліцину, того самого, який широко застосовують у неврологічній практиці як заспокійливий препарат при лікуванні легких форм депресії та неврастенії.

Міжнародна назва цієї амінокислоти - α-амінооцтова, вона має оптичну L-форму і є протеїногенною, тобто бере участь у процесі трансляції та входить до складу білкових макромолекул.
Роль білків та їх мономерів в обміні речовин
Неможливо уявити нормальну життєдіяльність організму ссавців, зокрема й людини, без гормонів, які з білкових молекул. амінокислот, що входять до їх складу, підтверджує їхню приналежність до α-форм. Наприклад, трийодтиронін та тироксин виробляються. щитовидною залозою. Вони регулюють обмін речовин та синтезуються в її клітинах з α-амінокислоти тирозину. У простих і складних білкахперебувають як 20 основних мономерів, і їх похідні. У протромбіні, який регулює згортання крові, присутня карбоксиглутамінова кислота, в міозині ( м'язовому протеїні) Виявляється метиллізин, у ферменті пероксидазі - селеноцистеїн.
Харчова цінність білків та їх мономерів
Розглядаючи будову амінокислот та його класифікацію, зупинимося на градації, заснованої на здатності чи неможливості білкових мономерів синтезуватися у клітинах. Аланін, пролін, тирозин та інші сполуки утворюються в реакціях пластичного обміну, а триптофан та ще сім інших амінокислот мають потрапити до нашого організму тільки з харчовими продуктами.
Одним з показників правильного та збалансованого харчуванняє рівень споживання людиною білкової їжі. Він повинен становити не менше четвертої частини від кількості їжі, що надійшла в організм за добу. Особливо важливо, щоб протеїни містили у своєму складі валін, ізолейцин та інші незамінні амінокислоти. У цьому випадку білки будуть називатися повноцінними. Вони надходять в організм людини з рослинної їжі або продуктів, які містять гриби.
Самі незамінні мономери білків не можуть синтезуватися в клітинах ссавців. Якщо розглядати будову молекул амінокислот, які є незамінними, можна переконатися, що вони належать до різним класам. Так, валін і лейцин відносяться до аліфатичного ряду, триптофан - до ароматичних амінокислот, а треонін - до гідроксиамінокислот.






