Mis on peptiidside bioloogia definitsioonis. Peptiidid. Peptiidsideme elektrooniline ja ruumiline struktuur
Teatud tingimustel (näiteks teatud ensüümidega kokkupuutel) on aminohapped võimelised üksteisega reageerima. Interaktsiooni tulemusena α-aminorühmad (-NH2) üks aminohape koos α-karboksüülhape Grupp ( -COOH) tekib teine aminohape peptiidside.
Haridus peptiidside võib ette kujutada kui veemolekuli eraldumist üksteisega liituvatest karboksüül- ja aminorühmadest ( Riis. 1.9):
Riis. 1.9 Peptiidsideme moodustumine
Peptiidside, mis on iseloomulik esmane struktuur valgud, ei ole täielikult vallaline. Selle pikkus on 0,132 nm, mis on tõelise C-N üksiksideme (0,149 nm) ja tõelise C-kaksiksideme keskmine. = N (0,127 nm). Mõnede teadete kohaselt peptiidside on osaliselt kaksik- ja osaliselt ühekordne:
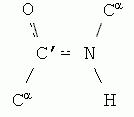
Joonis 1.10. Peptiidside
Peptiidsidemel on tasane struktuur(tasapinnaline ühendus), st kõik neli aatomit (C, N, O, H) asuvad selles üks lennuk, ja seda iseloomustab teatud jäikus, st.
Need peptiidsideme omadused tagatakse N- ja C-aatomite niinimetatud sp 2 elektronhübridisatsiooniga, pöörlemise puudumine ümber C´-N sideme
Vaatame lähemalt peptiidsideme peenstruktuure (elektroonilist).
Elektroonilised valemid C, N ja O:
Süsinik, lämmastik ja hapnikku kuuluma 2. periood, st on kaks energiataset. Teisel ( välised) energiatase lokaliseeritud kaks energiataset: s ja lk. Nende elementide elektroonilistel valemitel on järgmine vaade:
Süsinik K 1 s 2 2 2 2 p 2
Lämmastik N 1s 2 2s 2 2p 3
Hapnik O 1s 2 2s 2 2p 4
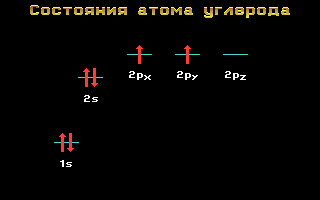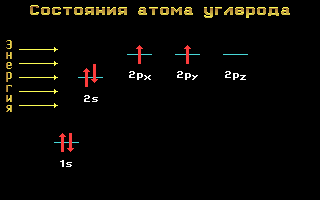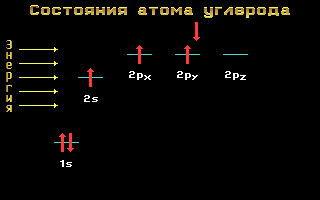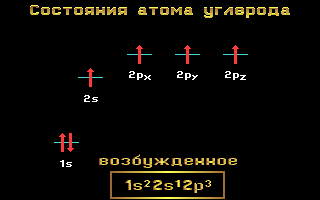
Riis. 1.11 Energiatasemed süsiniku aatom
Kovalentse peptiidsideme tekkele eelneb süsiniku- ja lämmastikuaatomite aatomiorbiitide sp 2 hübridisatsioon.
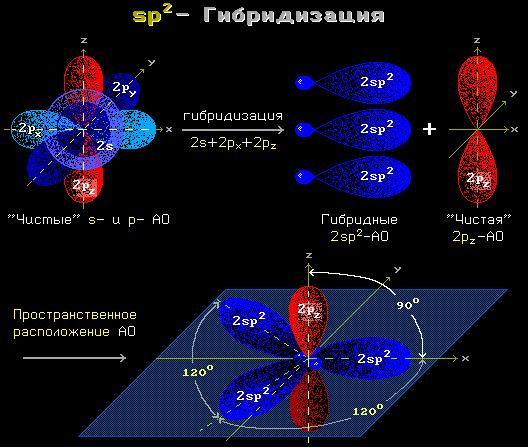
Riis. 1,12 sp 2 hübridisatsioon
sp 2-hübridisatsioon muudab ühe sfäärilise s- ja kaks pikendatud p-orbiidid aatomi elektronid kolmeks sp 2 -orbiidid. Need kolm orbiiti hõlmavad aatomit kolmes samas tasapinnas asuvas kovalentses sidemes..
Sp 2 hübridisatsioonis osalevad elektronid kovalentselt seotud C" ja N aatomid loovad "delokaliseeritud" elektronpilv, mis katab neid mõlemaid aatomeid ja levib ka - läbi C-O sideme - O-aatomini (seetõttu tõmmatakse C "=N ja C=O sidemed võrdsetena "poolteist").
![]()
Riis. 1.13 Kovalentse sideme delokaliseerimine peptiidsideme moodustumisel
Arvestatakse kovalentset sidet lokaliseeritud, kui selle elektronpaar on kahe tuumaga väljas ja seob ainult kaks aatom.
Delokaliseeritud ühendus- side, mille elektronpaar on hajutatud mitu (rohkem kui 2) aatomituuma. Sellised delokaliseerimine elektronide (hajutamine) on iseloomulik konjugeeritud π sidemed, st. mitu sidet vahelduvad üksikutega.
Elektronide hajumine on energeetiliselt soodne protsess, kuna viib molekuli energia vähenemiseni. P-elektronide delokaliseerumise vajalik tingimus on naabruses asuvate sp 2 aatomite p-aatomi orbitaalide π-kattumine.
C- ja N-aatomitel on aga rohkem p-elektronid välja arvatud need, mis on juba sp 2 orbiitidega seotud. Ja kuna need p-orbiidid on "kaheksade" kujuga risti kõigi kolme sp 2 orbiidiga, siis on nende p-elektronite lisaside side, mis nõuab "kaheksa" orbiidi lähenemist ja "sotsialiseerumist" (st üleminekuid aatomilt aatomile). ) nendel asuvatest elektronidest, - see p-elektronide sotsialiseerimine takistab pöörlemist ümber C "-N sideme.
Karboksüülrühma hapnikuaatom ja aminorühma vesinikuaatom võivad paikneda cis- või transs-positsioon seoses -C-N- sidemega.
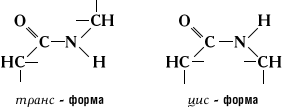
Riis. 1.14 cis- ja transs-peptiidsideme vorm
Suurem stabiilsus on katseliselt tõestatud transs-vormid.
PEPTIDID, looduslik või sünteetiline. Comm., to-rykh, mis on ehitatud a-aminohapete jääkidest, mis on omavahel ühendatud peptiid- (amiid)sidemetega C (O) NH. Võib sisaldada ka mitteaminohappelist komponenti (nt jääki). Peptiidides sisalduvate aminohappejääkide arvu järgi eristatakse dipeptiide, tripeptiide, tetrapeptiide jne. Kuni 10 aminohappejääki sisaldavad peptiidid, nn. oligopeptiidid, mis sisaldavad rohkem kui 10 aminohappejääki polüpeptiididest Pr, mille mol. m üle 6 tuhande naz.
Ajaloo viide. Esmalt eraldati peptiidid ensümaatilistest hüdrolüsaatidest. Mõiste "peptiidid" pakkus välja E. Fisher. Esimese sünteetilise peptiidi hankis T. Curtius 1881. aastal E. Fisher töötas 1905. aastal välja esimese üldine meetod peptiidide süntees ja sünteesitud hulk oligopeptiide lagunevad. hooned. Olendid. Peptiidide väljatöötamisele aitasid kaasa E. Fischeri õpilased E. Abdergalden, G. Leike ja M. Bergman. 1932. aastal kasutasid M. Bergman ja L. Zervas a-aminorühmade kaitsmiseks peptiidide sünteesil bensüüloksükarbonüülrühma (karbobenoksürühm), mis tähistas uus etapp peptiidide sünteesi arendamisel. Saadud N-kaitstud (N-karbobenoksüaminohappeid) kasutati laialdaselt erinevate peptiidide saamiseks, mida kasutati edukalt mitmete võtmeprobleemide ja nende B-B uurimiseks näiteks substraadi proteolüütilisuse uurimiseks. . N-karbobenoksüaminohapete kasutamisel sünteesiti esmakordselt ( jne). Oluline saavutus alguses välja töötatud. 50ndad P. Vaughan jt peptiidide süntees segameetodil (peptiidide sünteesi üksikasjalikke meetodeid käsitletakse allpool). 1953. aastal sünteesis V. Du Vigno esimese peptiidi β-oksütotsiini. P. Merrifieldi 1963. aastal välja töötatud kontseptsiooni alusel loodi tahkefaasilise peptiidi sünteesi kontseptsioon automaatselt. peptiidide süntesaatorid. Peptiidide kontrollitud ensümaatilise sünteesi meetodeid on intensiivselt välja töötatud. Uute meetodite kasutamine võimaldas läbi viia sünteesi jne.
Sünteetiline edu. peptiidid on valmistatud peptiidide, nagu dets. , geelfiltreerimine, suure jõudlusega (HPLC), immuno-chem. analüüs jne Saadud suur areng Vaadake ka lõpprühma analüüsi meetodeid ja peptiidide astmelisi lõhustamismeetodeid. Eelkõige loodi need automaatselt. aminohapete analüsaatorid ja automaatsed seadmed peptiidide primaarstruktuuri määramiseks - nn. sekveneerijad.
Peptiidide nomenklatuur. Peptiidide aminohappejääk, mis on vaba. a-aminorühm, mida nimetatakse. N-terminal ja kandja on tasuta. a-karboksüülrühm - C-ots. Peptiidi nimipärineb nimest. selle koostises olevad aminohappejäägid, mis on loetletud järjestikku, alustades N-otsast. Sel juhul kasutatakse triviaalseid nimetusi. , milles lõpp "in" asendatakse sõnaga "silt"; erand C-terminali jääk, nn. to-rogo ühtib nimega. vastav . Kõik peptiidides sisalduvad aminohappejäägid on nummerdatud alates N-otsast. Peptiidide () primaarse struktuuri registreerimiseks kasutatakse laialdaselt aminohappejääkide kolme- ja ühetähelisi nimetusi (näiteks Ala Ser -Asp Phe -GIy alanüül-serüül-asparagüül-fenüülalanüül-glütsiin).
Struktuur. on osaliselt St. See väljendub selle sideme pikkuse vähenemises (0,132 nm) võrreldes CN pikkusega (0,147 nm). Osaliselt topeltseotud tegelane muudab vabastamise võimatuks. asendajate pöörlemine selle ümber. seetõttu on peptiidrühm tasapinnaline ja sellel on tavaliselt trans-konfiguratsioon (vorm I). T. arr., peptiidahela selgrooks on rida jäikaid tasapindu, millel on liikuv ("hinge") liigend kohas, kus asümmeetrilised asuvad. C (f-le I on märgitud tärniga).
Peptiidide lahustes täheldatakse teatud konformeeride eelistatud moodustumist. Ketipikendusega saavutavad (sarnaselt) järjestatud elemendid suurema stabiilsuse sekundaarne struktuur(a - spiraal ja b - struktuur). Sekundaarse struktuuri moodustumine on eriti tüüpiline tavaliste peptiidide, eriti polüaminohapete puhul.
Omadused. Oligopeptiidid on lähedased St., sarnased. Oligopeptiidid on tavaliselt kristalsed. in-va, laadimisel lagunev. kuni 200 300 0 C. Nad on hästi sol. aastal , razb. to-max ja , peaaegu mitte sol. in org. r-hooldajad. Erand Hüdrofoobsetest jääkidest valmistatud oligopeptiidid.
Oligopeptiididel on amfoteersed omadused ja need võivad sõltuvalt söötme happesusest eksisteerida kujul või . Peamine neeldumisribad IR-spektris NH rühma puhul 3300 ja 3080 cm -1, C=O rühma puhul 1660 cm -1. UV-spektris on peptiidrühma neeldumisriba vahemikus 180-230 nm. Isoelektriline peptiidide punkt (pI) on väga erinev ja sõltub aminohappejääkide koostisest. Peptiidide pKa väärtused on a-COOH jaoks umbes. 3, -N H2 jaoks ligikaudu. kaheksa.
Chem. Oligopeptiidide pühad saared määratakse nendes sisalduvate funktsioonide järgi. rühmad, aga ka funktsioonid. Nende keemia. tähenduseks muutumine. kõige vähem sarnased vastavate p-sioonidega. Annavad positiivset. ja . Dipeptiidid ja nende derivaadid (eriti estrid) tsüklistuvad kergesti, muutudes. 5,7 n toimel.
vesinikkloriidhappe peptiidid hüdrolüüsitakse temperatuuril 105 0 C kuni 24 tunni jooksul.
Süntees. Chem. peptiidide süntees on luua rühma COOH üks ja NH2 vahel või peptiid. Vastavalt sellele eristatakse peptiidide sünteesi p-siooni karboksüül- ja amiinikomponente. Peptiidide sihipärase kontrollitud sünteesi läbiviimiseks on vaja eelnevalt. kõigi (või mõne) funktsioonide ajutine kaitse. rühmad, to-rukis haridusega mitte seotud, samuti esialgne. peptiidide sünteesi ühe komponendi aktiveerimine. Pärast sünteesi lõppu eemaldatakse. Bioloogiliselt aktiivsete peptiidide saamisel vajalik tingimus- ennetamine peptiidide sünteesi kõigil etappidel.
Naib. olulised viisid hariduse rakendamisel linnaosa p-taasaktiveeritud meetoditel. estrid, karbodiimiid, sega- ja asiidmeetod.
Aktiveeritud estri meetod põhineb eel- karboksüülkomponendi estri derivaadi moodustamine, viies sellesse tugevat elektrone eemaldavat asendajat sisaldava alkoholijäägi. Selle tulemusena moodustub väga reaktiivne ester, mis on kergesti avatud peptiidide sünteesi aminokomponendi toimele. aktivaatorina. estrid peptiidide sünteesil on laialdaselt kasutusel pentafluoro-, pentakloro-, trikloro- ja p-nitrofenüül ning hulk teisi kaitstud estreid ja peptiide.
Karbodiimiidi moodustumise meetod hõlmab kondenseeriva lagunemise kasutamist. asendatud. Eriti laialt levinud peptiidide sünteesis kasutati ditsükloheksüülkarbodiimiidi:
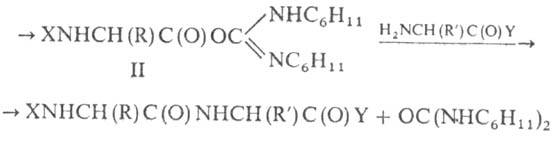
X ja Y vastavalt N- ja C-kaitserühmad veekeskkonnad, kuna p-sioonide ja vahepeal moodustunud O-atsüülisouurea (II) määrad erinevad oluliselt. Peptiidide sünteesis kasutatakse ka dekomp. vees lahustuvad karbodiimiidid (nt N-dimetüülaminopropüül-N"-etüülkarbodiimiid).
Segameetod põhineb esialgsel peptiidi sünteesi karboksüülkomponendi aktiveerimine, moodustades segatud karboksüül- või inorg-. sellele. Naib. kasutavad sageli kloroformhappe (klorosüsiniku) alküülestreid, eriti etüül- ja isobutüüleetreid, näiteks:
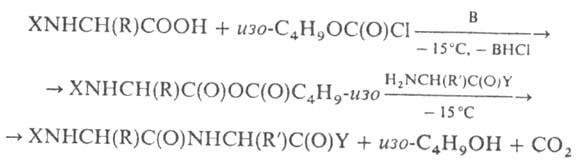
B - kolmanda taseme
Selle meetodiga peptiidide sünteesimisel on väga tõhusad segatud N-atsüülaminohapped ja pivaalhapped (trimetüüläädikhapped). Tänu tugevale panusele. karboksüül C tert-butüülrühma elektrofiilsus ülejäänud pivaalhappes on oluliselt vähenenud ja see koos steerilisega. takistusi, surub maha ebasoovitavad. kõrvalrajooni haridus ja tasuta. N-atsüülaminohapped, servad viiakse läbi vastavalt skeemile:
Segameetodi ühes versioonis kasutatakse kondenseeriva ainena 1-etoksükarbonüül-2-etoksü-1,2-dihüdrokinoliini. See on Comm. moodustab kergesti vaheühendi peptiidide sünteesi karboksüülkomponendiga. segatud, kiiresti ringkonda sisenev ja ebasoovitav on täielikult välistatud. kõrvalrajoon.
Segameetodi erijuhtum on sümmeetriline meetod. , milles kasutatakse 2 O. Nende kasutamine välistab võimaluse või on vale.
Asiidi sünteesimeetod hõlmab karboksüülkomponendi eelnevat aktiveerimist, muutes selle N-asendatud või peptiidiks:
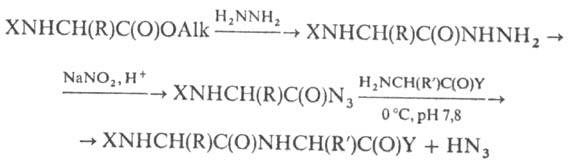
Nende ebastabiilsuse tõttu tasuta. vorm lahendusest reeglina ei ole isoleeritud. Kui p-tiooni asemel hüdrasiidiga kasutada lämmastikoksiidi alküülestreid (nt tert-butüülnitrit), võib asiidi läbi viia org-is. r-lahusti; saadud HN 3 on seotud tertsiaarsetega. Sageli on asiid ebasoovitavalt keeruline. külgmised p-sioonid (hüdrasiidi muutmine mitte amiidiks, vaid amiidiks; p-sioonhüdrasiid, mis põhjustab 1,2-diatsüülhüdrasiini moodustumist; int. moodustumine, to-ry, võib Curtiuse ümberpaigutamise tulemusena viia tuletise või vastavani jne). Asiidmeetodi eelisteks on väike määr, ilma kaitseta kasutamise võimalus.
Teisendamiseks kaitstud peptiidid vabakasutuse eripakkumistes. vabastamismeetodid, to-rukis, mis põhinevad p-sioonidel, pakkudes lõhustamist. , mis tagab kõigi säilimise . Blokeeringu eemaldamise näited: katalüütilise oksükarbonüülrühma eemaldamine atm juures. ja toatemperatuuril on tert-butüüloksükarbonüülrühma lõhustamine pehme, samuti hüdrolüütiline. trifluoroatsetüülrühma lõhustamine dil. r-kraav.
Bioloogiliselt aktiivsete peptiidide sünteesimisel on oluline, et seda ei esineks, servad võivad toimuda H + pöörduva lõhustamise tulemusena N-atsüülaminohappe või peptiidi a-C aatomist. panustada ja teile, kõrge temperatuur ja polaarsed lahendused. Mängib otsustavat rolli, katalüüsib, mis võib kulgeda läbi nn. aslaktooni mehhanism või enoliseerimine vastavalt skeemile:
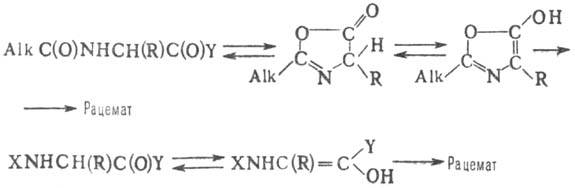
Naib. olulised eliminatsioonimeetodid: 1) peptiidahela pikendamine suunas C-otsast N-otsakasutades ROC(O) tüüpi N-kaitserühmi. 2) N-kaitstud peptiidi fragmentide aktiveerimine C-terminaalsete jääkidega või . 3) Asiidmeetodi kasutamine (liigse tertsiaarse puudumisel ja säilitamine madal temp. reaktsioonis keskkond). 4) Rakendus aktiveeritud. eetrid, to-rykh voolab läbi siirdeoleku, stabilisaator. vesiniksillad (nt N-hüdroksüpiperidiini ja 8-hüdroksükinoliiniga moodustunud estrid). 5) Karbodiimiidi meetodi kasutamine N-hüdroksüühendiga. või Lewise oma.
Koos peptiidide sünteesiga lahustes on oluline peptiidide süntees lahustumatute peptiidide abil. See hõlmab peptiide (p-tion või Maryfieldi meetod) ja peptiidide sünteesi polümeeride abil.
Tahkefaasilise peptiidi sünteesi strateegia näeb ette sünteesitud peptiidahela ajutise fikseerimise lahustumatule polümeeriahelale ja see viiakse läbi vastavalt skeemile:
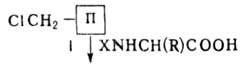
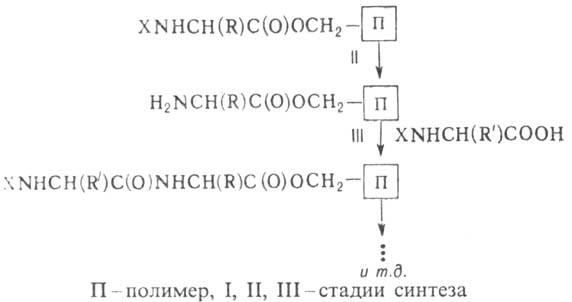
Tänu sellele meetodile oli võimalik asendada väga keerulised ja aeganõudvad vaheaine eraldamise ja puhastamise protseduurid. peptiidid lihtsate pesemistoimingutega ja , samuti vähendavad peptiidide sünteesi protsessi perioodiliselt korduvate protseduuride standardjärjestuseni, mida saab kergesti automatiseerida. Merrifieldi meetod võimaldas peptiidide sünteesi protsessi oluliselt kiirendada. Selle metoodika alusel erinevaid automaatide tüübid peptiidide süntesaatorid.
Ühendus on suure jõudlusega. Lahustumisvõimega peptiididele annab preparatiivne HPLC kvalitatiivse juurdepääsu uus tase chem. peptiidide süntees, mis omakorda avaldab soodsat mõju dekompi arengule. piirkondades, ütlevad nad. bioloogia, farmakoloogia ja meditsiin.
Polümeeride abil peptiidide sünteesi strateegia näeb ette ajutise seondumise suure molaarsusega. aktiveeritud karboksüülkomponent või peptiidide sünteesi kondenseeriv aine. Selle meetodi eeliseks on see, et fikseeritud peptiide saab sisestada liiga palju ja sünteesitud peptiidide eraldamine lahustumatutest ei ole keeruline.
Sellise sünteesi näiteks on aminokomponendi läbimine antud järjestuses läbi mitme. veerud, millest igaüks on seotud polümeeri aktivaatoriga. teatud eeter
Peptiidid. Elektrooniline ja ruumiline struktuur peptiidside.
TEGEVUS 14
PEPTIIDID JA VALGUD: STRUKTUUR, KLASSIFIKATSIOON JA FÜÜSIKALIS-KEEMILISED OMADUSED. IUD LAHENDUSED
Peptiidid. Peptiidsideme elektrooniline ja ruumiline struktuur.
Peptiidi (amiidi) rühmas -CO-NH- on süsinikuaatom sp 2 hübridisatsiooni olekus. Lämmastikuaatomi üksik elektronide paar konjugeerub C=O kaksiksideme π-elektronidega. Elektroonilise struktuuri seisukohast on peptiidrühm kolmetsentriline p, π-konjugeeritud süsteem, mille elektrontihedus on nihkunud elektronegatiivsema hapnikuaatomi poole. Konjugeeritud süsteemi moodustavad C-, O- ja N-aatomid asuvad samal tasapinnal. Elektrontiheduse jaotust amiidrühmas saab kujutada kasutades piirstruktuure (I) ja (II) või elektrontiheduse nihet, mis tuleneb vastavalt NH ja C=O rühmade +M- ja -M-efektidest ( III).
Konjugeerimise tulemusena toimub sideme pikkuste mõningane joondamine. C=O kaksikside pikeneb 0,124 nm-ni tavalise pikkusega 0,121 nm ja C-N side muutub lühemaks - 0,132 nm võrreldes tavalisel juhul 0,147 nm-ga (joonis 1). Tasapinnaline konjugeeritud süsteem peptiidrühmas raskendab pöörlemist ümber C-N sideme (pöörlemisbarjäär on 63-84 kJ/mol). Seega määrab elektrooniline struktuur ette peptiidirühma üsna jäiga tasapinnalise struktuuri.
Nagu näha jooniselt fig. 1, aminohappejääkide α-süsiniku aatomid paiknevad peptiidrühma tasapinnal piki erinevad küljed C-N sidemest, st soodsamas trans-asendis: aminohappejääkide külgradikaalid R on sel juhul ruumis üksteisest kõige kaugemal.
Polüpeptiidahelal on üllatavalt ühtlane struktuur ja seda saab kujutada üksteise suhtes nurga all paiknevate peptiiditasandite seeriana.
![]()
Riis. 1. Peptiidrühma -CO-NH- ja aminohappejääkide α-süsiniku aatomite tasapinnaline paigutus
rühmad, mis on omavahel seotud α-süsiniku aatomite kaudu Сα-N ja Сα-Сsp 2 sidemetega (joonis 2). Pöörlemine nende üksiksidemete ümber on aminohappejääkide külgradikaalide ruumilise paigutuse raskuste tõttu väga piiratud. Seega määrab peptiidrühma elektrooniline ja ruumiline struktuur suures osas ära polüpeptiidahela kui terviku struktuuri.






