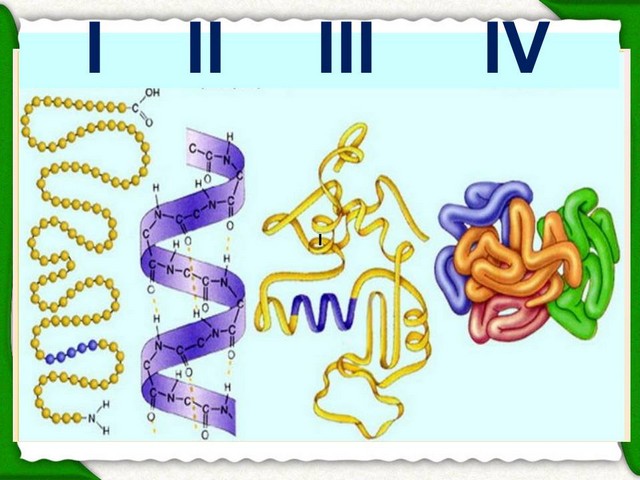
Millised biopolümeerid koosnevad aminohapetest. Polüpeptiidahela aminohapete järjestus, mis on omavahel seotud peptiidsidemetega


















![]()

 Tagasi edasi
Tagasi edasi
Tähelepanu! Slaidi eelvaade on ainult informatiivsel eesmärgil ja ei pruugi esindada esitluse kogu ulatust. Kui olete huvitatud see töö palun laadige alla täisversioon.
Tunni eesmärk: laiendada ja süvendada õpilaste teadmisi kõige olulisemast orgaaniline aine ah rakud – valgud.
Tunni eesmärgid:
- Hariduslik: võtta kokku õpilaste bioloogiaalased teadmised valgu funktsioonid, struktuur, struktuur, õpilastele tutvustada keemilised funktsioonid valke, paljastada seos keemiateadmiste ja inimese igapäevaelu vahel, kontrollida eelmistes tundides, aga ka bioloogiatundides õpitud ja kujunenud põhioskuste omastamise astet.
- Hariduslik: jätkata teadusliku maailmavaate kujundamist, kasvatada kõnekultuuri.
- Hariduslik: arendada kognitiivset huvi aine vastu, sellised protsessid nagu tähelepanu, loogiline mõtlemine, eruditsioon; oskusi iseseisev tööõpikuga oskust analüüsida informatsiooni, tuvastada põhjuslikke seoseid ainete koostise, struktuuri, funktsioonide ja kasutuse vahel; kohaldada teoreetilised teadmised praktika kohta; aminohapetest peptiidide moodustamise võrrandite koostamise oskus; kemikaalidega töötamise oskused; jätkata õpilaste keemilise kõne arendamist, nagu polümeer, alfa-aminohape, denaturatsioon, polükondensatsioonireaktsioon, laiendada õpilaste silmaringi täiendavate teabeallikate kaasamisega, jätkata teadmiste ja oskuste kasutamise oskuste ja oskuste kujundamist ning oskused uutes olukordades.
Tunni tüüp: kombineeritud
Varustus:
- munavalgelahus, vasksulfaadi (II), tsinkkloriidi, naatriumhüdroksiidi, etüülalkoholi lahused, katseklaasid nr 1– munavalge, lihapuljong, piim, nr 2 - puljongikuubik, vasktraat, villane niit, piirituslamp, tikud; didaktiline materjal (skeem "Keha keemiline koostis", " Üldvalem alfa-aminohapped", struktuurivalemid alaniin, seriin), töökaardid, arvuti, teler.
- Õpilaste laudadel: katseklaasid ainetega (nr 1 - munavalge, lihapuljong, piim, nr 2 - puljongikuubik), vasktraat, villane niit, piirituslamp, tikud; ülesandeid.
- Tahvlil: skeem "Keha keemiline koostis", "Alfa-aminohapete üldvalem", alaniini, seriini struktuurvalemid.
Tunni struktuur
II. Uue materjali õppimine
III. Ankurdamine
IV. Järeldus
v. Kodutöö
Tundide ajal
I. Organisatsioonihetk (1 min)
Õpetaja tervitus. Klassi tunniks valmisoleku kontrollimine. Psühholoogiline suhtumine klass. Puudujate märkimine.
II. Uue materjali õppimine (40 min)
1. Sissejuhatus tunni teemasse.
Õpetaja sissejuhatav kõne vestluselementidega. Skeemi täitmine tahvlil.
Keha koosneb paljudest ainetest. Klassifitseerime need. Siin on nimekiri erinevatest ainetest: vesi, valgud, süsivesikud, mineraalsoolad, rasvad, nukleiinhapped. Jagage need rühmadesse ja andke rühmadele nimed.
Skeemi täitmine. (õpilane tahvli juures)
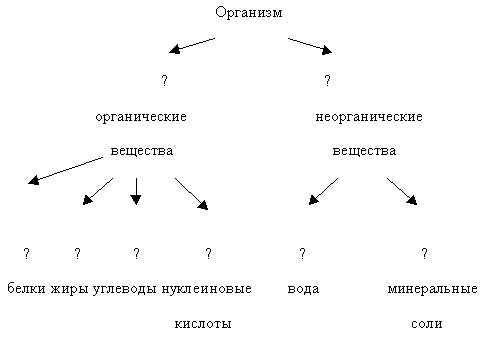
Ava õpiku lõik 27 lk.227 joon. 36, mis näitab keemiline koostis Inimkeha. Millist ainet on kehas rohkem? (vesi - 65%).
Milliseid aineid on keha moodustavatest orgaanilistest ainetest rohkem? (valgud)
Seega on elusorganismi aluseks valgud. Tänases tunnis vaatleme valke, nende koostist ja ehitust, tutvume valkude keemiliste funktsioonidega. Selleks vajame nii bioloogiakursuse teadmisi kui ka teie elukogemust.
Meie tunni teema: “Valgud kui biopolümeerid. Valkude keemilised funktsioonid”. ( slaid 1, Tunni kuupäeva ja teema kirjutamine vihikusse)
2. Valkude bioloogilised funktsioonid.
Vestlus, ülesannete täitmine vihikus.
Mõelge valkude bioloogilistele funktsioonidele. Täitke kirjalikult järgmine ülesanne. Võtke tööleht. (1. lisa)
Ülesanne number 1. (slaid 2)
Valgud ja nende funktsioonid on loetletud. Ühendage funktsioon noolte abil valguga. 1 minut ülesande täitmiseks. Olge ülesande täitmisel ettevaatlik.
- Ensüümid – ... (katalüütiline)
- Müosiin - ... (mootor)
- Hemoglobiin - ... (transport)
- Kollageen, keratiin - ... (struktuurne)
- Insuliin – ... (regulatiivne)
- Albumiin -... (reserv)
- Trombiin – ... (kaitsev)
- Glükogeen - ...----------------
Glükogeen on selles loendis lisaaine, kuna see ei ole valk. See on süsivesik.
Ja nüüd on teil küsimus bioloogiaõpetajalt Irina Arkadjevnalt (Slaid 3):
Teaduses on teada järgmine fakt: armunud keemiatudeng otsustas infot, et meie kehas on rauda, kasutada originaalsel viisil. Ta otsustas teha oma veres sisalduvast rauast südamedaamile sõrmuse. Väikesed portsjonid see vabastas verd, vabastas keemiliselt rauda. Kuid selline romantiline metallikaevandamise viis lõppes traagiliselt: ta suri aneemiasse. Ta ju ei teadnud, et meie veres on umbes 3–4 grammi rauda. Milline valk sisaldab rauda ja milline on selle tähtsus organismile? (raud on osa hemoglobiinivalgust, mis osaleb hapniku ülekandes).
Vaadake, kui mitmekesised on valkude funktsioonid. Kõik eluprotsessid on seotud valkudega. Tänu valkudele omandas keha võime liikuda, omastada toitu, kasvada, paljuneda ja reageerida välismõjudele.
Niisiis, me mäletasime mõningaid valkude bioloogilisi funktsioone. Liigume edasi järgmise küsimuse juurde: valk kui keemiline aine.
3. Valkude koostis ja struktuur.
Vestlus koos selgituselementidega, harjutused.
Mõelge valkude koostisele ja struktuurile.
Tehke pakutud sõnade põhjal valkude määratlus (4. slaid):
Valk, alfa-aminohape, biopolümeer, monomeer. (Valk on biopolümeer, mille monomeeriks on alfa-aminohape).
Millised keemilised elemendid moodustavad valke? (Süsinik, vesinik, hapnik, lämmastik, aga ka väävel, fosfor ja teised).
Kirjutage tahvlile pakutud osade alfa-aminohapete valem:
C, NH2, H, COOH, R.
(R-CHNH2-COOH) (õpilane tahvli juures)
Millised funktsionaalrühmad on aminohappes? (aminorühm, karboksüülrühm)
Millised omadused on aminohappel? (amfoteerne)
Miks on aminohape amfoteerne ühend? (aminorühm määrab aluselised omadused, karboksürühm määrab happelised omadused)
Kui palju aminohappeid moodustavad valgud? (kakskümmend)
Milline reaktsioon tekitab valke? (polükondensatsioon)
Mis on polükondensatsioonireaktsioon? (see on reaktsioon, mille tulemuseks on polümeeri moodustumine koos kõrvalsaaduse kõrvaldamisega)
Tehke tahvlil ja märkmikus järgmist.
Ülesanne number 2 (õpilane tahvli juures):
Kirjutage võrrand dipeptiidi tekkeks glütsiinist, seriinist. Märkige selles olevad peptiidsidemed.
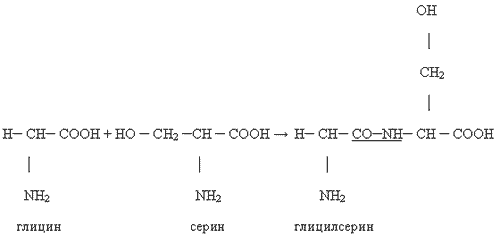
Saadud piirkond on insuliinivalgu dipeptiidpiirkond. Valkude polümeerahelad koosnevad kümnetest tuhandetest, miljonitest või enamatest aminohappejääkidest. Siin on mõnede valkude valemid (5. slaid):
- C 254 H 377 O 75 N 65 S 6 insuliin
- C 3032 H 4876 O 872 N 780 S 6 Fe 4 - hemoglobiin
- C 1864 H 3021 O 576 N 468 S 21 - laktoglobuliin (piimavalk)
Mis on teie arvates valkude molekulmass? (Väga suur). Näiteks insuliini molekulmass on M r 5727, hemoglobiin 66184, laktoglobuliini (piimavalgu) molekulmass on 39112.
Valguahel on nii pikk, et see on pakitud struktuuridesse, et oma funktsioone paremini täita.
Mõelge valkude struktuuridele.
Milliseid valkude struktuure te teate? (esmane, sekundaarne, tertsiaarne, kvaternaarne)
Modelleerime teie laual lebavast traadist valgu struktuuri. Võta ta.
Millise valgu struktuuriga saab seda võrrelda? (esmane)
Mis on valgu põhistruktuur? (aminohapete vaheldumine polüpeptiidahelas)
Kerige traat ümber käepideme. Millise valgu struktuuriga saab saadud heeliksit võrrelda? (teisene)
Mis on molekulis muutunud? (suurus on vähenenud, kuju on muutunud)
Tehke sellest spiraalist tükk. Mis on valgu struktuur? (tertsiaarne)
Mis on tertsiaarne struktuur? (kerake)
Pöörake üksteise poole, ühendage kaks kerakest? Mis on valgu struktuur? (kvaternaar)
Kaardilt täidame järgmise ülesande.
Kaardil on valgu struktuuride joonised. Numbrite all on toodud struktuure määratlevate linkide tüübid. Määrake valgu struktuur ja sidemete tüüp. Kirjutage pildi alla õige number.
Kontrollime ülesande õigsust. (6. slaid)
Milline struktuur on tugevaim? (esmane)
4. Valkude keemilised omadused.
Õpetaja selgitus vestluselementidega. Näidis- ja laborikatsete tegemine. Tahvlile ja vihikusse kirjutamine
Alustame valkude struktuuriga seotud omaduste uurimist. Tähelepanu ekraanile: tehnoloogiaõpetaja Tatjana Leonidovna küsimus (Slaid 7):
Iga perenaine teab, kui 1 roa jaoks on vaja keeta maitsev puljong, pannakse liha sisse külm vesi, ja kui maitsev liha 2 käigu jaoks - kuum. Kas sellel on keemiline tähendus?
Millisest valkude omadusest me räägime? (denatureerimise kohta)
1) Denatureerimine (kuumuse, kemikaalide jne tõttu)
Mis on denatureerimine? (valgumolekuli poolt oma struktuuri kaotamise protsess välistegurite muutumisel).
a) temperatuuri tõus
Mis põhjustab liha küpsetamisel denaturatsiooni? (küte, temperatuuri tõus)
Niisiis, uurisime valkude koostist ja struktuuri. Liigume edasi järgmise küsimuse juurde.
Vastame Tatjana Leonidovna küsimusele.
Miks pannakse liha maitsva puljongi saamiseks külma vette? maitsev liha- kuum? (Kui panna liha külma vette, lähevad lahustuvad valgud vette ja denatureerivad seal. Puljong tuleb maitsev. Kui paned liha kuuma vette, denatureerivad valgud kohe lihas, nii et liha tuleb maitsev)
– Millised tegurid peale temperatuuri põhjustavad denaturatsiooni? (temperatuuri muutus, kiiritamine, raskmetallide, hapete, orgaaniliste ainete toime, dehüdratsioon ja muud mõjud)
b) raskmetallide soolade mõju (dem.katse)
Võtan munavalge lahuse. Ühele klaasile lisan tsinkkloriidi, teise vask(II)sulfaati.
Mida me selles jälgime? (valgu voltimine)
Valgud seovad raskmetalliioone ja neutraliseerivad neid. Raskmetallidega mürgitamisel antakse ohvrile vastumürgiks piima.
c) orgaaniliste ainete toime (dem. kogemus)
Lisan munavalgelahusele etüülalkoholi. Jälgige valkude sadenemist.
Millised valgustruktuurid hävivad denatureerimisel? (sekundaarne, tertsiaarne, kvaternaar primaarse säilimisega). Bioloogilise aktiivsuse kaotus. Valk muutub kättesaadavaks seedeensüümide tegevuseks.
Mis on denatureerimine? (pööratav ja pöördumatu). See denaturatsioon on pöördumatu. Kas valgu struktuur saab taastuda? Kas me saame denatureerimisprotsessi tagasi pöörata? (Jah). Renaturatsioon on valgu struktuuri taastamise protsess.
Edasi Keemilised omadused aitab lahustes valke tuvastada.
2) Värvireaktsioonid
a) biureet (peptiidsideme peal)
See on universaalne reaktsioon valkude määramiseks. Vaatame videokogemust . (8. slaid)
Täitke oma märkmikusse diagramm.
Valk + ______________ = ____________ värvimine
Valk + ( leelis + CuSO 4)= lilla värvimine
Uurime katseklaasides leiduvaid tundmatuid aineid biureedi reaktsiooni abil. Jätkake laborikatsega vastavalt juhistele. (9. slaid)
Milline katseklaas sisaldab valku? Vaadake, millised ained teie katseklaasides olid (10. slaid):
- Katseklaas nr 1 - piim
- Katseklaas nr 2 - puljongikuubik
- Katseklaas nr 1 - lihapuljong
- Katseklaas nr 2 - puljongikuubik
- Katseklaas nr 1 - munavalge
- Katseklaas nr 2 - puljongikuubik
Valgu määramiseks valisin puljongikuubiku. Kas oravapuljongikuubik sisaldab? (Mitte). Ja selle koostises on näidatud taimsed rasvad ja kanaliha.
b) ksantoproteiin (aromaatsetel rõngastel) (videoklipp, slaid 11)
Täidame vihikusse diagrammi:
Valk +__________= ___________ värvimine
valk + konts. HNO3 = kollane värvimine
Lämmastikhappe hooletul ümberkäimisel jääb selle kokkupuutel nahaga kollane laik. See on ksantoproteiini reaktsioon sisekudedega.
Neid kvalitatiivseid reaktsioone saab elus rakendada. Ja millal ja kuhu ajendab lühike videoklipp Alla Surikova filmist “Otsi naist” (Slaid 12).
Millistel juhtudel ja mis eesmärgil saab neid elus rakendada? (Toiduainetööstuses, kohtuekspertiis valkude tuvastamiseks)
Biureet- ja ksantoproteiinireaktsioonid on kvalitatiivsed reaktsioonid, reaktsioonid, mis võimaldavad meil enesekindlalt hinnata, kas valk on meie ees või mitte.
3) Hüdrolüüs
Millist protsessi nimetatakse valkude hüdrolüüsiks? Sisestage puuduvad sõnad. (13. slaid)
Hüdrolüüs on ... valgu struktuuri hävitamine ..., samuti hapete või leeliste vesilahuste mõjul. (esmane, ensüümid)
Millised tooted tekivad valkude hüdrolüüsil? (aminohapped)
Kuidas muuta peptiidi moodustumise reaktsiooni võrrandit, et muuta see hüdrolüüsireaktsiooniks? (Kirjutage tagurpidi)
Glütsüülalaniini dipeptiidi hüdrolüüsi reaktsioonivõrrandi koostamiseks lisage vett. Peptiidside on katkenud. Vesinikuaatom on seotud ülejäänud aminorühmaga, hüdroksorühm ülejäänud karboksüülrühmaga.
Valkude hüdrolüüsi üldine skeem on teie õpikus.
Hüdrolüüs on seedimise alus.
4) Põlemine (süsinikdioksiidi, vee, lämmastiku moodustumisega.)
Lõhn: ... .
Kuidas kontrollida, kas toode on villast? (Vill on valk, peate põletama niiditüki ja määrama tulemuse lõhna järgi)
Jätkake laborikatsega vastavalt juhistele. (14. slaid)
Oleme vaadelnud valkude põhilisi keemilisi funktsioone.
III. Kinnitamine (3 min)
esiküsitlus.
Enne teid slaidil on sõnarühmad. Tehke mitme sõna kokkuvõte ühe sõna või terminiga. (Slaid 15-23)
A) tertsiaarne, sekundaarne, esmane, kvaternaarne -? (struktuurid)
B) 20, asendamatu -? (aminohappe)
C) valgud, rasvad, süsivesikud -? (orgaaniline aine)
D) temperatuur, pöörduv, pöördumatu -? (denatureerimine)
D) pepsiin, amülaas, trüpsiin -? (ensüümid)
E) Cu(OH)2, violetne värvus - ? (biureetiline reaktsioon)
IV. Järeldus (1 min)
Lõppsõna õpetajalt.
Täna tutvusime valgu keemiaga. Keemikud pole uurinud ühtki ainet nii kaua kui valke, enne kui neil õnnestus nende struktuuri saladus lahti harutada. Nad esinevad suur roll mitte ainult inimkehas, vaid ka elus. Pole juhus, et kreeka keelest tõlkes nimetatakse valke valkudeks, mis tähendab "esimene, peamine".
V. Kodutöö (1 min)
27. jagu
Valmistage ette sõnumeid teemadel:
A) värvireaktsioonide kasutamine
B) valkude uurimise ajalugu
C) denaturatsiooni põhjustavad tegurid.
Kirjandus
1. Artemenko A.I. hämmastav maailm orgaaniline keemia. - M.: Bustard, 2004.
2. Gorkovenko M.Yu. Tunni arengud keemias O.S.Gabrielyani treeningkomplektidele ja teistele.10. klass. M. "VAKO", 2005.
3. Rjabov M.A. Ülesannete ja harjutuste kogumik keemias: 10. klass: O.S.Gabrieliani jt õpikule “Keemia. Hinne 10". - M.: Eksam, 2008.
4. Keemia 10. klass. Proc. üldhariduse jaoks institutsioonid / O.S.Gabrielyan, F.N.Maskaev, S.Yu.Ponomarev, V.I.Terenin. – M.: Bustard, 2010.
Enamik orgaanilisi ühendeid bioloogilised polümeerid(kreeka poly many meros osa). Nende hulka kuuluvad valgud, nukleiinhapped ja polüsahhariidid (süsivesikud).
Taimerakkudes on ülekaalus süsivesikud, loomsetes rakkudes on aga rohkem valke.
Valkude ehk valkude ( kreeka protos on esimene, kõige olulisem) struktuur meenutab pikka ahelat, mille iga lüli on teatud aminohape. Kõik elusolendid on omavahel seotud toiduprotsesside kaudu. Vaatamata valkude ehituse erinevustele, kasutavad kõik organismid oma sünteesiks 20 identset aminohapet, neist 8 ei suuda inimorganism ise sünteesida ja neid tuleb varustada toiduga – neid nimetatakse asendamatuteks. Mõned valgud (piimakaseiin, lihasemüosiin) sisaldavad kõiki aminohappeid, teised (kalapiimas) aga alla poole.
Väikese 250 aminohappest koosneva valgu jaoks, millest igaüks on 20, on 20 250 (umbes 10 325) võimalikku molekuli! See on tohutu hulk: universumi nähtavas osas (üle 13 miljardi valgusaasta) "ainult" 1080 elektroni. Üllataval kombel moodustuvad väga erinevatest võimalikest aminohapete kombinatsioonidest eluks vajalikud funktsionaalsed valgud.
Valkude suhteline molekulmass ulatub kümnetesse tuhandetesse; insuliini - 5700 ja hemoglobiini - 65 000. Neid hiiglaslikke ühendeid, mis sisaldavad keskmiselt 300-500 aminohapet (tuhat aatomit), nimetatakse makromolekulideks.
Aminohapped on amfoteersed: neil on nii happelised kui aluselised omadused. Iga aminohappe koostis sisaldab lisaks ainult sellele spetsiifilisele radikaalile R happe (karbonüül)rühma COOH ja aminorühma NH2, mis annab sellele aluselised omadused (happelises ja aluselises aminohappes on rohkem kui üks). need rühmad). Ensüümide toimel võib ühe aminohappe karbonüülrühm interakteeruda teise aminohappe aminorühmaga, moodustades nn α-peptiidsideme, seetõttu nimetatakse valke ka polüpeptiidideks.
AT kunstlikud tingimused väljaspool rakku ilma ensüümide osaluseta erinevate tekkivate keemiliste sidemete vahel erinevad rühmad aminohapete aatomitest, ainult väike arv sidemeid saab olla -peptiid. Sellistel ühenditel puudub bioloogiline aktiivsus ja need ei ole valgud.
Valgus sisalduvate aminohapete järjestust nimetatakse primaarstruktuuriks. Pikliku ahela kujul ei ole valk võimeline oma spetsiifilisi funktsioone täitma. Sõbra järgi teise järel moodustavad valgu aminohapped kas spiraalseid struktuure (-heeliksid) või volte (nn -struktuurid, mis on kokku pandud volditud akordionilehtedeks). Sellised ruumiline korraldus polüpeptiidahela (ladumist) nimetatakse sekundaarstruktuuriks. Kuid isegi sellest keerulisest vormist ei piisa, et valgud saaksid täita kõiki oma funktsioone.
Enamikus valkudes on sekundaarse struktuuri elemendid (-heeliksid, -struktuurid ja korrastamata piirkonnad) täiendavalt virnastatud, et moodustada tertsiaarne struktuur. Kerakujulised (lat. globulus ball) valgud pakitakse palliks (või kerakeseks). Iga valk moodustab oma iseloomuliku gloobuli, millel on oma keerdkäigud. Keskmise valguahela pikkusega 100-200 nanomeetrit (1 nm = 10-9 m) on gloobuli läbimõõt vaid 5-7 nm. Fibrillaarsete (lat. fibrilla thread) valkude tertsiaarne struktuur moodustab filamentide või kihtide (valgud, kollageenid, keratiinid) kimpe.
Oma spetsiifiliste omaduste saamiseks moodustavad mõned valgud kõrgema järgu struktuure. Kvaternaarses struktuuris on mitu gloobulit (või fibrilli) ühendatud järjestikku. Niisiis koosneb hemoglobiini valk neljast globulaarsest subühikust (igaüks kannab heemirühma rauaiooniga).
Õige ruumilise struktuuri moodustumine toimub valguahela sünteesimisel (järjestikune aminohapete lisamine), valgu kokkupaneku igas etapis järgitakse miinimumreeglit potentsiaalne energia: hüdrofoobsed alad on peidetud sisse ja hüdrofiilsed alad surutakse välja; erineva märgiga laengud on võimalikult lähedased (näiteks NH3+ ja COO–). Kui neid voltimisreegleid mingil põhjusel rikutakse, on valk mitteaktiivne või isegi kehale ohtlik. Nakkuslikud prioonvalgud ( ing. proteininfektsiooni osakesed) erinevad oma tavalistest isovormidest ainult sekundaarse ja tertsiaarse struktuuri poolest, kuid põhjustavad inimestel ja imetajatel ravimatuid kesknärvisüsteemi haigusi. närvisüsteem("hullu lehma tõbi").
1. Milliseid molekule nimetatakse biopolümeerideks?
2. Kas meie keha sünteesib kõik vajalikud aminohapped?
3. Kuidas seostuvad aminohapped polüpeptiidiks?
4. Mida nimetatakse valgu primaarseteks, sekundaarseteks, tertsiaarseteks ja kvaternaarseteks struktuurideks? Mis on nende struktuuride funktsioon?
© Kõik õigused kaitstud
Töö tegi 11 "A" klassi lõpetaja Yezhely Igor
slaid 2
Valgud ehk valgud.
Kreeka keelest tõlgitud "protos" - esimene, pealik.
Need asuvad kõigi taime- ja loomarakkude protoplasmas ja tuumas, on peamised elukandjad.
- Albumiin (kanamunas)
- Hemoglobiin (inimese veres)
- Kaseiin (lehmapiimas)
- Müoglobiin ja müosiin (lihastes)
"Elu on valgukehade eksisteerimise viis"
(F. Engels)
slaid 3
Lihtsad kompleksvalgud koosnevad ainult aminohapete valgust ja mittevalgulisest osast
albumiin, fibriin (lipiidid, süsivesikud, metalliioonid) - proteolipiidid, hemoglobiin
Valkude mõiste ja nende klassifikatsioon
slaid 4
- Valgud on keerulised kõrgmolekulaarsed looduslikud ühendid, mis on ehitatud α-aminohapetest
- Valkudes olevad aminohapped on seotud peptiidsidemed
- Valgud kui biopolümeerid, nende koostis, struktuur ja funktsioonid rakus
- samade või erinevate aminohapete kõrvalradikaalid
- Umbes 20 tüüpi aminohappeid on osa valkudest.
Valgu koostis
slaid 5
Valgud kui biopolümeerid, nende koostis, struktuur ja funktsioonid rakus
slaid 6
Valgu esmane struktuur
Valgu molekulide organiseerituse aste
Polüpeptiidahela aminohapete järjestus, mis on omavahel seotud peptiidsidemetega
Slaid 7
Valgu molekulide organiseerituse aste
Heeliksiks keerdunud polüpeptiidahel, mida hoiab koos moodustis vesiniksidemed erinevate aminohapete karboksüül- ja amiinirühmade jääkide vahel
Slaid 8
- Valgu tertsiaarne struktuur
- Spiraal on omakorda keritud kera ja palli kujul.
- Seda struktuuri stabiliseerivad vesinik, ioonsed, kovalentsed, disulfiidsidemed ja hüdrofoobsed interaktsioonid.
Igal valgul on teatud keskkonnas oma eriline ruumiline struktuur.
Slaid 9
Valgu kvaternaarstruktuur on seos mitme molekuli ühtseks struktuuriks, millel on tertsiaarne organisatsioon (hemoglobiin, insuliin)
Slaid 10
Valgu molekuli struktuur
Valgud kui biopolümeerid, nende koostis, struktuur ja funktsioonid rakus
slaid 11
Valgud kui biopolümeerid, nende koostis, struktuur ja funktsioonid rakus
- Valgu tüübid
- Struktuurne
- Ensüümid
- Hormoonid
- Kokkutõmbuv
- toksiinid
- Varu
- Kaitsev
- Transport
- Valgu tüübid
slaid 12
Valkude klassifikatsioon nende funktsioonide järgi
- Valgu tüübid
- Ensüümid
- Hormoonid
- Transport
- Kaitsev
- Varu
- toksiinid
- Struktuurne
- Struktuurne
- katalüütiline
- Reguleerivad
- Kokkutõmbuv
- Kokkutõmbuv
- Transport
- Kaitsev
- Varu
- Kaitsev
- Keratiin
- Insuliin
- Müosiin
- Hemoglobiin
- Antikehad
- Kaseiin
- taimetoksiinid
- Valgu funktsioonide näited
slaid 13
- Kesktaseme teadmiste kontroll
- Uurige aminohapete mitmekesisuse skeemi.
- Mille poolest erinevad aminohapped üksteisest?
- Kirjeldage aminohapete olulisi komponente.
- Täpsustage need aminohapete osad. Mille vahel on peptiidside.
- Mis põhjustab mitmesuguseid valke?
Slaid 14
Kesktaseme teadmiste kontroll
Täida tabelis olevad lüngad.
Valgu struktuurne korraldus
1. Millised sidemed eksisteerivad valgu molekulis?
2. Milliste sidemete tõttu tekivad valguahelas pöörded?
3. Millised sidemed on valgu tertsiaarse struktuuri aluseks?
4. Milline struktuur pakub erinevaid valgu funktsioone?
slaid 15
Täname tähelepanu eest!
Vaadake kõiki slaide






