Valkude ja peptiidide ruumiline struktuur. Valgu molekuli ruumiline korraldus
Teatud spetsiifiliste funktsioonide täitmine valkude poolt sõltub nende molekulide ruumilisest konfiguratsioonist, lisaks on rakule energeetiliselt ebasoodne hoida valke laiendatud kujul, ahela kujul, mistõttu polüpeptiidahelad volditakse, omandades. teatud kolmemõõtmeline struktuur või konformatsioon. Määrake 4 taset ruumiline korraldus valgud.
Valgu esmane struktuur- aminohappejääkide järjestus polü peptiidahelat mis moodustab valgu molekuli. Aminohapete vaheline side on peptiid.
Kui valgu molekul koosneb ainult 10 aminohappejäägist, siis teoreetiliselt see arv valikuid valgu molekulid, mis erinevad aminohapete vaheldumise järjekorras - 10 20. 20 aminohappega saate neist rohkem kasu suur kogus erinevaid kombinatsioone. Inimese organismist on leitud umbes kümme tuhat erinevat valku, mis erinevad nii üksteisest kui ka teiste organismide valkudest.
See on valgumolekuli esmane struktuur, mis määrab valgumolekulide omadused ja selle ruumilise konfiguratsiooni. Ainuüksi ühe aminohappe asendamine teisega polüpeptiidahelas viib valgu omaduste ja funktsioonide muutumiseni. Näiteks kuuenda glutamiini aminohappe asendamine valiiniga hemoglobiini β-subühikus toob kaasa asjaolu, et hemoglobiini molekul tervikuna ei suuda täita oma põhifunktsiooni - hapniku transporti; sellistel juhtudel tekib inimesel haigus – sirprakuline aneemia.
sekundaarne struktuur- polüpeptiidahela järjestatud voltimine spiraaliks (näeb välja nagu venitatud vedru). Heeliksi pooli tugevdavad vesiniksidemed karboksüülrühmade ja aminorühmade vahel. Peaaegu kõik CO ja NH rühmad osalevad vesiniksidemete moodustamises. Need on nõrgemad kui peptiidsed, kuid korduvalt korrates annavad nad sellele konfiguratsioonile stabiilsuse ja jäikuse. Tasemel sekundaarne struktuur seal on valgud: fibroiin (siid, võrk), keratiin (juuksed, küüned), kollageen (kõõlused).
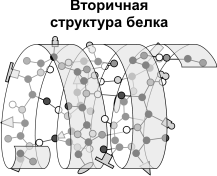

Tertsiaarne struktuur- polüpeptiidahelate pakkimine gloobulitesse, mis tulenevad keemiliste sidemete (vesinik-, ioon-, disulfiid) tekkimisest ja hüdrofoobsete interaktsioonide loomisest aminohappejääkide radikaalide vahel. Peamist rolli tertsiaarse struktuuri moodustamisel mängivad hüdrofiilsed-hüdrofoobsed interaktsioonid. Vesilahustes kipuvad hüdrofoobsed radikaalid vee eest peitu pugema, rühmitudes gloobuli sees, hüdrofiilsed radikaalid aga hüdratatsiooni (koostoime veedipoolidega) tulemusena molekuli pinnale. Mõnedes valkudes stabiliseeritakse tertsiaarne struktuur kovalentsete disulfiidsidemetega, mis moodustuvad kahe tsüsteiinijäägi väävliaatomite vahel. Tertsiaarse struktuuri tasemel on ensüümid, antikehad, mõned hormoonid.
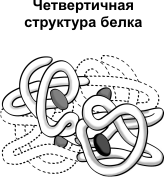
Kvaternaarne struktuur iseloomulik komplekssed valgud, mille molekulid moodustavad kaks või enam gloobulit. Alamühikuid hoiavad molekulis ioonsed, hüdrofoobsed ja elektrostaatilised interaktsioonid. Mõnikord tekivad kvaternaarse struktuuri moodustumisel subühikute vahel disulfiidsidemed. Enim uuritud kvaternaarse struktuuriga valk on hemoglobiini. See moodustub kahest α-subühikust (141 aminohappejääki) ja kahest β-subühikust (146 aminohappejääki). Iga subühik on seotud rauda sisaldava heemimolekuliga.
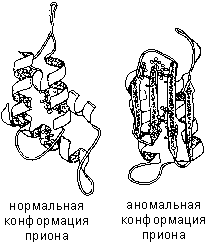
Kui valkude ruumiline konformatsioon mingil põhjusel normaalsest hälbib, ei saa valk oma funktsioone täita. Näiteks "hullu lehma tõve" (spongiformse entsefalopaatia) põhjus on prioonide, närvirakkude pinnavalkude, ebanormaalne konformatsioon.
Testi küsimused
1. Milline side moodustab valkude sekundaarstruktuuri.
a) vesinikside;
b) kovalentne side;
c) ester;
d) peptiidside.
Valkude kovalentne skelett koosneb sadadest üksikutest sidemetest. Kui vaba pöörlemine nende sidemete murdosa ümber oleks võimalik, oleks valkudel peaaegu piiramatu arv kolmemõõtmelisi struktuure. Kuid igal valgul on spetsiifiline funktsioon, mis eeldab selle ainulaadset ruumilist struktuuri. Asjaolu, et valgud kristalliseeruvad, annab tugeva tõendi selliste struktuuride olemasolu kohta. Ranget molekulaarset järjestust kristallis saab realiseerida, kui kõik molekulid on kristallis ühesuguse kujuga. 483 kDa ureaasi ensüüm oli üks esimesi kristalliseerunud valke.
Ruumiline paigutus aatomeid valgu molekulis nimetatakse konformatsioon. Konformatsioonilised muutused tekivad üksiksidemete ümber pöörlemisel ilma neid purustamata. Rakendatud valkudes neli taset arhitektuur.
Esmane struktuur seotud kovalentsete sidemetega aminohappejääkide vahel (aminohappejärjestus). Seotud aminohapete suhteline ruumiline paigutus ei ole spetsiifiline. Polüpeptiidahelatel ei saa olla valitud ruumilist struktuuri. Steerilised piirangud, aga ka paljud nõrgad mittevalentse vastasmõjud, viivad selleni, et mõned ruumivormid on stabiilsemad kui teised.
sekundaarne struktuur Termin "regulaarne konformatsioon" viitab külgnevate aminohappejääkide korrapärasele paigutusele polüpeptiidahelas. Polüpeptiidahelate sekundaarse struktuuri jaoks on kõige iseloomulikum a-spiraal ja b-konformatsioon.
Tertsiaarne struktuur Termin "polüpeptiidis" viitab kõigi aminohapete ruumilisele paigutusele polüpeptiidis. Sekundaarse ja tertsiaarse struktuuri vaheline seos ei ole praegu piisavalt selge. Mitu erinevat tüüpi sekundaarseid struktuure leidub sageli suure valgu tertsiaarses struktuuris.
Mitme peptiidahelaga valkudel on veel üks kõrge tase organisatsioonid: kvaternaarne struktuur, mis viitab polüpeptiidahelate või subühikute ruumilisele paigutusele valgus. Vahetasemeid saab eristada sekundaarse ja tertsiaarse struktuuri vahel. Sekundaarse struktuuri mitme elemendi stabiilset klastrit nimetatakse ülisekundaarne struktuur. Veelgi kõrgem struktuur on domeeni. Seda nimetatakse kompaktseks struktuuriks, mis võib koosneda 40 kuni 400 aminohappest, kusjuures domeen on eraldiseisev ühik suures polüpeptiidahelas. Paljud domeenid voldivad sõltumatult termodünaamiliselt stabiilseteks struktuurideks. Suur polüpeptiidahel võib sisaldada mitmeid kergesti eristatavaid domeene. Mõnel juhul on üksikutel domeenidel eraldi funktsioonid.
Valgu konformatsiooni stabiliseerib suur hulk nõrku mittevalentseid interaktsioone. Loodusliku valgu konformatsiooni stabiilsus on madal, seega on tüüpiliste valkude volditud ja voldimata olekute vaba energia erinevus füsioloogilistes tingimustes vahemikus 20 kuni 65 kJ/mol. Paljude polüpeptiidahela rühmade entroopia ja vesiniksidemed lahustiga (veega) viivad avatud vormideni. Volditud vormid põhjustavad keemilisi koostoimeid disulfiidsildade kujul, aga ka mittevalentseid koostoimeid: vesiniksidemed, hüdrofoobsed, ioonilised ja van der Waalsi interaktsioonid.
Valkude levinuim sekundaarstruktuur on a-heeliks. Selles struktuuris on polüpeptiidi karkass keerdunud piki molekuli suhteliselt pikka telge ja aminohappejääkide R-rühmad paiknevad koos väljaspool spiraalid. Heeliksi samm on 0,56 nm. Valkude teist tüüpi korrapärane struktuur on b-konformatsioon, mis aitab kaasa polüpeptiidahelate virnastamisele kihtidena, samas on võimalik nii paralleelne kui ka antiparalleelne ahelate paigutus. Mõnedes valkudes (näiteks kollageenis) leidub lisaks nendele korrapärastele konformatsioonidele ka teist tüüpi sekundaarseid struktuure: b-kordne ja b-pööre. Kuigi fibrillaarsetel valkudel on ainult ühte tüüpi sekundaarne struktuur, võivad globulaarsed valgud sisaldada ühe molekuli jaoks mitut tüüpi sekundaarset struktuuri. Globulaarsed valgud, sealhulgas ensüümid, transportvalgud, mõned hormoonid ja immunoglobuliinid, moodustavad volditud struktuure, mis on kompaktsemad kui a- ja b-konformatsioonid.
Tertsiaarne struktuur kujutab kõigi valgu aatomite kolmemõõtmelist paigutust ja tegeleb aminohappejääkide vaheliste pikamaa interaktsioonidega. Sea albumiini ühes ahelas on 584 jääki.
Allpool on näidatud ahela suhtelised suurused b-konformatsioonis, a-heeliksi vormis ja natiivses kerajas vormis.
b-konformatsioon: 200 x 0,5 nm
a-spiraal: 90 x 1,1 nm looduslik keraja vorm: 13x3 nm
Aatomite ruumiline paigutus valgu kristallvõres määratakse röntgendifraktsioonianalüüsiga, mis põhineb aatomite elektronkestade suhtes difraktsiooni nurkade ja intensiivsuse alusel. Praeguseks on see meetod loonud sadade globulaarsete valkude (müoglobiin, insuliin, tsütokroom c, lüsosüüm, ribonukleaas jne) tertsiaarsed struktuurid.
jaga- spiraalid ja b- vormid mõnedes valkudes.
Valgud võivad denatureerida kuumutamisel, pH järsul muutusel, töötlemisel orgaaniliste lahustitega, raskmetallide sooladega koos tertsiaarse struktuuri hävimisega ja funktsionaalse aktiivsuse kadumisega.
Tertsiaarsed struktuurid ei ole jäigad, valgusünteesi käigus tekivad need üsna kiiresti, mitte juhuslikult. Paljude valkude jaoks on piisavalt levinud mitut tüüpi tertsiaarseid struktuure (a/b tünn, b-b võileib ja teised).
Mõned valgud sisaldavad kahte või enamat eraldi peptiidahelat, mis võivad olla struktuurilt identsed või erinevad. Valkude ja selle alaühikute ruumiline paigutus kolmemõõtmelises kompleksis kujutab endast kvaternaarset struktuuri, mis määratakse praktikas valgu monokristalli röntgendifraktsioonianalüüsiga. Seega on kindlaks tehtud hemoglobiini kvaternaarne struktuur, mis sisaldab nelja polüpeptiidahelat ja nelja gemprosteetilise rühma.
Mõned valgud moodustavad supramolekulaarseid komplekse, mis säilitavad põhimõtted, mis on omased valgu organiseerimise kõikidele tasanditele. Nendest supramolekulaarsetest kompleksidest ehitatakse bioloogilised masinad, mis teostavad raku funktsioneerimist (lihaste kokkutõmbumine, valkude süntees ribosoomides, DNA pakkimine, organellide liikumine jne).
Küsimused enesekontrolliks
1. Peptiidsideme omadused.
2. PH mõju valkude konformatsioonilisele struktuurile.
3. Disulfiidsidemete roll.
4. Mis määrab valkude natiivse struktuuri termilise stabiilsuse?
5. Spetsiifiliste aminohapete lokaliseerimine globulaarsete valkude pinnal.
6. Mis määrab hemoglobiini molekulmassi?
Valgu esmane struktuur - aminohappe fragmentide järjestus, mis on kindlalt (ja kogu valgu eksisteerimise perioodi jooksul) ühendatud peptiidsidemetega. Valgumolekulide poolestusaeg on - enamiku valkude puhul umbes 2 nädalat. Kui vähemalt üks peptiidside on katkenud, moodustub teine valk.sekundaarne struktuur - see on polüpeptiidahela tuuma ruumiline korraldus. Neid on 3 peamised tüübid sekundaarne struktuur:
1) alfa spiraal - sellel on teatud omadused: laius, spiraali kahe pöörde vaheline kaugus. Valke iseloomustab parempoolne spiraal. Selles heeliksis on 36 aminohappejääki 10 pöörde kohta. Kõigil peptiididel, mis on paigutatud sellisesse spiraali, on täpselt sama spiraal. Alfaheeliks fikseeritakse vesiniksidemete abil spiraali ühe pöörde NH-rühmade ja külgneva pöörde C=O-rühmade vahel. Need vesiniksidemed on paralleelsed spiraali teljega ja korduvad mitu korda, seega hoiavad nad kindlalt spiraalset struktuuri. Pealegi hoitakse neid mõnevõrra pinges olekus (nagu kokkusurutud vedru).
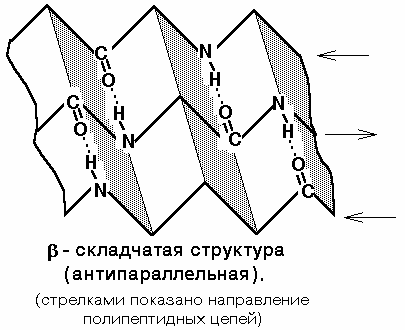
2) Beetavoldi struktuur- või volditud lehe struktuur. Samuti on see fikseeritud vesiniksidemetega C=O ja NH rühmade vahel. Kinnitab kaks polüpeptiidahela osa. Need ahelad võivad olla paralleelsed või antiparalleelsed. Kui sellised sidemed tekivad ühe peptiidi sees, siis on need alati antiparalleelsed ja kui erinevate polüpeptiidide vahel, siis paralleelsed.
3) ^ ebakorrapärane struktuur - sekundaarse struktuuri tüüp, mille puhul polüpeptiidahela erinevate lõikude paigutus üksteise suhtes ei ole korrapärase (püsiva) iseloomuga, seetõttu võivad ebakorrapärased struktuurid olla erineva konformatsiooniga.
^ Tertsiaarne struktuur - see on polüpeptiidahela kolmemõõtmeline arhitektuur - polüpeptiidahela spiraalsete, volditud ja ebakorrapäraste osade spetsiaalne vastastikune paigutus ruumis. Erinevatel valkudel on erinev tertsiaarne struktuur. Tertsiaarstruktuuri moodustamisel osalevad disulfiidsidemed ja kõik nõrgad sidemete tüübid.
On kaks üldine tüüp tertsiaarne struktuur:1) B fibrillaarsed valgud (nagu kollageen, elastiin), mille molekulid on pikliku kujuga ja moodustavad tavaliselt kudede kiulisi struktuure, on tertsiaarstruktuur esindatud kas kolmekordne alfa-heeliks(näiteks kollageenis) või beetavoldi struktuurid.
2) B globulaarsed valgud mille molekulid on sfääri või ellipsi kujuga (ladina nimi: GLOBULA- pall), on kõigi kolme tüüpi struktuuride kombinatsioon: alati esineb ebakorrapäraseid laike, on beeta-volditud struktuure ja alfa-heeliksid.
Tavaliselt globulaarsetes valkudes asuvad molekuli hüdrofoobsed piirkonnad sügaval molekulis. Omavahel ühendades tekivad hüdrofoobsed radikaalid hüdrofoobsed klastrid(keskused). Hüdrofoobse klastri moodustumine sunnib molekuli ruumis vastavalt painduma. Tavaliselt on globulaarses valgu molekulis molekuli sügavuses mitu hüdrofoobset klastrit. See on valgusmolekuli omaduste duaalsuse ilming: molekuli pinnal on hüdrofiilsed rühmad, seetõttu on molekul tervikuna hüdrofiilne ja hüdrofoobsed radikaalid on peidetud molekuli sügavustes.
Kvaternaarne struktuur ei esine kõigis valkudes, vaid ainult nendes, mis koosnevad kahest või enamast polüpeptiidahelast. Iga sellist ahelat nimetatakse antud molekuli ALLÜHIKS (või PROTOMEERIKS). Seetõttu nimetatakse kvaternaarse struktuuriga valke OLIGOMEERSETeks valkudeks. Valgu molekul võib sisaldada samu või erinevaid subühikuid. Näiteks hemoglobiini "A" molekul koosneb kahest ühte tüüpi subühikust ja kahest teist tüüpi subühikust, see tähendab, et see on tetrameer. Valkude kvaternaarsed struktuurid on fikseeritud igat tüüpi nõrkade sidemetega, mõnikord ka disulfiidsidemetega.
^ Füüsiline- Keemilised omadused valgud
Valgumolekuli aminohappeline koostis, s.o. primaarstruktuuri tunnused määratakse mitte ainult struktuurne korraldus, bioloogilised funktsioonid vaid ka valkude füüsikalis-keemilisi omadusi. Iseärasused füüsilised ja keemilised omadused kasutatakse üksikute valkude eraldamiseks ja eraldamiseks valgusegudest. Füüsikalis-keemilisi omadusi arvestades räägitakse valgumolekulide molekulmassist, amfoteersusest, laengu olemasolust, isoelektrilisest punktist, valkude võimest liikuda elektriväljas, valkude lahustuvusest ja valkude omadustest. valgu denatureerimise kohta.
^ Valkude molekulmass
"Valgud on suure molekulmassiga ühendid", algab selle ainete klassi määratlus. Valkude molekulmass ulatub 6 tonnist daltonist mitme miljonini. Näiteks: insuliin - 5733, hemoglobiin - 6450, - inimese globuliin - 160 000, glutamaatdehüdrogenaas - 1 miljon, tubaka mosaiikviirus - 40 miljonit daltonit.
Valkude molekulmassi määramiseks arvutatakse kõige täpsem meetod, kuid selleks peate teadma aminohapete koostist (st valgu esmane struktuur tuleb dešifreerida); kvaternaarse struktuuri olemasolu või puudumine peab olema teada ja kuna looduslike valkude tohutust mitmekesisusest (10 10 - 10 12) on see kõik teada vaid tuhande valgu kohta, jäävad peamised molekulmassi määramise meetodid:
viskosimeetriline;
osmomeetriline;
gravimeetriline;
geelfiltreerimine;
elektroforees (eriti kolm viimast meetodit).
Valkude lahustuvus
Valkude lahustuvus on väga erinev ja selle määravad:
- aminohapete koostis(mida rohkem polaarseid rühmi, seda parem lahustuvus);
valgumolekuli organisatsiooni tunnused (kerakujulised lahustuvad paremini kui fibrillaarsed);
lahusti omadused ( taimsed valgud lahustuvad paremini 60–80 ° alkoholis, albumiinid - vees ja soolalahustes, globuliinid - nõrkades soolalahustes).
Lahustuvust mõjutavad keskkonnategurid:
sõltub soolalahuste olemusest ja kontsentratsioonist, mis kajastub kontseptsioonis - lahuse ioontugevus, mis määratakse valemiga:
kus c on soola kontsentratsioon;
B on valents (st soola olemus).
Madala ioontugevusega leelis- ja leelismuldmetallide soolade soolad suurendavad lahustuvust, kuna. hüdratatsioonikihi moodustumise võimalus suureneb, ioontugevuse suurenemisel lahustuvus väheneb, kusjuures iga valk kaotab lahustuvuse, s.t. sadestub lahusest täpselt määratletud ioontugevusega. Valkude sadestumist leelis- ja leelismuldmetallisooladega lahustest nimetatakse väljasoolamiseks. Soola sadestusvõime sõltub nii katioonist kui ka anioonist. Katioone ja anioone saab paigutada kahte ritta vastavalt vasakult paremale langevale sadestusvõimsusele:
Katioonid: Cs, Rb, K, Na, Li, Ba, Sc, Ca, Mg
Anioonid: SO4, Cl, Br, NO3, J, KNS
Neid seeriaid nimetatakse lüotroopseteks seeriateks. Väljasoolamist kasutatakse laialdaselt valkude ja ensüümide eraldamiseks (näiteks albumiinid globuliinidest) ning puhastatud kujul valkude ja ensüümide saamiseks. Kuna väljasoolamine mõjutab hüdratatsioonikestat, on see protsess pöörduv. Samuti on võimalik eemaldada hüdratatsioonikest ja seeläbi sadestada lahusest valku vett eemaldavate ainetega - alkohol, atsetoon (kasutatakse valkude fraktsioneerimise meetodit erineva kontsentratsiooniga alkoholidega - Kohni järgi). See on omamoodi väljasoolamine ja kui mõju ei ole väga pikk, on protsess pöörduv.
Valkude lahustuvus sõltub temperatuurist ja temperatuuri tõustes 40 ° C-ni see suureneb ja edasise tõusuga väheneb tertsiaarsete ja kvaternaarsete (kui neid on) struktuuride muutuste tõttu, mida saab väljendada graafikuga.

Valkude lahustuvus oleneb ka söötme pH-st. Isoelektrilises olekus, kui molekuli kogulaeng on 0) ja hüdratatsioonikest ei moodustu, valgud sadestuvad. See omadus põhineb valgu isoelektrilise punkti määramisel, isoelektrilisel sadestumisel ja valkude eraldamisel (kui söötme pH muutub nii, et see vastab valgu isoelektrilisele punktile, siis see sadestub).
Meetodid valkude fraktsioneerimiseks (eraldamiseks) lahustuvuse järgi:
isoelektriline sade;
väljasoolamine;
eraldamine veetustajatega.
Valgustruktuurid on väga tundlikud keskkonnamuutuste, eriti tertsiaarsete ja kvaternaarsete muutuste suhtes. Nimetatakse looduslikele molekulidele omase muutumatu struktuuri ja omadustega valke looduslikud valgud. Igasugust mittehüdrolüütilist muutust valgu struktuuris, mis viib selle bioloogiliste ja füüsikalis-keemiliste omaduste muutumiseni, nimetatakse denaturatsiooniks (mittehüdrolüütiline, st ei mõjuta peptiidsidet, esmast struktuuri).
Denaturatsioonifaktorid:
füüsikaline: temperatuur, rõhk, ultraheli:
kemikaalid: happed, leelised, pesuained, raskmetallid, uurea;
bioloogilised: proteolüütilised ensüümid.
Denaturatsiooni märgid:
Bioloogilise aktiivsuse kaotus, võimetus oma funktsiooni täita.
Valgu molekuli konformatsiooni muutus.
Funktsionaalrühmade arvu suurenemine (ilmuvad hüdrofoobsed rühmad, mis on natiivse valgu molekuli sees).
Valgu lahustuvuse ja selle sadenemise vähendamine hüdrofoobse kesta kadumise tõttu.
Valgulahuste viskoossuse, optilise aktiivsuse, läbipaistvuse muutus.
Värvimismuutus, mida kasutatakse histoloogias.
Seoses valgu molekuli struktuuri muutumisega, uute rühmade ilmumisega molekuli pinnale muutuvad valgu sisesidemed proteolüütiliste ensüümide toimele paremini ligipääsetavaks, s.t. selline valk seeditakse paremini.
Denatureerimine on pöörduv protsess, kui mõju on lühiajaline ja denatureeriv aine eemaldatakse enne sekundaarse struktuuri mõjutamist.
Denatureerimist kasutatakse laialdaselt meditsiinis, tööstuses, laboripraktikas ja igapäevaelus.
^ Valkude eraldamine ja puhastamine
Valkude eraldamine ja puhastamine koosneb mitmest etapist:
Kudede lihvimine kuni rakuseinte hävitamiseni - homogeniseerimine.
Ekstraheerimine - valkude ekstraheerimine erinevate lahustitega; vesi, nõrk soolalahused, puhverdatud soolalahused jne.
Ekstrakti eraldamine esmalt fraktsioonideks ja seejärel kombineerimise teel üksikuteks valkudeks erinevaid meetodeid sadestamine (väljasoolamine, IET-sadestamine, diferentsiaaltsentrifuugimine), elektroforees, geelfiltreerimine, kromatograafia.
Valkude puhastamine (dialüüs, geelfiltreerimine, ümbersadestamine, diselektroforees).
Kristalliseerimine (väljasoolamine, lüofiliseerimine).
Homogeensuse seadistus.
Saada oma head tööd teadmistebaasi on lihtne. Kasutage allolevat vormi
Üliõpilased, magistrandid, noored teadlased, kes kasutavad teadmistebaasi oma õpingutes ja töös, on teile väga tänulikud.
Majutatud aadressil http://www.allbest.ru/
Valkude ja peptiidide ruumiline struktuur
Iga valk või peptiid on ruumis kindlal viisil volditud ja see konformatsioon määrab selle füüsikalis-keemilise ja bioloogilised omadused. Valgu (peptiidi) kui terviku ruumilist struktuuri kodeerib selle esmane struktuur. See seos loob eeldused teoreetiliseks arvutamiseks ja valkude sekundaarstruktuuri prognoosimiseks nende aminohappejärjestuse põhjal. Ruumiline struktuur on üsna liikuv, see tähendab, et see võib mõju all muutuda välised tingimused või mitmesugused ained ja selles mõttes on õigem rääkida valgu või peptiidi eelistatud konformatsioonist, ühest paljudest, energeetiliselt soodsaimast ruumilisest struktuurist. Keskkond, isegi kõige loomulikum, ei saa muud kui põhjustada valgu molekuli ja eriti selle rühmade reaktsiooni, mis asuvad gloobuli pinnal ja osalevad paljudes interaktsioonides. Elusrakus on valk pidevalt muutuvas keskkonnas ja on sunnitud end kuidagi ümber korraldama, kui ta puutub kokku naabervalkude, retseptorite või selliste püsivate partneritega nagu nukleiinhapped, lipiidid, polüsahhariidid, metalliioonid ja muud madalmolekulaarsed ained. kaaluühendid. Seetõttu on loomulik, et teadlane otsib täielikumat teavet valgu molekuli dünaamiliste omaduste kohta. Piltlikult öeldes tahab ta näha mitte fotot, vaid värvifilmi kõigist toimiva valgu molekuli seiklustest ja transformatsioonidest.
Ülimalt tähtis on loodusliku valgu konformatsiooni väljaselgitamine, mis määrab bioloogilise toime spetsiifilisuse. Kuna peptiid-valkainete ruumilise struktuuri analüüsimisel kasutatavad katsetingimused erinevad tavaliselt tingimustest, milles need toimivad in vivo, on igal juhul vaja rangelt tõestada, et uuritud eelistatud konformatsioon säilib üldiselt laias vahemikus keskkonnaparameetrid (näiteks lahuses või kristallis) .
Seega piisab peptiidide ja valkude ruumilise struktuuri selgitamisest raske ülesanne. Mõnel juhul saab konkreetse ühendi kolmemõõtmelist struktuuri selgitada mis tahes ühe meetodi alusel (näiteks kasutades kristalse valgu röntgendifraktsioonianalüüsi). Peptiidide ja väikeste valkude uurimisel lahustes toredaid tulemusi annab mitmete füüsikalis-keemiliste meetodite kombinatsiooni. Mõnikord saab väärtuslikku teavet teoreetiliste arvutusmeetodite ja eksperimentaalsete lähenemisviiside kasutamise kaudu.
Valkudes, nagu juba märgitud, eristatakse mitut ruumilise korralduse tasandit, st sekundaarseid, tertsiaarseid ja kvaternaarseid struktuure. Kuigi need mõisted on valkude puhul mõnevõrra vananenud ja peptiidide puhul neid üldse ei kasutata, kasutatakse neid järjepidevuse huvides, kuna lõppkokkuvõttes pakub see huvi Täielik kirjeldus antud valgu või peptiidi ruumiline struktuur aatomite täpsete koordinaatidega, kõigi konformatsiooniliste üleminekutega – otseses seoses teostatava bioloogilise funktsiooniga.
Aminohapete stereokeemia
valgu peptiidi aminohape
Kõiki valkudes leiduvaid aminohappeid (v.a proliin) saab esitada valemiga NH2CHRCOOH, kus R on erineva iseloomuga radikaalid. Üldjuhul on tegemist asümmeetrilise süsinikuaatomiga ühenditega ja seetõttu võib iga aminohape ruumis eksisteerida kahe vormina - asümmeetrilise tsentri L- ja D-konfiguratsiooniga.
Aminohapete kuulumist L- või D-seeriasse kõige lihtsamate esindajate (alaniin, seriin) puhul tõestab nende otsene redutseerimine vastavaks glütseraldehüüdiks stereospetsiifiliste transformatsioonide abil.
Kõik valgud sisaldavad ainult L-aminohappeid (välja arvatud optiliselt inaktiivne glütsiin), mida saab esitada Fisheri projektsioonivalemite kujul:
L-seeriasse kuulumine ei pruugi olla seotud polariseeritud valguse tasapinna kindla pöörlemissuunaga: L-aminohapetel on nii positiivne kui ka negatiivne pöörlemine, olenevalt radikaalist R ja uurimistingimustest.
D-aminohapetel on vastupidine konfiguratsioon:
D-aminohapete jäägid on osa paljudest looduslikest peptiididest, peamiselt antibiootikumidest. Eelkõige sisaldab gramitsidiin 8 B- fenüülalaniin kuni gramitsidiinini AGA --D-valiin, D- leutsiin, D-trüptofaan, aktinomütsiin D - D-isoleutsiin, polümüksiin - D-seriin, D-proliini leidub ergoalkaloidides.
Mõnel aminohappel on kaks asümmeetrilist süsinikuaatomit, mis teeb võimalikuks nelja optiliselt aktiivse stereomeerse vormi (2n, kus n on asümmeetriliste aatomite arv). Neid vorme illustreerib diagramm treoniini ja isoleutsiini kohta.
Asendaja ilmumine proliini pürrolidiinitsüklisse viib samuti moodustumiseni Tere-vormid, milles on asendaja (hüdroksürühm) ja karboksüülrühm cis-positsioon.
Valkude happelisel hüdrolüüsil tekib L-aminohapete segu, mida saab fraktsioneeriva kristallimise või kromatograafia abil eraldada. puhtal kujul. Samamoodi võib mitmete looduslike peptiidide (gramitsidiinid A ja S, aktinomütsiin jne) hüdrolüüsil saada ka vastavaid puhtaid D-aminohappeid.
Tihti saadakse uurimiseesmärkidel ja praktilistel vajadustel kasutatavad aminohapped mikrobioloogilise sünteesi abil (lüsiin jne) – siis on saadusteks L-isomeerid. Kui kasutatakse keemilist sünteesi, siis tekivad tavaliselt aminohapete L- ja D-isomeeride segud, st ratsemaadid. Neid kasutatakse eraldamiseks erinevaid trikke. Üks levinumaid on N-atsetüül-D,L-aminohapete või D,L-aminohapete vastavate estrite selektiivne hüdrolüüs ensüümide (atsülaaside, esteraaside jne) poolt; sel juhul lõhustub ainult L-vorm ja seega tekivad lahuses vabad L-aminohapped, mis on kergesti eraldatavad D-aminohappe derivaatidest, mis on ensümaatilise hüdrolüüsi suhtes stabiilsed.
Teiseks meetodiks on D, L-aminohapete soolade moodustamine optiliselt aktiivsete ainetega, nagu alkaloidid brutsiin ja strühniin, aga ka teised optiliselt aktiivsed amiinid, mida toodetakse tööstuslikus mastaabis (amfetamiin jne). Vastavate diastereomeersete soolade (D,L ja L,L) erineva lahustuvuse tõttu eraldatakse need kristallimise või fraktsioneeriva sadestamise teel ning järgneval hapetega lagunemisel moodustuvad optiliselt puhtad L- ja D-aminohapped. Need meetodid, mida varem laboris laialdaselt kasutati, kaotavad järk-järgult oma tähtsust. Tööstuslikes tingimustes kasutatakse ratseemiliste aminohapete eraldamiseks üha enam kromatograafiat optiliselt aktiivsetel adsorbentidel ja immobiliseeritud ensüümidel.
Peptiidside
Kodu struktuuriüksus valgud ja peptiidid on peptiid (amiid) side --CO--NH--. Vastavalt kaasaegsed ideed, on valkude peptiidside peaaegu tasane, selle peamised parameetrid on näidatud joonisel. AT normaalsetes tingimustes täheldatakse ainult väikeseid kõrvalekaldeid tasasest süsteemist (kuni 5-10 °); pingestatud tsüklilistes süsteemides on võimalikud suured deformatsioonid. Peptiidside on umbes 10% lühem kui tavaliselt, lihtne C--N ja sellel on "osaliselt kaksikside" -C=N-- iseloom. Seda probleemi uurides pakkusid L. Pauling ja R. Corey, kes analüüsisid röntgendifraktsioonianalüüsiga mitmeid mudeldi- ja tripeptiide, 1948.–1955. selgitage C-N sideme erilist olemust peptiidsideme kahe vormi vahelise "resonantsiga" a ja b.
Teisisõnu, valkudes ja peptiidides on C-N side osaliselt mitmekordne (nagu näitab struktuur c) lämmastikuaatomi üksiku elektronpaari interaktsiooni tõttu p-elektrooniline süsteem karbonüülrühm, mis põhjustab keerulist pöörlemist ümber C--N sideme (pöörlemisbarjäär on 63-84 kJ / mol).
Tavaliselt on peptiidsidemel trans-konfiguratsioon, st see on transplanaarne (joonis 33, a). Pingutatud tsüklilistes süsteemides (mõned tsüklopeptiidid, proliini derivaadid jne), samuti suur suurus N-alküülitud derivaatide lämmastikuaatomi juures olevad asendajad, võib peptiidside eksisteerida tasapinnalises cis-vormis (joonis 33b). cis- ja transs peptiidsidemeid saab eristada kasutades füüsilised meetodid(IR, NMR spektroskoopia jne). Valkudes on peptiidsidemel peaaegu alati trans-konfiguratsioon.
Sidenurgad ja sideme pikkused (nm) tollides trans- ja cis-peptiidsidemed (a ja b vastavalt)
Vaatleme nüüd peptiidahela fragmenti, mis sisaldab kahte lamedat peptiidsidet, millel on liikuv (teatud tüüpi liigend) liigend asümmeetrilise süsinikuaatomi asukohas (joonis 34).
Polüpeptiidahela kahetahuliste nurkade määramine
Selles peptiidahela lülis on võimalik pöörlemine asümmeetrilise aatomiga külgneva kahe lihtsideme N--С6 ja С6--С ümber. Sageli kasutatakse ka nurki u (ümber pööramine peptiidsidemed C "--N), samuti h1 ja h2 jne (pöörlemine ümber sidemete Cb - Sv, Sv - Cr jne). Null võrdluspunktiks võetakse konformatsioon (joon. 35), in mis c \u003d w \u003d w \u003d 0 ° (peamise peptiidahela jääkide varjatud paigutus) Nurkade lugemise suund - positiivne (kuni + 180 °) ja negatiivne (kuni - 180 °) on näidatud joonisel 35 nooltega.
On lihtne mõista, et peptiidahela mis tahes konformatsiooni saab kirjeldada nurkade z ja w väärtuste kogumiga iga C6 aatomi jaoks (tavaliselt u = 180°); teisisõnu on kõigi peptiidiühikute selliste väärtuste teadmine samaväärne täielik teave umbes ruumiline struktuur valgu ja peptiidi selgroog.
Graafiliselt on polüpeptiidahela konformatsioonilisi parameetreid mugavalt kujutatud, kasutades G. Ramachandrani poolt 1963. aastal välja pakutud kaarte (“Ramachandrani kaardid”) ning kajastades jäägi energia sõltuvust parameetritest q ja w (joonis 36). Nurkade c ja w väärtused kantakse piki koordinaattelge vahemikus -180° kuni +180°. Peptiidahela asendajate vahelise interaktsiooni tõttu ei saa nurgad q ja w võtta mingeid väärtusi - nende jaoks on lubatud ainult mõned diskreetsed piirkonnad (kaardil esile tõstetud tumedat värvi), mis vastavad peptiidahela energeetiliselt soodsatele konformatsioonidele, st sisuliselt on minimaalse energiaga piirkonnad. Nende üsna kompaktne lokaliseerimine näitab, et nurgad φ ja ω on omavahel seotud, muutus ühes neist toob kaasa muutuse teises. Näiteks kui nurk w omandab väärtuse vahemikus 60–120 °, siis nurga z puhul osutub väärtus, mis ei ületa -60 °, energeetiliselt soodsaks.
Peptiidahela konformatsioonid, mis vastavad nullväärtused nurgad c, w ja u (mustad nooled näitavad vaatleja pilgu suunda)
Mittevalentsed interaktsioonid peptiidahelas
Valkude ja peptiidide ruumilise struktuuri määravad peamiselt mittevalentsed interaktsioonid erinevate aatomite vahel, mille hulka kuuluvad van der Waalsi elektrostaatilised ehk ioonsed, ioon-dipool- ja dipool-dipool-, hüdrofoobsed, torsiooninteraktsioonid ja vesiniksidemed.
Peaahela kahetahuliste nurkade lubatud alad.
Vesiniksidemed tekivad reeglina liikuva vesinikuaatomi (--OH,--NH,--SH) ja heteroaatomi, kõige sagedamini hapnikuaatomi vahel. Vesinikside on doonor-aktseptor iseloom, st see moodustub heteroaatomi (elektronide doonor) jagamata elektronpaari osalusel; elektroni aktseptor on vesinikuaatom. Kõrgeim väärtus valkude ruumilise struktuuri moodustamiseks on neil CO vahel vesiniksidemed - ja peptiidi karkassi NH rühmad.
Mittepolaarses keskkonnas on CO...НN vesiniksideme energia umbes 16,7 kJ/mol ja keskkonna polaarsuse suurenemine vähendab seda energiat.
Lisaks sellele on võimalikud ka vesiniksidemed külgahelate funktsionaalsete rühmade osalusel, näiteks:
Hüdrofoobseid koostoimeid on raskem seletada. Põhimõtteliselt on sellised entroopilise iseloomuga vastasmõjud tingitud asjaolust, et mittepolaarsed asendajad surutakse veest välja ja kipuvad piirama nende kokkupuudet veega; vastupidi, vesi püüab taastada oma struktureeritud olekut ja justkui sunniviisiliselt rühmitab asendajad klastritesse, millel on minimaalselt energiat. Sellised "interaktsioonid" hõlmavad peamiselt aminohappejääkide mittepolaarseid külgrühmi.
Van der Waalsi interaktsioonid, mida kirjeldab Lenard-Jonesi potentsiaal, on aatomite külgetõmbejõudude ja nende elektronkestade vastastikuse tõukejõu summa. Nagu jooniselt näha, on kõige soodsam kaugus Rm võrdne interakteeruvate aatomite efektiivsete raadiuste summaga või sellele lähedane.
Lenard-Jonesi potentsiaal (potentsiaali miinimum vastab kaugusele Rm ja tõmbeenergiale Em)
Iga kontakti energiapanus on väike (<0,42 кДж/моль), но ввиду их большого числа ван-дер-ваальсовые взаимодействия дают основной вклад в суммарную энергию внутримолекулярных невалентных взаимодействий.
Ioonsed ehk elektrostaatilised vastasmõjud on laetud rühmade vastastikmõjud. Sel juhul, nagu on teada, sarnase laenguga rühmad tõrjuvad ja vastupidiselt laetud rühmad tõmbavad. Nende hulka kuuluvad eelkõige soolasidemeid moodustavate ionogeensete rühmade vastasmõju.
Soolasidemete energia hüdrofoobses keskkonnas võib ulatuda 41,9 kJ/mol, kuid nende arv valkudes on suhteliselt väike. Söötme dielektrilise konstandi suurendamine alandab soolasidemete energiat. Ioon-dipool ja dipool-dipool interaktsioonid on paljuski sarnased elektrostaatiliste vastasmõjudega.
Lõpuks iseloomustavad torsiooni vastasmõjud tavalise sideme "torsiooni". Eelkõige võib mis tahes rühma pöörlemine tavalise sideme ümber häirida selle sideme elektroonilist struktuuri ja põhjustada omamoodi "pidurdusreaktsiooni". Torsioonjõud on suhteliselt nõrgad, kuid analüüsides aminohappejääkide külgahelates C--C, C--N sidemete ümber toimuvaid pöörlemisi, ei saa neid ignoreerida.
Valgu ja peptiidi antud tingimustes realiseerunud konformatsioon määratakse kõigi loetletud interaktsioonide summaga ja on energeetiliselt kõige soodsam, mida peegeldab vastavate nurkade "löök" konformatsioonilise "Ramachandrani" lubatud aladel. kaardid".
Majutatud saidil Allbest.ru
Sarnased dokumendid
Aminohapped, mis moodustavad peptiide ja valke. Monoaminodikarboksüülhapped ja nende amiidid. Aminohapete enantiomeeria, soolade moodustumine. Mesomeeria ja peptiidsideme struktuur. Valkude eraldamise ja analüüsi meetodid. Elektroforees polüakrüülamiidgeelis.
esitlus, lisatud 16.12.2013
rolli eluslooduses. Valkude koostis ja omadused. Valkude klassifikatsioon. Valkude struktuuri määramine. Valgu olemasolu määramine. Valkude ja polüpeptiidide identifitseerimine. Peptiidide süntees. Valkude kunstlik tootmine. Aminohapped.
abstraktne, lisatud 01.12.2006
Valkude üldised omadused, klassifikatsioon, struktuur ja süntees. Valkude hüdrolüüs lahjendatud hapetega, valkude värvusreaktsioonid. Valkude tähtsus toiduvalmistamisel ja toitudes. Inimorganismi vajadus ja seeduvus valkudes.
kursusetöö, lisatud 27.10.2010
Hinnang Venemaa praegusele haldusterritoriaalsele struktuurile. Valguuuringud. Valkude klassifikatsioon. Koostis ja struktuur. Keemilised ja füüsikalised omadused. Valkude keemiline süntees. Valkude väärtus.
abstraktne, lisatud 13.04.2003
Biopolümeeride klassifikatsioon. Peptiide ja valke moodustavad aminohapped, struktuur ja omadused. Monoaminodikarboksüülhapped ja nende amiidid. Soola moodustumine. peptiidside. Valkude struktuurse organiseerituse tasemed. Nukleiinhapped ja nende derivaadid.
esitlus, lisatud 28.02.2012
Valgud peptiidsidemetega polümeeridena. Makrokompleksi (oligoproteiini) moodustumine, mis koosneb mitmest täielikust valgu subühikust. Fibrillaarsed ja kerakujulised rühmad. Valkude analüüs ja süntees. Merrifieldi meetod – peptiidide tahkefaasiline süntees.
abstraktne, lisatud 21.02.2009
Valkude kui makromolekulaarsete ühendite iseloomustus, nende struktuur ja teke, füüsikalis-keemilised omadused. Valkude seedimise ensüümid seedetraktis. Valkude laguproduktide imendumine ja aminohapete kasutamine kehakudedes.
abstraktne, lisatud 22.06.2010
Valgud on makromolekulaarsed looduslikud ühendid, mis koosnevad peptiidsidemetega seotud aminohappejääkidest. Valkude kvalitatiivne koostis, nende struktuur ja funktsioonid. Hüdrolüüsi protsessid (happe-aluselised, ensümaatilised) ja valkude denatureerimine.
esitlus, lisatud 11.02.2015
Valkude omaduste uuringud nende keemilise koostise ja struktuuri uurimiseks. Aminohape on valgu põhiline struktuuriüksus. valguvarud. Valgu sünteesi etapid. Aminohapete biosünteesi reguleerimine. Valkude seedimine. Valkude metabolismi patoloogia.
abstraktne, lisatud 17.01.2009
Aminohapete metabolismi tavalised rajad. Valkude väärtus ja funktsioon organismis. Valgu normid ja selle bioloogiline väärtus. Aminohapete allikad ja kasutusviisid. lämmastiku tasakaal. pankrease mahl. Komplekssete valkude seedimine. Transamineerimise mõiste.