Початок перетравлення білків відбувається в. Розщеплення білків у процесі травлення
Усі харчові продукти, головним чином, складаються з білків, вуглеводів та ліпідів. У процесі травлення у шлунково-кишковому трактіссавців три основних компоненти їжі: вуглеводи, жири та білки піддаються ферментативному гідролізу, розпадаючись при цьому на складові будівельні блоки, у тому числі вони утворені. Цей процес необхідний для утилізації харчових продуктівоскільки клітини, що вистилають кишечник, здатні всмоктувати в кровотік лише відносно невеликі молекули. Засвоєння полісахаридів і навіть дисахаридів стає можливим лише після їхнього повного гідролізу травними ферментами до моносахаридів. Аналогічно білки та ліпіди також повинні бути гідролізовані до блоків, з яких вони побудовані.
Процес травлення починається з ротової порожниниі шлунка, тоді як кінцеві етапи перетравлення всіх основних компонентів їжі та всмоктування в кров складових їх структурних блоків відбуваються в тонкому кишечнику. Анатомічно тонкий кишечник добре пристосований для виконання цієї функції, оскільки він має дуже велику площу поверхні, через яку відбувається всмоктування. Тонкий кишечник характеризується не тільки великою довжиною≈ 4,5 м), але також наявністю на нього внутрішньої поверхнімножини складок з великою кількістю пальцеподібних виступів, званих ворсинками. Кожна ворсинка покрита епітеліальними клітинами, що несуть численні мікроворсинки. Ворсинки створюють величезну поверхню, через яку продукти перетравлення швидко транспортуються в епітеліальні клітини, а з них - капіляри кровоносної системи і в лімфатичні судини, розташовані в стінці кишечника. Площа поверхні тонкого кишечника людини становить 180 м 2 , тобто. лише трохи менше ігровий майданчиктенісний корт.
У мікроворсинках містяться пучки актинових мікрофіламентів, з'єднаних в основах мікроворсинок з мережею міозинових ниток. Ця система ниток забезпечує хвилеподібні коливання мікроворсинок, завдяки яким відбувається місцеве перемішування та краще всмоктування перетравлених поживних речовин.
Засвоєння білків
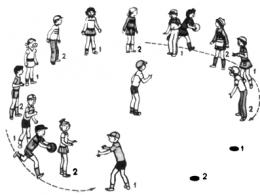
Білки їжі розщеплюються ферментами в шлунково-кишковому тракті до амінокислот, що їх складають (рис. 1.1). Білки, що надходять у шлунок, стимулюють виділення гормону гастрину, який у свою чергу викликає секрецію соляної кислоти обкладальними клітинами залоз слизової оболонки шлунка, а також пепсиногену головними клітинами. Шлунковий сік має рН від 1,5 до 2,5. Завдяки такій кислотності він діє як антисептик, вбиваючи більшість бактерій та інших клітин. Крім того, в умовах низького рН шлункового соку глобулярні білки піддаються денатурації, їх молекули розгортаються і внаслідок цього внутрішні пептидні зв'язки поліпептидних ланцюгів стають доступнішими для ферментативного гідролізу. Пепсиноген, що є неактивним попередником ферменту, або зимогеном, перетворюється на шлунковому соку на активний пепсин у результаті ферментативного дії самого пепсину, тобто. шляхом автокаталізу. У ході цього процесу з N-кінця поліпептидного ланцюга пепсиногену відщеплюються 42
|
Активність |
|
|
(К. Ф. 3.4.4.1) |
Tyr, Phe, Tгр, Leu, Glu, Gln |
|
(К. Ф. 3.4.4.4) |
Атакує пептидні зв'язки: Lys, Arg |
|
Хімотрипсин (К. Ф. 3.4.4.5) |
Атакує пептидні зв'язки: Tyr, Phe, Tr p |
|
Карбоксипептидаза (К. Ф. 3.4.2.1) |
Послідовне відщеплення С-кінцевих залишків |
|
Амінопептидаза (К. Ф. 3.4.1.1) |
Послідовне відщеплення N-кінцевих залишків |
Мал. 1.1. - Перетравлення білків: 1 - протеолітичні ферменти
амінокислотного залишку у вигляді суміші коротких пептидів. Інша частина, що залишається інтактною, молекули пепсиногену являє собою ферментативно активний пепсин (К. Ф. 3.4.4.1). У шлунку пепсин гідролізує ті пептидні зв'язки в білках, які утворені ароматичними амінокислотами: тирозином, фенілаланіном та триптофаном, а також рядом інших; у результаті з довгих поліпептидних ланцюгівутворюється суміш коротших пептидів.
Щойно кисле вміст шлунка потрапляє у тонкий кишечник, у ньому під впливом низького рН починається секреція гормону секретину, що у кров. Цей гормон стимулює виділення з підшлункової залози в тонкий кишечник бікарбонату, що призводить до нейтралізації НС1 шлункового соку. В результаті рН різко зростає від 1,5-2,5 до ≈ 7. У тонкому кишечнику перетравлення білків триває. Надходження амінокислот у дванадцятипалу кишку викликає звільнення гормону холецистокініну, який стимулює секрецію кількох ферментів підшлункової залози з оптимумом рН близько 7. Три з них: трипсин (К. Ф. 3.4.4.4), хімотрпсин (К. Ф.п. 5). (К. Ф. 3.4.2.1) – виробляються екзокринними клітинами підшлункової залози у вигляді ферментативно неактивних зимогенів: трипсиногену, хімотрипсиногену та прокарбоксипептидази, відповідно. Завдяки синтезу протеолітичних ферментів у вигляді неактивних попередників екзокринні клітини не зазнають руйнування цими ферментами. Потрапивши в тонкий кишечник, трипсиноген, під дією ентерокінази, спеціалізованого протеолітичного ферменту, що секретується клітинами кишкового епітелію, перетворюється на активну форму – трипсин. Вільний трипсин у міру свого утворення також бере участь у каталітичному перетворенні трипсиногену на трипсин. Утворення вільного трипсину обумовлено відщепленням гексапептиду від N-кінця полі пептидного ланцюгатрипсиногену.
Активний центр трипсину складається з трьох амінокислотних залишків: серин-195 (прийнято, що нумерація амінокислотних залишків у трипсині відповідає їх положенням у проферменті), гістидин-57 та аспарагінова кислота-102. Сорбційна ділянка містить карбоксильну групу аспарагінової кислоти-189, яка визначає специфічність трипсину до позитивно заряджених субстратів. Механізм каталітичного гідролізу включає стадію сорбції субстрату, розщеплення пептидного зв'язку з утворенням ацилферменту та перенесення ацильної групи на нуклеофільний акцептор. Трипсин гідролізує пептидні зв'язки, утворені за участю карбонільних груп лізину та аргініну.
Молекула хімотрипсиногену є одним поліпептидним ланцюгом з кількома внутрішньоланцюжковими дисульфідними зв'язками. Потрапивши у тонкий кишечник, хімотрипсиноген перетворюється на хімотрипсин під дією трипсину, який розриває довгий поліпептидний ланцюг хімотрипсиногену у двох місцях, вистригаючи дипептиди. Три фрагменти, що утворилися з вихідного ланцюга хімотрипсиногену, утримуються, однак, разом за допомогою перехресних дисульфідних зв'язків. Хімотрипсин гідролізує пептидні зв'язки, утворені залишками фенілаланіну, тирозину та триптофану. Отже, трипсин і хімотрипсин розщеплюють поліпептиди, що утворилися в шлунку під дією пепсину, на менші пептиди. Цей етап перетравлення білків протікає з дуже високою ефективністю, оскільки пепсин, трипсин та хімотрипсин виявляють при гідролізі поліпептидних ланцюгів різну специфічність щодо пептидних зв'язків, утворених різними амінокислотами.
Деградація коротких пептидів у тонкому кишечнику здійснюється іншими пептидазами. До них відноситься в першу чергу карбоксипептидаза – цинквмісний фермент, що синтезується в підшлунковій залозі у вигляді неактивного зимогену прокарбоксипептидази. Активний центр карбоксипептидази має форму кишені, у порожнині якої знаходиться атом Zn. До активного центру входять також залишки глутамінової кислоти, тирозину та аргініну. Функція останнього у механізмі каталізу – зв'язування С-кінцевої карбоксильної групи. Карбоксипептидаза послідовно відщеплює від пептидів С-кінцеві залишки.
Тонкий кишечник секретує також амінопептидазу (К. Ф. 3.4.1.1), що відщеплює від коротких пептидів один за одним N-кінцеві залишки.
В результаті послідовної дії цих протеолітичних ферментів і пептидаз білки, що перетравлюються, в кінцевому підсумку перетворюються на суміш вільних амінокислот, які далі транспортуються через епітеліальні клітини, що вистилають тонкі кишки. Вільні амінокислоти проникають у капіляри ворсинок і переносяться кров'ю до печінки.
У шлунково-кишковому тракті людини не всі білки перетравлюються цілком. Більшість тварин білків майже повністю гідролізуються до амінокислот, проте ряд білків фібрилярних, наприклад кератин, перетравлюється тільки частково. Багато білків рослинної їжі, зокрема білки зерен злаків, неповністю розщеплюються через те, що білкова частина насіння і зерен покрита неперетравлюваною целюлозною оболонкою (лушпинням).
Відомо рідкісне захворювання стеаторрею (завзятий пронос), при якому ферменти кишечника не здатні перетравлювати певні водорозчинні білки зерна, зокрема гліадин, що ушкоджує епітеліальні клітини кишечника. З їжі таких хворих виключають зернові продукти. Іншим захворюванням, пов'язаним з відхиленням від норми активності протеолітичних ферментів травного трактує гострий панкреатит. При цьому захворюванні, обумовленому порушенням процесу виділення соку підшлункової залози в кишечник, попередники протеолітичних ферментів (зимогени) перетворюються на відповідні каталітично активні форми дуже рано, будучи ще всередині клітин підшлункової залози.
В результаті ці потужні ферменти впливають на тканину самої залози, викликаючи глибоке і дуже болісне руйнування органу, що може призвести до смертельного результату. У нормі зимогени, що виділяються підшлунковою залозою, не активуються доти, доки не потраплять у тонкий кишечник. Підшлункова залоза захищається від самоперетравлення та іншим шляхом: у ній синтезується особливий білок – специфічний інгібітор трипсину. Оскільки вільний трипсин активує не тільки трипсиноген та хімотрипсиноген, але також і зимогени двох інших травних ферментів: прокарбоксипептидазу та проеластазу, інгібітор трипсину успішно запобігає передчасному утворенню вільних протеолітичних ферментів у клітинах підшлункової залози.
Засвоєння вуглеводів
У людини з вуглеводів перетравлюються переважно полісахариди: крохмаль і целюлоза, що містяться в рослинній їжі. Крохмаль повністю розщеплюються ферментами шлунково-кишкового тракту до складових їх структурних блоків, а саме вільної D-Глюкози (рис. 1.2). Цей процес починається у роті під час пережовування їжі завдяки дії ферменту амілази, що виділяється слинними залозами. Амілаза слини гідролізує багато з α-(1→4)-глікозидних зв'язків у крохмалі та в глікогені. При цьому утворюється суміш, що складається з мальтози, глюкози та олігосахаридів.
Перетравлення крохмалю та інших засвоюваних полісахаридів з утворенням D-глюкози продовжується і завершується в тонкому кишечнику, головним чином, під дією амілази підшлункової залози, яка синтезується в підшлунковій залозі і надходить через протоку підшлункової залози верхній відділтонкого кишківника. Цей відділ тонкого кишечника з найвищою травною активністю називається дванадцятипалою кишкою.
Целюлоза у більшості ссавців не піддається ферментативному гідролізу і не використовується через відсутність ферментів, здатних розщеплювати β-(1→4) зв'язки між послідовними залишками D-глюкози у целюлозі. Разом з тим неперетравлена целюлоза з рослинної їжі створює ту масу (звану іноді «клітковиною» або «грубим кормом»), яка сприяє нормальній перистальтиці кишечника. У жуйних тварин целюлоза піддається перетравленню, але не прямим шляхом, а під дією бактерій, що знаходяться в їхньому рубці (шлунку). Ці бактерії гідролізують целюлозу до D-Глюкози і далі зброджують D-глюкозу до лактату, ацетату та пропіонату, які всмоктуються та надходять у кров. Далі лактат і пропіонат у печінці жуйних перетворюються на цукор крові.
Гідроліз дисахаридів каталізують ферменти, що знаходяться у зовнішньому краї епітеліальних клітин, що вистилають тонкий кишечник. Сахароза, або очеретяний цукор, гідролізується з утворенням D-глюкози та D-фруктози під дією сахарази, яка називається також інвертазою (К. Ф. 3.2.1.26); лактоза гідролізується до D-глюкози та D-галактози під дією лактази, званої також β-галактозидазою (К. Ф. 3.2.1.23); в результаті гідролізу мальтози під дією мальтази утворюються дві молекули D-Глюкози. Багатьом представникам азіатських та африканських рас у дорослому стані властива непереносимість лактози, обумовлена зникненням у їхньому тонкому кишечнику лактазної активності, що була у грудному та дитячому віці. У людей з непереносимістю лактози цей цукор залишається в кишечнику в нерозщепленому вигляді і його частина піддається збродженню під дією мікроорганізмів. Це викликає діарею та утворення газів у кишечнику.

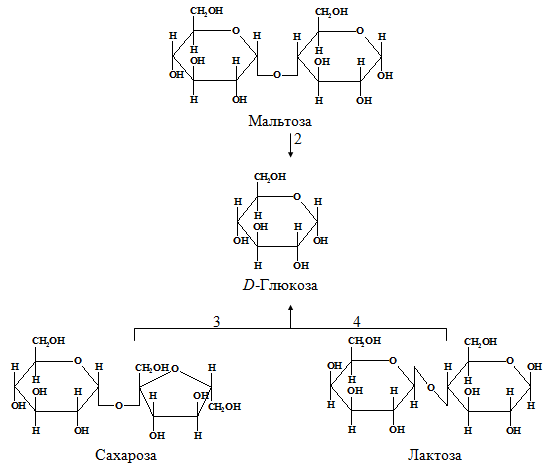
Мал. 1.2. – Перетравлення вуглеводів: 1 та 2 – амілолітичні ферменти; 3 – сахараза (К. Ф. 3.2.1.26); 4 - лактаза (К. Ф. 3.2.1.23)
В епітеліальних клітинах, що вистилають тонкий кишечник, D-фруктоза, D-ралактоза та D-манноза частково перетворюються на D-Глюкозу. Суміш усіх цих простих гексоз поглинається епітеліальними клітинами, що вистилають тонкий кишечник, і доставляється кров'ю до печінки.
Засвоєння жирів
Перетравлення триацилгліцеролів (нейтральних жирів) починається в тонкому кишечнику, куди з підшлункової залози надходить зимоген проліпазу. Тут проліпаза перетворюється на активну ліпазу (К. Ф. 3.1.1.3), яка в присутності жовчних кислот і спеціального білка, званого коліпазою, приєднується до крапель триацилгліцеролів і каталізує гідролітичне відщеплення одного або обох крайніх жирнокислотних залишків з утворенням суміші жирних кислоту вигляді їх Na + - або К + -солей (мил) та 2-моноацилгліцеролів. Невелика кількість триацилгліцеролів залишається при цьому негідролізованим (рис. 1.3).
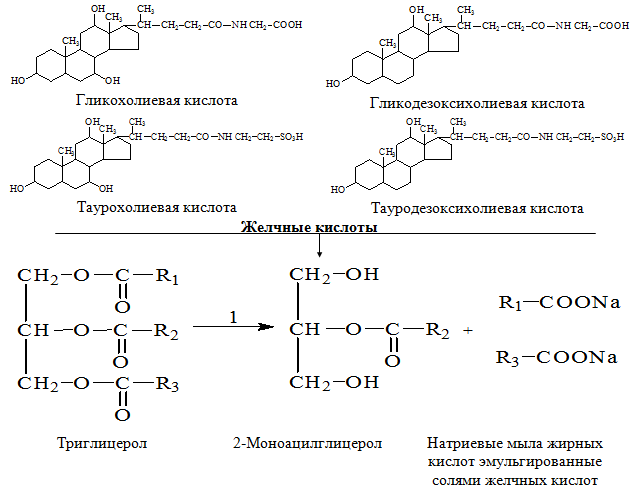
Жирні кислоти
Мал. - 1.3. Перетравлення ліпідів: 1 - ліпаза (К. Ф. 3.1.1.3), жовчні кислоти, Na +
Мила, що утворилися, і нерозщеплені ацилгліцероли емульгуються у вигляді дрібних крапельок під дією перистальтики (перемішують рухи кишечника), а також під впливом солей жовчних кислот і моноацилгліцеролів, які є амфіпатичними сполуками і тому функціонують як детергенти. Жирні кислоти та моноацилгліцероли з цих крапельок поглинаються кишковими клітинами, де з них в основному знову синтезуються триацилгліцероли. Далі триацилгліцероли проникають над капіляри крові, а невеликі лімфатичні судини кишкових ворсинок – лактеалі (інакше – молочні, чи хілезні, судини). Лімфа, що відтікає від тонких кишок, звана хілус (млечний сік), після перетравлення жирної їжінагадує по виду молоко через розмаїтість зважених у ній хіломікронів – найдрібніших крапельок емульгованих триацилгліцеролів діаметром близько 1 мкм. Хіломікрони мають гідрофільну оболонку, що складається з фоліпідів та спеціального білка, який утримує хіломікрони у зваженому стані. Хіломікрони проходять через грудну протоку в підключичну вену. Після споживання жирної їжі навіть плазма крові стає опалесцентною через високу концентрацію в ній хіломікронів, але ця опалесценція зникає через 1-2 години, т.к. триацилгліцероли виводяться з крові, надходячи головним чином жирову тканину.
Емульгування та перетравлення ліпідів у тонкому кишечнику сприяють солі жовчних кислот. Солі жовчних кислот людини – це в основному глікохолат натрію та таурохолат натрію, обидві є похідними холевої кислоти, яка кількісно переважає серед чотирьох основних жовчних кислот, присутніх в організмі людини. Солі жовчних кислот є потужними емульгаторами; вони надходять із печінки в жовч, яка виливається у верхній відділ тонкого кишечника. Після завершення всмоктування жирних кислот і моноацилгліцеролів з емульгованих крапель жиру в нижньому відділі тонкого кишечника відбувається зворотне всмоктування також солей жовчних кислот, що сприяли цьому процесу. Вони повертаються до печінки і використовуються повторно. Таким чином, жовчні кислоти постійно циркулюють між печінкою та тонким кишечником.
Жовчні кислоти грають виключно важливу рольу засвоєнні не тільки триацилгліцеролів, а й взагалі всіх жиророзчинних компонентів їжі. Якщо жовчні кислоти утворюються або секретуються в недостатній кількості, як це має місце при ряді захворювань, то неперетравлені та непоглинені жири з'являються в калі. При цьому погіршується всмоктування жиророзчинних вітамінів A, D, Е та К і може виникнути харчова недостатність вітаміну А.
Розщеплені поживні речовиниті, що потрапили в кров, транспортуються в печінку. У клітинах печінки – гепатоцитах глюкоза, амінокислоти та вільні жирні кислоти включаються до обмінних процесів організму.
Таким чином, процес засвоєння харчових продуктів у ссавців здійснюється у шлунково-кишковому тракті та заснований на ферментативно-кислотному гідролізі:
· полісахаридів (крохмалю та целюлози) до ді- та моносахаридів,
· білків до амінокислот,
· ліпідів до жирних кислот, з наступним всмоктуванням клітинами тонкого кишечника в кров, надходженням з кровотоком до печінки та включенням до обмінні процесиорганізму.
Білки їжі в ротовій порожнині не розщеплюються, тому що слина не містить гідролітичних ферментів.
Хімічне розщеплення білків починається у шлунку під впливом протеолітичних ферментів (пептидгідролаз), які розщеплюють пептидні зв'язки між амінокислотами.
Ці ферменти утворюються клітинами слизової оболонки шлунка, тонкого кишечника та підшлункової залози у неактивній формі. Така форма ферментів запобігає самоперетравленню білків у клітинах, де вони синтезуються, та стінок шлунково-кишкового тракту (спеціально для тих, хто все ще марить думками про те, що під час голодування шлунок перетравлює сам себе).
У шлунку перетравлення білків відбувається за участю ферменту шлункового соку пепсину, що утворюється з неактивного пепсиногену під впливом соляної кислоти. Пепсин виявляє максимальну ферментативну активність у сильно кислому середовищі при рН 1-2. Крім того, під впливом соляної кислоти відбувається набухання та часткова денатурація білків, що призводить до збільшення поверхні зіткнення ферменту з білками. Все це полегшує процес розщеплення білків у шлунку. Пепсин розщеплює пептидні зв'язки білкових молекул, внаслідок чого утворюються високомолекулярні пептиди та простетичні групи.
Білки, що не розщепилися в тонкому відділі кишечника, піддаються розщепленню в товстому кишечнику під впливом пептидаз, які синтезуються мікрофлорою, що знаходиться тут. Ферменти мікрофлори товстого кишечника здатні розщеплювати багато амінокислот їжі з утворенням різних токсичних речовин: фенолу, крезолу, індолу, сірководню, меркаптанів та ін. Таке перетворення амінокислот у товстому кишечнику називається гниттям білків. Токсичні речовини всмоктуються в кров і доставляються в печінку, де зазнають знешкодження. Весь процес перетравлення білків у шлунково-кишковому тракті займає в середньому 8-12 годин після їди.
Висновки
Джерело
З усього вищесказаного, слід очевидний висновок: Вживати вуглеводи разом з білком небажано.
У шлунку є особливий сфінктер, називається воротар шлунка, і в нього дуже цікава функція: відокремлювати пилоричну частину шлунка від ампули дванадцятипалої кишкиі виконувати функцію регулятора надходження кислого шлункового вмісту до дванадцятипалої кишки в міру її готовності до прийому наступних порцій хімусу (харчової кашки).
Так склалося, що кисле середовище шлунка не змінюється, як і лужне середовище кишкового соку. Тому, роблячи вінегрет, ви прирікаєте себе на один із наступних результатів:
1) Коли воротар шлунка не пускає їжу в кишечник до тих пір, поки білок не перевариться, цим ви відтягуєте надходження глюкози в кров, і, що набагато гірше, даєте можливість вуглеводам забродити. Це загрожує розщепленням вуглеводів на двоокис вуглецю, оцтову кислоту, спирт - речовини, які не придатні до засвоєння.
2) Коли більшу частину з'їденої їжі складають вуглеводи, і ретельно перемішавши їх з білком, протягуєте всю цю справу в кишечник раніше часу, що обернеться надалі гниттям білка в товстому кишечнику. Шлунок не знає механізму, щоб розділяти ці ретельно перемішані речовини та розмістити по різним частинамсвоєї порожнини.
Те, що білкове гниття постійно спостерігається в товстому кишечнику "цивілізованої" людини, ще не означає, що таке явище можна вважати нормальним. А гниття - це смердючі випорожнення, утруднений стілець, здутий живітта гази.
Підсумовуючи, робити слід так:
· Насамперед, з'їдати всі вуглеводи, дуже ретельно пережовуючи, т.к. перетравлення почнеться ще в ротовій порожнині. Через кисле середовище в шлунку, вуглеводи надовго там не затримаються, до того часу, коли ви приступите до білкової частини, основна частина вуглеводів вже провалиться в кишечник (для більшої надійності, краще зробити паузу 15-20 хвилин).
· Жири, що стосується горіхів, здобних виробів і т.п., краще вживати з вуглеводами, тому що потрібне лужне середовище і тому що ліпіди уповільнюють шлункову секрецію, тим самим гальмують травлення. У випадку, коли жир не можна відокремити від білка, наприклад олію, що використовується при приготуванні, купувати цю недугу можна сирими зеленими овочами.
· Білки, відповідно, йдуть останнім номером.
Розділивши і вживши їжу в такій послідовності, ви вбиваєте трьох зайців відразу:
1. займаєте кишечник органічними речовинами, що виконують енергетичну функцію;
2. займаєте шлунок головними носіями життя;
3. і що важливо, у такий спосіб можна тупо більше з'їсти (актуально на періодичному голодуванні).
Вірити на слово підручнику фізіології, підручнику біохімії і особливо мені особисто нікого не закликаю, просто спробуйте і складіть власну думку.
у шлунково-кишковому тракті під дією ферментів протеаз (пептидщцролаз). Субстратна специфічність цих ферментів полягає в тому, що кожен із них з найбільшою швидкістюрозщеплює пептидні зв'язки, утворені певними амінокислотами. Протеази, що гідролізують пептидні зв'язки всередині білкової молекули, відносять до групи ендопептидаз. Ферменти, що належать до групи екзопептидаз, гідролізують пептидний зв'язок, утворений кінцевими амінокислотами. Під дією всіх протеаз ШКТ білки їжі розпадаються на окремі амінокислоти, які потім надходять у клітини тканин.
А. Перетравлення білків у шлунку
Шлунковий сік – продукт кількох типів клітин. Обкладальні (парієтальні) клітини стінок шлунка утворюють соляну кислоту, головні клітини секретують пепсиноген. Додаткові та інші клітини епітелію шлунка виділяють слиз, що містить муцин. Парієтальні клітини секретують у порожнину шлунка також глікопротеїн, який називають " внутрішнім фактором(фактором Касла). Цей білок пов'язує зовнішній фактор" - вітамін В 12 , запобігає його руйнації і сприяє всмоктування.
1. Утворення та роль соляної кислоти
Основна функція травної шлунка полягає в тому, що в ньому починається перетравлення білка. Істотну роль цьому процесі грає соляна кислота. Білки, що надходять у шлунок, стимулюють виділення гістамінута групи білкових гормонів - гастринів(див. розділ 11), які, у свою чергу, викликають секрецію НСІ та проферменту – пепсиногену. НСI утворюється в клітинах обкладин шлункових залоз під час реакцій, представлених на рис. 9-2.
Джерелом Н + є Н 2 3 , яка утворюється в обкладальних клітинах шлунка з 2 , що дифундує з крові, і Н 2 Про під дією ферменту карбоангідрази (карбонатдегідра-тази):
Н 2 Про + СО 2 → Н 2 СО 3 → НСО 3 - + H +
Дисоціація Н 2 3 призводить до утворення бікарбонату, який за участю спеціальних білків виділяється в плазму в обмін на С1 - , і іонів Н + , які надходять у просвіт шлунка шляхом активного транспорту, що каталізується мембранною Н + / К + -АТФ-азою. При цьому концентрація протонів у просвіті шлунка збільшується у 10 6 разів. Іони С1 - надходять у просвіт шлунка через хлоридний канал.
Концентрація НСl у шлунковому соку може досягати 0,16 М, рахунок чого значення рН знижується до 1,0-2,0. Прийом білкової їжі часто супроводжується виділенням лужної сечі за рахунок секреції великої кількостібікарбонату у процесі утворення НСl.
Мал. 9-2. Секреція соляної кислоти у шлунку. 1 - карбоангідраза; 2 - Н+/К+-АТФ-аза; 3 - білки-переносники аніонів; 4 – хлоридний канал.
Під дією НСl відбувається денатурація білків їжі, що не зазнали термічної обробки, що збільшує доступність пептидних зв'язків протеаз. НСl має бактерицидну дію і перешкоджає попаданню патогенних бактерій у кишечник. Крім того, соляна кислота активує пепсиноген та створює оптимум рН для дії пепсину.
2. Механізм активації пепсину
Під дією гастринів у головних клітинах шлункових залоз стимулюються синтез та секреція пепсиногену – неактивної форми пепсину. Пепсиноген – білок, що складається з одного поліпептидного ланцюга з молекулярною масою 40 кД. Під дією НСl він перетворюється на активний пепсин (молекулярна маса 32,7 кД) з оптимумом рН 1,0-2,5. У процесі активації в результаті часткового протеолізу від N-кінця молекули пепсиногену відщеплюються 42 амінокислотні залишки, які містять майже всі позитивно заряджені амінокислоти, наявні в пепсиногені. Таким чином, в активному пепсині переважають негативно заряджені амінокислоти, які беруть участь у конформаційних перебудовах молекули і формуванні активного центру. Активні молекули пепсину, що утворилися під дією НСl, швидко активують інші молекули пепсиногену (аутокаталіз). Пепсин в першу чергу гідролізує пептидні зв'язки в білках, утворені ароматичними амінокислотами (фенілаланін, триптофан, тирозин) та дещо повільніше – утворені лейцином та дикарбоновими амінокислотами. Пепсин – ендопептидаза, тому в результаті його дії у шлунку утворюються короткі пептиди, але не вільні амінокислоти.
3. Вікові особливості перетравлення білків у шлунку
У дітей грудного вікуу шлунку знаходиться фермент реннін(хімозин), що викликає згортання молока. Основний білок молока - казеїн, що представляє суміш декількох білків, що різняться амінокислотного складута електрофоретичної рухливості. Реннін каталізує відщеплення від казеїну глікопептиду, внаслідок чого утворюється параказеїн. Параказеїн приєднує іони Са 2+ , утворюючи нерозчинний потік, чим запобігає швидкий вихідмолока зі шлунка. Білки встигають розщепитися під дією пепсину. У шлунку дорослих людей ренніну немає, молоко вони створюються під дією НСl і пепсину.
У слизовій оболонці шлунка людини знайдено ще одну протеазу. гастриксин.Усі 3 ферменти (пепсин, ренін і гастриксин) подібні по первинної структурищо вказує на їх походження від загального гена-попередника.
4. Порушення перетравлення білків у шлунку
При різних захворюваннях ШКТ у шлунку порушується виділення НСl та пепсиногену, при цьому перетравлення білків помітно знижується. Найчастіше зустрічаються патологічні зміни кислотності шлункового соку. Порушення утворення пепсину відзначають рідше і виявляють при значніших ураженнях шлунка.
Визначення кислотності шлункового соку використовують для діагностики різних захворюваньшлунка (табл. 9-2). Підвищена кислотністьшлункового соку зазвичай супроводжується печією, діареєю і може бути симптомом виразки шлунка та дванадцятипалої кишки, а також гіперацидного гастриту. Знижена кислотністьбуває за деяких видів гастритів. Повна відсутність НСl та пепсину (шлункова ахілія) спостерігається при атрофічних гастритахі часто супроводжується перніціозною анемією внаслідок недостатності вироблення фактора Касла та порушення всмоктування вітаміну В 12 (див. розділ 3). Анацидність(рН шлункового соку >6,0) свідчить про значну втрату слизової оболонкою шлунка обкладувальних клітин, що секретують соляну кислоту, що часто спричиняє рак шлунка.
Кислотність шлункового соку виявляється у титраційних одиницях (ТІ) - кількість 0,1 М NaOH в 1 мл, витрачене на титрування 100 мл шлункового соку за певним індикатором. При визначенні кислотності шлункового соку розрізняють: загальну кислотність, пов'язану НСl та вільну НСl.
- Загальна кислотність шлункового соку.сукупність всіх кислотореагуючих речовин шлункового соку, є секретом шлунка, що збирається протягом 1 год.
Таблиця 9-2. Компоненти шлункового соку в нормі та при патологічних станах
| Стан | рН | Кислотність (ТІ) | Пепсин | Фактор Касла | Молочна кислота | Кров | ||
| загальна | пов'язана НСl | вільна НСl | ||||||
| Норма | 1,5-2,0 | 40-60 | 20-30 | 20-40 | + | + | - | - |
| Гіперацидний гастрит | 1,0 | 80 | 40 | + | ± | - | - | |
| Гіпоацидний гастрит | 2,5 | 40 | 20 | ± | ± | ± | - | |
| Ахілія | 7,0 | 20 | - | - | - | + | - | |
| Виразка шлунка | 1,5 | 60 | 40 | + | + | - | + | |
| Рак шлунка | 6,0 та> |
40-60 | 20 | + | + | + | + | |
Значення загальної кислотності в нормі становлять 40-60 ТЕ.
- Пов'язана соляна кислота- НСl, пов'язана з білками та продуктами їх перетравлення. Значення пов'язаної НСl у здорових людей- 20-30 ТІ.
- Вільна НСl- Соляна кислота, не пов'язана з компонентами шлункового соку. Значення вільної НСl у нормі - 20-40 ТЕ. рН шлункового соку в нормі - 1,5-2,0.
Молочна кислота в нормі у шлунковому соку відсутня. Вона утворюється при зменшенні вмісту або відсутності вільної соляної кислоти внаслідок розмноження молочнокислих бактерій або злоякісних пухлин шлунка, в клітинах яких глюкоза окислюється анаеробним шляхом.
При діагностиці захворювань шлунка, крім біохімічних аналізів, обов'язково проводять рентгенологічні та ендоскопічні дослідження, а також біопсію.
Б. Перетравлення білків у кишечнику
Шлунковий вміст (хімус) у процесі перетравлення надходить у дванадцятипалу кишку. Низьке значення рН хімусу викликає у кишечнику виділення білкового гормону секретину, що надходить у кров. Цей гормон стимулює виділення з підшлункової залози в тонкий кишечник панкреатичного соку, що містить НСО 3 - , що призводить до нейтралізації НСl шлункового соку та інгібування пепсину. В результаті рН різко зростає від 1,5-2,0 до 7,0.
Надходження пептидів у тонкий кишечник викликає секрецію іншого білкового гормону – холецистокініну (див. розділ 11), який стимулює виділення панкреатичних ферментів з оптимумом рН 7,5-8,0. Під дією ферментів підшлункової залози та клітин кишечника завершується перетравлення білків.
1. Активація панкреатичних ферментів
У підшлунковій залозі синтезуються проферменти ряду протеаз: трипсиноген, хімотрипсиноген, проеластаза, прокарбоксипептидази А та В. У кишечнику вони шляхом часткового протеолізу перетворюються на активні ферменти трипсин, хімотрипсин, еластазу та карбок-сипептида А.
Активація трипсиногенувідбувається під дією ферменту епітелію кишківника ентеропептидази.
Цей фермент відщеплює з N-кінця молекули трипсиногену гексапептид Вал-(Асп)4-Ліз. Зміна конформації частини поліпептидного ланцюга, що залишилася, призводить до формування активного центру, і утворюється активний трипсин. Послідовність Вал-(Асп) 4 -Ліз властива більшості відомих трипсиногенів різних організмів- Від риб до людини.
Трипсин, що утворився активує хімотрипсиноген,з якого виходить кілька активних ферментів (рис. 9-3). Хімотрипсиноген складається з одного поліпептидного ланцюга, що містить 245 амінокислотних залишків та п'яти дисульфідних містків. Під дією трипсину розщеплюється пептидний зв'язок між 15-ю та 16-ю амінокислотами, внаслідок чого утворюється активний π-хімотрипсин. Потім під дією π-хімотрипсину відщеплюється дипептид сер(14)-арг(15), що призводить до утворення δ-хімотрипсину. Відщеплення дипептиду тре(147)-арг(148) завершує утворення стабільної форми активного ферменту - α-хімотрипсину, який складається з трьох поліпептидних ланцюгів, з'єднаних дисульфідними містками.
Інші проферменти панкреатичних протеаз (проеластазу та прокарбоксипептидази А та В) також активуються трипсином шляхом часткового протеолізу. В результаті утворюються активні ферменти - еластаза та карбокси-пептидази А та В.
2. Специфіка дії протеаз
Трипсин переважно гідролізує пептидні зв'язки, утворені карбоксильними групами аргініну та лізину. Хімотрипсини найбільш активні щодо пептидних зв'язків, утворених карбоксильними групами ароматичних амінокислот (Фен, Тир, Три).
Карбоксипептидази А і В - цинкові ферменти, що відщеплюють С-кінцеві залишки амінокислот. Причому карбоксипептидазу А
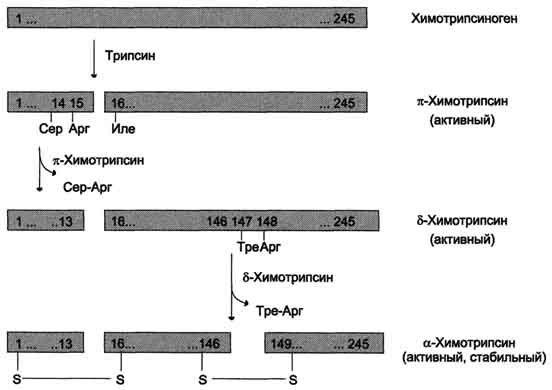
Мал. 9-3. Активація хімотрипсіногену.Молекула хімотрипсиногену складається з 245 амінокислотних залишків і має п'ять дисульфідних містків. На схемі показані ділянки ферменту, що піддаються протеолізу. а-хімотрипсин - активна стабільна форма ферменту - складається з трьох поліпептидних ланцюгів, ковалентно пов'язаних між собою двома дисульфідними містками і нековалентно - за рахунок водневих зв'язківта гідрофобних взаємодій.
відщеплює переважно амінокислоти, що містять ароматичні або гідрофобні радикали, а карбоксипептидаза В - залишки аргініну та лізину.
Останній етап перетравлення – гідроліз невеликих пептидів, що відбувається під дією ферментів амінопептидаз та дипептидаз, які синтезуються клітинами тонкого кишечника в активній формі.
- Амінопептидазипослідовно відщеплюють N-кінцеві амінокислоти пептидного ланцюга. Найбільш відома лейцинамінопептидаза - Zn 2+ - або Мn 2+ -що містить фермент, незважаючи на назву, що володіє широкою специфічністю по відношенню до N-кінцевих амінокислот.
- Дипептидазирозщеплюють дипептиди на амінокислоти, але не діють трипептиди.
В результаті послідовної дії всіх травних протеаз більшість харчових білків розщеплюється до вільних амінокислот.
В. Захист клітин від дії протеаз
Клітини підшлункової залози захищені від дії травних ферментів тим, що:
- ці ферменти утворюються у вигляді неактивних попередниківу клітинах підшлункової залози та активуються лише після секреції у просвіт кишечника. Таким чином, місце синтезу та місце дії цих ферментів просторово розділені.
- у клітинах підшлункової залози присутній білок-інгібітор трипсину,утворює з активною формоюферменту (у разі передчасної активації); міцний комплекс.
У порожнині шлунка та кишечника протеази не контактують з білками клітин, оскільки слизова оболонка покрита шаром слизу, а кожна клітина містить зовнішньої поверхніплазматичної мембрани полісахариди, які не розщеплюються протеазами і тим самим захищають клітину від їхньої дії.
Руйнування клітинних білків протеазами відбувається при виразкової хворобишлунка або дванадцятипалої кишки. Однак початкові механізми виникнення виразки ще мало вивчені.
Г. Транспорт амінокислот у клітини
Амінокислоти, що утворилися під час перетравлення білків, швидко всмоктуються в кишечнику. Транспорт їх здійснюється двома шляхами: через комірну систему печінки, що веде прямо в печінку, і по лімфатичних судинах, що сполучаються з кров'ю через грудну лімфатичну протоку. Максимальна концентрація амінокислот у крові досягається через 30-50 хв після прийому білкової їжі (вуглеводи та жири уповільнюють всмоктування амінокислот). Всмоктування L-амінокислот (але не D-ізомерів) – активний процес, що потребує витрати енергії. Амінокислоти переносяться через кишкову стінку від її слизової поверхні в кров (рис. 9-4). Перенесення через щіткову облямівку здійснюється цілим рядом переносників, багато з яких діють за участю Nа + -залежних механізмів симпорту, подібно до перенесення глюкози (див. розділ 7).
Різна швидкість проникнення амінокислот через мембрани клітин свідчить про наявність транспортних систем, Забезпечують перенесення амінокислот як через зовнішню плазматичну мембрану, так і через внутрішньоклітинні мембрани В даний час відомо принаймні п'ять специфічних транспортних систем, кожна з яких функціонує
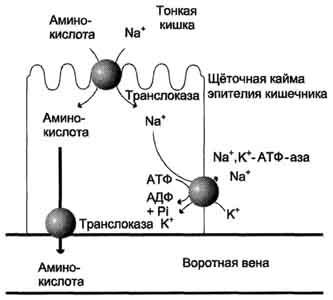
Мал. 9-4. Механізм всмоктування амінокислот у кишечнику. L-амінокислота надходить в ентероцит шляхом симпорт з іоном Na + . Далі специфічна транслоказа переносить амінокислоту через мембрану в кров. Обмін іонів натрію між клітинами здійснюється шляхом первинно-активного транспорту за допомогою Nа + К + -АТФ-ази.
для перенесення певної групи близьких за будовою амінокислот:
- нейтральних, з коротким бічним ланцюгом (аланін, серії, треонін);
- нейтральних, з довгим або розгалуженим бічним ланцюгом (валін, лейцин, ізолейцин);
- з катіонними радикалами (лізин, аргінін);
- з аніонними радикалами (глутамінова та аспарагінова кислоти);
- імінокислот (пролін, оксипролін).
Причому до Nа + -залежних відносяться переносники амінокислот, що входять до першої та п'ятої групи, а також переносник метіоніну. Незалежні від Na+ переносники специфічні для деяких нейтральних амінокислот (фенілаланін, лейцин) та амінокислот з катіонними радикалами (лізин).
Амінокислоти конкурують одна з одною за специфічні ділянки зв'язування. Наприклад, всмоктування лейцину (якщо концентрація його досить висока) зменшує всмоктування ізолейцину та валіну.
Одна із специфічних транспортних систем для деяких нейтральних амінокислот функціонує в кишечнику, нирках та, мабуть, мозку. Вона отримала назву γ-глутамільного циклу (рис. 9-5).
У цій системі беруть участь 6 ферментів, один з яких знаходиться в клітинної мембрани, а решта - у цитозолі. Ключову рольу транспорті амінокислоти грає мембранно-пов'язаний фермент γ -глутамілтрансфераза.Цей фермент є глікопротеїном і каталізує перенесення γ-глутамільної групи від глутатіону (іноді іншого γ-глутамільного пептиду) на амінокислоту, що транспортується, і подальше перенесення комплексу в клітину. Глутатіон є трипептид - γ-глутамілцистеінілгліцин, який знаходиться у всіх тканинах тварин. Реакція протікає так (див. схему А на с. 468).
Амінокислота, пов'язана з γ-глутамільним залишком, виявляється усередині клітини. У наступній реакції відбувається відщеплення γ-глутамільного.
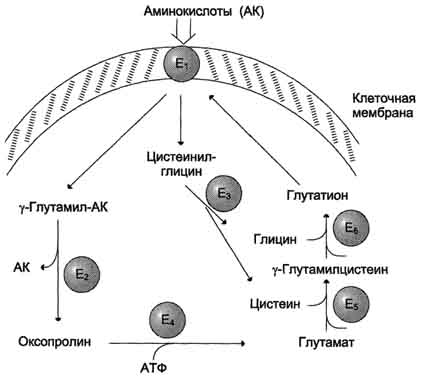
Мал. 9-5.γ -Глутамільний цикл.Система складається з одного мембранного та п'яти цитоплазматичних ферментів. Перенесення амінокислоти всередину клітини здійснюється в комплексі з глутамільним залишком глутатіону під дією γ-глутамілтрансферази. Потім амінокислота звільняється, а γ-глутамільний залишок кілька стадій перетворюється на глутатіон, який здатний приєднувати наступну молекулу амінокислоти. Е 1 - γ-глутамілтрансферазу; Е 2 - у-глутамілциклотрансферазу; Е 3 - пептидазу; Е 4 - оксопроліназ; Е 5 - γ-глутамілцистеїнсинтетаза; Е 6 – глутатіонсинтетаза.
залишку під дією ферменту γ-глутамілциклотрансферази (див. схему Б).
Дипептид цистеїнілгліцин розщеплюється під дією пептидази на 2 амінокислоти – цис-теїн та гліцин. Внаслідок цих 3 реакцій відбувається перенесення однієї молекули амінокислоти в клітину (або внутрішньоклітинну структуру). Наступні 3 реакції забезпечують регенерацію глутатіону, завдяки чому цикл повторюється багаторазово. Для транспортування в клітину однієї молекули амінокислоти за участю γ-глутамільного циклу витрачаються 3 молекули АТФ.
Д. Порушення перетравлення білків та транспорту амінокислот
Невелику частку продуктів перетравлення білка становлять короткі негідролізовані пептиди. У деяких людей виникає імунна реакція на прийом білка, що, очевидно, пов'язане із здатністю до всмоктування
таких пептидів. Продукти повністю перетравленого білка (амінокислоти) позбавлені антигенних властивостей та імунних реакцій не викликають.
У новонароджених проникність слизової оболонки кишечника вища, ніж у дорослих, тому в кров можуть надходити антитіла молозива (секрет молочних залоз, що виділяється в перші дні після пологів, збагачений антитілами та антитоксинами). Це посилюється наявністю у молозиві білка – інгібітора трипсину. Протеолітичні ферменти в травних секретах новонароджених мають низьку активність. Все це сприяє всмоктуванню в кишечнику невеликої кількостінативних білків, достатнього для забезпечення імунної реакції. Очевидно, подібне посилення всмоктувальної здатності кишечника є причиною непереносимості білків їжі (наприклад, молока і яєць), що спостерігається іноді у дорослих людей.
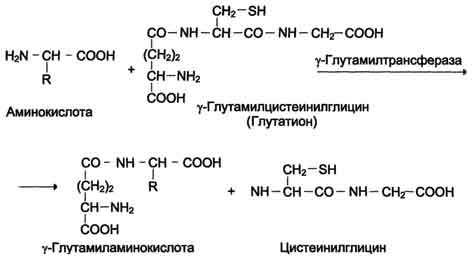
Схема А
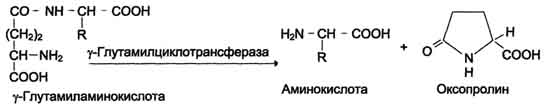
Схема Б
Дедалі більше підтверджень отримує гіпотеза, за якою при захворюванні целіакії (нетропічній спру)відбувається порушення клітин слизової оболонки кишківника, де всмоктуються невеликі негідролізовані пептиди. Целіакія характеризується підвищеною чутливістю до глютену - білка клейковини зерен злаків, що вживаються з їжею людиною. Цей білок чинить токсичну дію на слизову оболонку тонкої кишки, що призводить до її патологічним змінамта порушення всмоктування. Патогенез захворювання недостатньо зрозумілий.
Такі захворювання, як цистинурія,хвороба Хартнапата деякі інші, виникають внаслідок дефекту переносників нейтральних амінокислот у кишечнику та нирках. Описано вроджену патологію, пов'язану з дефектом ферменту 5-оксопролінази (рис. 9-5, реакція 4). При цьому із сечею виділяється оксопролін. У цих хворих порушено транспорт амінокислот у тканині та їх метаболізм у клітинах.