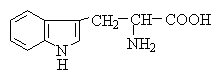
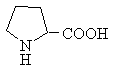
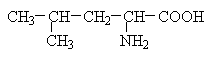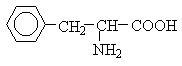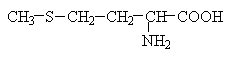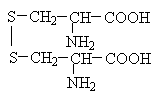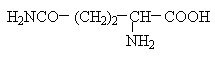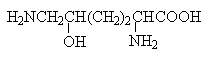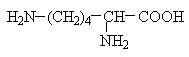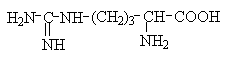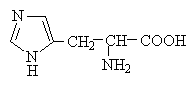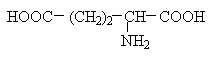Амінокислоти з полярними позитивно зарядженими радикалами
Розділ III. БІЛКИ
§ 6. АМІНОКИСЛОТИ ЯК СТРУКТУРНІ ЕЛЕМЕНТИ БІЛКІВ
Природні амінокислоти
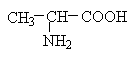
Амінокислоти у живих організмах зустрічаються переважно у складі білків. Білки побудовані переважно двадцятьма стандартними амінокислотами. Вони є a-амінокислотами і відрізняються один від одного будовою бічних груп (радикалів), що позначаються буквою R:
Різноманітність бічних радикалів амінокислот грає ключову рольформування просторової структури білків, при функціонуванні активного центру ферментів.
Структура стандартних амінокислот наведена наприкінці параграфа табл.3. Природні амінокислоти мають очевидні назви, оперувати якими при записах структури білків незручно. Тому для них введені трилітерні та однолітерні позначення, які також представлені в табл.3.
Просторова ізомерія
У всіх амінокислот, крім гліцину, a-вуглецевий атом є хіральним, тобто. їм характерна оптична ізомерія. У табл. 3 хіральний атом вуглецю позначений зірочкою. Наприклад, для аланіну проекції Фішера обох ізомерів виглядають так:
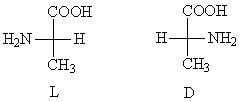
Для їх позначення, як і вуглеводів, використовується D, L-номенклатура. До складу білків входять лише L-амінокислоти.
L-і D-ізомери можуть взаємно перетворюватися один на одного. Цей процес називається рацемізацією.
Цікаво знати! У білку зубів – дентині –L-аспарагіновакислота мимоволі рацемізується при температурі людського тілазі швидкість 0,10% на рік. У період формування зубів у дентині міститься лишеL-аспарагінова кислота, у дорослої людини в результаті рацемізації утворюєтьсяD-Апарагінова кислота. Чим старша людинатим вище вміст D-ізомеру. Визначивши співвідношення D-і L-ізомерів можна досить точно встановити вік. Так було викрито мешканців гірських селищ Еквадору, які приписували собі занадто великий вік.
Хімічні властивості
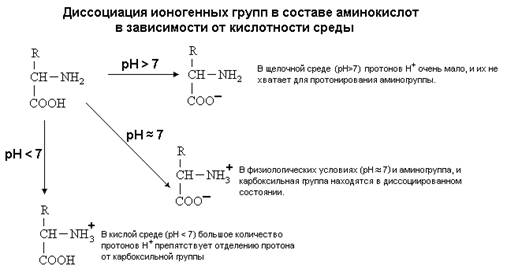
Амінокислоти містять аміно-і карбоксильну групи. Через це вони виявляють амфотерні властивості, тобто властивості і кислот та основ.
При розчиненні амінокислоти у воді, наприклад, гліцину, його карбоксильна група дисоціює з утворенням водню іону. Далі іон водню приєднується за рахунок неподіленої пари електронів у атома азоту до аміногрупи. Утворюється іон, в якому одночасно присутні позитивний та негативний заряди, так званий цвіттер-іон:
Така форма амінокислоти є переважною в нейтральному розчині. У кислому середовищі амінокислота, приєднуючи іон водню, утворює катіон:
У лужному середовищі утворюється аніон:
Таким чином, залежно від рН середовища амінокислота може бути позитивно зарядженим, негативно зарядженим та електронейтральним (при рівності позитивних і негативних зарядів). Значення рН розчину, у якому сумарний заряд амінокислоти дорівнює нулю, називається ізоелектричною точкоюданої амінокислоти. Для багатьох амінокислот ізоелектрична точка лежить поблизу рН 6. Наприклад, ізоелектричні точки гліцину та аланіну мають значення 5,97 та 6,02 відповідно.
Дві амінокислоти можуть реагувати один з одним, внаслідок чого відщеплюється молекула води та утворюється продукт, який називається дипептидом:
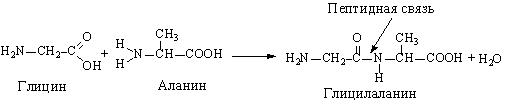
Зв'язок, що з'єднує дві амінокислоти, має назву пептидного зв'язку. Якщо скористатися літерними позначеннями амінокислот, утворення дипептиду можна схематично представити так:
Аналогічно утворюються трипептиди, тетрапептидиі т.д.:
H 2 N – ліз – ала – глі – СООН – трипептид
H 2 N – трп – гіс – ала – ала – СООН – тетрапептид
H 2 N – тир – ліз – глі – ала – лей – глі – трп – СООН – гептапептид
Пептиди, що складаються з невеликої кількостіамінокислотних залишків, мають загальну назву олігопептиди.
Цікаво знати! Багато олігопептидів мають високу біологічну активність. До них відноситься ряд гормонів, наприклад, окситоцин (нанопептид) стимулює скорочення матки, брадикінін (нанопептид) пригнічує. запальні процесиу тканинах. Антибіотик граміцидин С (циклічний декапептид) порушує регуляцію іонної проникності в мембранах бактерій і цим вбиває їх. Грибні отрути амманітину (октапептиди), блокуючи синтез білка, здатні викликати сильне отруєння у людини. Широко відомий аспартам - метиловий ефір аспартілфенілаланіну. Аспартам має солодкий смак та використовується для надання солодкого смаку різним продуктам, напоям.
Класифікація амінокислот
Існує кілька підходів до класифікації амінокислот, але найкращою є класифікація, заснована на будові їх радикалів. Виділяють чотири класи амінокислот, що містять радикали. наступних типів; 1) неполярні (або гідрофобні); 2) полярні незаряджені; 3) негативно заряджені та 4) позитивно заряджені:
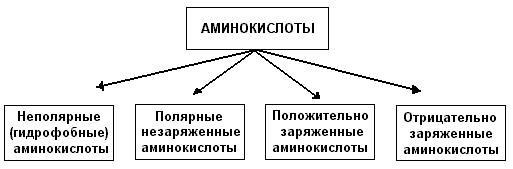
До неполярних (гідрофобних) відносяться амінокислоти з неполярними аліфатичними (аланін, валін, лейцин, ізолейцин) або ароматичними (фенілаланін і триптофан) R-групами і одна сірковмісна амінокислота - метіонін.
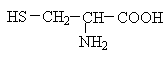
Полярні незаряджені амінокислоти порівняно з неполярними краще розчиняються у воді, більш гідрофільні, тому що їх функціональні групи утворюють водневі зв'язки з молекулами води. До них відносяться амінокислоти, що містять полярну НО-групу (серин, треонін і тирозин), HS-групу (цистеїн), амідну групу (глутамін, аспарагін) і гліцин (R-група гліцину, представлена одним атомом водню, занадто мала, щоб компенсувати сильну полярність a-аміногрупи та a-карбоксильної групи).
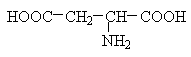
Аспарагінова та глутамінова кислоти відносяться до негативно заряджених амінокислот. Вони містять по дві карбоксильні та по одній аміногрупі, тому в іонізованому стані їх молекули матимуть сумарний негативний заряд:
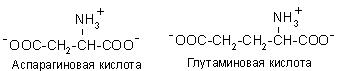
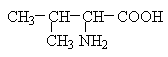
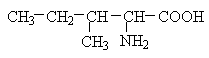
До позитивно заряджених амінокислот належать лізин, гістидин та аргінін, в іонізованому вигляді вони мають сумарний позитивний заряд:
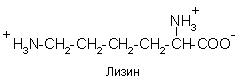
Залежно від характеру радикалів природні амінокислоти також поділяються на нейтральні, кисліі основні. До нейтральних відносяться неполярні та полярні незаряджені, до кислих – негативно заряджені, до основних – позитивно заряджені.
Десять з 20 амінокислот, що входять до складу білків, можуть синтезуватися в людському організмі. Інші повинні бути у нашій їжі. До них відносяться аргінін, валін, ізолейцин, лейцин, лізин, метіонін, треонін, триптофан, фенілаланін та гістидин. Ці амінокислоти називаються незамінними. Незамінні амінокислотичасто входять до складу харчових добавок, використовуються як лікарські препарати.
Цікаво знати! Винятково важливу рольграє збалансованість харчування людини за амінокислотами. При нестачі незамінних амінокислот у їжі організм саморуйнується. При цьому страждає насамперед головний мозок, що призводить до різним захворюваннямцентральної нервової системи, психічним розладам. Особливо вразливий молодий організм, що росте. Так, наприклад, при порушенні синтезу тирозину з фенілаланіну у дітей розвивається тяжке захворюванняфінілпіровиноградна олігофренія, що викликає важку розумову відсталістьчи загибель дитини.
Таблиця 3
Стандартні амінокислоти
|
Амінокислота (тривіальна назва) |
Умовні позначення |
Структурна формула |
||
|
Латинське |
||||
|
трилітерне |
однобук-венне |
|||
|
НЕПОЛЯРНІ (ГІДРОФОБНІ) |
||||
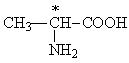 |
||||
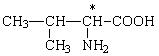 |
||||
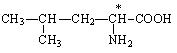 |
||||
|
Ізолейцин |
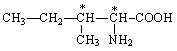 |
|||
 |
||||
|
Фенілаланін |
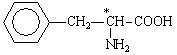 |
|||
|
Триптофан |
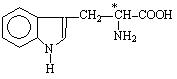 |
|||
|
Метіонін |
||||
|
ПОЛЯРНІ НЕЗАРЯЖЕНІ |
||||
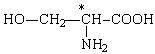 |
||||
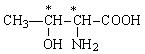 |
||||
|
Аспарагін |
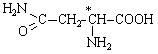 |
|||
|
Глутамін | ||||
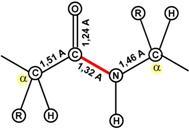
СТРУКТУРА АМІНОКИСЛОТ. ПЕПТИДНИЙ ЗВ'ЯЗОК
Білки – високомолекулярні сполуки, утворені з а-амінокислот, пов'язаних між собою пептидними зв'язками.
У природі відомо понад 300 різних амінокислот, але лише 20 з них входять до складу білків людини, тварин та інших вищих організмів. Кожна амінокислота має карбоксильну групу, аміногрупув а-положенні (у 2-го атома вуглецю) та радикал(бічний ланцюг), що відрізняється у різних амінокислот.
При фізіологічному значенні рН (7,4) карбоксильна група амінокислот зазвичай дисоціює, а аміногрупа протонується.
Усі амінокислоти (за винятком гліцину) містять асиметричний атом вуглецю, тому можуть існувати у вигляді L- та D-стереоізомерів:
Для синтезу білків людини використовуються лише L-амінокислоти. У білках з тривалим терміноміснування L-ізомери повільно можуть набувати D-конфігурацію, причому це відбувається з певною, характерною для кожної амінокислоти швидкістю. Так, білки дентину зубів містять L-аспартат, який перетворюється на D-форму при температурі тіла людини зі швидкістю 0,01% на рік. Оскільки дентин емалі практично не обмінюється і не синтезується у дорослих без травми, за змістом D-аспартату можна встановити вік людини, що використовується в клінічній та криміналістичній практиці.
Радикали(бічні ланцюги) амінокислот є варіабельною частиною пептиду і можуть містити різні функціональні групи:
полярні (гідрофільні):
Гідроксильна -ВІН;
Карбоксильну-СООН;
Аміногрупу -NH 2;
Іміногрупу = NH;
Амідну-CO-NH 2;
Тіольну-SH;
неполярні (гідрофобні):
Метильну-СН 3;
Фенільна
Хімічні групи радикалів мають різні властивості, які зумовлюють властивості пептидів, що містять їх (табл. 1.1). Так, наявність неполярних груп -СН 3
ливает гідрофобність, а велика кількість полярних груп -ОН, -SH, -СООН, -NH 2 робить пептиди гідрофільними. Усі амінокислоти, що входять до білків, залежно від структури та полярності радикалів можна розділити на 4 групи (див. табл. 1.1).
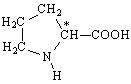
До складу білків людини входить 19 амінокислот та 1 циклічна імінокислота - пролін, що має іміногрупу -NH-. Роль гідрофобного радикала в цій молекулі грає насичений аліфатичний тривуглецевий ланцюг, що утворює 5-членний цикл між α-вуглецевим атомом та іміногрупою:
Класифікація амінокислот за полярністю радикалів
Додаткову позитивно заряджену групу в радикалі мають лізин та аргінін. У лізину друга аміногрупа, здатна приєднувати Н + , розташовується в е-положенні аліфатичного ланцюга, а у аргініну позитивний заряд набуває, хуанідінова група, Крім того, гістидин містить слабо іонізовану імідазольну групу, тому при фізіологічних коливаннях значень 7,4) гістидин заряджений або нейтрально, або позитивно. При збільшенні кількості протонів серед імідазольна група гістидину здатна приєднувати протон, набуваючи позитивний заряд, а при збільшенні концентрації гідроксильних груп - віддавати протон, втрачаючи позитивний заряд радикала. Позитивно заряджені радикали – катіони.
Найбільшу розчинність у воді мають полярні заряджені радикали амінокислот.
За здатністю синтезуватися в організмі амінокислоти можуть бути:
- Замінні(Можуть синтезуватися в організмі): ала, асп, глу, глі, асн, глн, про, сір;
- частково замінні: арг, гіс;
- умовно замінні: тир, цис;
- незамінні: фен, мет, три, три, вал, ліз, лей, мулі.
рівні структурної організаціїбілкових молекул:
1.) Первинна структура;
2.) Вторинна структура;
3.) Третинна структура;
4.) Четвертична структура.
Первинна структура білків- це послідовність амінокислот в поліпептидного ланцюга, з'єднаних пептидними зв'язками Послідовність амінокислот у поліпептидному ланцюзі визначає наступні рівні структурної організації білка, його найважливіші фізико-хімічні, біологічні властивостіі є унікальною у кожному окремому випадку (закріпленою генетично).
Вторинна структура- це конфігурація поліпептидного ланцюга в просторі, що утворюється в результаті взаємодій між функціональними групами, що входять до складу пептидного кістяка.
Види вторинної структури:
1.) α – спіраль;
2.) β – структура;
3.) Нерегулярні вторинні структури(Кільця, вигини, петлі).
β – структураформується між лінійними ділянками одного поліпептидного ланцюга, утворюючи при цьому складки або між різними поліпептидними ланцюгами. Поліпептиді ланцюга або їх частини можуть формувати паралельні та антипаралельні β-структури. Певні поєднання альфа-спіралей та бета-структур у деяких білках називають супервторинноїструктурою білків. Вони мають специфічні назви: структура «бета-бочки», «цинковий палець».
Третинна структура- це спосіб укладання поліпептидного ланцюга у просторі у вигляді компактного пакування, за рахунок зв'язків між радикалами. У підтримці третинної структури важливу роль відіграють слабкі, але численні водневі зв'язки, іонні та гідрофобні взаємодії, а також сильні дисульфідні зв'язки.
Четвертична структура- це вищий рівеньструктурної організації, можливий в усіх білків. Це спосіб укладання у просторі поліпептидних ланцюгів та формування єдиного у структурному та функціональному відносинах макромолекулярного утворення. Кожен окремо взятий поліпептидний ланцюг, що отримав назву протоміруабо субодиниці, Найчастіше не має біологічної активності.
Амінокислоти здатні з'єднуватися між собою зв'язками, які називаються пептиднимипри цьому утворюється полімерна молекула. Якщо кількість амінокислот не перевищує 10, то нова сполука називається пептид; якщо від 10 до 40 амінокислот – поліпептидякщо більше 40 амінокислот – білок.
Зв'язки у білках.
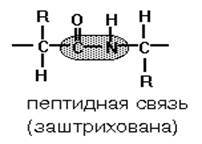
Пептидна зв'язок– це зв'язок між α-карбоксильною групою однієї амінокислоти та α-аміногрупою іншої амінокислоти.
Освіта пептидного зв'язку
При необхідності назвати пептид до всіх назв амінокислот додають суфікс "-іл", тільки остання амінокислота зберігає свою назву незмінною.
Наприклад, аланіл-серил-триптофан або γ-глутамініл-цистеїніл-гліцин (по-іншому званий глутатіон).
Мономери амінокислот, що входять до складу білків, називають " амінокислотні залишкиАмінокислотний залишок, що має вільну аміногрупу, називається N-кінцевимі пишеться зліва, а має вільну карбоксильну групу - С-кінцевимі пишеться праворуч. Пептиди пишуться та читаються з N-кінця. Ланцюг атомів, що повторюються, в поліпептидному ланцюгу -NH-CH-CO- носить назву " пептидний кістяк".
До властивостей пептидного зв'язку належать:
1.) Копланарність. Всі атоми, що входять в пептидну групу, знаходяться в одній площині, при цьому атоми "Н" і "О" розташовані по різні сторонивід пептидного зв'язку.
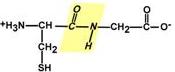
2.) Транс-положення заступників. Радикали амінокислот по відношенню до осі C-Nзв'язки знаходяться по "різні" сторони, в транс-положенні.
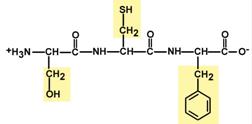
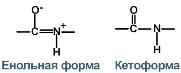
3.) Дві рівнозначні форми. Пептидна зв'язок має кетоформу та енольну форму.
4.) Здатність до утворення водневих зв'язків. Атоми вуглецю і азоту, що входять в пептидний зв'язок мають здатність утворювати два водневі зв'язки з іншими пептидними групами.
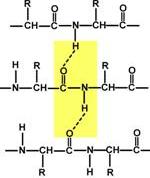
5.) Пептидна зв'язок має частково характер подвійного зв'язку. Довжина пептидного зв'язку менша, ніж одинарного зв'язку, вона є жорсткою структурою, і обертання навколо неї утруднене. Але оскільки крім пептидної, в білку є й інші зв'язки, ланцюжок амінокислот здатний обертатися навколо основної осі, що надає білкам різну конформацію ( просторове розташуванняатомів).
Міжланцюгові та внутрішньоланцюгові поперечні дисульфідні зв'язки.Дисульфідний зв'язок утворюється між двома залишками цистеїну та «зшиває» дві ділянки поліпептидного ланцюга (або ланцюгів), яким належать ці залишки. Цей зв'язок залишається стабільним у тих умовах, за яких білок зазвичай денатурує. Обробка білка надмурашиною кислотою (окислювальною зв'язку S-S) або бета-меркаптоетанолом (що відновлює зв'язку S-S з регенерацією двох залишків цистеїну) призводить до поділу поліпептидних ланцюгів, пов'язаних дисульфідними зв'язками; їх первинна структурапри цьому не торкається.
Водневі зв'язки
утворюються: 1) між групами, що входять до складу бічних ланцюгів та здатними до формування водневих зв'язків; 2) між атомами азоту і кисню, що належать пептидним групам кістяка; 3) між полярними залишками, розташованими на поверхні молекули білка, та молекулами води. Усі вони відіграють важливу роль у стабілізації вторинної, третинної тощо структури білка.
Гідрофобні взаємодії. Неполярні бічні ланцюги нейтральних амінокислот у білках мають тенденцію до асоціації. Стехіометричні співвідношення при цьому не дотримуються, тому ніяких зв'язків у звичайному сенсі не виникає. Тим не менш, ці взаємодії відіграють важливу роль у підтримці структури білка.
Електростатичні зв'язки. Ці сольові зв'язки виникають між різноіменно зарядженими групами, що входять до складу бічних ланцюгів амінокислот. Наприклад, аміногрупа лізину при фізіологічних рН несе заряд +1, а карбоксильна група аспартату або глутамату у складі бічного ланцюга несе заряд -1. Отже, ці групи можуть електростатично взаємодіяти, стабілізуючи структуру білка.
Міцність зв'язків.У ході денатурації білків (наприклад, при обробці сечовиною або додецилсульфатом натрію у присутності надлишку іонів Н+ та ОН-) водневі та гідрофобні зв'язки, а також зв'язки електростатичної природи руйнуються, а пептидні та дисульфідні зберігаються.
Доменні білкимістять у своїй структурі домени(Структурні ділянки молекул з третинною структурою). Деякі домени є функціонально автономними утвореннями у складі білкових молекул. Окремі домени пов'язані між собою пептидними фрагментами (шарнірними ділянками). Прикладами доменних білків є ферменти 7 – гліцеральдегідфосфатдегідрогеназу та фосфогліцераткіназу. У їхньому складі окремі домени реалізують різні етапискладного каталітичного шляху.
Ці групи взаємодіють із дипольними молекулами води, які орієнтуються навколо них.
Негативно заряджені амінокислоти. Сюди відносяться аспарагінова та глутамінова кислоти. Мають додаткову СООН-групу в радикалі - в нейтральному середовищі набувають негативного заряду.
Усі вони гідрофільні.
Позитивно заряджені амінокислоти: аргінін, лізин та гістидин. Мають додаткову NH2-групу (або імідазольне кільце, як гістидин) у радикалі - у нейтральному середовищі набувають позитивного заряду.
![]()
Усі вони також є гідрофільними.
Такі властивості притаманні вільних амінокислот. У білку ж іоногенні групи загальної частини амінокислот беруть участь в утворенні пептидного зв'язку, і всі властивості білка визначаються властивостями тільки радикалів амінокислот.
Не всі амінокислоти, що беруть участь у побудові білків людського тіла, здатні синтезуватись у нашому організмі. На цьому заснована ще одна класифікація амінокислот – біологічна.
ІІ. Біологічна класифікація.
а) Незамінні амінокислоти, їх ще називають "есенційними". Вони не можуть синтезуватися в організмі людини і повинні обов'язково поводитися з їжею. Їх 8 та ще 2 амінокислоти відносяться до частково незамінних.
Незамінні: метіонін, треонін, лізин, лейцин, ізолейцин, валін, триптофан, фенілаланін.
Частково незамінні: аргінін, гістидин.
а) Замінні (можуть синтезуватись в організмі людини). Їх 10: глутамінова кислота, глутамін, пролін, аланін, аспарагінова кислота, аспарагін, тирозин, цистеїн, серин та гліцин.
ІІІ. Хімічна класифікація- відповідно до хімічною структуроюрадикалу амінокислоти (аліфатичні, ароматичні).
Білки синтезуються на рибосомах, ні з вільних амінокислот, та якщо з їх сполук з транспортними РНК (т-РНК).
Цей комплекс називається "аміноацил-т-РНК".
ТИПИ ЗВ'ЯЗКІВ МІЖ АМІНОКИСЛОТАМИ В МОЛЕКУЛІ БІЛКУ
1. КОВАЛЕНТНІ ЗВ'ЯЗКИ – звичайні міцні хімічні зв'язки.
б) дисульфідний зв'язок
2. НЕКОВАЛЕНТНІ (СЛАБІ) ТИПИ ЗВ'ЯЗКІВ - фізико-хімічні взаємодії родинних структур. У десятки разів слабше, ніж звичайний хімічний зв'язок. Дуже чутливі до фізико-хімічних умов середовища. Вони неспецифічні, тобто поєднуються один з одним не суворо певні хімічні угруповання, а найрізноманітніші хімічні групи, але відповідають певним вимогам.
а) Водневий зв'язок
б) Іонний зв'язок
в) Гідрофобна взаємодія
ПЕПТИДНИЙ ЗВ'ЯЗОК.
Формується за рахунок COOH-групи однієї амінокислоти та NH2-групи сусідньої амінокислоти. У назві пептиду закінчення назв усіх амінокислот, крім останньої, що знаходиться на «С»-кінці молекули змінюються на «мул»
Тетрапептид: вал-аспарагіл-лізил-серин

ПЕПТИДНИЙ ЗВ'ЯЗОК формується ТІЛЬКИ ЗА РАХУНОК АЛЬФА-АМІНОГРУПИ І СУДІЙ COOH-ГРУПИ ЗАГАЛЬНОГО ДЛЯ ВСІХ АМІНОКИСЛОТ ФРАГМЕНТУ МОЛЕКУЛИ!!! Якщо карбоксильні та аміногрупи входять до складу радикалу, то вони ніколи(!) не беруть участь у формуванні пептидного зв'язку в молекулі білка.
Будь-який білок - це довга нерозгалужена поліпептидна ланцюг, що містить десятки, сотні, а іноді більше тисячі амінокислотних залишків. Але якою б довжиною не був поліпептидний ланцюг, завжди в основі її - стрижень молекули, абсолютно однаковий у всіх білків. Кожен поліпептидний ланцюг має N-кінець, на якому знаходиться вільна кінцева аміногрупа та С-кінець, утворений кінцевою вільною карбоксильною групою. На цьому стрижні сидять, як бічні гілочки, радикали амінокислот. Числом, співвідношенням та чергуванням цих радикалів один білок відрізняється від іншого. Сама пептидна зв'язок є частково подвійною з лактим-лактамной таутомерії. Тому навколо неї неможливе обертання, а сама вона за міцністю в півтора рази перевершує звичайний ковалентний зв'язок. На малюнку видно, що з кожних трьох ковалентних зв'язків у стрижні молекули пептиду або білка дві є простими і допускають обертання, тому стрижень (весь поліпептидний ланцюг) може згинатися у просторі.
Хоча пептидний зв'язок досить міцний, його порівняно легко можна зруйнувати хімічним шляхом - кип'ятінням білка в міцному розчині кислоти або лугу протягом 1-3 діб.
До ковалентних зв'язків у молекулі білка крім пептидної, відноситься також ДИСУЛЬФІДНИЙ ЗВ'ЯЗОК.
Цистеїн - амінокислота, яка в радикалі має SH-групу, за рахунок якої і утворюються дисульфідні зв'язки.
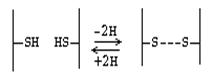
Дисульфідний зв'язок - це ковалентний зв'язок. Однак біологічно вона набагато менш стійка, ніж пептидна зв'язок. Це тим, що у організмі інтенсивно протікають окислювально-відновні процеси. Дисульфідний зв'язок може виникати між різними ділянками одного і того ж поліпептидного ланцюга, тоді він утримує цей ланцюг у вигнутому стані. Якщо дисульфідна зв'язок виникає між двома полипептидами, вона об'єднує в одну молекулу.
СЛАБІ ТИПИ ЗВ'ЯЗКІВ
У десятки разів слабші за ковалентні зв'язки. Це не певні типизв'язків, а неспецифічна взаємодія, що виникає між різними хімічними угрупованнями, що мають високу спорідненість один до одного (спорідненість – це здатність до взаємодії). Наприклад: протилежно заряджені радикали.
Таким чином, слабкі типи зв'язків – це фізико-хімічні взаємодії. Тому вони дуже чутливі до змін умов середовища (температури, pH середовища, іонної сили розчину тощо).
Водневий зв'язок- це зв'язок, що виникає між двома електронегативними атомами за рахунок атома водню, який з'єднаний з одним із електронегативних атомів ковалентно (див. рисунок).
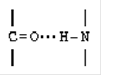
Водневий зв'язок приблизно в 10 разів слабший, ніж ковалентний. Якщо водневі зв'язки повторюються багаторазово, то вони утримують поліпептидні ланцюжки з високою міцністю. Водневі зв'язки дуже чутливі до умов зовнішнього середовищата присутності в ній речовин, які самі здатні утворювати такі зв'язки (наприклад, сечовина).
ІОННИЙ ЗВ'ЯЗОК- виникає між позитивно та негативно зарядженими угрупованнями (додаткові карбоксильні та аміногрупи), які зустрічаються в радикалах лізину, аргініну, гістидину, аспарагінової та глутамінової кислот.
ГІДРОФОБНЕ ВЗАЄМОДІЯ- неспецифічне тяжіння, що виникає в молекулі білка між радикалами гідрофобних амінокислот - викликається силами Ван-дер-Ваальса і доповнюється силою води, що виштовхує,. Гідрофобна взаємодія слабшає або розривається у присутності різних органічних розчинників та деяких детергентів. Наприклад, деякі наслідки дії етилового спирту при проникненні всередину організму обумовлені тим, що під його впливом послаблюються гідрофобні взаємодії в молекулах білків.
Будова та класифікація альфа-амінокислот
Природні амінокислоти відповідають загальній формулі RCH(NH 2)COOH і відрізняються будовою радикалу R. Формули та тривіальні назви найважливіших амінокислот наведені у таблиці. Для біологічного функціонування амінокислот у складі білків визначальним є полярність радикалу R. За цією ознакою амінокислоти поділяють такі основні групи (див. таблицю).
Таблиця. Найважливіші a-амінокислоти RCH(NH 2)COOH
|
Назва |
Позначення | ||
|
Амінокислоти, що містять неполярний радикал R |
|||
|
| |||
|
| |||
|
| |||
|
|
Ізолейцин | ||
|
|
Фенілаланін | ||
|
|
Триптофан | ||
|
| |||
|
|
Метіонін | ||
|
| |||
|
Амінокислоти, що містять полярний неіоногенний радикал R |
|||
|
| |||
|
| |||
|
|
Гідроксипролін | ||
|
|
Аспаргін | ||
|
|
Глутамін | ||
|
Амінокислоти, що містять полярний позитивно заряджений радикал R |
|||
|
| |||
|
|
5-гідроксилізин | ||
|
| |||
|
|
Гістідін | ||
|
Амінокислоти, що містять полярний негативно заряджений радикал R |
|||
|
|
Аспаргінова кислота | ||
|
|
Глутамінова кислота | ||
|
| |||
|
| |||
Класифікація
1.Амінокислоти, що містять неполярний радикал R. Такі групирозташовуються всередині молекули білка та зумовлюють гідрофобні взаємодії.
2.Амінокислоти, що містять полярний неіоногенний радикал R.Амінокислоти цього типу мають у складі бічного радикалу полярні групи, які не здатні до іонізації у водному середовищі (спиртовий гідроксил, амідна група). Такі групи можуть розташовуватися як усередині, і поверхні молекули білка. Вони беруть участь у освіті водневих зв'язків коїться з іншими полярними групами.
3.Амінокислоти, що містять радикал R, здатний до іонізації в водному середовищіз утворенням позитивно чи негативно заряджених груп.Такі амінокислоти містять у бічному радикалі додатковий основний або кислотний центр, який у водному розчині може приєднувати або віддавати протон.
![]()
У білках іоногенні групи цих амінокислот розташовуються, зазвичай, лежить на поверхні молекули і зумовлюють електростатичні взаємодії.
Класифікація
За радикалом
Неполярні: аланін, валін, ізолейцин, лейцин, пролін, метіонін, фенілаланін, триптофан,
Полярні незаряджені (заряди компенсовані) при pH=7: , серин, треонін, цистеїн, аспарагін, глутамін, тирозин
Полярні заряджені негативно при pH=7: аспартат, глутамат
Полярні заряджені позитивно при pH=7: лізин, аргінін, гістидин
За функціональними групами
Аліфатичні
Моноаміномонокарбонові: гліцин, аланін, валін, ізолейцин, лейцин
Оксимоноамінокарбонові: серін, треонін
Моноамінодикарбонові: аспартат, глутамат, рахунок другої карбоксильної групи несуть у розчині негативний заряд
Аміди моноамінодикарбонових: аспарагін, глутамін
Діаміномонокарбонові: лізин, аргінін, несуть у розчині позитивний заряд
Ароматичні: фенілаланін, тирозин, триптофан, (гістидин)
Гетероциклічні: триптофан, гістидин, пролін
Імінокислоти: пролін
За класами аміноацил-тРНК-синтетаз
Клас I: валін, ізолейцин, лейцин, цистеїн, метіонін, глутамат, глутамін, аргінін, тирозин, триптофан
Клас II: гліцин, аланін, пролін, серин, треонін, аспартат, аспарагін, гістидин, фенілаланін
Для амінокислоти лізин існують аміноацил-тРНК-синтетази обох класів.
Шляхами біосинтезу
Шляхи біосинтезу протеїногенних амінокислот є різноплановими. Одна й та сама амінокислота може утворюватися різними шляхами. До того ж різні шляхи можуть мати дуже схожі етапи. Тим не менш, мають місце і виправдані спроби класифікувати амінокислоти шляхом їх біосинтезу. Існує уявлення про наступні біосинтетичні сімейства амінокислот: аспартату, глутамату, серину, пірувату та пентоз. Не завжди конкретну амінокислоту можна однозначно віднести до певної родини; робляться поправки для конкретних організмів та враховуючи переважний шлях. За сімействами амінокислоти зазвичай розподіляють так:
Сімейство аспартату: аспартат, аспарагін, треонін, ізолейцин, метіонін, лізин.
Сімейство глутамату: глутамат, глутамін, аргінін, пролін.
Сімейство пірувату: аланін, валін, лейцин.
Сімейство серину: серин, цистеїн, гліцин.
Сімейство пентоз: гістидин, фенілаланін, тирозин, триптофан.
Фенілаланін, тирозин, триптофан іноді виділяють у сімейство шикімату.
За здатністю організму синтезувати з попередників
Незамінні
Для більшості тварин і людини незамінними амінокислотами є: валін, ізолейцин, лейцин, треонін, метіонін, лізин, фенілаланін, триптофан
Замінні
Для більшості тварин і людини замінними амінокислотами є: гліцин, аланін, пролін, серин, цистеїн, аспартат, аспарагін, глутамат, глутамін, тирозин.
Класифікація амінокислот на замінні та незамінні не позбавлена недоліків. Наприклад, тирозин є замінною амінокислотоюлише за умови достатнього надходження фенілаланіну. Для хворих на фенілкетонурію тирозин стає незамінною амінокислотою. Аргінін синтезується в організмі людини і вважається замінною амінокислотою, але у зв'язку з деякими особливостями його метаболізму при певних фізіологічних станах організму може бути прирівняний до незамінних. Гістидин також синтезується в організмі людини, але не завжди в достатній кількості, тому має надходити з їжею.
За характером катаболізму у тварин
Біодеградація амінокислот може йти різними шляхами.
За характером продуктів катаболізму у тварин протеїногенні амінокислоти ділять на три групи:
Глюкогенні – при розпаді дають метаболіти, що не підвищують рівень кетонових тіл, здатні відносно легко ставати субстратом для глюконеогенезу: піруват, α-кетоглутарат, сукциніл-KoA, фумарат, оксалоацетат
Кетогенні - розпадаються до ацетил-KoA і ацетоацетил-KoA, що підвищують рівень кетонових тіл у крові тварин і людини і перетворюються в першу чергу на ліпіди.
Глюко-кетогенні – при розпаді утворюються метаболіти обох типів
Амінокислоти:
Глюкогенні: гліцин, аланін, валін, пролін, серин, треонін, цистеїн, метіонін, аспартат, аспарагін, глутамат, глутамін, аргінін, гістидин.
Кетогенні: лейцин, лізин.
Глюкокетогенні (змішані): ізолейцин, фенілаланін, тирозин, триптофан.
Стереоізомери(просторові ізомери) - хімічні сполуки, що мають однакову будову, але відрізняються просторовим розташуванням атомів. Стереоізомери мають однакову конституцію, але різні конфігурацію та/або конформацію.