Põhilised aminohapperadikaalid. Aminohapete üldised omadused ja struktuur. Aminohapete klassifikatsioon. Valgu aminohappeline koostis
Aminohapped on valgumolekulide komponendid. Valgud koosnevad aminohapetest, mis on omavahel seotud peptiidsidemetega.
Praegu on 20 aminohapet, mis moodustavad meie kehas rohkem kui 50 tuhat erinevat valku ja 20 tuhat ensüümi, ensüümi ( komplekssed ained valgu olemus). Nendest 28 aminohappest on kõik tervislikud Inimkeha suudab sünteesida mis tahes vajalikku valku.
Aminohapete eraldamine asendamatuteks ja mitteolulisteks.
Aminohapete jagamine asendamatuteks ja mitteolulisteks toimub vastavalt nende võimele sünteesida organismis. Sest erinevad organismid mitteoluliste/asendamatute aminohapete loetelu on erinev. Allpool on toodud inimesele iseloomulik aminohapete jaotus.
Asendamatud aminohapped.
- isoleutsiin;
- leutsiin;
- lüsiin;
- metioniin;
- fenlalaniin;
- treoniin;
- trüptofaan;
- valiin.
Mitte asendamatud aminohapped ei saa inimkehas teistest aminohapetest sünteesida. Neid aminohappeid tuleb toiduga varustada.
Tinglikult asendamatud aminohapped.
- histidiin;
- tsüstiin;
- türosiin.
Tinglikult asendamatud aminohapped teatud tingimustel sünteesitud või mitte. Näiteks arginiini süntees organismis 30 aasta pärast väheneb oluliselt.
Asendatavad aminohapped.
- alaniin
- asparagiin
- asparagiinhape
- glütsiin.
Mitteasendatavad aminohapped võib sünteesida kehas (teistest aminohapetest, transamiinimisreaktsioonides)
Aminohapete struktuur.
Igas aminohappe molekulis on süsinikuaatom, mis on seotud nelja asendajaga. Üks neist on vesinikuaatom, teine on karboksüülrühm - COOH. Vesinikuioon on karboksüülrühmast kergesti eraldatav H+, mille tõttu esineb aminohapete nimes sõna "hape". Kolmas asendaja on aminorühm - NH2. Aminohappe neljas element on aatomite rühm, mida üldiselt tähistatakse R. Kõikidel aminohapetel on erinevad R-rühmad ja igaüks neist mängib oma, väga oluline roll. R-rühma nimetatakse ka külgkett.
Aminohappe üldvalemi neutraalses keskkonnas (ph=7) saab kirjutada järgmiselt NH2 + CHRCOO -
Mis puutub rühma COOH, siis orgaanilised keemikud suhtuvad sellesse suure austusega: kõigile teistele molekuli süsinikuaatomitele antakse tähised sõltuvalt nende kaugusest karboksüülrühmast. Sellele lähimat aatomit nimetatakse alfa-aatom, teine - beeta-aatom jne. Aminohapetes sisalduv süsinikuaatom, mis on karboksüülrühmale kõige lähemal ehk alfa-aatom, on samuti seotud aminorühmaga, mistõttu valgu moodustavad looduslikud aminohapped on nn. alfa-aminohapped .
Looduses leidub ka aminohappeid, milles NH2 rühm on seotud karboksüülrühmast kaugemal asuvate süsinikuaatomitega. Loodus valis aga valkude ehitamiseks alfa-aminohapped. See on eelkõige tingitud asjaolust, et ainult pikkade ahelatega ühendatud alfa-aminohapped suudavad tagada suurte valgu molekulide struktuuri piisava tugevuse ja stabiilsuse.
R-rühmas erinevate alfa-aminohapete arv on suur. Kuid sagedamini kui teised, leidub valkudes vaid 20. erinevad aminohapped. Neid võib pidada valgumolekuli "keele" tähestikuks. Keemikud nimetavad neid peamisi aminohappeid standardseteks, aluselisteks või normaalseteks. Tavaliselt jagatakse aluselised aminohapped nelja klassi.
Esimene aminohapete klass on mittepolaarsete kõrvalahelatega aminohapped.
Teine on polaarset rühma sisaldavad aminohapped.
Järgmised kaks klassi moodustavad külgahelatega aminohappeid, mis võivad olla laetud positiivselt (need ühinevad kolmandaks klassiks) või negatiivselt (neljandaks). Näiteks karboksüülrühma dissotsiatsioon annab aniooni - COO- ja lämmastikuaatomi protoneerimine - katiooni, näiteks -NH3 +. Asparagiin- ja glutamiinhapete külgahelates on veel üks karboksüülrühm -COOH, mis elusrakule iseloomulike pH väärtuste korral (pH = 7) eraldub vesinikiooniga (H +) ja omandab negatiivse laengu. Aminohapete lüsiini, arginiini ja histidiini külgahelad on positiivselt laetud, kuna neil on lämmastikuaatomid, mis, vastupidi, võivad siduda vesinikiooni.
aminohapete isomeerid. Aminohapete D- ja L-vormid.
Iga alfa-aminohape (va glütsiin) sõltuvalt suhteline positsioon neli asendajat võivad esineda kahel kujul. Nad erinevad üksteisest, nagu objekt omast peegeldus. Selliseid ühendeid nimetatakse kiraalne(alates roheline."khir" - "käsi").
Kiraalsed molekulid avastas 1848. aastal suur prantsuse teadlane Louis Pasteur. kahte tüüpi optilisi isomeere ( enantiomeerid) orgaanilisi molekule nimetatakse D-vormiks (alates lat. dexter - "parem") ja L-vorm (alates lat. laevus - "vasakule"). Muide, teiste kiraalsete molekulide - glükoosi ja fruktoosi - üks nimetusi on dekstroos ja levuloos.
Kõik praegu uuritavad valgud sisaldavad ainult L-seeria aminohappeid, milles, kui arvestada kiraalset aatomit H-aatomi poolelt, paiknevad NH3+, COO- rühmad ja radikaal -R päripäeva. Vajadus ehitada rangelt määratletud enantiomeerist bioloogiliselt oluline polümeeri molekul on ilmne – kahe enantiomeeri ratseemilise seguga saaks kujuteldamatult keeruka diastereoisomeeride segu.
Valgud sisaldavad ainult L-aminohappeid.
Tuleb märkida, et D-aminohapped on looduses üsna laialt levinud ja lisaks on nad osa bioloogiliselt olulistest oligopeptiididest.
Normaalseks toimimiseks vajab keha täielik komplekt 20 asendamatust alfa-L-aminohappest.
Aminohapped on rasv- või aromaatsete ainete derivaadid rasvhapped, mis sisaldavad amiin- või karboksüülrühma, mis erinevad ainult radikaalide poolest.
Kõik aminohapped sisaldavad: 1) karboksüülrühma (–COOH), 2) aminorühma (–NH 2), 3) radikaali või R-rühma (ülejäänud molekul). Radikaali struktuur erinevad tüübid aminohapped on erinevad. Sõltuvalt aminohappeid moodustavate aminorühmade ja karboksüülrühmade arvust on: neutraalsed aminohapped, millel on üks karboksüülrühm ja üks aminorühm; aluselised aminohapped, millel on rohkem kui üks aminorühm; happelised aminohapped, millel on rohkem kui üks karboksüülrühm.
Aminohapped on amfoteersed ühendid, kuna lahuses võivad nad toimida nii hapete kui alustena. Vesilahustes esinevad aminohapped erinevates ioonsetes vormides.
Aminohapete koostis orav:
Valgud on mitteperioodilised polümeerid, mille monomeerideks on α-aminohapped. Tavaliselt nimetatakse valgu monomeerideks 20 tüüpi α-aminohappeid, kuigi rakkudest ja kudedest on leitud üle 170 neist.
Olenevalt sellest, kas aminohappeid saab sünteesida inimeste ja teiste loomade kehas, on olemas: ebaolulised aminohapped – saab sünteesida; asendamatuid aminohappeid ei saa sünteesida. Asendamatud aminohapped tuleb sisse võtta koos toiduga. Taimed sünteesivad igasuguseid aminohappeid.
Sõltuvalt aminohapete koostisest on valgud: terviklikud – sisaldavad kogu aminohapete komplekti; mittetäielik - nende koostises puuduvad mõned aminohapped. Kui valgud koosnevad ainult aminohapetest, nimetatakse neid lihtsateks. Kui valgud sisaldavad lisaks aminohapetele ka mitteaminohappelist komponenti (proteesirühma), nimetatakse neid kompleksideks. Proteesirühma võivad esindada metallid (metalloproteiinid), süsivesikud (glükoproteiinid), lipiidid (lipoproteiinid), nukleiinhapped (nukleoproteiinid).
Aminohapete klassifikatsioon:
Monoaminomonokarboksüül
R-CH3 alaniin
R-CH2OH seriin
R-SH-CH2 tsüsteiin
R-CH3-S-CH2-CH2 metioniin
Diaminomonosüsinik
CH2-NH2-CH2-CH2 liviin
Monoamiindikarboksüülhape
COOH-CH2 asparagiinhape
COOH-CH 2 -CH 2 glutamiini aminohape
Diaminodikarboksüülhape
Tsüstiin (kaks tsüsteiini)
Tsüklilised aminohapped (fenüülalaniin, türosiin, trüptofaan)
Asendamatud aminohapped – ei ole võimelised sünteesima inimeste ja loomade kehas (trüptofaan, fenüülalaniin, lüsiin, valiin, treoniin, leutsiin, isoleutsiin, metioniin)
Looduslike ainete tohutu hulga hulgas on aminohapetel eriline koht. Seda seletatakse nende erakordse tähtsusega nii bioloogias kui ka in orgaaniline keemia. Fakt on see, et molekulid lihtsad ja komplekssed valgud, mis on eranditult kõigi eluvormide aluseks Maal. Just sel põhjusel pöörab teadus tõsist tähelepanu selliste küsimuste uurimisele nagu aminohapete struktuur, omadused, tootmine ja kasutamine. Nende ühendite tähtsus on suur ka meditsiinis, kus neid kasutatakse meditsiinilised preparaadid. Inimestele, kes mõtlevad tõsiselt enda tervist ja juhib aktiivset eluviisi, mis on üks toiduvormidest (nn sportlik toitumine). Mõnda nende tüüpidest kasutatakse orgaanilise sünteesi keemias lähteainena sünteetiliste kiudude – enanti ja kaproni – tootmisel. Nagu näete, on aminokarboksüülhapetel nii looduses kui ka inimühiskonna elus väga oluline roll, seega tutvume nendega lähemalt.
Aminohapete struktuuri tunnused
Selle klassi ühendid kuuluvad amfoteersete orgaaniliste ainete hulka, see tähendab, et need sisaldavad kahte funktsionaalset rühma ja seetõttu on neil kaks omadust. Eelkõige sisaldavad molekulid süsivesinikradikaale, mis on kombineeritud NH2 aminorühmade ja COOH karboksüülrühmadega. Keemilistes reaktsioonides teiste ainetega toimivad aminohapped kas aluste või hapetena. Selliste ühendite isomeeria avaldub kas süsinikskeleti ruumilise konfiguratsiooni või aminorühma asukoha muutumise tõttu ning aminohapete klassifikatsioon määratakse süsivesinikradikaali struktuuriliste tunnuste ja omaduste alusel. See võib olla sirge või hargnenud ahela kujul ning sisaldada ka tsüklilisi struktuure.
Aminokarboksüülhapete optiline aktiivsus
Kõik taimede, loomade ja inimeste organismides esinevad polüpeptiidide monomeerid ja nende 20 tüüpi kuuluvad L-aminohapete hulka. Enamik neist sisaldab asümmeetrilist süsinikuaatomit, mis pöörab polariseeritud valguskiire vasakule. Kahel monomeeril, isoleutsiinil ja treoniinil, on kaks sellist süsinikuaatomit ja aminoäädikhappel (glütsiinil) pole ühtegi. Aminohapete klassifitseerimist optilise aktiivsuse järgi kasutatakse laialdaselt biokeemias ja molekulaarbioloogias valkude biosünteesi translatsiooniprotsessi uurimisel. Huvitav on see, et aminohapete D-vormid ei ole kunagi osa polüpeptiidahelad valgud, kuid need esinevad bakterite membraanides ja aktinomütseedi seente ainevahetusproduktides, st tegelikult leidub neid looduslikes antibiootikumides, näiteks gramitsidiinis. Biokeemias on D-vormiga ained laialt tuntud ruumiline struktuur, nagu tsitrulliin, homoseriin, ornitiin, mis mängivad olulist rolli rakkude ainevahetuse reaktsioonides.
Mis on tsvitterioonid?
Tuletame veel kord meelde, et valgu monomeerid sisaldavad amiinide funktsionaalrühmi ja karboksüülhapped. Osakesed -NH 2 ja COOH interakteeruvad üksteisega molekulis, mis põhjustab sisemise soola, mida nimetatakse bipolaarseks iooniks (tsvitterioon), ilmumiseni. Sellised sisemine struktuur aminohapped selgitavad neid kõrge võimekus interaktsioonile polaarsete lahustitega, näiteks veega. Laetud osakeste olemasolu lahustes määrab nende elektrijuhtivuse.
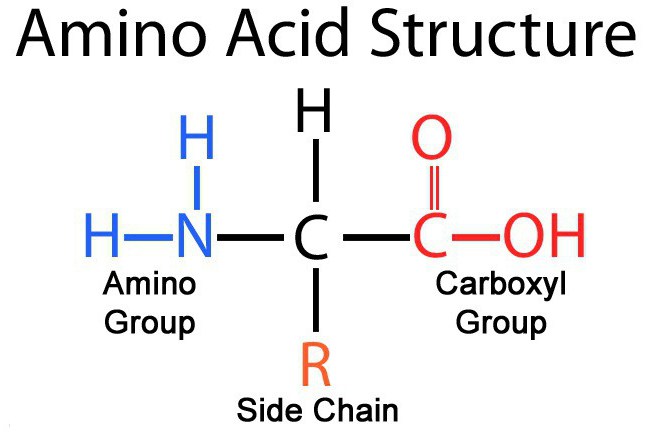
Mis on α-aminohapped
Kui aminorühm asub molekulis karboksüülrühma asukohast lähtudes esimese süsinikuaatomi juures, klassifitseeritakse selline aminohape α-aminohappeks. Neil on klassifikatsioonis juhtiv koht, sest just nendest monomeeridest koosnevad kõik bioloogiliselt aktiivsed ained. valgu molekulid nt ensüümid, hemoglobiin, aktiin, kollageen jne. Selle aminohapete klassi struktuuri võib vaadelda glütsiini näitel, sama, mida kasutatakse laialdaselt neuroloogilises praktikas rahustina. depressiooni ja neurasteenia kerged vormid.

Selle aminohappe rahvusvaheline nimetus on α-aminoäädikhape, sellel on optiline L-vorm ja see on proteinogeenne, see tähendab, et see osaleb translatsiooniprotsessis ja on osa valgu makromolekulidest.
Valkude ja nende monomeeride roll ainevahetuses
Imetajate, sealhulgas inimeste organismi normaalset talitlust on võimatu ette kujutada ilma valgu molekulidest koosnevate hormoonideta. Nende koostises sisalduvate aminohapete sisaldus kinnitab nende kuulumist α-vormidesse. Näiteks toodetakse trijodotüroniini ja türoksiini kilpnääre. Nad reguleerivad ainevahetust ja sünteesitakse selle rakkudes α-aminohappest türosiinist. Lihtsas ja komplekssed valgud seal on nii 20 põhimonomeeri kui ka nende derivaate. Protrombiinis, mis reguleerib vere hüübimist, on karboksüglutamiinhape, müosiinis ( lihasvalk) leidub metüüllüsiini, ensüümis peroksidaas – selenotsüsteiin.
Valkude ja nende monomeeride toiteväärtus
Arvestades aminohapete struktuuri ja nende klassifikatsiooni, peatugem gradatsioonil, mis põhineb valgu monomeeride võimel või võimatusel rakkudes sünteesida. Plastilise ainevahetuse reaktsioonides tekivad alaniin, proliin, türosiin ja teised ühendid, trüptofaan ja veel seitse aminohapet peaksid aga meie kehasse sattuma vaid toiduga.
Üks näitajaid õige ja tasakaalustatud toitumine on inimese valgu tarbimise tase. See peaks moodustama vähemalt veerandi kogu kehasse sisenenud toidukogusest päevas. Eriti oluline on, et valgud sisaldaksid valiini, isoleutsiini ja teisi asendamatuid aminohappeid. Sel juhul nimetatakse valke täielikuks. Inimkehasse satuvad nad taimsest või seeni sisaldavast toidust.
Olulisi valgumonomeere ei saa imetajarakkudes sünteesida. Kui arvestada asendamatute aminohappemolekulide struktuuri, saame veenduda, et need kuuluvad erinevad klassid. Niisiis kuuluvad valiin ja leutsiin alifaatsetesse sarjadesse, trüptofaan - aromaatsete aminohapete hulka ja treoniin - hüdroksüaminohapete hulka.