Kui palju erinevaid aminohappeid on ühes valgus. §3. orgaaniline aine. Aminohapped. Oravad
ELUSAINE ABC. VALGUD
Rohkem kui 4 miljardit aastat tagasi tekkisid Maal väikestest anorgaanilistest molekulidest arusaamatul viisil valgud, millest said elusorganismide ehituskivid. Kõik elusolendid võlgnevad oma lõputu mitmekesisuse ainulaadsetele valgumolekulidele ja muud eluvormid universumis on teadusele veel tundmatud.
valgud või valgud(alates kreeka keel"Protos" - "esimene") on looduslikud orgaanilised ühendid, mis tagavad mis tahes organismi kõik eluprotsessid. Valkudest on ehitatud silma lääts ja võrk, kilpkonna kest ja seente mürgised ained ... Valkude abil seedime toitu ja võitleme haigustega. Tänu spetsiaalsetele valkudele helendavad öösel tulikärbsed ning ookeani sügavustes värelevad meduusid salapärase valgusega.
Valgumolekule on elusrakus kordades rohkem kui kõigis teistes (välja arvatud muidugi vesi!). Teadlased on leidnud, et enamikus organismides moodustavad valgud üle poole nende kuivmassist. Ja valgutüüpide mitmekesisus on väga suur – nii väikese organismi nagu bakter ühes rakus Escherichia soja" (vt lisaesseed "Uurimisobjekt - prokarüootid"), on umbes 3 tuhat erinevat valku.
Esmakordselt eraldas valgu (gluteeni kujul) 1728. aastal itaallane Jacopo Bartolomeo Beccari (1682-1766) nisujahust. Seda sündmust peetakse valgukeemia sünniks. Sellest ajast alates, peaaegu kolm sajandit looduslikud allikad on saadud tuhandeid erinevaid valke ja uuritud nende omadusi.
BIOLOOGILISED "HELMED"
Valgu molekul on väga pikk. Keemikud nimetavad selliseid molekule polümeerne(alates kreeka keel"poly" - "palju" ja "meros" - "osa", "jaga"). Tõepoolest, pikk polümeeri molekul koosneb paljudest omavahel seotud väikestest molekulidest. Nii nööritakse kaelakees niidile helmed. Polümeerides mängivad niidi rolli helmeste-molekulide vahelised keemilised sidemed.Valkude saladus peitub nende samade helmeste omadustes. Enamik polümeere ei võta ruumis stabiilset kuju, muutudes samasugusteks helmesteks, millel ei saa olla ruumilist struktuuri: kui riputada need kaela, on need rõnga või ovaalse kujuga, kui paned need kasti. , kõverduvad need ebamäärase kujuga palliks. Nüüd kujutame ette, et mõned helmed võivad üksteise külge "kleepuda". Näiteks tõmbavad punased ligi kollased. Siis omandab kogu kett teatud kuju, tänu selle olemasolule "kleepub kokku" kollastest ja punastest helmestest
Midagi sarnast juhtub ka valkudes. Üksikud väikesed molekulid, millest valk koosneb, on võimelised "kokku kleepuma", kuna nende vahel toimivad atraktiivsed jõud. Selle tulemusena on igal valguahelal ainult talle iseloomulik ruumiline struktuur. Tema on see, kes määrab imelised omadused valgud. Ilma sellise struktuurita ei saaks nad täita funktsioone, mida nad elusrakus täidavad.
Kui valke keedetakse pikka aega tugevate hapete või leeliste juuresolekul valguahelad lagunevad nende koostisosadeks
nimetatakse aminohapeteks. Aminohapped on "helmed", millest valk koosneb, ja need on paigutatud suhteliselt lihtsalt.
KUIDAS AMINOHAPE ON KUJUNUD
Igas aminohappe molekulis on süsinikuaatom, mis on seotud nelja asendajaga. Üks neist on vesinikuaatom, teine on karboksüülrühm -COOH. See "vabastab" kergesti vesinikiooni H+, mille tõttu esineb aminohapete nimes sõna "hape". Kolmas asendaja on aminorühm -NH2 ja lõpuks neljas asendaja on aatomite rühm, mida üldiselt tähistatakse R-ga. Kõikidel aminohapetel on erinevad R-rühmad ja igaüks neist mängib oma, väga oluline roll.
"Helmete" omadused, mis eristavad üht aminohapet teisest, on peidetud R-rühmadesse (nimetatakse ka külgahelateks). Mis puutub rühma -COOH, siis orgaanilised keemikud suhtuvad sellesse suure austusega: kõigile teistele molekuli süsinikuaatomitele antakse tähised sõltuvalt nende kaugusest karboksüülrühmast. Sellele lähimat aatomit nimetatakse a-aatom, teine - sisse-aatom, järgmine - juures-aatom jne Aminohapetes olev süsinikuaatom, mis on karboksüülrühmale kõige lähemal, s.o. a-aatom on samuti seotud aminorühmaga, seega nimetatakse valgu moodustavaid looduslikke aminohappeid a-aminohapped.
Looduses leidub ka aminohappeid, milles NH^-rühm on seotud karboksüülrühmast kaugemal asuvate süsinikuaatomitega. Valkude ehitamiseks on loodus aga täpselt valinud a-aminohapped. See on eelkõige tingitud asjaolust, et a-pika ahelaga ühendatud aminohapped on võimelised tagama suurte valgu molekulide struktuuri piisava tugevuse ja stabiilsuse.
Number a-R-rühmas erinevad aminohapped on suured. Kuid sagedamini kui teised, leidub valkudes vaid 20 erinevat aminohapet. Neid võib pidada valgumolekuli "keele" tähestikuks. Keemikud nimetavad neid peamisi aminohappeid standardseteks, aluselisteks või normaalseteks. Tavaliselt jagatakse aluselised aminohapped nelja klassi.
Esimene hõlmab mittepolaarsete külgahelatega aminohappeid. Teises - polaarset rühma sisaldavad aminohapped. Järgmised kaks moodustavad külgahelatega aminohappeid, mis võivad olla laetud positiivselt (need ühinevad kolmandaks klassiks) või negatiivselt (neljandaks). Näiteks karboksüülrühma dissotsiatsioon annab aniooni - COO - ja lämmastikuaatomi protoneerimine - katiooni, näiteks -NH 3 +. Asparagiin- ja glutamiinhappe külgahelatel on veel üks karboksüülrühm COOH, mis elusrakule tüüpiliste pH väärtuste juures (pH = 7) laguneb koos vesinikiooniga (H +) ja omandab negatiivse laengu. . Aminohapete lüsiini, arginiini ja histidiini külgahelad on positiivselt laetud, kuna neil on lämmastikuaatomid, mis, vastupidi, võivad siduda vesinikiooni.
Iga a-aminohape (välja arvatud glütsiin), võib sõltuvalt nelja asendaja vastastikusest paigutusest esineda kahel kujul. Need erinevad üksteisest nagu objekt oma peegelpildist või kui parem käsi vasakult. Selliseid ühendeid nimetatakse koor(alates roheline."khir" - "käsi"). Kiraalsed molekulid avastas 1848. aastal suur prantsuse teadlane Louis Pasteur. Orgaaniliste molekulide kahte tüüpi optilisi isomeere nimetatakse D-vormiks (alates lat. dexter - "parem") ja Z-kujuline (alates lat. laevus - "vasakule"). Muide, teiste kiraalsete molekulide - glükoosi ja fruktoosi - üks nimetusi on dekstroos ja levuloos. Tähelepanuväärne on see, et valkude koostisesse kuuluvad ainult Z-aminohapped ja kõik valgu elu Maal - "vasakule".
Normaalseks eluks vajab keha 20 põhilist a-Z-aminohapet. Kuid mõnda neist saab sünteesida organismi enda rakkudes, teised aga peavad sisenema valmis alates toiduained. Esimesel juhul nimetatakse aminohappeid vahetatavad ja teises - asendamatu. Hiljutine komplekt erinevad organismid erinev. Näiteks valge roti jaoks on 10 aminohapet asendamatud ja piimhappebakterite jaoks - 16. Taimed suudavad iseseisvalt sünteesida mitmesuguseid aminohappeid, luua neid, mida valkudes ei leidu.
Mugavuse huvides sümboliseeritakse 20 peamist aminohapet aminohappe vene või ingliskeelse nimetuse ühe või kolme esimese tähega, näiteks alaniin - Ala või A, glütsiin - Gly või G.
MIS ON PEPTID
Polümeerne valgumolekul moodustub pikaks aminohappehelmeste ahelaks liitumisel. Need on ühendatud keemiliste sidemete keermega tänu amino- ja karboksüülrühmadele, mis esinevad kõigis a-süsiniku aatomiga seotud aminohapetes.
Sellise reaktsiooni tulemusena tekkinud ühendeid nimetatakse peptiidideks; (-CO-NH-rühmitus neis on peptiidirühm, ja side süsiniku ja lämmastiku aatomite vahel on peptiidside(nimetatakse ka amiidiks). Aminohapete sidumine peptiidsidemed, on võimalik saada peptiide, mis koosnevad väga paljude aminohapete jääkidest. Selliseid ühendeid nimetatakse polüpeptiidid. Valgumolekuli polüpeptiidstruktuuri tõestas 1902. aastal saksa keemik Emil Hermann Fischer.
Aminohappeahela otstes on vabad amino- ja karboksüülrühmad; neid ahela otsasid nimetatakse N- ja C-otsteks. Polüpeptiidahela aminohappejäägid nummerdatakse tavaliselt N-otsast.
Aminohappejääkide koguarv valgumolekulis varieerub väga laias vahemikus. Niisiis koosneb iniminsuliin 51 aminohappejäägist ja imetava ema piima lüsosüüm 130-st. Inimese hemoglobiinis on 4 aminohappeahelat, millest igaüks koosneb umbes 140 aminohappest. On valke, millel on ühes ahelas peaaegu 3 tuhat aminohappejääki.
Valkude molekulmass on vahemikus umbes 11 000 väikeste valkude puhul, mis koosnevad 100 aminohappejäägist, kuni 1 miljon või enam väga pikkade polüpeptiidahelatega valkude või mitmest polüpeptiidahelast koosnevate valkude puhul.
Tekib küsimus: kuidas saab kõigest 20 molekulist luua kogu tohutut valikut erinevate funktsioonide ja omadustega valke? Ja vastus sellele looduse saladusele on lihtne – igal valgul on oma unikaalne aminohappeline koostis ja unikaalne aminohapete kombinatsiooni järjekord, nn. esmane struktuur orav.
SPIRAALID JA KIHID
50ndate alguses. 20. sajandil Ameerika keemikud Linus Carl Pauling (1901–1994), kes pälvis Nobeli preemia keemilise sideme olemuse uurimise eest, ja Robert Corey (1897–1971) tegid ettepaneku, et mõned aminohappeahela lõigud valkudes on väänatud spiraal. Tänu eksperimentaalsete meetodite täiustamisele (valkude struktuuri uuritakse röntgenikiirguse abil) leidis see hiilgav oletus mõne aasta pärast kinnitust.
Tõepoolest, polüpeptiidahelad moodustavad väga sageli sisse keerdunud heeliksi parem pool. See on esimene, kõige rohkem madal tase valguahelate ruumiline korraldus Siin hakkavad rolli mängima "helmeste"-aminohapete nõrgad interaktsioonid: C \u003d 0 rühm ja N-H rühm erinevatest peptiidsidemetest võivad moodustada üksteisega vesiniksideme. Selgus, et Paulingi ja Corey avastatud heeliksis tekib selline side iga i-nda aminohappe C=0 rühma ja N-H rühm (i + 4)-s aminohappe, st aminohappejäägid on omavahel ühendatud, eraldatud üksteisest nelja "helmega". Need vesiniksidemed ja stabiliseerida sellist spiraali tervikuna. Ta sai nime a.-spiraalid.
Hiljem selgus, et a-heeliks pole ainus viis aminohapete ahelate virnastamiseks. Lisaks spiraalidele moodustavad need ka kihte. Tänu samadele vesiniksidemetele C=0 ja vahel N-H sõber mitu erinevat fragmenti ühest polüpeptiidahel. Tulemuseks on terve kiht – seda nimetati ^-kiht.
Enamikus valkudes on a-heeliksid ja p-kihid läbisegi kõikvõimalikud voltid ja ahelafragmendid, millel puudub kindel struktuur. Valgu üksikute osade ruumilise struktuuri käsitlemisel ütlevad nad valgu molekuli sekundaarstruktuuri kohta.
VALK RUUMIS
Valgu molekuli täieliku "portree" saamiseks ei piisa primaar- ja sekundaarstruktuuri tundmisest. See teave ei anna veel aimu ei molekuli mahust ega kujust, veel vähem ahelaosade asukohast üksteise suhtes. Aga kõik spiraalid ja kihid on kuidagi ruumi paigutatud. Polüpeptiidahela üldist ruumilist struktuuri nimetatakse tertsiaarne struktuur orav.
Valgumolekulide – müoglobiini ja hemoglobiini – esimesed ruumilised mudelid ehitati 50ndate lõpus. 20. sajandil Inglise biokeemikud John Coudery Kendrew (sündinud 1917) ja Max Ferdinand Perutz (sündinud 1914). Seda tehes kasutasid nad röntgenkiirtega tehtud katsete andmeid. Valkude struktuuri alaste uuringute eest pälvisid Kendrew ja Perutz 1962. aastal Nobeli preemia. Ja sajandi lõpus määrati juba mitme tuhande valgu tertsiaarne struktuur.
Kui moodustub valgu tertsiaarne struktuur, näitavad lõpuks aktiivsust R-rühmad, aminohapete kõrvalahelad. Just tänu neile "kleepuvad" enamus "helmestest" aminohapetest omavahel kokku, andes ahelale ruumis teatud kuju.
Elusorganismis on valgud alati sees veekeskkond. Ja enamus suur number aluselised aminohapped – kaheksa – sisaldavad mittepolaarseid R-rühmi. Muidugi kipub valk oma molekulis mittepolaarseid külgahelaid usaldusväärselt peitma, et piirata nende kokkupuudet veega. Teadlased nimetavad seda hüdrofoobsete interaktsioonide esinemiseks (vt artiklit "Elu väikseim ühik").
Hüdrofoobse interaktsiooni tõttu võtab kogu polüpeptiidahel ruumis teatud kuju, st moodustab tertsiaarse struktuuri.
Valgu molekulis töötavad teised jõud. Osa aluseliste aminohapete külgahelatest on negatiivselt laetud ja osa positiivselt laetud. Kuna negatiivseid laenguid tõmbavad positiivsed, siis vastavad "helmed" "kleepuvad kokku". Elektrostaatilised vastasmõjud või, nagu neid teisiti nimetatakse, soolasillad, - teine oluline jõud, mis stabiliseerib tertsiaarset struktuuri.
Seitsmel aluselisel aminohappel on polaarsed kõrvalahelad. Nende vahel võivad tekkida vesiniksidemed, millel on ka oluline roll valgu ruumilise struktuuri säilitamisel.
Tsüsteiini kahe aminohappejäägi vahel tekivad mõnikord kovalentsed sidemed (-S-S-), mis fikseerivad asukoha väga kindlalt. erinevad saidid valguahelad üksteise suhtes. Selliseid ühendusi nimetatakse disulfiidsillad. Need on valkudes kõige vähem interaktsioonid (mõnel juhul puuduvad need täielikult), kuid neil pole tugevust.
VALKUDE RUUMILISE ORGANISATSIOONI KÕRGEIM TASE
Valgu molekul ei pruugi koosneda ühest, vaid mitmest polüpeptiidahelast. Iga selline ahel on iseseisev ruumistruktuur - allüksus. Näiteks valk hemoglobiin koosneb neljast subühikust, mis moodustavad ühe molekuli, mis paiknevad peaaegu korrapärase tetraeedri tippudes. Allüksused "kleepuvad" üksteise külge samade jõudude tõttu, mis stabiliseerivad tertsiaarset struktuuri. Need on hüdrofoobsed vastasmõjud, soolasillad ja vesiniksidemed.
Kui valk koosneb mitmest alaühikust, siis väidetavalt on see olemas kvaternaarne struktuur. Selline struktuur on kõrgeim tase valgu molekuli organiseerimine. Erinevalt kolm esimest tasemel, ei ole kõigil valkudel kvaternaarset struktuuri. Ligikaudu pooltel tänapäeval tuntud valkudest seda ei ole.
MIKS VALGUD KARTAVAD KUUMUST
Valgu ruumilist struktuuri toetavad sidemed hävivad üsna kergesti. Lapsepõlvest teame, et munade keetmisel muutub läbipaistev munavalge elastseks valgeks massiks ja piim pakseneb hapudes. See juhtub albumiini valkude ruumilise struktuuri hävimise tõttu munavalge ja kaseiin (ingl. caseus - "juust") piimas. Sellist protsessi nimetatakse denatureerimine. Esimesel juhul põhjustab see kuumutamist ja teisel - happesuse märkimisväärne suurenemine (piimas elavate bakterite elulise aktiivsuse tagajärjel). Denatureerimise käigus kaotab valk oma võime täita organismis omaseid funktsioone (sellest ka protsessi nimi: alates lat. denaturare - "looduslikest omadustest ilmajätmine"). Denatureeritud valgud on organismil kergemini seeditavad, seega on toidu kuumtöötlemise üks eesmärke valkude denatureerimine.
MIKS ON VAJA RUUMILIST STRUKTUURI
Looduses ei juhtu peaaegu midagi juhuslikult. Kui valk on võtnud ruumis teatud kuju, peab see täitma mingit eesmärki. Tõepoolest, ainult "õige" ruumilise struktuuriga valk saab omada teatud omadusi, st täita kehas neid funktsioone, mis on talle ette nähtud. Ja ta teeb seda samade aminohapete R-rühmade abil. Selgub, et külgahelad ei hoia ruumis mitte ainult valgumolekuli "õiget" kuju. R-rühmad võivad siduda teisi orgaanilisi ja anorgaanilisi molekule, osaleda keemilistes reaktsioonides, toimides näiteks katalüsaatorina.
Sageli on polüpeptiidahela ruumiline organiseeritus lihtsalt "vajalik selleks, et koondada teatud ruumipunktidesse teatud funktsiooni täitmiseks vajalik kõrvalahelate kogum. Võib-olla ei toimu elusorganismis ühtegi protsessi ilma valkude osaluseta .
MIS ON ENSÜÜMIDE SALADUS
Kõik rakus toimuvad keemilised reaktsioonid toimuvad spetsiaalse valkude klassi tõttu - ensüümid. Need on katalüütilised valgud. Neil on oma saladus, mis võimaldab neil töötada palju tõhusamalt kui teised katalüsaatorid, kiirendades reaktsioone miljardeid kordi.
Oletame, et mitu sõpra ei saa kuidagi kohtuda. Aga niipea, kui keegi neist sõbrad sünnipäevale kutsus, ei lasknud tulemus kaua oodata: kõik sattusid määratud ajal samasse kohta.
Et kohtumine toimuks, oli vaja sundida sõpru ühendust võtma. Ensüüm teeb sama. Selle molekulis on nn sidumiskeskused. Need sisaldavad teatud tüüpi jaoks atraktiivseid keemilised ühendid(ja ainult neile!) "Hubane toolid" - R-rühmad, mis seovad teatud osi reageerivate ainete molekulidest. Näiteks kui ühes molekulis on mittepolaarne rühm, on seondumiskohas hüdrofoobsed kõrvalahelad. Kui molekulis on negatiivne laeng, ootab seda ensüümi molekulis positiivse laenguga R-rühm.
Selle tulemusena seostuvad mõlemad reaktiivide molekulid ensüümiga ja on üksteise vahetus läheduses. Veelgi enam, need rühmad, kes peavad astuma keemilisesse reaktsiooni, on ruumis orienteeritud reaktsiooniks vajalikul viisil. Nüüd võetakse üles ensüümi külgahelad, mis täidavad katalüsaatori rolli. Ensüümis on kõik “läbi mõeldud” nii, et ka R-rühmad-katalüsaatorid paiknevad sündmuste toimumiskoha lähedal, mida nn. aktiivne keskus. Ja pärast reaktsiooni lõppemist "vabastab" ensüüm tootemolekulid (vt artiklit "Ensüümid - kõigi ametite meister").
KUST TULEB IMmuunsus
Valgud täidavad kehas paljusid funktsioone; need näiteks kaitsevad rakke soovimatute sissetungide eest, kaitsevad neid kahjustuste eest. Spetsiaalsed valgud - antikehad omavad võimet ära tunda rakkudesse sattunud baktereid, viirusi, võõrpolümeeri molekule ja neid neutraliseerida.
Kõrgematel selgroogsetel kaitseb keha võõrosakeste eest immuunsüsteem. See on loodud nii, et organism, millesse tungivad sellised "agressorid" - antigeenid, hakkab tootma antikehi. Antikeha molekul seondub tugevalt antigeeniga: antikehadel on sarnaselt ensüümidega ka sidumiskeskused. Aminohapete külgahelad paiknevad tsentrites nii, et sellesse lõksu sattunud antigeen ei pääse enam antikeha “raudkäppadest” välja. Pärast antikehaga seondumist väljutatakse vaenlane kehast.
Võite viia kehasse väikese koguse teatud polümeerimolekule, mis on osa nakkushaigust põhjustavatest bakteritest või viirustest.
Vastavad antikehad ilmuvad koheselt kehasse. Nüüd ründavad need antikehad kohe verre või lümfi sattunud “päris” patogeenset mikroobi ja haigus võidetakse. See nakkuse vastu võitlemise viis pole midagi muud kui vaktsineerimine, mida paljud ei armasta. Tänu sellele omandab keha immuunsuse nakkushaiguste vastu.
MIKS ON RAUDA HEMOGLOBIINIS
Looduses leidub valke, mis sisaldavad lisaks aminohapetele ka teisi keemilisi komponente, nagu lipiide, suhkruid, metalliioone. Tavaliselt mängivad need komponendid olulist rolli valgu bioloogilise funktsiooni täitmisel. Niisiis viiakse läbi molekulide ja ioonide ülekandmine ühest elundist teise transpordivalgud vereplasma. Valk hemoglobiini(alates kreeka keel"hema" - "veri" ja lat. globus - "pall", "pall" sisaldub vererakkudes - erütrotsüüdid (alates kreeka keel"erythros" - "punane" ja "kitos" - "rakk"), toimetab hapniku kopsudest kudedesse. Hemoglobiini molekulis on rauaiooni Fe 24 kompleks kompleksse orgaanilise molekuliga, nn. kalliskivid. Hemoglobiin koosneb neli valku allüksused ja igaüks neist sisaldab ühte heemi.
Raua ioon osaleb otseselt hapniku sidumises kopsudes. Niipea, kui sellele lisatakse vähemalt ühes alaühikus hapnikku, muudab ioon ise kohe veidi oma asukohta valgu molekulis. Raua liikumine "provotseerib" selle alaühiku kogu aminohappeahela liikumist, mis muudab selle tertsiaarset struktuuri veidi. Teine allüksus, kes pole veel hapnikku lisanud, “tunneb”, mis naabriga juhtus. Ka selle struktuur hakkab muutuma. Selle tulemusena seob teine alaühik hapnikku kergemini kui esimene. Hapniku lisamine kolmandale ja neljandale alaühikule toimub veelgi väiksemate raskustega. Nagu näha, aitavad allüksused üksteist oma töös. Selleks vajab hemoglobiin kvaternaarset struktuuri. Süsinikmonooksiid CO (kõnekeeles süsinikmonooksiid) seondub heemis oleva rauaga sadu kordi tugevamini kui hapnik. Süsinikmonooksiid on inimestele surmav, kuna jätab hemoglobiini hapniku sidumise võimest ilma.
JA VEEL VALKE...
Need toimivad toitainetena. Paljude taimede (nisu, mais, riis jne) seemned sisaldavad toiduvalgud. Nende hulka kuuluvad ka albumiin - munavalge ja kaseiini põhikomponent - peamine valk piim. Valgutoidu seedimisel inimkehas toimub peptiidsidemete hüdrolüüs. Valgud “lahutatakse” üksikuteks aminohapeteks, millest organism “ehitab” hiljem uusi peptiide või kasutab neid energia saamiseks. Sellest ka nimi:
Kreeka sõna "peptos" tähendab "seeditud". Huvitaval kombel juhivad peptiidsideme hüdrolüüsi ka valgud – ensüümid.
Osaleda rakulise ja füsioloogilise aktiivsuse reguleerimises. To nagu valgud hõlmavad paljusid hormoonid(alates kreeka keel“hormao” – “soovitan”), näiteks insuliin, mis reguleerib glükoosi metabolismi, ja kasvuhormoon.
Need annavad kehale võimaluse kuju muuta ja liikuda. Selle eest vastutavad valgud aktiin ja müosiin, millest lihased ehitatakse.
Teostage tugi- ja kaitsefunktsioone, kinnitusi bioloogilised struktuurid ja annab neile jõudu. Nahk on peaaegu puhas valk kollageen, samas kui juuksed, küüned ja suled koosnevad sitkest, lahustumatust valku keratiinist.
MIS ON GEENIDES KIRJUTATUD
Valkude aminohapete järjestust kodeerivad geenid, mida talletatakse ja päranduvad DNA molekulide abil (vt artikleid "Päriliku teabe hoidja. DNA" ja "Geeni ekspressioon"). Valgu ruumilise struktuuri määrab aminohapete järjestus. Selgub, et päriliku teabe sisu moodustavad mitte ainult valkude esmased, vaid ka sekundaarsed, tertsiaarsed ja kvaternaarsed struktuurid. Järelikult on valkude poolt täidetavad funktsioonid geneetiliselt programmeeritud. Nende funktsioonide tohutu loetelu võimaldab valke õigustatult nimetada elu peamisteks molekulideks. Seetõttu on teave valkude kohta see hindamatu aare, mis kandub looduses edasi põlvest põlve.
Inimeste huvi nende orgaaniliste ühendite vastu kasvab iga aastaga. Tänapäeval on teadlased juba paljude valgumolekulide struktuuri dešifreerinud. Nad selgitavad välja erinevate valkude funktsioonid, püüavad kindlaks teha funktsioonide ja struktuuri vahelisi seoseid. Sarnasuste ja erinevuste tuvastamine erinevates elusorganismides sarnaseid funktsioone täitvate valkude puhul võimaldab tungida sügavamale evolutsiooni saladustesse.
Aminohapped – VANUSE INDIKAATORID
Aminohapete D- ja L-vormidel on võime väga aeglaselt üksteiseks muutuda. Teatud (väga pika) aja jooksul net D- või I-vorm võib muutuda mõlema vormi võrdse koguse seguks. Sellist segu nimetatakse raiemage, ja protsess ise raie mizaiii. Ratsemiseerumise kiirus sõltub temperatuurist ja aminohappe tüübist. Seda omadust saab kasutada organismide ja vajadusel ka elusolendite fossiilsete jäänuste vanuse määramiseks. Näiteks dentiini valgu (dentin - luu hambad) 1-as-paragiinhape raemiseerub spontaanselt kiirusega 0,1% aastas. Lastel hammaste moodustumise perioodil sisaldab dentiin ainult 1-asparagiinhapet. Hambast eraldatakse dentiin ja selles määratakse 0-vormi sisaldus. Testi tulemused on üsna täpsed. Niisiis, 97-aastase naise puhul, kelle vanus oli dokumenteeritud, näitas test 99-aastaseks. Eelajalooliste loomade - elevantide, delfiinide, karude - fossiilsete jäänuste kohta tehtud uuringute andmed on hästi kooskõlas radionukliidmeetodil saadud dateerimistulemustega.
MIKS SENGER NOBELI AUHINNAD SAAS
Valkude hüdrolüüsil aminohapeteks (peptiidsideme hävitamine veega) kaob teave nende ühendamise järjestuse kohta. Seetõttu pikka aega Usuti, et valgu primaarstruktuuri määramine on täiesti lootusetu ülesanne. Aga 50ndatel. 20. sajandil Inglise biokeemik Frederick Sanger (sündinud 1918) suutis dešifreerida aminohapete järjestuse hormooninsuliini polüpeptiidahelates. Selle töö eest, mille valmimiseks kulus mitu aastat, pälvis Sanger 1958. aastal auhinna Nobeli preemia keemias (kakskümmend aastat hiljem sai ta koos W. Gilbertiga teise preemia panuse eest DNA esmase struktuuri loomisesse).
Sangeri poolt esmakordselt sõnastatud aminohappejärjestuse määramise põhimõtted on tänapäevalgi kasutusel, kuid kõikvõimalike variatsioonide ja täiustustega. Valgu primaarstruktuuri kindlaksmääramise protseduur on keeruline ja mitmeastmeline: see sisaldab kümmekonda erinevad etapid. Esmalt jagatakse valk üksikuteks aminohapeteks ning määratakse nende tüüp ja kogus antud aines. Järgmises etapis ei jagune pikk valgu molekul enam täielikult, vaid fragmentideks. Seejärel määratakse nendes fragmentides aminohapete ühendamise järjekord, eraldades need järjestikku ükshaaval. Valgu jagamine fragmentideks toimub mitmel viisil, nii et erinevates fragmentides on kattuvad piirkonnad. Olles välja selgitanud aminohapete järjekorra kõikides fragmentides, saavad nad täieliku teabe selle kohta, kuidas aminohapped valguses paiknevad. XX sajandi lõpuks. on loodud spetsiaalsed seadmed, mis määravad automaatrežiimis aminohapete järjestuse valgu molekulis - sekveneerijad(alates Inglise järjestus - "järjestus").
JA PIIMATOOTED
Piim on rasva kolloidne lahus vees. Mikroskoobi all on selgelt näha, et see on heterogeenne: rasvakuulikesed hõljuvad värvitus lahuses (seerumis).
Lehmapiim sisaldab tavaliselt 3–6% rasva (peamiselt glütserooli ja küllastunud estreid karboksüülhapped- palmitiin, steariin), umbes 3% valkudest, aga ka süsivesikuid, orgaanilisi happeid, vitamiine ja mineraalaineid.
Valk kaseiin piimas esineb köidetud vorm- aminohappe seriiniga kovalentselt seotud fosfaatrühmad moodustavad kaltsiumiioonidega sooli. Piima hapestamisel need soolad hävivad ja kaseiin vabaneb valge kohupiima massina. Inimese maos toimub spetsiaalsete ensüümide toimel protsess, mida nimetatakse "kaseiini kalgendamiseks". Kalgenenud kaseiin sadestub ja eritub kehast aeglasemalt ning seetõttu imendub see paremini. Kaseiin on väga toitev:
see sisaldab peaaegu kõiki aminohappeid, inimesele vajalik et ehitada oma valke. Puhtal kujul on see maitsetu valge pulber, mis ei lahustu vees. Lisaks sellele sisaldab piim ka teisi valke, näiteks laktalbumiini. Keedmisel muutub see valk lahustumatuks vormiks, moodustades keedetud piima pinnale iseloomuliku valge kile – vahu.
Suhkur laktoos C^HdgO, mis on osa piimast, isomeriseerub sahharoosiks. Inimkehas laguneb see suhkur ensüümi laktaasi toimel monosahhariidideks glükoosiks ja galaktoosiks, mis imenduvad kergesti. Tänu sellele näiteks täidavad imikud süsivesikute varusid. Huvitav on see, et paljudel inimestel (peamiselt mongoloidide rassi esindajatel) on keha sees täiskasvanueas kaotab võime laktoosi lagundada.
Seedetrakti läbides laktoos ei imendu, vaid muutub kasvulavaks erinevate patogeenide tekkeks, mis põhjustab üldist halb enesetunne. Sellepärast rahvad Kaug-Ida(jaapanlased, hiinlased) praktiliselt ei söö piimatooteid.
Tööstuslikes tingimustes töödeldakse piima kuumtöötlusega, mille eesmärk on pärssida mikroorganismide arengut ja pikendada selle säilivusaega. Selleks piim pastöriseeritakse - hoitakse 30 minutit temperatuuril 65 ° C, samuti kasutatakse lühiajalist kuumtöötlust - kuumutatakse 10-20 s kuni 71 ° C. Võrreldes pastöriseerimisega, kuumtöötluskonservid toitaineid eriti vitamiinid. Et piim ei eralduks kooreks ja vadakuks, see homogeniseeritakse – see juhitakse rõhu all läbi väikeste aukude. Rasvakuulikesed purustatakse, nende suurus väheneb ja piim muutub viskoossemaks.
Märkimisväärne osa piimast läheb töötlemiseks - või, juustu ja piimatoodete (keefir, fermenteeritud küpsetatud piim, kalgendatud piim, hapukoor) tootmiseks.
Keefiri saamiseks piima kääritatakse - hoitakse 8-10 tundi 20-25 °C juures, lisades piimhappebakterite seemet. Nende toimel laguneb laktoos piimhappeks:
s „n „ o „ + n, o \u003d
4CH3CH(OH)COOH. piim (2-hüdroksüpropaanhape).
Piimhape on see, mis määrab keefiri spetsiifilise maitse. Lahusesse kogunedes toimub kaseiini koagulatsioon (koagulatsioon), mis vabaneb vabal kujul. Seetõttu on keefir paksema konsistentsiga kui piim. Laktoosi piimhappekääritamisega kaasneb alkoholkäärimine, mille tõttu in fermenteeritud piimatooted, eriti keefiris, on väike kogus alkoholi (kuni 0,03%). Hapendatud piimatooted sisaldavad ka mikroorganisme, mis pärsivad patogeensete bakterite arengut ja parandavad seeläbi seedimist.
Kodujuustu saadakse ka piima kääritamisel piimhappebakteritega. Selle põhikomponent on kaseiinvalk.
Valmistuma võid, vadakust on vaja eraldada piima moodustavad rasvatilgad. Selleks klopitakse koor – ülemine rasvasem kiht, mis tekib piima settimisel.
Kaseiini leidub ka juustudes. Nende valmistamiseks lisatakse piimale bakteriaalne starter ja spetsiaalsed ensüümid ning seejärel kuumutatakse segu teatud temperatuurini. Ensüümid viiakse uuesti vabanenud trombi sisse ja kuumutatakse. Sel juhul toimub kaseiini struktuuri ja koostise osaline muutus. Seejärel asetatakse segu vormidesse ja kaua aega- kuni kuus kuud - hoitakse madalal temperatuuril (mitte üle 15 ° C). Laagerdumisel laguneb kaseiin ensüümide toimel polüpeptiidideks ja vabadeks aminohapeteks. Osa aminohapetest oksüdeeritakse õhuhapniku toimel ning moodustuvad ammoniaak, aldehüüdid ja ka ketohapped, mis annavad juustule iseloomuliku maitse.
Hapupiim on tavaline näide valkude denatureerimisest.
VASKE VERI
Kalmaar elab Vaikse ookeani Peruu hoovuse külmades vetes Dosidicus gigas. Selle sigarikujuline keha koos kombitsatega ulatub 3,5 m pikkuseks ja hiiglase mass võib ületada 150 kg. Võimsad hiired viskavad veejoa välja jõuga, millega see tuletõrjevoolikust välja lööb, tänu millele suudab kalmaar liikuda kiirusega kuni 40 km/h. Väga tugeva ja terava nokaga võib see lõhkuda terastrossi. Pealtnägijate sõnul rebib kalmaar sõna otseses mõttes puruks 20-kilose kala. See metsik kiskja on inimestele väga ohtlik. Frank Lane'i raamat The Kingdom of the Octopus väidab, et "inimene, kes kukub üle parda kohtades, kus elab palju kalmaare, ei ela poolt minutitki."
Energiaga "laadimiseks" vajab see ookeanielanik palju hapnikku - vähemalt 50 liitrit tunnis. Mereveest tulev hapnik kandub vaske sisaldava spetsiaalse valgu - hemianiini (alates) abil kogu kalmaari keha kreeka keel"gema" - "veri" ja "kyanos" - "sinine", "sinine").
Väärib märkimist, et selgroogsete veres "transpordivad" hapnikku raua aatomid heemi koostises, mis on eriline. kompleksne molekul, mis on osa hemoglobiinivalgust. Nad on sõna otseses mõttes täidetud punaste verelibledega - erütrotsüüdid. Hemoglobiini molekul sisaldab nelja heemi fragmenti, millest igaüks on võimeline siduma hapniku molekuli. Erinevalt hemoglobiinist on hemianiinis vase aatomid otseselt seotud valgu molekulidega, mis ei sisaldu üheski rakus, kuid "hõljuvad" veres vabalt. Aga üks hemoiiani molekul
See on võimeline siduma kuni 200 vase aatomit. Ja hemoiiani-na on veel üks omadus - selle molekulid on tohutud isegi valkude jaoks. "Tavalistes" valkudes, mis on osa munadest, piimast, hiirtest, on molekulmass vahemikus 6 tuhat kuni 1 miljon ja hemianiini molekulmass võib ulatuda 10 miljonini! See on üks suurimaid valke; ainult viiruste valgukompleksid on oma suuruse ja massi poolest suuremad.
Hemoiyanin on väga iidne orav. See on hemoglobiinist lihtsam ja mitte nii tõhus. Kuid madala hapnikusisaldusega sisse merevesi hemianiin varustab sellega üsna edukalt külmavereliste loomade kudesid. Niisiis on hapniku rõhk homaari lõpustes vaid 7 mm Hg. Art. (930 Pa) ja kudedes - 3 mm Hg. Art.; Pealegi on selle gaasi kontsentratsioon homaari veres 20 korda kõrgem kui merevees.
Lisaks kalmaaridele kannavad hapnikku “sinise vere” abil ka kümnejalgsed vähid (homaarid, krabid, krevetid). Hemoiianiini leidub kõigis peajalgsetes (kaheksajalad, kalmaarid, seepia), erinevates tigudes, ämblikes jne. Kuid kammkarpidel, austritel ja teistel kahepoolmelistel seda pole.
Hemianiini kogus veres võib olla väga erinev. Niisiis ulatub krapsakas kaheksajalas ja hobuserauakrabis (lülijalgsete tüüpi mereloom) selle ebatavalise valgu kontsentratsioon 10 g-ni 100 ml vere kohta - peaaegu sama palju hemoglobiini inimveres. Samal ajal istuvas söödavas molluskis, leplikas Hatiotis tuberculatasisse 100 ml verd on ainult 0,03 g hemianiini. See on arusaadav: mida aktiivsem on loom,
mida rohkem hapnikku vajab ta energiakulude katmiseks, seda suurem on hapnikku kandva valgu kontsentratsioon veres.
Hemoianiin avastati 60ndatel. XIX sajandil, mil bioloogid märkasid, et peajalgsete veri muutub lõpuste läbimisel siniseks. Ja 1878. aastal tõestas Belgia füsioloog Leon Frederic, et sinise värvuse põhjustab hapniku reaktsioon vaske sisaldava valguga, mida ta nimetas hemianiiniks. Kui viimane kaotab hapniku, muutub see erinevalt hemoglobiinist värvituks. Tähelepanuväärne on see, et Frederick lõpetas kogu töö uue valgu uurimisel ühe päeva jooksul.
Vase täielik eraldamine hemianiinist pole keeruline. Alya, piisab, kui töödelda valku hapniku puudumisel reagendiga, mis seostub tugevalt monovalentse vase ioonidega. Samamoodi saate määrata vase sisaldust hemianiinis. Sellest metallist ilma jäädes kaotab see hapniku kandmise võime. Kuid kui Cu-1 ioone sisestatakse seejärel valgulahusesse, taastab hemianiin oma füsioloogilise aktiivsuse. Nii tõestati, et hapniku puudumisel on hemianiini vask oksüdatsiooni olekus +1. Selle gaasi liia korral toimub metalli osaline oksüdeerumine. Sel juhul on hemianiiniga seotud hapnikumolekuli kohta alati kaks vase aatomit. Seega oksüdeerib hapnik täpselt pooled vase aatomitest. See on veel üks erinevus hemianiini ja hemoglobiini vahel, mis on palju levinum loomamaailmas, kus kõik raua aatomid on võrdsed ja nende laeng on +2 nii vabas olekus kui ka koos hapnikuga.
Kasutatud kirjanduse loetelu:
1) Entsüklopeedia lastele “Avanta +” 17. köide. Keemia. Moskva 2000. (lk 480-293)
Monoaminomonokarboksüülaminohapped.
Glütsiin- glükokool, α-aminoäädikhape
Ainus optiliselt inaktiivne aminohape. Sellel on magus maitse ja see on üks levinumaid. Eriti palju seda želatiinis. See on prekursor puriinide biosünteesis, hemoglobiini porfüriini osa, klorofüll, heemilised ensüümid. Osaleb bakteriraku seinte moodustamises. Toimib inhibeeriva vahendajana selgroog ja enamikus ajutüve struktuurides, kus seda leidub suurtes kontsentratsioonides.
L-alaniin-α-aminopropioonhape
H3C-C-COOH
Leidub peaaegu kõigis valkudes. mängib suur roll lämmastikuühendite vahetamisel. See võib olla karotenoidide, kummi, rasvade ja süsivesikute sünteesi lähteaine.
L-Valiin- α-aminoisovaleriinhape
H3C-CH-C-COOH
Sellel on hüdrofoobsete interaktsioonide võime, mis on oluline valgu molekuli struktuuri loomisel ja stabiliseerimisel. Leidub paljudes valkudes, kuid tavaliselt mitte suured hulgad. Osaleb alkaloidide, mõnede tsüklopeptiidide, pantoteenhappe, penitsilliini sünteesis.
L-leutsiin- α-aminoisokaproonhape
H3C-CH-CH2-C-COOH
L-isoleutsiin- α-amino-β-etüül-β-metüülpropioonhape
H3C-CH2-CH-C-COOH
Mõlemad aminohapped lahustuvad vees halvasti. Valgud sisalduvad väikestes kogustes, mis on võimelised hüdrofoobseks koostoimeks. Need on kääritamise ajal fuselõlide allikaks.
L-Seriin- α-amino-β-hüdroksüpropioonhape
HO-CH2-C-COOH
See mängib olulist rolli iga organismi ainevahetuses. See on osa fosfolipiididest (fosfatidüülseriinidest), bradükiniini ja kallidiini polüpeptiididest, osaleb mõnede proteolüütiliste ensüümide aktiivse keskuse ehitamises, aminoalkoholi sfingosiini (sfingolipiidide komponendi) sünteesis. Mõned valgud, näiteks piimakaseiin või vitelliin munakollane, sisaldub estri kujul – nn seriinfosforhape, millel on oluline roll noore kasvava looma organismi ainevahetuses. Taimedel tekib see glütsiinist fotorespiratsiooni käigus.
L-treoniin- α-amino-β-hüdroksüvõihape
H3C-CH-C-COOH
Osaleb B12-vitamiini, antibiootikumi aktinomütsiin D sünteesis.
L-tsüsteiin- α-amino-β-merkaptopropioonhape
HS-CH2-C-COOH
Osaleb väävliallikana taimede ja loomade ainevahetuses ning ka sulfhüdrüül-SH-rühma olemasolu tõttu, mis on redutseerija. Tripeptiidis sisalduv glutatioon amiini kujul koensüümis A esineb paljude ensüümide aktiivses keskuses. Valkude ja peptiidide molekulides (insuliin, ACTH jne) osaleb disulfiidsidemete moodustamisel polüpeptiidahelate vahel või ühe ahela sees, seega on tal oluline roll valgu molekuli tertsiaarse struktuuri moodustamisel. See on ühend, mille kujul mõned mikroorganismid ja taimed metaboliseerivad vesiniksulfiidi. Kahest tsüsteiini molekulist, kui need on oksüdeeritud, saadakse tsüstiin. Vastupidine üleminek on sama lihtne. Nii moodustub elusorganismide üks olulisemaid redokssüsteeme.
Valkudes domineerib tsüstiin tsüsteiinist. Seda leidub suurtes kogustes karvade, sarvede ja kabja valkudes.
L-metioniin- α-amino-y-metüültiovõihape
H3C-S-CH2-CH2-C-COOH
Üks peamisi metüülrühmade doonoreid taimerakuseina süsivesikute, koliini, adrenaliini, kreatiini, steroolide ja väävliallika sünteesil tiamiini moodustumisel. Piimavalgus – kaseiinis on palju metioniini. Lipotroopse tegurina on ravimtoode ateroskleroosiga.
Diaminomonokarboksüülaminohapped.
L-lüsiin- α, ε-diaminokaproonhape
H2N-CH2-CH2-CH2-CH2-C-COOH
Seda leidub peaaegu kõigis valkudes, eriti kalapiimavalkudes, mis kuuluvad protamiinide ja histoonide hulka. See on alkaloidide (anabasiin, nikotiin, lupaniin, koniin) sünteesi lähteprodukt. Osaleb oma ε-aminorühmaga ensüümi valguosa ja koensüümi vahelise kompleksi moodustamisel, näiteks biotiinist sõltuvates ensüümides.
See sisaldub väikestes kogustes teraviljaseemnete, eriti maisi, valkudes, mis vähendab oluliselt viimase toiteomadusi.
L-arginiin- α-amino-δ-guanidüül-n-palderiinhape.
H2N-C-NH-CH2-CH2-CH2-C-COOH
Leidub kõigis valkudes. Sisaldub suurel hulgal põhiliste valkude-histoonide ja protamiinide koostises ning seetõttu leidub seda rohkelt kalapiimavalkudes. See mängib olulist rolli valkude metabolismis, osaledes uurea, kreatiini sünteesis. Selgrootute lihastes sisalduva fosfoarginiini kujul täidab see funktsiooni, mis sarnaneb kõrgemate loomade fosfokreatiini funktsiooniga.
Monoaminodikarboksüülaminohapped.
L-aknaragiinhape, aspartaat- α-aminomerevaikhape
HOOS-CH2-C-COOH
See lahustub vees halvasti, lahus on happeline. See sisaldub suurtes kogustes kõigis taimsetes valkudes ning mängib olulist rolli taimede ja loomade ainevahetuses, eriti osaledes transaminatsioonireaktsioonides, uurea, kreatiini ja tsüklopeptiidide moodustumisel. Selle dekarboksüülimisel tekib α- või β-alaniin, mis on vajalik karnosiini, anseriini ja koensüüm A (CoA) sünteesiks. Asparagiinhappe amiid - asparagiin koguneb väga suurtes kogustes kaunviljade seemnete idanemise ajal, eriti pimedas, süsivesikute puudumise või ammoniaagi ülejäägi tõttu. Asparagiini leidub vereplasmas ja mõnedes loomsetes valkudes (insuliin, hemoglobiin, müoglobiin jne). Inimestel ja loomadel osaleb asparagiin, nagu asparagiinhape, aktiivselt transamiinimisreaktsioonides, toimib puriini ja pürimidiini aluste, nikotiinhappe sünteesi eelkäijana ning on taimedes lämmastiku reserv- ja transpordivorm.
L-glutamiinhape- glutamaat, α-aminoglutaarhape
HOOS-CH2-CH2-C-COOH
Vesilahustes annab see happelise reaktsiooni. Seda leidub suurtes kogustes kõigis valkudes. Sisaldub foolhape, glutatioon. Koos asparagiinhape mängib peamist rolli aminohapete metabolismis, osaledes aktiivselt transamiinimise, deamineerimise, otsese amiinimise reaktsioonides. Glutamiinhappe dekarboksüleerimisel tekib γ-aminovõihape, millel on suur tähtsus aju metabolismis, tugevdades eelkõige inhibeerimisprotsesse, ja δ-aminolevuliinhapet, mis osaleb porfüriinide sünteesis. Glutamiinhappe amiid – glutamiin, on loomade ja taimede lämmastiku transpordivorm, algühend puriini- ja pürimidiini aluste sünteesil, nikotiinhape. Glutamiinhappe mononaatriumsool toimib maitseainena, millel on kanapuljongi maitse ja lõhn.
tsüklilised aminohapped.
L-fenüülalaniin- α-amino-β-fenüülpropioonhape
Leidub kõigis valkudes. Osaleb flavonoidide, alkaloidide biosünteesis. Omab hüdrofoobsete interaktsioonide võimet. Põhjustab ksantoproteiini reaktsiooni valkudele. Gramitsidiini molekuli ja antibiootikumi türotsidiini koostis sisaldab D-fenüülalaniini, mida looduses vabal kujul ei leidu.
L-türosiin- α-amino-β-hüdroksüfenüülpropioonhape
Üks levinumaid aminohappeid looduses; leidub kõigis valkudes, välja arvatud mõned protamiinid. See on hormoonide (türoksiin, norepinefriin, adrenaliin), alkaloidide (morfiin, kodeiin, papaveriin) sünteesi esialgne substraat. Türosiini oksüdatsioon türosinaasi mõjul põhjustab melaniinide (naha, juuste, sulgede pigment) moodustumist.
L-trüptofaan- α-amino-β-indolüülpropioonhape
Seda leidub peaaegu kõigis valkudes. Teravilja seemned on trüptofaanivaesed. Laguneb valkude happelise hüdrolüüsi käigus. Trüptofaan on nikotiinhappe (PP-vitamiin), heteroauksiini sünteesi algprodukt.
L-histidiin- α-amino-β-imidasoolpropioonhape
Kuulub aluseliste aminohapete rühma - vesilahustes annab leeliselise reaktsiooni. Märkimisväärne kogus histidiini leidub globiinis - valgu komponent vere hemoglobiin. Sisaldub mõnede proteolüütiliste ensüümide aktiivsetesse keskustesse.
L-proliin- pürrolidiin-a-karboksüülhape
On aminohape. Lahustame hästi alkoholis. Eriti kõrge on proliini sisaldus teravilja seemnevalkudes (proamiinides), kollageenis, elastiinis ja hambaemaili proteiinis. See on osa paljudest tsüklopeptiidantibiootikumidest - gramitsidiin, lihheniformiin, aktinomütsiin D.
L-hüdroksüproliin
On tuletis L-proliin. Märkimisväärsetes kogustes leidub seda rakuseina valkudes, želatiinis ja kollageenis.
Valgud ehk valgud on kõrgmolekulaarsed lämmastikku sisaldavad ühendid, mis koosnevad aminohapetest, mis on ahelas ühendatud peptiidsidemega. Valgud sünteesitakse aminohapetest ja muundatakse seedimisel aminohapeteks seedetrakti või katabolism organismis. Valkude funktsioonid elusorganismide rakkudes on väga mitmekesised – ühel või teisel viisil on nad seotud peaaegu kõigi organismi eluvaldkondadega.
Looduslikke aminohappeid on umbes 150, kuid sünteesi käigus elusorganismides kasutatakse enamasti 20 standardset aminohapet.
Toitumise osas jagunevad aminohapped asendamatuteks ja mitteolulisteks.
Asendamatud aminohapped ei sünteesita inimkehas ja neid tuleb varustada toiduga. Nende hulka kuuluvad üheksa aminohapet: valiin, leutsiin, isoleutsiin, treoniin, metioniin, lüsiin, fenüülalaniin, trüptofaan, histidiin. Histidiin on klassifitseeritud kui asendamatu aminohape ainult vastsündinutele. Kui nende aminohapete kogus toidus ei ole piisav, on inimorganismi normaalne areng ja talitlus häiritud.
Vahetatav nimetatakse aminohapeteks, mida keha saab teistest sünteesida mitteasendatavad aminohapped või asendamatute aminohapete lämmastik. Nende hulka kuuluvad ülejäänud 11 aminohapet.
Teatud kogus mitteasendamatuid aminohappeid peab tulema ka toidust, vastasel juhul kulub asendamatuid aminohappeid nende tekkeks. Ainult glutamiinhapet ja seriini peetakse metaboolselt täielikult asendatavateks.
Aminohapete liigitamine asendamatuteks ja mitteolulisteks ei ole samuti puudusteta, näiteks türosiin on asendamatu aminohape vaid piisava fenüülalaniinivaru korral. Arginiini sünteesitakse inimkehas ja seda peetakse asendamatuks aminohappeks, kuid selle metabolismi mõningate iseärasuste tõttu võib seda teatud keha füsioloogilistes tingimustes võrdsustada asendamatuga. Histidiini sünteesitakse ka inimkehas, kuid mitte alati piisavad kogused seetõttu tuleb seda võtta koos toiduga.
Kaasaegsed andmed näitavad, et asendamatute aminohapete biosüntees kogustes, mis vastavad täielikult keha vajadustele, on enamasti võimatu, seega tuleb meeles pidada, et asendamatud ja asendamatud aminohapped on keha valkude ehitamiseks võrdselt olulised.
Aminohapped, mis moodustavad keha- ja toiduvalgud
Valkude omadused määratakse aminohapete kogumi järgi, millest need koosnevad, aminohapete koguarvust ja järjestusest, milles need on omavahel seotud. Kombinatsioon 20 aminohappest, millest igaüks võib valguses esineda suvalise arvu kordi, võimaldab teil luua peaaegu piiramatu kogus ainulaadsed valgu molekulid. Inimkeha sisaldab vähemalt 30 000 erinevat valku ja ainuüksi maksas on üle 1000 ensüümvalgu.
Valkude funktsioonid
Valgud on kohustuslikud komponendid kõik elusrakud. Viiendik inimkehast koosneb valkudest. Valke leidub peaaegu kõigis elundites ja kudedes. Ainult uriin ja sapp ei sisalda tavaliselt valku. Pool kogu valku on lihastes, 1/5 - luudes ja kõhredes, 1/10 - nahas. Juuksed, nahk, küüned sisaldavad ka valku keratiini. See valk ei seedita ega imendu soolestikus.Valkude bioloogilised funktsioonid on äärmiselt mitmekesised. Valgud osalevad rakkude kasvus ja paljunemises. Nad täidavad katalüütilisi (ensüümid), reguleerivaid (hormoonid), struktuurseid (kollageen), kontraktiilseid (müosiin), transpordi (hemoglobiin, müoglobiin), kaitsvaid (immunoglobuliinid, interferoon), varu (albumiin) ja muid funktsioone. Valgud moodustavad bioloogilise aluse rakumembraanid- raku ja raku organellide kõige olulisem komponent.
Valkude osalusel normaalne vee tasakaalu organism, säilib normaalne keskkonna pH. Verevalgud tekitavad onkootilist survet, mis hoiab vedeliku sees veresooned ja takistab vedeliku kogunemist rakuvälisesse ruumi. Vereplasma valkude vähenemise korral ei tasakaalusta onkootiline rõhk osmootset rõhku, mis surub vedeliku veresoontest välja. See viib turse tekkeni (nn "näljane turse").
Toiduvalkude kvaliteedi hindamine
AT seedetrakt valgud lagundatakse aminohapeteks, mis imenduvad ja kasutatakse uute kehavalkude moodustamiseks või kasutatakse energia saamiseks või on aminohapped uute mitteasendamatute aminohapete moodustumise eelkäijad. Toiduvalgu kvaliteedi määrab selle olemasolu täielik komplekt asendamatuid aminohappeid teatud koguses ja teatud vahekorras asendamatute aminohapetega.Toiduvalgu kvaliteeti hinnatakse mitmete bioloogiliste ja keemiliste meetodite abil:
- Valgu bioloogilise väärtuse hindamine
Valgu (või valku sisaldava toidu) bioloogiline väärtus tähendab kehas omastatava lämmastiku osakaalu kogu seedetraktis imenduvast lämmastikust. Valkude bioloogilise väärtuse mõõtmisel lähtutakse sellest, et lämmastiku omastamine organismis on suurem piisava asendamatute aminohapete sisalduse korral toiduvalgus, mis on piisav organismi kasvu toetamiseks. - Valgu efektiivsuse suhe
Valgu efektiivsuse suhe põhineb eeldusel, et kasvavate loomade kehakaalu tõus on võrdeline tarbitud valgu kogusega. - Valkude aminohapete skoor
Aminohapete skoor on toidus sisalduva konkreetse asendamatu aminohappe ja "ideaalses" valgu aminohappes sisalduva aminohappe suhe. Aminohapete skoor arvutatakse, jagades konkreetse asendamatu aminohappe koguse toidus sama aminohappe kogusega ideaalses valgus. Saadud andmed korrutatakse seejärel 100-ga ja saadakse uuritava aminohappe aminohapete skoor."Ideaalse" valgu mõiste hõlmab ka hüpoteetilise kõrge valgu ideed toiteväärtus mis rahuldab täielikult inimkeha vajadused asendamatud aminohapped. Täiskasvanu jaoks kasutatakse "ideaalse" valguna FAO/WHO komitee aminohapete skaalat. Aminohapete skaala näitab iga asendamatu aminohappe sisaldust 100 g standardvalgus.
Liha, muna ja piima loomsed valgud on "ideaalsele" valgule kõige lähemal. Enamik taimseid valke sisaldab ebapiisav kogusüks või mitu asendamatut aminohapet. Näiteks teraviljavalgud ja nendest saadud tooted on lüsiini ja treoniini osas defektsed (piiratud). Paljude kaunviljade (erandiks on sojaoad ja oad) valgud on metioniini ja tsüsteiini osas piiratud (60-70% optimaalsest kogusest).
Kuumtöötlemise ajal või pikaajaline ladustamine osadest aminohapetest saadused, võivad tekkida organismi mitte omastatavad ühendid, s.t. aminohapped muutuvad "kättesaamatuks". See vähendab valgu väärtust.
Valkude toiteväärtust saab parandada (st suurendada bioloogiline väärtus või aminohapete skoor hapete piiramiseks), lisades piiravat aminohapet või lisades selle suurenenud sisaldusega komponenti või segades valke erinevate piiravate aminohapetega. Niisiis saab nisuvalgu bioloogilist väärtust suurendada, lisades 0,3-0,4% lüsiini, maisiproteiini - 0,4% maski ja 0,7% trüptofaani. Loomi sisaldavate segaroogade valmistamine ja taimsed tooted, aitab kaasa täisväärtuslike toiduvalgukompositsioonide tootmisele.
Valkude seedimine ja aminohapete imendumine
Kõik pikast aminohapete ahelast koosnevad toiduvalgud ei suuda seedetraktis imenduda. Need jagunevad vabadeks aminohapeteks või fragmentideks, mis koosnevad 2 või 3 aminohappest. Valkude lagunemist katalüüsivad spetsiifilised seedeensüümid – proteaasid. Valkude seeduvus ulatub 65%-st mõnede taimsete valkude puhul 97%-ni munavalgu puhul.Vabad aminohapped imenduvad vereringesse ja transporditakse organitesse ja kudedesse, eelkõige maksa. Suurim arv aminohapped püütakse kinni maksas, kus sünteesitakse vereplasma valgud ja spetsiifilised ensüümvalgud. Aminohapped, mis ei osale uute valgu molekulide biosünteesis, läbivad maksas deaminatsiooni, s.t. aminorühma kõrvaldamine. osalevad deaminatsiooniprotsessides. aktiivsed vormid vitamiin B6.
Keha vajadus valgu järele
Inimkehas ei ole valkude hoidmiseks suurt ladu. Osaliselt täidavad depoofunktsiooni vereplasma ja maksavalgud. Plasma albumiin toimib labiilse valgureservina ja see lõhustatakse, et tagada elutähtis aminohapete vajadus. Plasmaglobuliinid ei lõhustu isegi siis, kui albumiinivarud on ammendunud.
Loomad ja taimsed valgud imendub kehas erinevalt. Kui piima, piimatoodete, munade valgud seeditakse 96%, liha ja kala - 93-95%, siis leiva valgud - 62-86%, köögiviljade - 80%, kartulite ja mõnede kaunviljade valgud. 70%.
Nende toodete segu võib aga olla bioloogiliselt täiuslikum, kuna mõned valgud rikastuvad vastastikku teiste aminohapetega.
Valkude assimilatsiooni astet kehas mõjutab toiduainete saamise tehnoloogia ja nende kulinaarne töötlemine. Mõju analüüsimine mitmesugused toidutoorme ja -toodete töötlemisel (jahvatamine, temperatuur, kääritamine jne) neis sisalduvate valkude seeduvuse kohta tuleb tähele panna, et enamikus toiduainetööstustes ei toimu tehnoloogia järgimisel aminohapete lagunemist. . Toidu mõõduka kuumtöötlusega, eriti taimset päritolu, suureneb valkude seeduvus mõnevõrra, kuna valkude osaline denatureerimine hõlbustab proteaaside juurdepääsu peptiidsidemetele. Intensiivse kuumtöötlemise korral seeduvus väheneb. Praadimisel koos kooriku ja söestumisega hävib osa aminohappeid või väheneb valgu imendumine nendest roa või toote osadest.
Valguvajadus on valgu kogus, mis rahuldab kõik keha metaboolsed vajadused. See peab ühelt poolt arvesse võtma füsioloogiline seisund organism ning teiselt poolt toiduvalkude endi omadused ja dieetiüldiselt. Aminohapete seedimine, imendumine ja metaboolne kasutamine oleneb dieedi komponentide omadustest.
Valguvajadusel on kaks komponenti. Esimene peab rahuldama üldlämmastiku vajaduse, mis tagab asendamatute aminohapete ja muude lämmastikku sisaldavate endogeensete bioloogiliselt biosünteesi. toimeaineid. Tegelikult on üldlämmastiku vajadus valgu vajadus. Valguvajaduse teise komponendi määrab inimorganismi vajadus asendamatute aminohapete järele, mida kehas ei sünteesita. See on valguvajaduse spetsiifiline osa, mis sisaldub kvantitatiivselt esimeses komponendis, kuid hõlmab teatud kvaliteediga valgu tarbimist, s.t. üldlämmastiku kandjaks peaksid olema valgud, mis sisaldavad teatud koguses asendamatuid aminohappeid.
Vajadus asendamatute aminohapete järele erinevas vanuses mg/kg päevas
| Aminohappe | Lapsed varajane iga
(3-4 kuud) | Lapsed (alates kahest aastast) | Teismelised (10 aastat ja vanemad) |
täiskasvanud |
| Histidiin | 28 | - | - | 8-12 |
| Isoleutsiin | 70 | 31 | 28 | 10 |
| Leutsiin | 161 | 73 | 44 | 14 |
| Lüsiin | 103 | 64 | 44 | 14 |
| Metioniin + tsüsteiin | 58 | 27 | 22 | 13 |
| Fenüülalaniin + türosiin | 125 | 69 | 22 | 14 |
| Treoniin | 87 | 37 | 28 | 7 |
| trüptofaan | 17 | 12,5 | 3,3 | 3,5 |
| Valiin | 93 | 38 | 25 | 10 |
| Olulised aminohapped kokku | 714 | 352 | 216 | 84 |
1. Mis ained on bioloogilised polümeerid? Millised ained on monomeerid biopolümeeri molekulide moodustamiseks?
Bioloogilised polümeerid on: b) nukleiinhapped; c) polüsahhariidid; e) valgud.
Biopolümeeri molekulide ehitamiseks kasutatavad monomeerid on: a) aminohapped; d) nukleotiidid; e) monosahhariidid.
2. Millised funktsionaalrühmad on iseloomulikud kõikidele aminohapetele? Millised omadused neil rühmadel on?
Kõiki aminohappeid iseloomustab aluseliste omadustega aminorühma (–NH 2) ja happeliste omadustega karboksüülrühma (–COOH) olemasolu.
3. Mitu aminohapet osaleb looduslike valkude moodustumisel? Nimetage nende aminohapete ühised struktuuriomadused. Mille poolest need erinevad?
Looduslike valkude moodustumisel osaleb 20 aminohapet. Selliseid aminohappeid nimetatakse valke moodustavateks. Nende molekulides on karboksüülrühm ja aminorühm seotud sama süsinikuaatomiga. Selle põhjal on valke moodustavad aminohapped üksteisega sarnased.
Valke moodustavad aminohapped erinevad külgrühma (radikaali) koostise ja struktuuri poolest. See võib olla mittepolaarne või polaarne (neutraalne, happeline, aluseline), hüdrofoobne või hüdrofiilne, mis annab igale aminohappele erilised omadused.
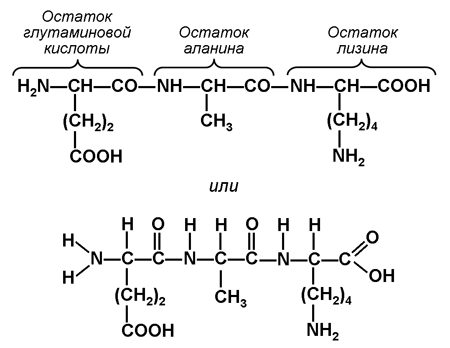
4. Kuidas on aminohapped polüpeptiidahelaks ühendatud? Ehitage dipeptiid ja tripeptiid. Ülesande täitmiseks kasutage struktuurivalemid aminohapped, mis on näidatud joonisel 6.
Ühe aminohappe aminorühm (–NH 2) suudab suhelda teise aminohappe karboksüülrühmaga (–COOH). Sel juhul vabaneb veemolekul ja aminorühma lämmastikuaatomi ja karboksüülrühma süsinikuaatomi vahele tekib peptiidside. Saadud molekul on dipeptiid, mille molekuli ühes otsas on vaba aminorühm ja teises otsas vaba karboksüülrühm. Tänu sellele võib dipeptiid enda külge siduda teisi aminohappeid, moodustades oligopeptiide. Kui sel viisil ühendada rohkem kui 10 aminohappejääki, moodustub polüpeptiid.
Dipeptiidi (näiteks Ala-Glu) struktuurivalemit võib esitada järgmiselt:
Tripeptiidi (näiteks Glu-Ala-Lys) struktuurivalemit võib esitada järgmiselt:
5. Kirjeldage tasemeid struktuurne korraldus valgud. Millised keemilised sidemed tekivad erinevad tasemed Valgumolekulide struktuurne korraldus?
Valgumolekulid võivad võtta erinevaid ruumilisi vorme, mis esindavad nende struktuurikorralduse nelja taset.
Peptiidsidemetega ühendatud aminohappejääkide ahel (lineaarne järjestus) on valgumolekuli esmane struktuur. Igal kehavalgul on ainulaadne esmane struktuur. Primaarstruktuuri alusel luuakse teist tüüpi struktuure, seega just esmane struktuur määrab valgu kuju, omadused ja funktsioonid.
Sekundaarne struktuur tekib vesiniksidemete moodustumisel polüpeptiidahela erinevate aminohappejääkide NH-rühmade vesinikuaatomite ja CO-rühmade hapnikuaatomite vahel.
Tertsiaarne struktuur moodustub vesiniku, ioonide, disulfiidsete (S-S sidemed tsüsteiini aminohappejääkide vahel) ja muude sidemete moodustumise tõttu, mis tekivad erinevad rühmad valgumolekuli aatomid vesikeskkonnas. Sel juhul sobib polüpeptiidheeliks omamoodi mähisesse (gloobulisse) nii, et hüdrofoobsed aminohapperadikaalid on sukeldatud gloobuli sisse, hüdrofiilsed aga asuvad pinnal ja interakteeruvad veemolekulidega.
Mõne valgu molekulide koostis sisaldab mitte ühte, vaid mitut polüpeptiidi, mis moodustavad ühe kompleksi. Nii moodustub kvaternaarne struktuur. Polüpeptiidid ei ole seotud kovalentsete sidemetega, kvaternaarse struktuuri tugevuse annab nõrkade molekulidevaheliste jõudude koostoime.
Seega on valgumolekuli esmane struktuur tingitud peptiidsidemete olemasolust aminohappejääkide vahel. sekundaarne struktuur stabiliseerida vesiniksidemeid, tertsiaarne - vesinik, ioonne, disulfiid jne, kvaternaarne - nõrk molekulidevaheline interaktsioon.
6. Inimene ja loomad saavad aminohappeid toidust. Millistest aminohapetest saab taimedes sünteesida?
Taimed on autotroofsed organismid. Nad sünteesivad aminohappeid fotosünteesi esmastest saadustest (mis omakorda moodustuvad süsinikdioksiid ja vesi) ja lämmastikku sisaldavad anorgaanilised ühendid (ammooniumioonid, nitraadiioonid). Seega on taimedes aminohapete sünteesi algaineteks CO 2, H 2 O, NH 4 + (NH 3), NO 3 -.
7. Mitu erinevat tripeptiidi saab ehitada kolmest aminohappemolekulist (näiteks alaniin, lüsiin ja glutamiinhape), kui iga aminohapet saab kasutada ainult üks kord? Kas neil peptiididel on samad omadused?
Valmistada saab kuus tripeptiidi: Ala-Liz-Glu, Ala-Glu-Liz, Liz-Ala-Glu, Liz-Glu-Ala, Glu-Ala-Liz ja Glu-Liz-Ala. Kõigil saadud peptiididel on erinevad omadused.
8. Valkude segu lahutamiseks komponentideks kasutatakse elektroforeesi meetodit: elektriväljas liiguvad üksikud valgumolekulid teatud kiirusega ühele elektroodidest. Sel juhul liiguvad mõned valgud katoodi poole, teised aga anoodi poole. Kuidas on valgumolekuli struktuur seotud selle võimega liikuda elektriväljas? Mis määrab valgumolekulide liikumissuuna? Mis määrab nende kiiruse?
Vesilahustes on valku moodustavad happeliste aminohapete radikaalid karboksüülrühmade dissotsiatsiooni tõttu negatiivselt laetud:
–COOH → –COO – + H +
Aluseliste aminohapete radikaalidel on positiivne laeng, mis on tingitud vesinikioonide (H +) lisamisest lämmastikuaatomitele, mis moodustavad need radikaalid:
–NH2 + H+ → NH3+
Polüpeptiidahela otstes paiknev karboksüülrühm ja aminorühm omandavad samuti laengu (vastavalt negatiivse ja positiivse). Nii et lahuses valgu molekul omab teatud kogulaengut, mis määrab selle liikumise elektriväljas.
Valgu molekuli laeng sõltub happeliste ja aluseliste aminohappejääkide vahekorrast. Kui valgus domineerivad happelised aminohappejäägid, siis on molekuli kogulaeng negatiivne ja see liigub anoodi (positiivselt laetud elektroodi) poole. Kui ülekaalus on aluseliste aminohapete jäägid, siis on molekuli kogulaeng positiivne ja valk liigub katoodi (negatiivse laenguga elektrood) suunas.
Liikumiskiirus sõltub eelkõige valgumolekuli laengu suurusest, selle massist ja ruumilisest konfiguratsioonist.






