Rasvade ja süsivesikute sarnased funktsioonid. Biokeemia: aine, ülesanded. Lipiidid, süsivesikud, valgud: struktuur, keemilised ja füüsikalis-keemilised omadused, klassifikatsioon, bioloogiline roll
Valgud (valgud, polüpeptiidid) on kõrgmolekulaarsed orgaanilised ained, mis koosnevad alfa-aminohapetest, mis on ahelas ühendatud peptiidsidemega. elusorganismides aminohapete koostis valgud määratakse geneetilise koodi järgi, enamasti kasutatakse sünteesil 20 standardset aminohapet. Paljud nende kombinatsioonid annavad valgu molekulidele väga erinevaid omadusi. Lisaks teevad valgu koostises olevad aminohapped sageli translatsioonijärgseid modifikatsioone, mis võivad tekkida nii enne, kui valk hakkab oma funktsiooni täitma, kui ka rakus "töötamise" ajal. Sageli moodustub elusorganismides mitu valgu molekuli keerulised kompleksid näiteks fotosünteesi kompleks. Valgud ehk valgud (kreeka keelest "protos" - "esimene") on looduslikud orgaanilised ühendid, mis tagavad mis tahes organismi kõik eluprotsessid.
Esmakordselt eraldas valgu (gluteeni kujul) 1728. aastal itaallane Jacopo Bartolomeo Beccari (1682-1766) nisujahust. Seda sündmust peetakse valgukeemia sünniks. Esimese valgu - insuliini - aminohappejärjestuse määramine valkude sekveneerimisega tõi Frederick Sangeri Nobeli preemia keemias 1958. aastal. Valkude hemoglobiini ja müoglobiini esimesed kolmemõõtmelised struktuurid said röntgendifraktsiooniga vastavalt Max Perutz ja John Kendrew 1958. aastal, mille eest said nad 1962. aastal Nobeli keemiaauhinna.
1.1 Organisatsiooni tasemed
Lisaks polüpeptiidi aminohappejärjestusele (esmastruktuur) on ülimalt oluline valgu tertsiaarne struktuur, mis tekib voltimise käigus (inglise keelest voltimine, “folding”). Tertsiaarne struktuur kujuneb struktuuride koosmõju tulemusena rohkem madalad tasemed. Valgu struktuuril on neli taset (vt joonis 1).
Joonis 1 – Valkude struktuuride tasemed
Esmane struktuur on aminohapete järjestus polüpeptiidahelas. Olulised omadused esmane struktuur on konservatiivsed motiivid - mängivad aminohapete kombinatsioonid võtmeroll valgu funktsioonides. Liigi evolutsiooni käigus säilivad konservatiivsed motiivid, mis võimaldavad sageli ennustada tundmatu valgu funktsiooni.
Primaarstruktuur - polüpeptiidahelas peptiidsidemetega üksteisega seotud aminohapete arv ja järjestus
Sekundaarne struktuur on polüpeptiidahela fragmendi lokaalne järjestus, mis on stabiliseeritud vesiniksidemetega. Allpool on kõige levinumad tüübid sekundaarsed struktuurid s valgud:
- α-heeliksid - tihedad pöörded ümber molekuli pikitelje, üks pööre on 3,6 aminohappejääki ja spiraali samm on 0,54 nm (seega on 0,15 nm aminohappejäägi kohta), heeliksit stabiliseerib vesinik sidemed H ja O peptiidrühmade vahel, mis on eraldatud 4 ühikuga. Heeliks on ehitatud ainult ühte tüüpi aminohapete stereoisomeeridest (L). Kuigi see võib olla kas vasaku- või paremakäeline, on valkudes ülekaalus paremakäelised. Spiraal puruneb glutamiinhappe, lüsiini, arginiini elektrostaatilise interaktsiooni tõttu. Lähedal asuvad asparagiini, seriini, treoniini ja leutsiini jäägid võivad steeriliselt segada heeliksi teket, proliini jäägid põhjustavad ahela paindumist ja lõhuvad ka α-heeliksid;
– β-lehed (volditud kihid) – mitu siksakilist polüpeptiidahelad, milles vesiniksidemed moodustuvad üksteisest suhteliselt kaugel (0,347 nm aminohappejäägi kohta) esmane struktuur aminohapped või erinevad valguahelad ja mitte tihedalt asetsevad, nagu α-heeliksi puhul. Need ahelad on tavaliselt suunatud koos nende N-terminalidega vastasküljed(antiparalleelne orientatsioon). β-lehtede tekkeks on olulised aminohapete kõrvalrühmade väikesed suurused, tavaliselt on ülekaalus glütsiin ja alaniin;
– π-heeliksid;
– 310-spiraalid;
on järjestamata killud.
Igal valgul on lisaks esmasele struktuurile ka teatud sekundaarne struktuur. Tavaliselt sarnaneb valgu molekul venitatud vedruga.
Tertsiaarne struktuur - ruumiline struktuur polüpeptiidahel (valgu moodustavate aatomite ruumiliste koordinaatide kogum). Struktuurselt koosneb sekundaarstruktuuri elementidest, stabiliseeritud erinevat tüüpi interaktsioonid, milles hüdrofoobsed interaktsioonid mängivad otsustavat rolli. Tertsiaarse struktuuri stabiliseerimisel osalevad:
- kovalentsed sidemed (kahe tsüsteiinijäägi vahel - disulfiidsillad);
– ioonsidemed aminohappejääkide vastaslaenguga külgrühmade vahel;
– vesiniksidemed;
– hüdrofiilsed-hüdrofoobsed koostoimed. Suheldes ümbritsevate veemolekulidega, "kipub" valgumolekul kokku kõverduma, nii et aminohapete mittepolaarsed külgrühmad eraldatakse vesilahusest; molekuli pinnale ilmuvad polaarsed hüdrofiilsed kõrvalrühmad.
Polüpeptiidahelad volditakse spetsiaalsel viisil kompaktseks gloobuliks. Globulaarsete valkude polüpeptiidahelate voltimise viisi nimetatakse tertsiaarseks struktuuriks.
Kvaternaarne struktuur (või allüksus, domeen) - vastastikune kokkulepe mitu polüpeptiidahelat ühe valgukompleksi osana. valgu molekulid, mis on osa kvaternaarse struktuuriga valgust, moodustuvad ribosoomidel eraldi ja alles pärast sünteesi lõppu moodustavad ühise supramolekulaarse struktuuri. Kvaternaarse struktuuriga valk võib sisaldada nii identseid kui ka erinevaid polüpeptiidahelaid. Kvaternaarse struktuuri stabiliseerimisel osalevad samad interaktsioonitüübid kui tertsiaarstruktuuri stabiliseerimisel. Supramolekulaarsed valgukompleksid võivad koosneda kümnetest molekulidest. Paljud valgud koos spetsiaalse keeruline struktuur koosneb mitmest polüpeptiidahelast. Nende polüpeptiidahelate pakendamise ja kokkuvoldimise viisi nimetatakse valgu kvaternaarseks struktuuriks.
1.2 Füüsikalised omadused
Valgud on amfoteersed elektrolüüdid. Söötme teatud pH väärtuse korral on positiivsete ja negatiivsete laengute arv valgu molekulis sama. Valkudel on mitmesugused struktuurid. On valke, mis ei lahustu vees, ja on valke, mis lahustuvad vees kergesti. On valke, mis näevad välja nagu filamendid, ulatudes sadade nanomeetriteni; on valke, mille kuju on vaid 5-7 nm läbimõõduga pallikesed. Neil on suur molekulmass (104-107). Need moodustavad kolloidseid lahuseid, millest sadestuvad anorgaaniliste soolade kontsentratsiooni suurenemisel, raskmetallide soolade, orgaaniliste lahustite lisamisel või kuumutamisel (denatureerimine).
1.3 Denatureerimine
Üldiselt säilitavad valgud oma struktuuri ja seega ka füüsikalis-keemilisi omadusi, nagu lahustuvus sellistes tingimustes nagu temperatuur ja pH, millega organism on kohanenud. Nende tingimuste muutmine, nagu valgu kuumutamine või töötlemine happe või leelisega, viib valgu kvaternaarsete, tertsiaarsete ja sekundaarsete struktuuride kadumiseni. Valgu (või muu biopolümeeri) struktuuri kadumist nimetatakse denaturatsiooniks. Denaturatsioon võib olla täielik või osaline, pöörduv või pöördumatu. Enamik kuulus juhtum pöördumatu valkude denaturatsioon igapäevaelus on preparaat kana muna mõju all olles kõrge temperatuur vees lahustuv läbipaistev valk ovalbumiin muutub tihedaks, lahustumatuks ja läbipaistmatuks. Denatureerimine on mõnel juhul pöörduv, nagu vees lahustuvate valkude ammooniumisooladega sadestamise (sadestamise) korral, ja seda kasutatakse puhastusmeetodina. Denaturatsioon on valkude loomulike omaduste kadumine nende molekulide ruumilise struktuuri rikkumise tõttu.
1.4 Biuree reaktsioon
Biureedi reaktsioon on kvalitatiivne kõikide valkude jaoks ilma eranditeta, samuti nende mittetäieliku hüdrolüüsi saaduste jaoks, mis sisaldavad vähemalt kahte peptiidsidet. Biureedi reaktsioon tuleneb peptiidsidemete olemasolust valkudes, mis aluselises keskkonnas moodustavad vask(II)sulfaadiga värvilisi vasesoolalaadseid komplekse. Biureedi reaktsiooni annavad ka mõned mittevalgulised ained, nagu biureet (NH2-CO-NH-CONH2), oksamiid (NH2CO-CO-NH2), mitmed aminohapped (histidiin, seriin, treoniin, asparagiin) ( vaata joonist 2).
Joonis 2 – biuree reaktsioon
1.5 Valkude funktsioonid
Nagu teisedki bioloogilised makromolekulid (polüsahhariidid, lipiidid) ja nukleiinhapped, on valgud kõigi elusorganismide vajalikud komponendid, nad osalevad enamikes raku eluprotsessides. Valgud viivad läbi ainevahetust ja energiamuutusi. Valgud on osa rakustruktuuridest - organellidest, mis erituvad rakuvälisesse ruumi rakkudevahelise signaalivahetuse, toidu hüdrolüüsi ja rakkudevahelise aine moodustamise eesmärgil.
Tuleb märkida, et valkude klassifitseerimine nende funktsiooni järgi on üsna meelevaldne, sest eukarüootides võib sama valk täita mitmeid funktsioone. Sellise multifunktsionaalsuse hästi uuritud näide on lüsüül-tRNA süntetaas, ensüüm aminoatsüül-tRNA süntetaaside klassist, mis mitte ainult ei seo lüsiini tRNA-ga, vaid reguleerib ka mitmete geenide transkriptsiooni. Valgud täidavad oma ensümaatilise aktiivsuse tõttu paljusid funktsioone. Niisiis, ensüümid on motoorne valk müosiin, proteiinkinaasi reguleerivad valgud, transportvalk naatrium-kaalium adenosiintrifosfataas jne.
katalüütiline funktsioon. Valkude tuntuim roll organismis on erinevate keemiliste reaktsioonide katalüüs. Ensüümid on spetsiifiliste katalüütiliste omadustega valkude rühm, st iga ensüüm katalüüsib ühte või mitut sarnast reaktsiooni. Ensüümid katalüüsivad lõhustamisreaktsioone komplekssed molekulid(katabolism) ja nende süntees (anabolism), samuti DNA replikatsioon ja parandamine ning RNA matriitsi süntees. Tuntud on mitu tuhat ensüümi; nende hulgas, nagu näiteks pepsiin, lagundavad seedimise käigus valke. Translatsioonijärgse modifikatsiooni käigus lisavad või eemaldavad mõned ensüümid teiste valkude keemilisi rühmi. Teada on umbes 4000 valkude katalüüsitud reaktsiooni. Reaktsiooni kiirenemine ensümaatilise katalüüsi tulemusena on mõnikord tohutu: näiteks ensüümi orotaatkarboksülaasi poolt katalüüsitav reaktsioon kulgeb 1017 korda kiiremini kui katalüüsimata reaktsioon (78 miljonit aastat ilma ensüümita, 18 millisekundit ensüüm). Molekule, mis kinnituvad ensüümi külge ja muutuvad reaktsiooni tulemusena, nimetatakse substraatideks.
Kuigi ensüümid koosnevad tavaliselt sadadest aminohapetest, interakteeruvad substraadiga vaid väike osa neist ja veelgi väiksem arv – keskmiselt 3-4 aminohapet, mis asuvad sageli primaarses aminohappejärjestuses üksteisest kaugel – on otseselt seotud. katalüüsis. Ensüümi osa, mis kinnitab substraadi ja sisaldab katalüütilisi aminohappeid, nimetatakse ensüümi aktiivseks saidiks.
transpordifunktsioon. Väikeste molekulide transpordis osalevatel lahustuvatel valkudel peaks olema kõrge afiinsus (afiinsus) substraadi suhtes, kui seda esineb suures kontsentratsioonis, ja seda on lihtne vabastada madala substraadikontsentratsiooniga kohtades. Transpordivalkude näide on hemoglobiin, mis kannab kopsudest hapnikku teistesse kudedesse ja süsihappegaasi kudedest kopsudesse, samuti sellega homoloogseid valke, mida leidub kõigis elusorganismide kuningriikides.
Mõned membraanivalgud osalevad väikeste molekulide transportimisel läbi rakumembraani, muutes selle läbilaskvust. Membraani lipiidkomponent on veekindel (hüdrofoobne), mis takistab polaarsete või laetud (ioonide) molekulide difusiooni. Membraani transpordivalgud liigitatakse tavaliselt kanalivalkudeks ja kandevalkudeks. Valgukanalid sisaldavad sisemisi veega täidetud poore, mis võimaldavad ioonidel (ioonkanalite kaudu) või veemolekulidel (akvaporiinide kaudu) liikuda läbi membraani. Paljud ioonkanalid on spetsialiseerunud ainult ühe iooni transportimiseks; seega eristavad kaaliumi- ja naatriumikanalid sageli neid sarnaseid ioone ja lasevad neist läbi ainult ühe. Kandjavalgud seovad sarnaselt ensüümidega iga molekuli või iooni, mida nad kannavad, ja erinevalt kanalitest saavad nad ATP energiat kasutades aktiivselt transportida. Membraani transpordivalkudele võib omistada ka "raku jõujaama" - ATP süntaasi, mis teostab prootoni gradiendi tõttu ATP sünteesi.
kaitsefunktsioon. Neid on mitut tüüpi kaitsefunktsioonid valgud:
– füüsiline kaitse. Selles osaleb kollageen - valk, mis moodustab sidekudede (sealhulgas luud, kõhred, kõõlused ja naha sügavad kihid (dermis)) rakkudevahelise aine aluse; keratiin, mis moodustab sarvjas kilpide, juuste, sulgede, sarvede ja muude epidermise derivaatide aluse. Tavaliselt peetakse selliseid valke struktuurse funktsiooniga valkudeks. Selle valkude rühma näideteks on fibrinogeenid ja trombiinid, mis osalevad vere hüübimises;
- keemiline kaitse. Toksiinide seondumine valgu molekulidega võib tagada nende detoksifitseerimise. Eriti oluline roll maksaensüümid mängivad inimestel mürgitust, lõhustades mürke või muutes need lahustuvaks vormiks, mis aitab kaasa nende kiirele eemaldamisele organismist;
- immuunkaitse. Vere ja muude bioloogiliste vedelike moodustavad valgud osalevad organismi kaitsereaktsioonis nii patogeenide kahjustuste kui ka rünnakute korral. Komplemendisüsteemi valgud ja antikehad (immunoglobuliinid) kuuluvad teise rühma valkude hulka; need neutraliseerivad baktereid, viirusi või võõrvalke. Antikehad, mis on osa adaptiivsest immuunsussüsteem, liituge tulnukaga antud organism aineid, antigeene ja seeläbi neutraliseerida, suunates need hävimispaikadesse. Antikehad võivad erituda rakkudevahelisse ruumi või kinnituda spetsiaalsete B-lümfotsüütide membraanidele, mida nimetatakse plasmarakkudeks. Kuigi ensüümidel on substraadi suhtes piiratud afiinsus, kuna liiga tugev kinnitumine substraadiga võib segada katalüüsitud reaktsiooni, ei ole antikeha antigeeniga seondumise püsivusel mingeid piiranguid.
struktuurne funktsioon. Tsütoskeleti struktuurvalgud, nagu omamoodi armatuur, annavad kuju rakkudele ja paljudele organellidele ning osalevad rakkude kuju muutmises. Enamus struktuursed valgud on filamentsed valgud: näiteks aktiini ja tubuliini monomeerid on kerakujulised lahustuvad valgud, kuid pärast polümerisatsiooni moodustavad pikad filamentid, millest moodustub tsütoskelett, mis võimaldab rakul oma kuju säilitada. Kollageen ja elastiin on rakkudevahelise aine põhikomponendid sidekoe(näiteks kõhred) ning juuksed, küüned, linnusuled ja mõned kestad koosnevad teisest struktuurvalgust, keratiinist.
Hormonaalne (signaal) funktsioon. Valkude signaalimisfunktsioon on valkude võime toimida signaalainetena, edastades signaale rakkude, kudede, elundite ja erinevate organismide vahel. Signaalfunktsiooni kombineeritakse sageli reguleeriva funktsiooniga, kuna paljud rakusisesed regulaatorvalgud teostavad ka signaaliülekannet. äratusfunktsioon teostada valke-hormoone, tsütokiine, kasvufaktoreid jne.
Hormoone kantakse veres. Enamik loomseid hormoone on valgud või peptiidid. Hormooni seondumine retseptoriga on signaal, mis käivitab rakus vastuse. Hormoonid reguleerivad ainete kontsentratsiooni veres ja rakkudes, kasvu, paljunemist ja muid protsesse. Selliste valkude näide on insuliin, mis reguleerib glükoosi kontsentratsiooni veres.
Rakud suhtlevad üksteisega, kasutades rakkudevahelise aine kaudu edastatavaid signaalvalke. Selliste valkude hulka kuuluvad näiteks tsütokiinid ja kasvufaktorid.
Tsütokiinid on väikesed peptiidi infomolekulid. Need reguleerivad rakkudevahelisi interaktsioone, määravad nende ellujäämise, stimuleerivad või pärsivad kasvu, diferentseerumist, funktsionaalset aktiivsust ja apoptoosi, tagavad immuun-, endokriin- ja immuunsüsteemi toimimise koordineerimise. närvisüsteemid. Tsütokiinide näide on kasvaja nekroosifaktor, mis edastab põletikulisi signaale keharakkude vahel.
toitumisfunktsioon. Nende valkude hulka kuuluvad nn varuvalgud, mis salvestuvad energia- ja aineallikana taimeseemnetes ja loomamunades; tertsiaarsete munakoorte valgud (ovalbumiinid) ja peamine piimavalk (kaseiin) täidavad samuti peamiselt toitumisfunktsiooni. Organismis kasutatakse aminohapete allikana mitmeid teisi valke, mis omakorda on bioloogilised prekursorid. toimeaineid ainevahetusprotsesside reguleerimine.
Mootori (mootori) funktsioon. Terve klass motoorseid valke tagab keha liikumise, näiteks lihaste kokkutõmbumise, sealhulgas liikumise (müosiin), rakkude liikumise kehas (näiteks leukotsüütide amööboidne liikumine), ripsmete ja lipulite liikumist, samuti aktiivset ja suunatud rakusisene transport (kinesiin, düneiin). Dyneiinid ja kinesiinid transpordivad molekule mööda mikrotuubuleid, kasutades energiaallikana ATP hüdrolüüsi. Dyneiinid transpordivad molekule ja organelle raku perifeersetest osadest tsentrosoomi suunas, kinesiinid - vastassuunas. Dyneiinid vastutavad ka ripsmete ja lippide liikumise eest eukarüootides. Müosiini tsütoplasmaatilised variandid võivad osaleda molekulide ja organellide transpordis läbi mikrofilamentide.
1.6 Valgu struktuur
Valgumolekulid on lineaarsed polümeerid, mis koosnevad α-L-aminohapetest (mis on monomeerid) ja mõnel juhul modifitseeritud aluselistest aminohapetest (kuigi modifikatsioonid toimuvad pärast valgusünteesi ribosoomil). Teaduskirjanduses kasutatakse aminohapete tähistamiseks ühe- või kolmetähelisi lühendeid. Kuigi esmapilgul võib tunduda, et "ainult" 20 tüüpi aminohapete kasutamine enamikus valkudes piirab valgustruktuuride mitmekesisust, ei saa tegelikult valikute arvu üle hinnata: vaid 5 aminohappest koosneva ahela puhul see on juba üle 3 miljoni ja 100 aminohappe ahelat (väike valk) saab esitada rohkem kui 10^130 variandina. Valke, mille pikkus on 2 kuni mitukümmend aminohappejääki, nimetatakse sageli peptiidideks, kõrgema polümerisatsiooniastmega valkudeks, kuigi see jagunemine on väga tingimuslik. Valgu moodustumisel tekivad ühe aminohappe α-aminorühma (-NH2) ja teise aminohappe α-karboksüülrühma (COOH) interaktsiooni tulemusena peptiidsidemed. Valgu otsi nimetatakse C- ja N-otsateks (olenevalt sellest, kumb terminaalsetest aminohapperühmadest on vaba: vastavalt -COOH või -NH2). Kui valk sünteesitakse ribosoomil, kinnituvad uued aminohapped C-otsa, mistõttu peptiidi või valgu nimi antakse aminohappejääkide loetlemisel alates N-otsast.
Aminohapete järjestus valgus vastab antud valgu geenis sisalduvale informatsioonile. See teave esitatakse nukleotiidide järjestuse kujul ja üks aminohape vastab kolmest nukleotiidist koosnevale järjestusele DNA-s - nn tripletile või koodonile. See, milline aminohape mRNA antud koodonile vastab, määrab geneetiline kood, mis võib inimeseti veidi erineda. erinevad organismid. Valkude süntees ribosoomidel toimub reeglina 20 aminohappest, mida nimetatakse standardseks. Erinevates organismides on DNA-s aminohappeid kodeerivaid kolmikuid 61–63 (st võimalike kolmikute arvust (4³ = 64) lahutatakse stoppkoodonite arv (13). Seetõttu muutub võimalikuks, et enamik aminohappeid happeid võivad kodeerida erinevad kolmikud. Siis jah, geneetiline kood võib olla üleliigne või muul juhul taandarenenud.Lõpuks tõestati see mutatsioonide analüüsi käigus tehtud katses.Erinevaid aminohappeid kodeeriv geneetiline kood on erineva degeneratsiooniastmega ( kodeeritud 1 kuni 6 koodonit), sõltub see selle aminohappe esinemissagedusest valkudes, välja arvatud arginiin. Sageli ei ole kolmandal positsioonil olev alus spetsiifilisuse jaoks hädavajalik, see tähendab, et üks aminohape võib olla esindatud nelja koodoni võrra, mis erinevad ainult kolmanda aluse poolest. Mõnikord on erinevus puriini eelistamises pürimidiinile. Seda nimetatakse kolmanda aluse degeneratsiooniks.
Selline kolme koodoni kood töötati välja evolutsiooni alguses. Kuid erinevatel evolutsioonietappidel ilmnenud organismide erinevuste olemasolu näitab, et see ei olnud alati nii. Homoloogsetel valkudel (eeldatavasti ühise evolutsioonilise päritoluga ja sageli sama funktsiooni täitvatel), näiteks erinevate organismide hemoglobiinidel, on ahelas paljudes kohtades identsed, konserveerunud aminohappejäägid. Mujal on erinevaid aminohappejääke, mida nimetatakse varieeruvateks. Vastavalt homoloogia astmele (aminohappejärjestuse sarnasus) on võimalik hinnata evolutsioonilist kaugust taksonite vahel, millesse võrreldavad organismid kuuluvad.
1. Valkude struktuur.
2. Süsivesikute struktuur.
3. Lipiidide struktuur.
1. Valkude struktuur.
Valgud on orgaanilised ühendid, mis koosnevad peptiidsidemetega seotud aminohapetest. Aminohapped on karboksüülhapped, mis sisaldavad samal süsinikuaatomil paiknevaid amino- ja karboksüülrühmi.Valkude hulka kuulub 22 aminohapet, mis jagunevad kõrvalahela omaduste järgi 4 rühma: hüdrofoobsed,
hüdrofiilne mitteioonne, hüdrofiilne negatiivse laenguga ja hüdrofiilne positiivse laenguga.
I. hüdrofoobsed aminohapped.



Glütsiin. Alaniin Valiin Leutsiin

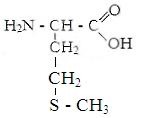


Isoleutsiin Metioniin Tsüstiin Fenüülalaniin

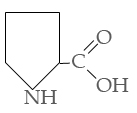
Trüptofaani proliin
II hüdrofiilsed mitteioonsed aminohapped.

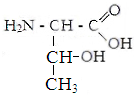


Seriin Treoniin Asparagiin Glutamiin

Oksüproliin
III. hüdrofiilsed aminohapped koos jääkidega α-D- glükopüranoos.




Asparagiin-glutamiin-tsüsteiin-türosiin
happeline hape
IV. hüdrofiilsed aminohapped positiivselt laetud radikaaliga.
![]()
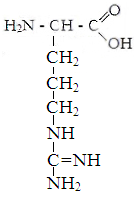

Lüsiin Arginiin Histidiin
Valkude füüsikalis-keemilised omadused.
Valgumolekuli pinnal paiknevad asparagiini, glutamiinhapete, türosiini ja tsüstiini radikaalid, dissotsieerudes vesinikiooniks, annavad sellele negatiivse laengu. Hüdroksüüliooniks dissotsieeruvad lüsiini, arginiini ja histidiini radikaalid, vastupidi, annavad valgu molekulile positiivse laengu. Enamikul valkudel on molekuli kohta rohkem negatiivseid laenguid. Laengu tõttu tõrjuvad nad üksteist ega kleepu kokku konglomeraatideks. Ühtekuuluvust takistab ka valgumolekuli ümber olev vesikiht.
Nõrgalt happelises keskkonnas pidurdub osa negatiivselt laetud aminohapperadikaalide dissotsiatsioon, võrreldakse positiivsete ja negatiivsete laengute arvu, valgu molekulid muutuvad elektriliselt neutraalseks ning kleepuvad kokku konglomeraatideks ja sadestuvad. Nende kleepumist soodustab ka kuumutamine, mis viib veekesta kadumiseni. PH väärtust, mille juures valgumolekul muutub elektriliselt neutraalseks, nimetatakse valgu isoelektriliseks punktiks.
Valkude klassifikatsioon. Valgud jagunevad lihtsateks, mis koosnevad ainult aminohapetest (albumiinid, globuliinid, proamiinid, gluteliinid, protamiinid, histoonid ja proteinoidid) ja kompleksseteks, mis koosnevad valgulisest ja mittevalgulisest osast. Kromoproteiinides võib mittevalguline osa olla värviline aine (näiteks heem hemoglobiinis), lipoproteiinides lipiidosa, glükoproteiinides, heteropolüsahhariid, fosfoproteiinides, fosforhape, nukleoproteiinides, DNA või RNA. Nukleiinhapped koosnevad nukleotiididest. Viimased koosnevad lämmastiku alusest, puriinist (adeniin ja guaniin) või pürimidiinist [tsütosiin, tümiin (DNA-s) või uratsiil (RNA-s)], desoksüriboos (DNA-s) või riboos (RNA-s) ja fosforhape. Allpool on näidatud nukleotiidi kokkupanek adeniinist, desoksüriboosist ja fosforhappest.

DNA molekul koosneb neljast nukleotiidist6 desoksüadenosiinmonofosfaadist (dAMP), desoksüguanosiinmonofosfaadist (dGMP), desoksütsütidiinmonofosfaadist (dCMP) ja desoksütümidiinmonofosfaadist (dTMP). Nukleotiidid on omavahel seotud fosfodiestersideme kaudu desoksüriboosi teise süsinikuaatomi ja külgneva nukleotiidi fosforhappe vahel, nagu on näidatud dAMP-st, dGMP-st, dCMP-st ja dTMP-st koosneva DNA fragmendi valemis.

Struktuur ja bioloogiline roll süsivesikuid.
Süsivesikud on polüoksükarbonüülühendid, mis oma olemuselt on aldo- või ketoalkoholid või nende derivaadid. Keemilise struktuuri järgi on: 1) monosahhariidid (riboos, desoksüriboos, glükoos, galaktoos, fruktoos jne); 2) oligoshariidid (sahharoos, maltoos, laktoos jne); 3) homoposahhariidid (glükogeen, tärklis, kiudained jne) ja heteroplsahhariidid (hüaluroonhape, kondroitiinväävelhape, kerataansulfaat jne).
1. Monosahhariidid.

D-desoksüriboosi muundumine α-D- desoksüribofuranoos.
D-glükoosi muundamine α-D- glükopüranoos 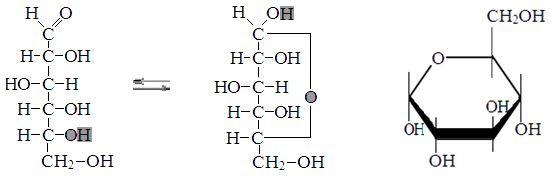
D-glükoosi muundamine α-D- glükopüranoos

D-glükoosi muundamine β-D- glükopüranoos

D-glükoosi muundamine β-D- glükopüranoos

D-fruktoosi muundamine β-D- fruktofuranoos
2. Oligisahhariidid

Maltoos
Laktoos 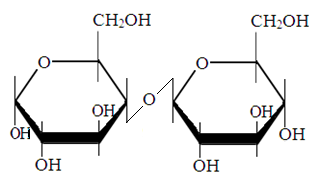

sahharoos.
3. Homolisahhariidid

Tselluloos, koosneb jääkainetest β-D- glükopüranoos.

Tärklis, koosneb jääkainetest α-D- glükopüranoos.
![]()

Hüaluroon- ja kondroitiinväävelhapped, heteropolüsahhariidide komponendid.
Süsivesikute bioloogiline roll.
Süsivesikud on kehas peamine energiamaterjal. Kui 1 g glükoosi oksüdeeritakse, vabaneb 4,1 kcal. Süsivesikud on lipiidide oksüdatsiooni jaoks hädavajalikud. Glükogeen ja tärklis on varuenergia materjalid.
Riboos on osa RNA, ATP, NAD, FAD, vitamiini B 12 ja teiste ainete nukleotiididest ning desoksüriboos on osa DNA-st.
Süsivesikud on plastikmaterjali allikas triglütseriidide, kolesterooli, mitteasendatavad aminohapped ja muud ained.
Heteropolüsahhariidid on glükoproteiinide mittevalguline osa, mis osaleb paljudes protsessides: sidekoe moodustumine, immuunvastuse kujunemine, vere hüübimine jne.
Loeng nr 2
Vitamiinid: nomenklatuur, klassifikatsioon, bioloogiline roll.
1. Vitamiinide klassifikatsioon.
2. Hüpovitaminoos
3. Rasvlahustuvad vitamiinid.
4. Veeslahustuvad vitamiinid.
5. Vitamiinilaadsed ained.
vitamiinid- madala molekulmassiga orgaanilised ühendid, mis on vajalikud keha eluks, kuid mida selles ei sünteesita või sünteesitakse ebapiisavates kogustes ja mida saadakse seetõttu väikestes kogustes koos toiduga või seedesüsteemi organites asuvatest mikroorganismidest.
Veel 1880. aastal oli N.I. Lunin tõestas, et lisaks valkudele, süsivesikutele, lipiididele, veele ja mineraalidele vajab organism lisaaineid. K. Funk eraldas ühe neist ainetest riisikliidest, vitamiini B 1, mis sisaldas aminorühma. Seetõttu tegi ta ettepaneku nimetada neid aineid vitamiinideks (vita – elu). Siis selgus, et kõik vitamiinid ei sisalda aminorühma.
Vitamiinide klassifikatsioon . Need jagunevad 2 rühma: rasvlahustuvad ja vees lahustuvad. Igal vitamiinil on 3 nimetust: täht, kliiniline ja keemiline. On mitmeid vitamiinitaolisi aineid, mis ei sobi mõnele mõistele "vitamiinid". Vitamiinide tarbimise puudumisel areneb avitaminoos ja vähenenud tarbimise korral hüpovitaminoos. Teatud vitamiinide (A, D jne) liigse tarbimise korral on võimalik hüpervitaminoos.
Hüpovitaminoosi põhjused .
A. Eksogeenne hüpovitaminoos areneb, kui:
1) teatud toiduainete puudumine: värsked köögiviljad, liha, rasvad jne;
2) vitamiinide kadu säilitamisel, toiduainete töötlemisel, toiduvalmistamisel jne.
B. Endogeenne hüpovitaminoos areneb, kui:
1) ebapiisavalt efektiivne vitamiinide tarbimine soolestikust selle põletiku ajal, samuti sapphapete sissevõtmise rikkumise tõttu maksapatoloogia ja sapiteede ummistumise korral, mis põhjustab soolte hüdrolüüsi ja imendumise vähenemist. lipiidid koos neis lahustunud vitamiinidega;
2) seedetrakti mikroorganismide hukkumine kõrge kontsentreeritud söödaga toitmisel, antibiootikumidega ravimisel ja muudel põhjustel;
3) vitamiinide transpordi rikkumine veres koos teatud valkude sisalduse vähenemisega selles;
4) provitamiinide vitamiinideks muundamise rikkumine ebapiisava ultraviolettkiirgusega, seda muundamist teostavate ensüümide puudumine;
5) antivitamiinide sattumine organismi.
rasvlahustuvad vitamiinid.
A-vitamiin (antikseroftalmiline); retinool.

A-vitamiini bioloogiline roll:
1. See on bioloogiliste membraanide komponent, soodustab nende süsivesikute-valgu komplekside biosünteesi, stabiliseerib rakkude, eriti epiteeli, struktuuri ja toetab nende barjäärifunktsiooni.
2. Omab antioksüdantseid omadusi.
3. Reguleerib kasvu, kudede diferentseerumist, organismi kui terviku, eriti noorloomade organismi arengut.
4. Toetab immuunsüsteemi talitlust.
5. See on osa võrkkesta koonuste ja varraste rodopsiinist (visuaalne lilla). Valguse toimel jagatakse rodopsiin valguks opsiiniks ja retinaldehüüdiks (A-vitamiini derivaat), mis viib valgusimpulsi tekkeni.
igapäevane vajadus (inimesele) - 2,3 mg.
A-vitamiini rikkad toidud : tursamaksaõli, maks, piimatooted, munakollane Looma kehas lõhustatakse karoteen karoteenaasi toimel A-vitamiiniks.
Hüpovitaminoosi A ilmingud :
Selle esimesed ilmingud on nägemise halvenemine pimedas (ööpimedus). Keha kasv ja areng aeglustuvad. Vähendatud immuunsus. Epiteeli barjäärifunktsiooni rikkumise tõttu on kahjustatud pisarajuhad, pisar ei liigu silma sarvkestale ja see pehmeneb (kseroftalmia). Mõjutatud on ka hingamisteede, urogenitaaltrakti, naha ja muude struktuuride epiteel, mis põhjustab nende põletikku.
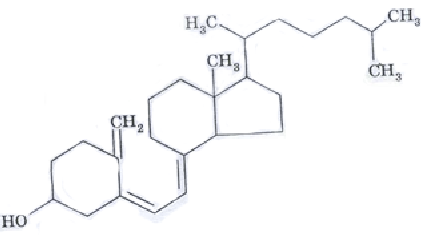
D-vitamiinid(anti-rachitic); kaltsiferoolid (ergokaltsiferool ja kolekaltsiferool) Neist esimese eelkäija on ergosterool, mis pärast ultraviolettkiirtega kiiritamist muutub ergokaltsiferooliks (vitamiin D 2). Nahk sisaldab teist provitamiini D, mis pärast ultraviolettkiirtega kokkupuudet muudetakse samuti kolekaltsiferooliks (vitamiin D 3). Mõlemad vitamiinid sisenevad maksa, kus nende 25. süsinikuaatom läbib hüdroksüülimise 25-hüdroksülaasi toimel, ja seejärel neerudesse. Viimases hüdroksüleeritakse 1-hüdroksülaasi toimel ka esimene süsinikuaatom ja tekivad 1,25-dihüdrokaltsiferoolid, millel on bioloogiline aktiivsus. Kell ebapiisav tegevus 25- ja 1-hüdroksülaas arendab D-resistentset rahhiidi.
igapäevane vajadus (inimestel) - 10-25 mcg.
D-vitamiini bioloogiline roll:
1) on peensoole seina Ca ++ -siduva valgu komponent, mis osaleb selle iooni neeldumises;
2) soodustavad kaltsiumi- ja fosfaadiioonide reabsorptsiooni (reabsorptsiooni) neerutuubulitest;
3) aktiveerib leeliselise fosfataasi.
Tänu sellele säilitavad nad veres püsiva kaltsiumi- ja fosfaadiioonide kontsentratsiooni, aidates kaasa mineraliseerumisele. luukoe.
D-vitamiini rikkad toidud: kalaõli, maks, taimeõlid, piimatooted, pärm, munakollane jne.
Hüpovitaminoosi D ilming noortel loomadel - rahhiit. Kaltsiumi- ja fosfaadiioonide kontsentratsiooni vähenemise tõttu veres on häiritud nende varustamine luukoega. Luud pehmenevad (osteoporoos) ja jäsemed painduvad keha raskuse all. Fontanellid kasvavad üle hilinemisega, hambad puhkevad, keha kasv ja areng on häiritud.
E vitamiinid(antisteriilne); tokoferoolid. Metüülrühmade paigutus benseenitsüklis on üksteisest erinev. Sünteesiti K-vitamiini vikasooli vees lahustuv analoog. Antivitamiin K – dikumariini – kasutatakse vere hüübimise suurendamiseks.
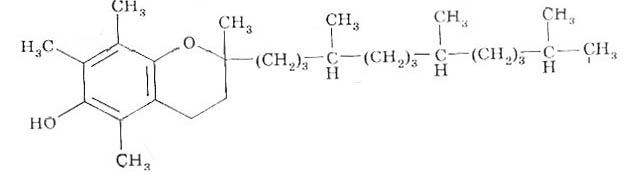
bioloogiline roll.
1. Need on antioksüdandid (takistavad peroksiidide moodustumist raku membraanistruktuurides). Raku ja selle organellide membraanidesse kinnitunud tokoferoolid katavad oma hüdrofoobse külgahelaga küllastumata kaksiksidemed. rasvhapped membraani fosfolipiidid reaktiivsetest hapnikuliikidest. Sel juhul inaktiveeritakse viimased, reageerides tokoferooli kromanoolitsükliga. Saadud E-vitamiini oksüdeeritud vorm redutseeritakse askorbiinhappe toimel. Saadud dehüdroaskorbaat redutseeritakse glutatiooniga, glutamiinhappest, tsüsteiinist ja glütsiinist koosneva tripertiidiga, tagasi askorbaadiks. Vesinikuioonide doonoriks on tsüsteiini SH-rühm.
2. Osaleda redoksprotsessides, mis toimuvad mitokondrite hingamisahelas, kreatiini muundamisel kreatiinfosfaadiks, geenides transkriptsiooni käigus jne.
Tänu nendele omadustele toetavad tokoferoolid erinevate organite, aga eriti reproduktiivsüsteemi rakkude ehitust ja talitlust, mis on kahjustuste suhtes väga tundlikud. Nad toetavad spermatogeneesi, munaraku moodustumist, aitavad kaasa selle viljastamisele, raseduse arengule, selle kulgemisele. Seetõttu nimetatakse vitamiine E antisteriilseks.
igapäevane vajadus (inimestel) - 5 mg.
E-vitamiini rikkad toidud: astelpajuseemned, teravili, või ja taimeõlid, maks, liha, kapsas, mahlane sööt jne.
Hüpovitaminoosi ilmingud
Isastel tekivad munandites degeneratiivsed muutused, spermatogenees on häiritud, tekivad spermatosoidid, mis ei ole võimelised rakku viljastama. AT rasked juhtumid areneb munandite atroofia, millele järgneb seksuaalomaduste halvenemine.
Emasloomadel on munatootmine häiritud. Kui toimub selle viljastumine, embrüogenees, siis ei pruugi loode sündida, ilmnevad raseduse katkemised.
Lihaskiudude redoksprotsesside rikkumise tõttu toimub müofibrillide degeneratsioon. Kreatiini ebaefektiivse muundamise tõttu kreatiinfosfaadiks pärineb see lihaskiud veres (hüperkreatineemia) ja uriiniga (kretinuuria). Seda täheldatakse hobuste ja veiste lihasdüstroofia korral.
K rühma vitamiinid(antihemorraagiline): fülokinoon (K1-vitamiin) ja menakinoon (K2-vitamiin). Nende struktuur põhineb 1,4-naftokinooni tsüklil ja isopreeni kõrvalahelal.

Bioloogiline roll
Nad osalevad vere hüübimisprotsessides, olles ensüümide koensüümid, mis muudavad inaktiivsed vere hüübimisfaktorid aktiivseteks: protrombiin trombiiniks, prokonvertiin konvertiiniks, fibrinogeen fibriiniks. Nende tegurite aktiveerimise protsessis muundatakse nende koostises sisalduv glutamiinhape γ-karboksüglutamiinhappeks.
igapäevane vajadus (inimestel) - 10-15 mg.
K-vitamiini toidud: nõges, maks, kapsas, juurvili, mahlane sööt jne. K-vitamiini moodustavad seedetrakti mikroorganismid.
Hüpovitaminoosi K ilmingud mao-, soole-, emaka- ja muud verejooksud.
Vees lahustuvad vitamiinid
B-vitamiin 1 (antineuriitiline); tiamiin sisaldab oma koostises pürimidiini ja tiosooli tsükleid. See on tiamiindifosfaadi (TDP) biosünteesi eelkäija: tiamiin + ATP Tiaminkinaas TDF + AMP.

Bioloogiline roll
TDF on üks viiest polüensüümi komplekse moodustavast koensüümist, mis eemaldab samaaegselt vesiniku ja süsinikdioksiidi ioone püroviinamarihappest (püruvaatdehüdrogenaas; aeroobne glükolüüsi reaktsioon) ja α-ketoglutaarhappest (α-ketoglutaraadi dehüdrogenaas; Krebsi tsükli reaktsioon). TDP on ka transketolaasi koensüüm.
igapäevane vajadus (inimestel) - 1,5-2 mg.
B-vitamiini rikkad toidud 1 : teraviljad, tatar, kaunviljad, maks, liha jne.
Hüpovitaminoosi B ilmingud 1 :
1. Püruvaatdehüdrogenaasi reaktsiooni pärssimine, mis viib püruviinhappe kuhjumiseni närvikoesse. See kahjustab närvitüvesid, arendab nende põletikku – polüneuriiti. Samuti väheneb atsetüül-CoA tootmine, mis toob kaasa energia- ja plastmaterjali nappuse;
2. Viimase puudumist soodustab ka pentoositsükli oksüdatiivse haru võtmeensüümi transketolaasi aktiivsuse pärssimine;
3. Tiamiinist sõltuva aneemia teke on võimalik, kuna TDF osaleb vereloomes;
B-vitamiin 2 (kasvufaktor); riboflaviin põhineb selle struktuuril
isoalloksasiini tsükkel. See on koensüümide flaviin mononukleotiidi (FMN) ja flaviinadeniini dinukleotiidi (FAD) biosünteesi eelkäija.

Bioloogiline roll:
1. FMN on mitokondriaalse hingamisahela ühe ensüümi koensüüm.
2. FAD, nagu TDP, on üks viiest koensüümist, mis moodustavad püruvaatdehüdrogenaasi ja α-ketoglutaraatdehüdrogenaasi polüensüümi kompleksid, mis eemaldab samaaegselt vesinikioone ja süsinikdioksiid vastavalt püruviinhape (aeroobne glükolüüsi reaktsioon) ja α-ketoglutaarhape (Krebsi tsükli reaktsioon).
3. FAD on atsüül-CoA dehüdrogenaasi (rasvhapete β-oksüdatsiooniensüüm), glutatioondisulfiidi redutseeriva glutatioonreduktaasi ja teiste ensüümide koensüüm.
igapäevane vajadus (inimestel) - 1,7 mg.
2 : teraviljad, munad, maks, liha, köögiviljad, mahlane sööt jne.
Hüpovitaminoosi B ilmingud 2 :
1. Glükolüüsireaktsioonide, Krebsi tsükli, mitokondrite hingamisahela funktsiooni pärssimine viib ATP tootmise, biosünteesiprotsesside efektiivsuse vähenemiseni, millele järgneb noorloomade kasvu ja arengu rikkumine, rakkude aktiivsuse vähenemine. keha resistentsus patogeensete tegurite suhtes. 2. Plastmaterjali vähesuse tõttu on sageli häiritud hemoglobiini biosüntees, tekib aneemia.
3. Sageli arendada vaskularisatsiooni, põletikku silmamuna, sarvkest (keratiit), läätse hägustumine (katarakt).
B-vitamiin 3 (antidermatiit); pantoteenhape koosneb 2,4-dihüdroksü-3,3-dimetüülvõihappest ja β-alaniinist, mis on omavahel seotud peptiidside. See on koensüümi HS-koensüüm A (CoA) biosünteesi eelkäija.
AGA - CH 2 - C ---- CH - CO -NH - CH 2 -CH 2 - COOH
2,4-dioksü-3,3-dimetüül- β-a l a n i n
võihape
Bioloogiline roll
1. CoA, nagu FAD ja TDP, on üks viiest koensüümist, mis moodustavad püruvaatdehüdrogenaasi ja α-ketoglutaraatdehüdrogenaasi polüensüümi kompleksid, mis eemaldab samaaegselt vastavalt vesinikioone ja süsinikdioksiidi püruviinhappest (aeroobne glükolüüsi reaktsioon) ja α- ketoglutaarhapped (reaktsioon Krebsi tsükkel).
2. Olles aktiveeritud rasvhapete ja muude hapete (atsüül-CoA) koostisosa, osaleb CoA nende oksüdatsioonireaktsioonides.
3. Atsetüül-CoA ja teiste aktiveeritud orgaaniliste hapete osana osaleb CoA paljude ainete (rasvhapped, atsüülglütseroolid, kolesterool, steroidhormoonid, gemma jne) biosünteesis.
igapäevane vajadus (inimestel) - 3-5 mg.
B-vitamiini rikkad toidud 3 : maks, pärm ja paljud teised toidud.
Hüpovitaminoosi B ilmingud 3 :
Põletik nahka(dermatiit) ja juuste väljalangemine
(alopeetsia);
Südame, neerude, mao, neerupealiste jt kahjustused
siseorganid;
Ajukoe kahjustus, mille tagajärjeks on
liikumise koordineerimine.
B-vitamiin 5 (PP; anti-pellagric); nikotiinhape ja nikotiinamiid põhinevad püridiini tsüklil. See on koensüümide NAD ja NADP biosünteesi eelkäija.
Bioloogiline roll
NAD ja NADP on enam kui 50 glükolüüsi, rasvhapete β-oksüdatsiooni, glutamaadi oksüdatiivse deaminatsiooni, Krebsi tsükli, mitokondriaalse hingamisahela, pentoositsükli jne dehüdrogenaasi koensüümid.
igapäevane vajadus (inimestel) - 18 mg.
B-vitamiini rikkad toidud 2 : maks, liha, teraviljad, kartul, juurviljad, mahlane sööt, pärm ja muud toiduained.
Hüpovitaminoosi B ilming 5 - pellagra. Tema märgid:
1) põletik liblika kujul avatud nahapiirkondades (dermatiit);
2) Seedesüsteemi kudede kahjustused: vähenenud happesusega gastriit, soolekahjustus, verine kõhulahtisus (diarröa);
3) Närvirakkude kahjustus ja ajufunktsiooni kahjustus.
B-vitamiin 6 (antidermatiit); püridoksiin, püridoksamiin ja püridoksaal põhinevad samuti püridiini tsüklil. See on koensüümi püridoksaalfosfaadi (PP) biosünteesi eelkäija.

Bioloogiline roll :
PF on aminohapete metabolismi ensüümide koensüüm: aminotransferaasid (aspartaataminotransferaas, alaniinaminotransferaas jt), dekarboksülaasid (glutamaatdekarboksülaas, histidiindekarboksülaas jt). Selle roll on suur väävlit sisaldavate aminohapete metabolismis, heemi sünteesis aminolevuliinhappest, püridoksiini trüptofaanist jne.
igapäevane vajadus (inimestel) - 2 mg.
B-vitamiini rikkad toidud 6 : maks, teravilja terad, pärm jne.
Hüpovitaminoosi B ilming 5 :
1) epiteelkoe kahjustused: pellagralaadne dermatiit, silma limaskestade, suuõõne, neelu jne põletik;
2) kesknärvisüsteemi talitlushäired - epilepsiahood;
3) väävlit sisaldavate aminohapete metabolismi vaheproduktide ilmumine uriinis: homotsüsteiin ja tsüstaatioon.
B-vitamiin 12 (aneemiavastane); kobalamiin sisaldab oma koostises koobaltit, mis on seotud nelja pürroolitsükli lämmastikuaatomitega, riboosijääke, fosforhapet ja muid radikaale. Kobalamiin on kahe koensüümi biosünteesi eelkäija: metüül kobalamiin (CH 3 -vitamiin B 12) ja desoksüadenosüül kobalamiin (desoksüadenosüül-vitamiin B 12).
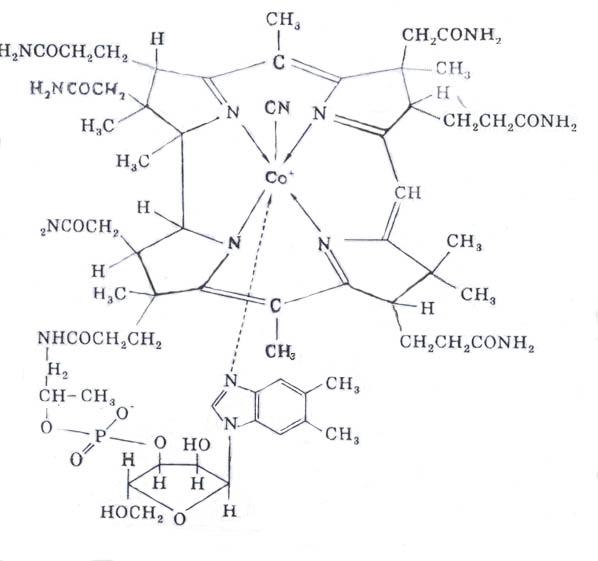
Bioloogiline roll vitamiin B 12
1. Metüülkobalamiin on ensüümide koensüüm, mis katalüüsib rühmade -CH 3 ja teiste ühe süsiniku radikaalide ülekandmise reaktsioone ühest ainest teise, näiteks metüültetrahüdrofoolhappest (CH 3 -THFC) homotsüsteiiniks (metioniini reaktsioon). biosüntees):
CH3-THFK + homotsüsteiin Tetrahüdropteroüülglutamaat- Metioniin + THFA
metüültransferaas
kobalamiin
2. Deoksüadenosüülkobalamiin on osa isomerisatsioonireaktsioone katalüüsivatest ensüümidest. Niisiis, aminohapete valiini, isoleutsiini ja treoniini, aga ka propioonhappe metabolismi käigus, mis tekkis mäletsejaliste kiudainete lagunemisel mikroorganismide poolt, tekib sama lõpptoode, metüülmalonüül-CoA. Viimane siseneb isomerisatsioonireaktsiooni, mida katalüüsib S-metüülmalonüül-CoA-mutaas, mille koensüümiks on desoksüadenosüülkobalamiin:
Metüülmalonüül-CoA S -metüülmalonüül-CoA-mutaas suktsinüül-CoA
Deoksüadenosüülkobalamiin
3. Kobalamiini derivaadid aitavad kaasa nukleiinhapete biosünteesile, osaledes desoksüriboosi, tümiini nukleotiidide ja muude ainete moodustumisel, eriti vereloomeorganites.
igapäevane vajadus (inimestel) - 3 mcg. Mäletsejalistel rahuldab see seedetrakti mikrofloora aktiivsust.
B-vitamiini rikkad toidud 12 : veisemaks, liha, kala, munad. Soolestikus imendumiseks peab kobalamiin astuma kompleksi maos toodetud gastromukoproteiiniga. Mäletsejalistel täielikult ja teistel loomadel osaliselt rahuldatakse B12-vitamiini vajadus tänu seedetrakti mikrofloora aktiivsusele.
Hüpovitaminoosi B ilming 12 :
1. Mäletsejaliste väga kontsentreeritud söötmisel on häiritud B 12 -vitamiini tootva mikrofloora aktiivsus, mis ei põhjusta mitte ainult metüülmalonüül-CoA suktsinüül-CoA-ks muutumise pärssimist, millele järgneb ketoatsidoos, vaid ka metioniini ja teiste lipotroopsete ainete puudus, mis aitab kaasa atsüülglütseroolide kogunemisele maksas.
2. Mao patoloogia korral on häiritud gastromukoproteiini tootmine, mis põhjustab vitamiini B 12 imendumise halvenemist, järgnevat nukleiinhapete biosünteesi pärssimist vereloomeorganites ja aneemia teket.
3. Metüülmalonüül-CoA akumuleerumine ajukoes viib selle osalemiseni malonüül-CoA asemel rasvhapete biosünteesi reaktsioonides. See viib hargnenud ahelaga rasvhapete moodustumiseni, mis aitab kaasa närvikiudude müeliinkestade struktuuri rikkumisele.
B-vitamiin Koos(aneemiavastane); foolhape sisaldab pteridiinitsüklit (1), mis on seotud p-aminobensoehappe (2) ja glutamiinhappega (3).

Bioloogiline roll :
Foolhape on metüül- (-CH3), metüleen- (-CH2-), metenüül- (-CH \u003d), formüül- (-CH) ja formimiinrühmade ülekandes osalevate transferaaside koensüümide biosünteesi eelkäija.
(-CH=NH). Need ensüümid osalevad puriini nukleotiidide, koliini, aminohapete seriini, metioniini, glütsiini ja teiste ainete biosünteesis.
igapäevane vajadus (inimestel) - 0,1 mg.
B-vitamiini rikkad toidud 12 : taimelehed, pärm, lutsernijahu, sojajahu, kartul jne.
Hüpovitaminoos B Koos areneb defitsiidi korral foolhape söödas malabsorptsioon soolestikus koos selle patoloogiaga. See väljendub aneemias, leukotsüütide sisalduse vähenemises veres, kasvu, arengu ja looma produktiivsuse vähenemises. Rasketel juhtudel on võimalik kaela ja jäsemete halvatus.
C-vitamiin(antikorbutikum); C-vitamiin . See on vitamiin ainult inimestele, Aafrika ahvidele ja merisigadele. Teistel loomadel on see sünteesitav, kuid patoloogiliste seisundite korral võib see puududa. Struktuuriliselt on askorbiinhape sorbitoolalkoholi derivaat - 2,3-dienool-guloonhappe laktoon.
eraldab kaks vesinikiooni, mis on seotud teise ja kolmanda süsinikuaatomiga, muutudes dehüdroaskorbaadiks.
Bioloogiline roll :askorbiinhape
1. On antioksüdant. Rakkude vesifaasis interakteerub see aktiivsete hapniku metaboliitidega, inaktiveerides neid. Rakkude lipiidfaasis taastab see glutatioondisulfiidi, mis tekkis tokoferüülkinooni redutseerimisel glutatiooniga või viimase koostoimel aktiivsete hapniku metaboliitidega.
2. Toetab mitokondriaalse hingamisahela talitlust, kandes vesinikioone üle tsütokroomidele või hapnikumolekulile.
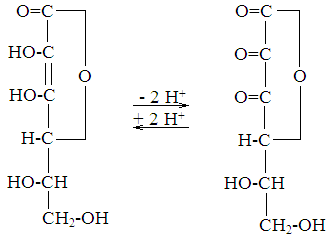
askorbiindehüdroaskorbino-
hape
3. Soodustab sidekoe küpsemist, osaledes proliini hüdroksüülimise reaktsioonides hüdroksüproliiniks ja lüsiini oksülüsiiniks.
4. Osaleb teistes hüdroksüülimisreaktsioonides, mis on seotud türosiini katabolismiga türoksiiniks, melaniiniks, dopamiiniks, norepinefriiniks ja adrenaliiniks, sidekoe rakkudevahelise aine glükoproteiinide biosünteesis, steroidhormoonid, sapphapped ja muud ained.
igapäevane vajadus (inimestel) - 100 mg.
B-vitamiini rikkad toidud 12 : puuviljad, marjad, värsked köögiviljad, kibuvitsamarjad jne.
Askorbiinhappe puudumise ilming kehas
Sideaine rakkudevahelise aine biosünteesi rikkumise tõttu
kude muudab basaalmembraani struktuuri veresooned, mis põhjustab verejooksu suurenemist, mitmete täpsete hemorraagiate (petehhiate) ilmnemist.
Luukoe orgaanilise maatriksi sünteesi rikkumine viib
selle haprus, sagedased luumurrud, lõualuude alveoolide struktuuri nõrgenemine, hammaste kaotus nendest.
3. Antioksüdantide süsteemi talitluse pärssimine toob kaasa organismi vastupanuvõime vähenemise patogeensetele teguritele, loomade produktiivsuse languse ja nende toimimisaja lühenemise.
P-vitamiin(kapillaare tugevdav); bioflavonoidid (flavonool, rutiin, kvertsetiin, eriodiktiin, hesperidiin jt) on ainete rühm, mis on üles ehitatud kromooni või flavaani difenüülpropaani tsükli alusel.

Bioloogiline roll :
1. Sidekoe rakkudevahelise aine koostis sisaldab heteropolüsahhariidi hüaluroonhapet. Rutiin pärsib hüaluronidaasi, mis lagundab seda, stabiliseerides sidekoest ehitatud struktuure.
2. Koos askorbiinhape, millega ta on funktsionaalselt tihedalt seotud, rutiin reguleerib redoksprotsesse, on antioksüdant.
P-vitamiini rikkad toidud: värsked köögiviljad, puuviljad, tee.
Hüpovitaminoosi P ilming:
1) veresoonte suurenenud läbilaskvus, kudede hemorraagia, verejooks;
2) Keha vastupanuvõime vähenemine patogeensete tegurite suhtes, üldine nõrkus, valu jäsemetes.
Vitamiinitaolised ained on samuti vajalikud keha eluks, kuid ei vasta mõne märgi puhul mõistele "vitamiinid".
Koliin oma struktuuris on see aminoetüülalkohol, mis sisaldab lämmastikuaatomi juures kolme metüülrühma: HO-CH2 - CH2 -N≡ (CH 3) 3
Koliini bioloogiline roll.
1. See on osa fosfatidüülkoliinist (letsitiin), mis on rakumembraani struktuuride komponent. Osaledes selle fosfoglütseriidi biosünteesis, soodustab koliin atsüülglütseroolide vabanemist maksast, takistades rasvade infiltratsiooni sellesse elundisse.
2. Metüülrühmade doonorina osaleb metioniini, adrenaliini, kreatiini ja teiste ainete biosünteesis.
3. See on osa atsetüülkoliinist, mis edastab närvirakust impulsi.
Koliini allikad rakkudes.
Osaliselt saavad loomad koliini koos loomse ja taimse toiduga ning osaliselt - endogeense sünteesi tõttu: aminohappe seriini dekarboksüülimine, millele järgneb saadud etanoolamiini metüülimine. Metüülrühmade doonoriteks võivad olla metionium, foolhape ja vitamiin B 12.
Koliini puudumise ilming kehas: maksa rasvainfiltratsioon, neerude hemorraagiline degeneratsioon, ebapiisavalt efektiivsest akceleriini sünteesist tingitud vere hüübimise häired jne.
Inositool(inositool) on oma struktuurilt tsükliline kuueliikmeline alkohol.
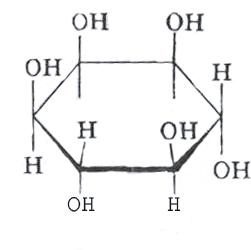
Bioloogiline roll :
1. See on fosfatidüülinositoolfosfoglütseriidi komponent, millest fosfolipaas D katalüüsitud reaktsiooni tulemusena eraldub inositool-1,4,5-trifosfaat, mis on sekundaarne vahendaja insuliini, paratüreoidhormooni, türokaltsitoniini toimel. ja teised bioloogiliselt aktiivsed ained toimivad rakkudele;
2. Omab lipotroopset toimet, takistab rasvade infiltratsiooni maksa;
3. reguleerib soolestiku motoorikat, osmootset rõhku spermatosoidides, rasvhapete oksüdatsiooni, amülaasi aktiivsust jne.
Inositoolirikkad toidud: nisuidud, apelsinid, rohelised herned. Seda palju ja loomsetes toodetes: maks, liha, piim.
Inositooli puuduse ilming kõige enam hiirtel ja rottidel. Seda väljendatakse kasvu ja arengu peatumises, rasvade infiltratsioonis maksa koos kolesterooli ladestumisega.
koensüümK(ubikinooni) keemiline struktuur on 2,3-dimetoksü-5-metüül-1,4-bensokinoon, mille isopreeni ahel on kuuendal positsioonil.
![]()
Ubikinooni bioloogiline roll : on mitokondriaalse hingamisahela oluline komponent, mis viib elektronide ülekande membraanidehüdrogenaasidest tsütokroomidele.
Ubikinooni allikad rakkudes.
Loomaorganism saab seda ainet erinevate söötadega ja osaliselt endogeense biosünteesi tulemusena mevaloonhappest ning fenüülalaniini ja türosiini ainevahetusproduktidest.
Ubikinooni puuduse ilming kehas . See seisund areneb, kui kehasse siseneb ebapiisav kogus toitu, valkude rikas. See viib aneemia tekkeni, mis ei ole tavapäraste vahenditega ravitav, kuid ubikinooniga ravitav. Viimase puudumine võib põhjustada lihasdüstroofiat ja kardiovaskulaarset puudulikkust.
H-vitamiin(antidermatiit); biotiin.
Selle molekul koosneb imidasooli- ja tiofeenitsüklitest. Viimasele lisatakse ülejäänud palderjanhape.
H2C CH- (CH2)4-COOH
Biotiin
Bioloogiline roll biotiin :
Sellest ainest, sidudes seda aminohappe lüsiini ε-aminorühmaga, moodustub H-vitamiini koensümaatiline vorm, mis on osa karboksülaasist, mis katalüüsib kahte reaktsioonirühma: a) toimub ATP (atsetüül) osalusel. -CoA-, propionüül-CoA- ja püruvaatkarboksülaas); b) jätkamine ilma ATP (metüülmalonüül-CoA-karboksülaas jne) osaluseta. Seetõttu osaleb biotiin aktiivselt rasvhapete, puriini nukleotiidide ja muude ainete biosünteesis.
igapäevane vajadus (inimestel) - 0,25 mg.
Biotiini allikad rakkudes : taimsed (kartul, kaunviljad, spinat, tomatid jne) ja loomsed saadused (maks, neerud, munakollane, piim jne). Loomadel on biotiini võimeline tootma seedetrakti mikrofloora.
Biotiini puuduse ilming kehas: söögiisu vähenemine, unisus, aneemia, lihasvalu, dermatiit, millega kaasneb rasunäärmete suurenenud talitlus, juuste väljalangemine jne.
lipoehape; 1,2-ditiolaan-3-palderiinhape. See esineb oksüdeeritud (-S-S-) ja redutseeritud (-SH) kujul, mis võimaldab tal täita koensüümi funktsiooni.
H 2 CCH– (CH 2) 4 - COOH
S ------- S
Lipoehape
Bioloogiline roll lipoehape: on osa mitme ensüümi kompleksidest, mis teostavad vesiniku ja süsinikdioksiidi ioonide samaaegset elimineerimist (oksüdatiivne dekarboksüülimine) püroviinamari- ja α-ketoglutaarhappest.
Lipoehappe puudumise ilming kehas - " püruvism", mis väljendub püroviinamari- ja teiste ketohapete suurenenud kontsentratsioonis veres, metaboolne atsidoos, lihasspasmid, ja rasketel juhtudel - polüneuriidi korral.
VitamiinU(haavandivastane faktor); metüülmetioniin
HOOC-CH-CH2-CH2-S+
Bioloogiline roll metüülmetioniin:
1) on positiivne mõju mao- ja sooltehaavanditega, stimuleerides nende elundite epiteeli taastumist;
2) biogeense amiini histamiini metüülimine metüülhistamiiniks, soodustab selle eritumist organismist;
3) nagu metioniin, on ta metüülrühmade doonor koliini, kreatiini ja teiste ainete biosünteesis;
4) aitab eemaldada organismist liigset kolesterooli.
Metüülmetioniini sisaldavad toidud: värske kapsas, petersell ja naeris, roheline tee, banaanid, tomatid jne.
Metüülmetioniini puudumise ilming kehas - mao- ja peensoolehaavandite teke.
B-vitamiin 15 (pangaamhape) on glükoonhappe ja dimetüülglütsiini ester: COOH
(H-C-OH) 4 CH3
CH2-O-CO-CH2-N
Pangamiinhappe bioloogiline roll:
1) osaleb metüülrühmade allikana koliini, metioniini ja kreatiini biosünteesis ning on seetõttu lipotroopsete omadustega;
2) võtab osa kudede hingamise protsessidest, valkude biosünteesist, neerupealiste tööst.
Pangamiinhapperikkad toidud: taimeseemned, pärm, maks jne.
Pangamiinhappe puudumise ilming:
1) rasvade infiltratsioon maksas;
2) hapnikunälg.
p-aminobensoehape vajalik mikroorganismide ja loomade eluks.

P-aminobensoehappe bioloogiline roll:
1) vitamiini foolhappe osana osaleb ta reaktsioonides, milles osaleb temast sünteesitav koensüüm tetrahüdrofoolhape: nukleiinhapete süntees jne.
2) osaledes türosiinist pärineva melaniini pigmendi biosünteesis, see aitab kaasa naha, villa, sulgede jne pigmentatsioonile.
P-aminobensoehappe rikkad toidud: nisuidud, kartul, pärm, liha, maks, loomade neerud jne.
Meditsiinis ja veterinaarmeditsiinis kasutatakse p-aminobensoehappe sulfoonamiidide analooge. Viimased asendavad struktuurse sarnasuse tõttu konkureerivalt p-aminobensoehapet mikroorganismide ensüümides, millele järgneb paljunemise peatumine.
Vitamiin F ; küllastumata rasvhapped. F-vitamiini omadused on oleiinhapped (C 17 H 33 -COOH), linoolhapped (C 17 H 31 -COOH), linoleenhapped (C 17 H 29 -COOH) ja arahhidoonhapped (C 19 H 31 -COOH).
Küllastumata rasvhapete bioloogiline roll:
1) on osa bioloogiliste rakumembraanide fosfolipiididest. Seetõttu on need vajalikud rakkude, eriti suguelundite, naha ja veresoonte endoteeli rakkude moodustamiseks ja parandamiseks. 2) küllastumata rasvhapetest sünteesitakse prostaglandiine, tromboksaane, leukotrieene ja teisi signaalmolekule.
Vitamiinirikkad toidud F : oleiin-, linool- ja linoleenhapet leidub taimsetes ja vähemal määral loomsetes rasvades. Arahhidoonhapet leidub ainult loomsete rasvade koostises.
Defitsiidiga küllastumata rasvhapped häirub suguelundite talitlus, tekivad nahahaigused, kolesterooli kontsentratsiooni tõus veres, veresoonte skleroos.
Rakkude koostis sisaldab palju orgaanilisi ühendeid: süsivesikuid, valke, lipiide, nukleiinhappeid ja muid ühendeid, mida elutus looduses ei leidu. Orgaanilist ainet nimetatakse keemilised ühendid sisaldavad süsinikuaatomeid.
Süsinikuaatomid on võimelised sõlmima üksteisega tugeva kovalentse sideme, moodustades väga erinevaid ahela- või tsüklimolekule.
Kõige lihtsamad süsinikku sisaldavad ühendid on süsivesinikud – ühendid, mis sisaldavad ainult süsinikku ja vesinikku. Enamik orgaanilisi, s.t süsinikuühendeid sisaldavad aga ka muid elemente (hapnik, lämmastik, fosfor, väävel).
bioloogilised polümeerid(biopolümeerid). Bioloogilised polümeerid on orgaanilised ühendid, mis moodustavad elusorganismide rakud ja nende ainevahetusproduktid.
Polümeer (kreeka keelest "poly" - palju) on mitmelüliline ahel, milles lüliks on mis tahes suhteliselt lihtne aine - monomeer. Üksteisega ühenduses olevad monomeerid moodustavad ahelaid, mis koosnevad tuhandetest monomeeridest. Kui tähistame monomeeri tüüpi konkreetse tähega, näiteks A, siis võib polümeeri kujutada väga pika monomeeriühikute kombinatsioonina: A-A-A-A-...-A. Need on näiteks teile tuntud orgaanilised ained: tärklis, glükogeen, tselluloos jne. Biopolümeerid on valgud, nukleiinhapped, polüsahhariidid.
Biopolümeeride omadused sõltuvad nende molekulide struktuurist: polümeeri moodustavate monomeersete üksuste arvust ja mitmekesisusest.
Kui kombineerite kahte tüüpi monomeere A ja B kokku, võite saada väga suur komplekt mitmesuguseid polümeere. Selliste polümeeride struktuur ja omadused sõltuvad arvust, suhtest ja vaheldumise järjekorrast, st monomeeride asukohast ahelates. Polümeeri, mille molekulis monomeeride rühm kordub perioodiliselt, nimetatakse regulaarseks. Sellised on näiteks skemaatiliselt kujutatud polümeerid korrapärase monomeeride vaheldumisega:
A B A B A B A B...
A A B B A A B B...
A B B A B B A B B A B B...
Siiski on võimalik saada palju rohkem polümeeride variante, milles monomeeride korratavuses pole nähtavat mustrit. Selliseid polümeere nimetatakse ebaregulaarseteks. Skemaatiliselt saab neid kujutada järgmiselt:
AABBBBBBAAABBBBBBBAAB...
Oletame, et iga monomeer määrab polümeeri mingi omaduse. Näiteks monomeer A määrab suure tugevuse ja monomeer B elektrijuhtivuse. Neid kahte monomeeri erinevates vahekordades kombineerides ja erinevatel viisidel vaheldumisi võib saada tohutul hulgal erinevate omadustega polümeerseid materjale. Kui me ei võta kahte tüüpi monomeere (A ja B), vaid rohkem, suureneb polümeeri ahelate variantide arv oluliselt.
Riis. 2. Glükoosi molekuli struktuur
Selgus, et mitut tüüpi monomeeride kombineerimine ja permutatsioon pikkades polümeeriahelates annab paljude variantide konstrueerimise ja määrab kõigi organismide osaks olevate biopolümeeride erinevad omadused. See põhimõte on meie planeedi elu mitmekesisuse aluseks.
Süsivesikud ja nende struktuur. Süsivesikud on laialt levinud kõigi elusorganismide rakkudes. Süsivesikud on orgaanilised ühendid, mis koosnevad süsinikust, vesinikust ja hapnikust. Enamikus süsivesikutes on vesinik ja hapnik reeglina samas vahekorras kui vees (sellest ka nende nimi - süsivesikud). Üldvalem sellised süsivesikud C n (H 2 0) m. Näiteks üks levinumaid süsivesikuid - glükoos, elementaarne koostis mis C 6 H 12 0 6 (joonis 2). Glükoos on lihtne suhkur. Mitmed lihtsuhkrute jäägid ühinevad omavahel ja moodustavad komplekssuhkruid. Piim sisaldab piimasuhkrut, mis koosneb kahe lihtsuhkru (disahhariidi) molekulide jääkidest. Piimasuhkur on kõigi imetajate poegade peamine energiaallikas.
Tuhanded identsete suhkrute molekulide jäägid, mis üksteisega ühenduvad, moodustavad biopolümeere - polüsahhariide. Elusorganismid sisaldavad palju erinevaid polüsahhariide: taimedes on see tärklis (joonis 3), loomadel glükogeen, mis koosneb samuti tuhandetest glükoosi molekulidest, kuid veelgi hargnenud. Tärklisel ja glükogeenil on keharakkude elutegevuseks vajaliku energia akumulaatori roll. Väga tärkliserikkad on kartulid, nisuterad, rukis, mais jne.

Riis. 3. Lõik hargnevast polümeersest tärklisemolekulist, kus iga lüli on tärklis
Süsivesikute funktsioonid. Süsivesikute kõige olulisem funktsioon on energia. Süsivesikud on nendest toituvate organismide peamine energiaallikas orgaaniline aine. AT seedetrakt inimeste ja loomade polüsahhariidtärklis lagundatakse spetsiaalsete valkude (ensüümide) toimel monomeerüksusteks – glükoosiks. Soolestikust verre imenduv glükoos oksüdeerub rakkudes süsinikdioksiidiks ja veeks koos keemiliste sidemete energia vabanemisega ning selle liig talletatakse glükogeeni kujul maksa- ja lihasrakkudesse. Intensiivsetel perioodidel lihaste töö või närvipinge(või nälgimise ajal) loomade lihastes ja maksas suureneb glükogeeni lagunemine. Sel juhul moodustub glükoos, mida tarbivad intensiivselt töötavad lihas- ja närvirakud.
Seega on polüsahhariidide biopolümeerid ained, milles talletatakse taime- ja loomorganismide rakkude poolt kasutatav energia.
Taimedes moodustub glükoosi polümerisatsiooni tulemusena mitte ainult tärklis, vaid ka tselluloos. Tsellulooskiud moodustavad taimeraku seinte tugeva aluse. Tänu oma erilisele struktuurile on tselluloos vees lahustumatu ja kõrge tugevusega. Sel põhjusel kasutatakse tselluloosi ka kangaste valmistamiseks. Puuvill on ju peaaegu puhas tselluloos. Inimeste ja enamiku loomade soolestikus puuduvad ensüümid, mis suudaksid lõhustada sidemeid tselluloosi moodustavate glükoosimolekulide vahel. Mäletsejalistel lagundatakse tselluloosi bakterite ensüümide toimel, mis pidevalt elavad spetsiaalses maoosas.
Tuntud on ka komplekssed polüsahhariidid, mis koosnevad kahte tüüpi lihtsuhkrutest, mis vahelduvad regulaarselt pikkades ahelates. Sellised polüsahhariidid täidavad struktuurseid funktsioone loomade tugikudedes. Nad on osa naha, kõõluste, kõhrede rakkudevahelisest ainest, andes neile tugevust ja elastsust. Sellel viisil, oluline funktsioon süsivesikute biopolümeerid on struktuurne funktsioon.
On suhkrute polümeere, mis on osa rakumembraanid; need pakuvad sama tüüpi rakkude interaktsiooni, rakkude poolt üksteise äratundmist. Kui eraldatud maksarakud segatakse neerurakkudega, hajuvad nad sama tüüpi rakkude vastasmõju tõttu iseseisvalt kahte rühma: neerurakud ühinevad ühte rühma ja maksarakud teise rühma. Üksteist äratundmisvõime kadumine on iseloomulik pahaloomulistele kasvajarakkudele. Rakkude äratundmise ja interaktsiooni mehhanismide selgitamine võib olla oluline, eriti vähiravi väljatöötamisel.
Lipiidid. Lipiidide struktuur on mitmekesine. Kõigil neil on aga üks ühisvara: need kõik on mittepolaarsed. Seetõttu lahustuvad nad sellistes mittepolaarsetes vedelikes nagu kloroform, eeter, kuid on vees praktiliselt lahustumatud. Lipiidide hulka kuuluvad rasvad ja rasvaineid. Rakus rasvade oksüdatsiooni käigus tekib see suur hulk energia, mida kasutatakse erinevates protsessides. See on rasvade energiafunktsioon.
Rasvad võivad koguneda rakkudesse ja olla tagavaraks toitaine. Mõnel loomal (näiteks vaaladel, loivalistel) ladestub naha alla paks kiht nahaalune rasv, mis oma madala soojusjuhtivuse tõttu kaitseb neid alajahtumise eest, st täidab kaitsefunktsiooni.
Mõned lipiidid on hormoonid ja osalevad regulatsioonis füsioloogilised funktsioonid organism. Fosforhappe jääki sisaldavad lipiidid (fosfolipiidid) on kõige olulisemad lahutamatu osa rakumembraanid, st nad täidavad struktuurset funktsiooni.
- Kirjeldage süsivesikute molekulide struktuuri vastavalt nende funktsioonidele rakus.
- Täpsustage iga loetletud aine funktsioonid kehas: glükoos, tselluloos, tärklis, glükogeen.
- Kasutades §-dest 1 ja 2 saadud teadmisi, vastake küsimusele, milles seisneb elava ja eluta ühtsus.






