Valgu molekuli struktuurne korraldus. Valgu molekuli struktuur
Valkude polüpeptiidstruktuur. Esiteks valgud isoleeritud rohkem kui 250 aastat tagasi ja 18. sajandi teisel poolel - 19. sajandi alguses. on korduvalt kirjeldanud taimede ja loomade valgulisi aineid.
Praegu on valkude keemiline elementaarne koostis hästi teada. Tavaliselt sisaldavad need 50–55% C, 21–23% 0 2, 15–17% N2, umbes 7% H2, 0–3% S. Lisaks võivad kompleksvalgud sisaldada P-d ja mõningaid metalle.
Kaasaegsete andmete kohaselt leidub mitmesuguste valkude koostises kõige sagedamini 20 tüüpi aminohappeid. Just 20 aminohappe geneetiline kood eksisteerib kolmikute kujul (DNA nukleotiidide kolmikud). Mõnikord on valkudes ka teisi aminohappeid, need moodustuvad valgu modifitseerimise tulemusena pärast nende biosünteesi, nad on mittekodeerivad (tsüstiin, hüdroksüproliin, hüdroksülüsiin ja mõned teised). Valkude koostises leiti ainult α-aminohappeid, valdav enamus L-konfiguratsioonis.
Aminohapped on omavahel ühendatud kovalentse peptiid- või amiidsidemega. Selle moodustumine toimub ühe aminohappe aminorühma (NH 2) ja teise aminohappe karboksüülrühma (-COOH) tõttu koos veemolekuli vabanemisega.
H 2 N-CH-C-OH + H-N-CH-COOH → H 2 N-CH-C-N-CH-COOH + H 2 0
transpeptiidside
Looduses on transpeptiidside tavaline, vähem stabiilne cis-peptiidside on vähem levinud. Peptiidside on osaliselt topelt-, osaliselt ühekordne, nende struktuuride vahel toimub vastastikune üleminek. Üksiksideme eluiga on mõnevõrra pikem kui kaksiksidemel (6:4), peptiidside on 60% üksik- ja 40% kaksikside.
Resonantsnähtuse tulemusena tekib kõikuv, dünaamiline side, mida ei ole võimalik kirjeldada ühe valentsstruktuuri alusel. Kuna pöörlemine ümber kaksiksideme on pärsitud, siis kõik aatomid peptiidside paiknevad ligikaudu samal tasapinnal, st on tasapinnaline, ainult lämmastikuaatomi ümber, säilitavad sidemed osaliselt püramiidse iseloomu. Praeguseks on peptiidirühmades kindlaks tehtud kõik sideme nurgad ja sideme pikkused (joonis 3).
Riis. 3. Aatomitevahelised kaugused (nm) ja nurgad peptiidsidemes. Kõik raami sees olevad aatomid on ligikaudu samal tasapinnal.
Aminohapetest moodustunud polümeere nimetatakse peptiidideks või valkudeks, olenevalt neis sisalduvate struktuuriüksuste arvust. Tavapäraselt aktsepteeritakse, et kuni 20 aminohappejääki sisaldavad peptiidid kuuluvad oligopeptiidide hulka, nende hulgas on di-, tri-, tetrapeptiide jne. Polüpeptiidide molekulis on 20 kuni 50 aminohappejääki. Peptiidahelad, mis ühendavad rohkem kui 50 aminohapet ja mille molekulmass on üle 6000, kuuluvad valkude hulka.
Väikseim valk on hormooninsuliin, mis koosneb 51 aminohappejäägist. Aminohappeühikute arv valgus võib ulatuda mitmesajani või isegi tuhandeni. Valkude tüüpide arv looduses on tohutu, nende mitmekesisus on seotud erinev komplekt aminohapped, millest valk koosneb, ja nende vaheldumise järjekord molekulis. Nii et juba kolmest aminohappest saad 6 erinevat tripeptiidi, neljast - 24 tetrapeptiidi, viiest - 120 pentapeptiidi, 11-40 miljonist isomeerist ja 20-st. erinevad aminohapped, millest igaüks esineb ainult üks kord, võib teoreetiliselt tekkida astronoomiline arv (2·10 18) isomeere. Eluslooduses realiseerub aga vaid väike osa võimalikest isomeeridest.
Valgumolekulide struktuuri kirjeldamiseks võeti kasutusele primaarsete, sekundaarsete, tertsiaarsete ja kvaternaarsete struktuuride mõisted.
esmane struktuur. Under valgu esmane struktuur molekulid mõistavad aminohapete järjestust polüpeptiidahelas (või -ahelates) ja disulfiidsidemete asukohta. Polüpeptiidahela ühes otsas on vaba aminorühm (N-ots) ja teises otsas karboksüülrühm (C-ots). Selle N-ots on võetud ahela alguseks, siit algab aminohapete loendus. See langeb kokku polüpeptiidahela sünteesi suunaga ribosoomil, mis omakorda vastab 5'-3' mRNA suunale.
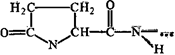
Polüpeptiidahela N-otsa aminorühm võib mõnikord olla atsetüülitud, lisades jäägi äädikhape(CH3-CO-NH). Atsetüülimisega blokeeritud N-terminalid on iseloomulikud ka paljude taimeviiruste, mõnede loomaviiruste ja bakterite ümbrisvalkudele.
C-otsas leidub kas vaba karboksüülrühma (enamikus valkudes) või amideeritud (mõned hormoonid, mesilasmürk). C-terminali modifikatsioonid on haruldasemad kui N-terminaalsed modifikatsioonid.
Üksikute peptiidide nimed moodustatakse vastavalt nende koostises olevatele aminohappejääkidele, alustades N-otsast. Samal ajal muutub kõigi aminohapete nimedes, välja arvatud viimane, lõpp sõnale “muda”. Näiteks L-alanüül-L-tsüsteüül-L-metioniin. Valkude täielik aminohappejärjestus on antud lühendatud aminohapete nimetustena. Võeti kasutusele aminohapete kolme- ja ühetäheline tähistus (tabel 5).

Tabel 5 Aminohappejääkide tähistused
Peamine ühendus esmane struktuur valgud – peptiidside. See side on üsna jäik ja seetõttu on selle konformatsiooniline liikuvus piiratud.
Erinevused homoloogsete valkude struktuuris annavad väärtuslikku teavet ka üksikute aminohappejääkide rolli kohta molekuli toimimises. Aktiivsetes kohtades paiknevaid või polüpeptiidahela konformatsiooni määravaid jääke ei saa muuta geneetiliselt või keemilise modifikatsiooniga, ilma et see mõjutaks funktsiooni. Seega on praegu teadaolevad variatsioonid tsütokroom c primaarstruktuuris erinevad tüübid elusorganisme ei seostata oluliste muutustega valgu funktsionaalsetes omadustes, kuna kõige vähem muutuvad piirkonnad, mis on seotud heemiga, samuti piirkonnad, mis vastutavad ruumilise voltimise eest
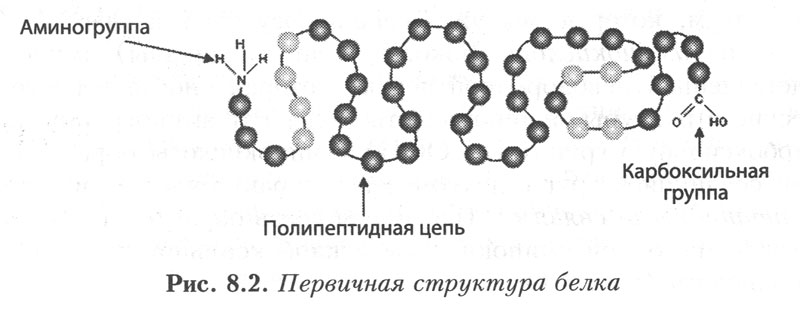
Riis. 4. Valgu esmane struktuur
Aminohapete vaheldumise kehtestamine valkudes näitas ka seda, et evolutsiooni käigus toimus geenide kahekordistumine ja sulandumine. Vastavate geenide dubleerimisega algab tavaliselt valkude diferentseerumine.
sekundaarne struktuur. Sekundaarne struktuur on järjestatud ruumiline paigutus polüpeptiidahela üksikud lõigud, võtmata arvesse aminohapete külgradikaalide tüüpi ja konformatsiooni. See moodustub peptiidrühmade vaheliste vesiniksidemete sulgemise tõttu. Sekundaarset struktuuri esindavad peamiselt sellised korrapärased struktuurid nagu α-heeliks, volditud kihid (β-struktuur), β-pain. Osa polüpeptiidahelast ei oma järjestatud struktuuri, selliseid piirkondi nimetatakse amorfseteks või struktuurituteks piirkondadeks.
α-spiraalsetes piirkondades ja β-volditud struktuuriga piirkondades on kõigil polüpeptiidahela järjestikku paiknevatel peptiidiüksustel identsed vastastikused orientatsioonid, kuna kõik väändenurgad φ ja kõik nurgad ψ Сα juures on samad. Sel juhul on polüpeptiidahela saidil lineaarne struktuur, mis moodustub lineaarsetest rühmadest.
Lineaarne rühm on spiraali mähis, mille parameetrid (nihe piki telge korduva elemendi kohta, elementide arv mähise kohta, raadius jne) sõltuvad nurkade φ ja ψ suurusest. Spiraal, milles on vähem kui kaks elementi mähise kohta, ei ole võimalik. Valkudes on leitud mitut tüüpi lineaarseid rühmi, millel ei ole steerilisi takistusi; need on stabiliseeritud vesiniksidemed kas polüpeptiidahela ühes osas (heeliks) või külgnevate sektsioonide vahel (β-lehe struktuur).
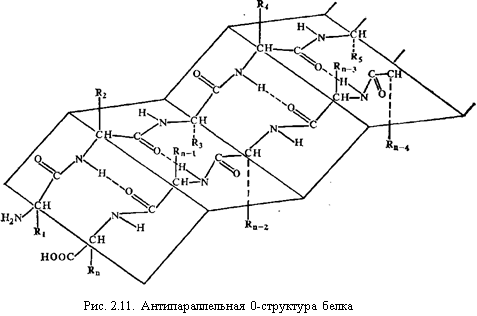
Riis. 5. Valgu antiparalleelne β-struktuur.
Volditud kihte saab moodustada mitte ainult üks polüpeptiidkett (sel juhul on vesiniksidemed selle ahela sees), vaid ka rühm tihedalt asetsevaid polüpeptiide. peptiidahelad molekulis (vesiniksidemed sulguvad ahelate vahel). Teist tüüpi β-struktuur on tüüpiline sellistele fibrillaarsetele valkudele nagu siidfibroiin, juuksekeratiin, mis koosneb mitmest polüpeptiidahelast. Globulaarsetes valkudes osaleb β-lehtstruktuuri moodustamises tavaliselt umbes 15% polüpeptiidahela aminohappejääkidest. Enamik volditud kihte sisaldab vähem kui kuut ketti. Volditud kihid ei ole reeglina tasased, neid iseloomustab kerge vasakpoolne keerdumine.
 Tertsiaarne struktuur. Tertsiaarne struktuur iseloomustab järjestatud ja amorfsete piirkondade ruumilist paigutust polüpeptiidahelas tervikuna, mis saavutatakse kõrvalradikaalide interaktsiooni kaudu ja sõltub nende tüübist ja konformatsioonist. Seega kirjeldab tertsiaarne struktuur kogu valgu molekuli ruumilist paigutust, kui see on moodustatud ühest polüpeptiidahelast. Tertsiaarne struktuur on otseselt seotud valgumolekulide kujuga, mis võib olla erinev: sfäärilisest niidikujuliseni. Seega iseloomustab globulaarsetes valkudes tertsiaarset struktuuri polüpeptiidahela üsna tihe pakend keerdunud molekuli kujul, mis sarnaneb oma kujuga pallile. Globulaarsete valkude tertsiaarse struktuuri säilitamisel ja selle fikseerimisel osalevad erinevat tüüpi sidemed, kovalentsed, ioonsed või soola-, vesiniku- ja hüdrofoobsed vastasmõjud (loetletud sideme energia kahanevas järjekorras). Tertsiaarse struktuuri moodustamisel on domineeriv roll hüdrofoobsetel interaktsioonidel, mis tekivad aminohapete mittepolaarsete külgradikaalide vahel.
Tertsiaarne struktuur. Tertsiaarne struktuur iseloomustab järjestatud ja amorfsete piirkondade ruumilist paigutust polüpeptiidahelas tervikuna, mis saavutatakse kõrvalradikaalide interaktsiooni kaudu ja sõltub nende tüübist ja konformatsioonist. Seega kirjeldab tertsiaarne struktuur kogu valgu molekuli ruumilist paigutust, kui see on moodustatud ühest polüpeptiidahelast. Tertsiaarne struktuur on otseselt seotud valgumolekulide kujuga, mis võib olla erinev: sfäärilisest niidikujuliseni. Seega iseloomustab globulaarsetes valkudes tertsiaarset struktuuri polüpeptiidahela üsna tihe pakend keerdunud molekuli kujul, mis sarnaneb oma kujuga pallile. Globulaarsete valkude tertsiaarse struktuuri säilitamisel ja selle fikseerimisel osalevad erinevat tüüpi sidemed, kovalentsed, ioonsed või soola-, vesiniku- ja hüdrofoobsed vastasmõjud (loetletud sideme energia kahanevas järjekorras). Tertsiaarse struktuuri moodustamisel on domineeriv roll hüdrofoobsetel interaktsioonidel, mis tekivad aminohapete mittepolaarsete külgradikaalide vahel.
fibrillaarsed valgud täidavad kehas struktuurset funktsiooni. Need on halvasti lahustuvad või lahustumatud valgud, mis erinevad kõrge sisaldus mittepolaarsed aminohapped. Nende hulka kuuluvad näiteks side- ja kontraktiilsete kudede valgud, juuksed, nahk, mõned taimede rakumembraanide valgud, vetikad ja mitmed teised valgud.
 Kvaternaarne struktuur. Kvaternaarses struktuuris on need valgud, mille molekul koosneb kahest või enamast mittekovalentselt seotud polüpeptiidahelast. Kvaternaarne struktuur on tüüpiline reeglina valkudele, mille suhteline molekulmass on üle 50 000-100 000. Kvaternaarse struktuuriga valke nimetatakse oligomeerseteks.
Kvaternaarne struktuur. Kvaternaarses struktuuris on need valgud, mille molekul koosneb kahest või enamast mittekovalentselt seotud polüpeptiidahelast. Kvaternaarne struktuur on tüüpiline reeglina valkudele, mille suhteline molekulmass on üle 50 000-100 000. Kvaternaarse struktuuriga valke nimetatakse oligomeerseteks.
Kvaternaarset struktuuri mõistetakse viisina suhteline positsioonüksikute polüpeptiidahelate ruumis molekulis, nendevaheliste sidemete olemust. Kompleksseid supramolekulaarseid struktuure nimetatakse mõnikord kvaternaarse struktuuriga valkudeks. valgu struktuurid, milles on kombineeritud kuni mitusada subühikut, näiteks bakterilipud, viiruspead jne.
Teatud ideed selle kohta ruumiline struktuur ja valgusmolekulide kuju saadi elektronmikroskoobiga tehtud uuringutes. Paljudes valkudes on molekulide kuju kompaktne ja esindab sfäärilisi või ellipsoidikujulisi osakesi läbimõõduga 10–30 nm. muud valgu molekulid piklikud 5-15 nm läbimõõduga ja mitusada nm pikkuste keermete kujul, kolmandad moodustavad vardakujulisi struktuure läbimõõduga 10-20 nm ja pikkusega 100-300 nm.
Kõige täpsema teabe valkude ruumilise struktuuri kohta saadi röntgendifraktsioonianalüüsiga, mille abil uuritakse valkude molekulide struktuuri kristallilises olekus. Nagu selgus, on valgukristallides täielikult säilinud molekuli natiivne konformatsioon, mida stabiliseerib suur hulk kristallisatsioonivett.
Valgumolekulide pikki filamentseid vorme nimetatakse tavaliselt fibrillaarseteks valkudeks. Need sisaldavad pikki paralleelseid polüpeptiidahelaid, mida hoiavad koos ristsidemed (joonis 12). Neid valke iseloomustab suur mehaaniline tugevus ja nad täidavad tavaliselt struktuurset funktsiooni. Fibrillaarsete valkude hulka kuuluvad kõõluste kollageen, lihaste müosiin, siidfibriin, karvade ja sulgede keratiin.
Sfäärilise kujuga molekule nimetatakse globulaarseteks valkudeks. Nende polüpeptiidahelad on volditud gloobuliteks, millel on erineva pikenemisastmega pöörleva ellipsoidi kuju. Globulaarsete valkude hulka kuuluvad ensüümid, regulaator- ja transpordivalgud ning taimevalgud.
Valgumolekulide globulaarsete ja fibrillaarsete konformatsioonide vahel on palju üleminekuvorme, mis on iseloomulikud paljudele valkudele.
Valgumolekulide kuju suurte erinevuste ja nende polümerisatsiooni kõrge astme tõttu tekivad valkude molekulmasside määramisel märkimisväärsed raskused, mistõttu on neil eesmärkidel välja töötatud. spetsiaalsed meetodid uurimine. Väga hästi lahustuvate ja lisandivabade valkude puhul saab molekulmassi määrata üsna suure täpsusega valgulahuse osmootse rõhu muutuste põhjal. Täheldatakse pöördvõrdelist seost valkude molekulmassi ja nende lahuste osmootse rõhu suuruse vahel.
Hästi puhastatud valkude kristallvormide puhul määratakse molekulmassid suure täpsusega röntgendifraktsioonianalüüsiga.
Valkude molekulmasside määramisel kasutatakse väga sageli settimisanalüüsi meetodit, mis põhineb valgu lahuse kiirel tsentrifuugimisel tekkiva suure tsentrifugaaljõu toimel valgumolekulide settimise (settimise) kiiruse mõõtmisel. . Esimese kiire tsentrifuugimise (ultratsentrifuugi) installatsiooni kavandasid T. Svedberg ja D.B. Nikols aastal 1923. Tänapäevastes ultratsentrifuugides saab luua tsentrifugaalkiirenduse üle 500 000 g. Tsentrifugaaljõu toimel hakkavad lahuses ühtlaselt jaotunud valgumolekulid teatud kiirusega liikuma tsentrifugaaljõu suunas, moodustades liidese sadestunud valkude ja pöörlemiskeskmest eemalduva puhta lahusti vahel. Liidese asukoht teatud ajavahemike järel salvestatakse optilise süsteemi abil ja nende tulemuste põhjal määratakse settimise tegur, mis väljendab valkude settimise kiirust.
Valgu molekulmassi suurenedes settimiskoefitsient suureneb, kuid nende näitajate vahel puudub rangelt otsene seos, kuna settimiskiirus sõltub ka molekulide kujust.
Settimiskoefitsiendi väärtust väljendatakse tavaliselt eriühikutes - swedbergs, mis on tähistatud sümboliga S. Üks swedberg (1S) on arvuliselt võrdne 1×10 -13 sekundiga. Enamiku taimsete valkude puhul on settimiskoefitsiendid vahemikus 1-20S.
Valgumolekulide settimise ja difusiooni koefitsientide põhjal arvutati paljude erinevatest objektidest eraldatud valkude molekulmassid:
ribonukleaas 12640 α-amülaas 97600
hemoglobiin 64500 katalaas 247500
nisu gliadiin 27500 kanep edestiin 300000
munaalbumiin 44000 sojaureaas 483000
maisi zein 50000 pepsiin 35500
Oligomeerseid valke moodustavate polüpeptiidide molekulmasside määramiseks kasutatakse laialdaselt polüakrüülamiidgeelis laetud osakeste elektroforeesi meetodit, mis võimaldab elektrivälja mõjul polüpeptiide väga täpselt eraldada.
Elektrivälja mõjul liiguvad laetud polüpeptiidimolekulid anoodi või katoodi suunas läbi poorse kandja, milleks on akrüülamiidi ja bisakrülamiidi ühisel polümerisatsioonil teatud puhverkeskkonnas tekkiv polüakrüülamiidgeel. See geel on väga hüdreeritud ja sellel on poorid teatud suurused sõltuvalt akrüülamiidi ja bisakrülamiidi vahekorrast. Laetud osakeste liikumiskiirus poorses kandjas oleneb laengu suurusest, molekulmassist ja molekulide ruumilisest konfiguratsioonist, seetõttu eraldatakse elektroforeesi tulemusena eraldunud osakesed, mis erinevad elektrilaengu ja ruumiparameetrite poolest. polüakrüülamiidgeelis jaotatakse kitsaste tsoonide kujul, mis on värvitud spetsiaalse värvainega. Värviliste tsoonide suurused näitavad täpselt elektroforeesi käigus eraldatud polüpeptiidide kontsentratsiooni ja nende koguarv näitab erinevate polüpeptiidide olemasolu uuritavas segus ( riis. 13).
Valgud.doc
Valgulised ained
3. VALGUAINED JA NENDE OMADUSED
1. Definitsioon
Taimi ja teisi elusorganisme moodustavatest orgaanilistest ainetest on bioloogiliselt kõige olulisemad valkained ehk valgud. Valgud, mis moodustavad rakkude tsütoplasma aluse, mängivad olulist rolli kõigi organismide elus.
Valke nimetatakse kõrgmolekulaarseteks kolloidseteks ühenditeks, mis koosnevad α-aminohapetest.
2. Valkude lokaliseerimine
Suurem osa taimsetest valkudest on koondunud seemnetesse ja puuviljadesse. Teistes taimekudedes on nende massiosa suhteliselt väike võrreldes loomsete kudedega, kus valgud moodustavad poole või rohkemgi elusraku kuivaine massist.
Seega on valkude massiosa taimede vegetatiivsetes organites - varred, lehed, juured - vahemikus 0,3 kuni 3,0%, kuid teravilja terades 8 kuni 15%, õlitaimede seemnetes - 18 kuni 3,0%. 28, liblikõieliste taimede seemnetes - 25–50% (märgkaalu järgi). Lihastes - 18-23%, maksas - 17-19%, ajus - 7-9% (märgkaalu järgi).
Väärtus massiosa terades ja seemnetes leiduvad valgud määrab suuresti bioloogiline väärtus tehnoloogilise töötlemise käigus saadud tooted; ainult mõnel juhul raskendab valkude olemasolu taimsete toorainete töötlemise tehnoloogiat ja halvendab saadud toodete kvaliteeti. Suurenenud proteiinisisaldus peedijuurtes raskendab sahharoosi kristalliseerumist emalahusest.
Suure valgusisaldusega tubakalehtedes omandab tubakasuits halb lõhn põlenud suled. Sellist toortubakat hinnatakse madalamalt.
Samas annab veinivalmistamisel valkude olemasolu viinamarjavirdes veinimaterjalidele spetsiifilise maitse. Küpsetamisel määrab suuresti nisutera suurenenud valgusisaldus kõrge kvaliteet ja leiba.
^
3. Valkude funktsioonid
Taimedes täidavad valgud mitmesuguseid funktsioone, millest olulisemad on:
3.1 Katalüütiline. Kõige arvukam valkude rühm on ensüümvalgud, mis katalüüsivad biokeemilisi reaktsioone. Ensüümvalkude abil elusrakus saavutatakse ainete regulaarne keemiliste muundumiste jada, mis tagab organismide elutegevuse.
3.2 Varu. Varuvalgud sisse suured hulgad akumuleeruvad teravilja ja seemnete rakkudesse küpsemise ajal taimel ning seejärel tera ja seemnete idanemise ajal hüdrolüüsitakse need aminohapeteks või molekulaarseteks peptiidideks, mida rakk kasutab seejärel uue taime moodustamiseks. varajased staadiumid arengut. Looma kehas valke varusse ei ladustata, seetõttu tuleb neid igapäevaselt varustada toiduga vajalikes kogustes.
3.3 Kaitsev. Kaitsevalgud kaitsevad elusorganismi hävimise eest või aitavad kaasa selle ellujäämisele kahjustuste korral. Kaitsefunktsioon valgud – taimede poolt toodetud toksiinid, seisneb selles, et need kaitsevad taimi loomade poolt söömise eest ning pärsivad ka paljude taimede seemneid kahjustavate putukakahjurite proteolüütilisi ensüüme.
3.4 Struktuurne. Struktuursed valgud on osa taimede, sealhulgas seemnete ja viljade, sisekudedest. Need moodustavad ka raku biomembraanide struktuurse aluse, tagades, et rakuorganellid säilitavad vajaliku biokeemiliste reaktsioonide jada.
3.5 Kontraktiil ja mootor. Need valgud hõlmavad lihaste müosiini.
3.6 Regulatiivne. Need valgud osalevad metaboolsete reaktsioonide reguleerimises. Nende hulka kuuluvad paljud hormoonid, näiteks insuliin, mis reguleerib glükoosi metabolismi.
3.7 Transport. Transpordivalgud kannavad spetsiifilisi molekule või ioone. Näiteks hemoglobiin. Nad seovad hapnikku ja kannavad selle perifeersetesse kudedesse.
^
4. Valkude elementaarne koostis
Valgud sisaldavad süsinikku, hapnikku, vesinikku, lämmastikku, mõnikord ka väävlit või seleeni. Sisaldada võib ka rauda, vaske, tsinki, fosforit ja mõnda muud elementi. Näiteks sisaldab nisuteravalgu koostis süsinikku 51 kuni 53%, hapnikku - 21 kuni 23%, vesinikku - 6 kuni 8%, lämmastikku - 16 kuni 19%, väävlit - 0,7 kuni 1, 3%.
^
5. Valkude aminohappeline koostis
Valkude struktuurikomponendid – nende monomeerid – on aminohapped. Keetmisel tugevate hapete, leelistega ja ka hüdrolüütiliste ensüümide toimel lagunevad valkained aminohapeteks.
Vaatamata asjaolule, et looduses on teada üle 200 aminohappe, koosnevad valgud peamiselt 20 aminohappest.
Aminohapped on alifaatsed, aromaatsed või heterotsüklilised ühendid, mis sisaldavad vähemalt ühte amino- ja ühte karboksüülrühma.
Kõrval keemiline struktuur need on tuletised rasvhapped, milles α-asendis olev vesinik on asendatud amiinirühmaga (–NH2):
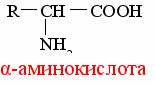
Igal aminohappel, välja arvatud keemilisel, on triviaalne (traditsiooniline) nimi, mis on mõnikord tuletatud allikast, millest aminohape esmakordselt eraldati, või selle omadustest, näiteks: asparagiinhape- esimene aminohape, mis avastati 1806. aastal, leiti oataime spargli seemnetest, glutamiinhape - nisugluteenis (inglise keelest tõlgitud) gluteen"- gluteen). Glütsiin sai oma nime magusa maitse järgi (kreeka keelest "glykos" - magus).
^
5.1 Asendamatud aminohapped
Taimed suudavad sünteesida kõiki valke moodustavaid aminohappeid. Inimese ja looma organism ei suuda sünteesida kõiki valkude sünteesiks vajalikke aminohappeid. Aminohappeid, mida inimese ja looma organism ei sünteesi, kuid mis on osa nende valkudest, nimetatakse nn. asendamatu, või asendamatud aminohapped.
Inimese jaoks on need asendamatud aminohapped 10 aminohapet: valiin, treoniin, leutsiin, isoleutsiin, metioniin, lüsiin, arginiin, histidiin, fenüülalaniin, trüptofaan.
Need aminohapped on osa valkudest, kuid neid võib leida ka elusorganismides ja vabas olekus.
Ülejäänud 10 aminohapet ( asendamatud aminohapped), mis on valgu osa, saab loomade ja inimeste kehas sünteesida teistest ühenditest, sealhulgas asendamatutest aminohapetest.
^
5.2 Bioloogiliselt täisväärtuslik toit
Sõltuvalt asendamatute aminohapete kvantitatiivsest sisaldusest peetakse tooteid bioloogiliselt täielikuks või halvemaks. Terved toidud- need on tooted, mille valkudes kõik sisaldub asendamatud aminohapped sisse tasakaalustatud summa. Kasulikkuse standardiks on inimese piimavalgud ja kana muna. Nende hulka kuuluvad piim ja piimatooted, liha, munavalged ja kala. Alates taimsed tooted läheneda kaunviljade seemnete täielikele valkudele. Teraviljade tera on bioloogiliselt halvem, kuna neis on vähe olulisi happeid. Need on nisu, rukki, maisi valgud, mis sisaldavad ebapiisav kogus metioniin, lüsiin, trüptofaan.
6 Valgumolekuli moodustumisel osalevad sidemed
^
6.1 Peptiidside
Valgumolekuli osana moodustavad aminohapped hargnemata ahela, milles need on seotud kovalentsete peptiidsidemetega:
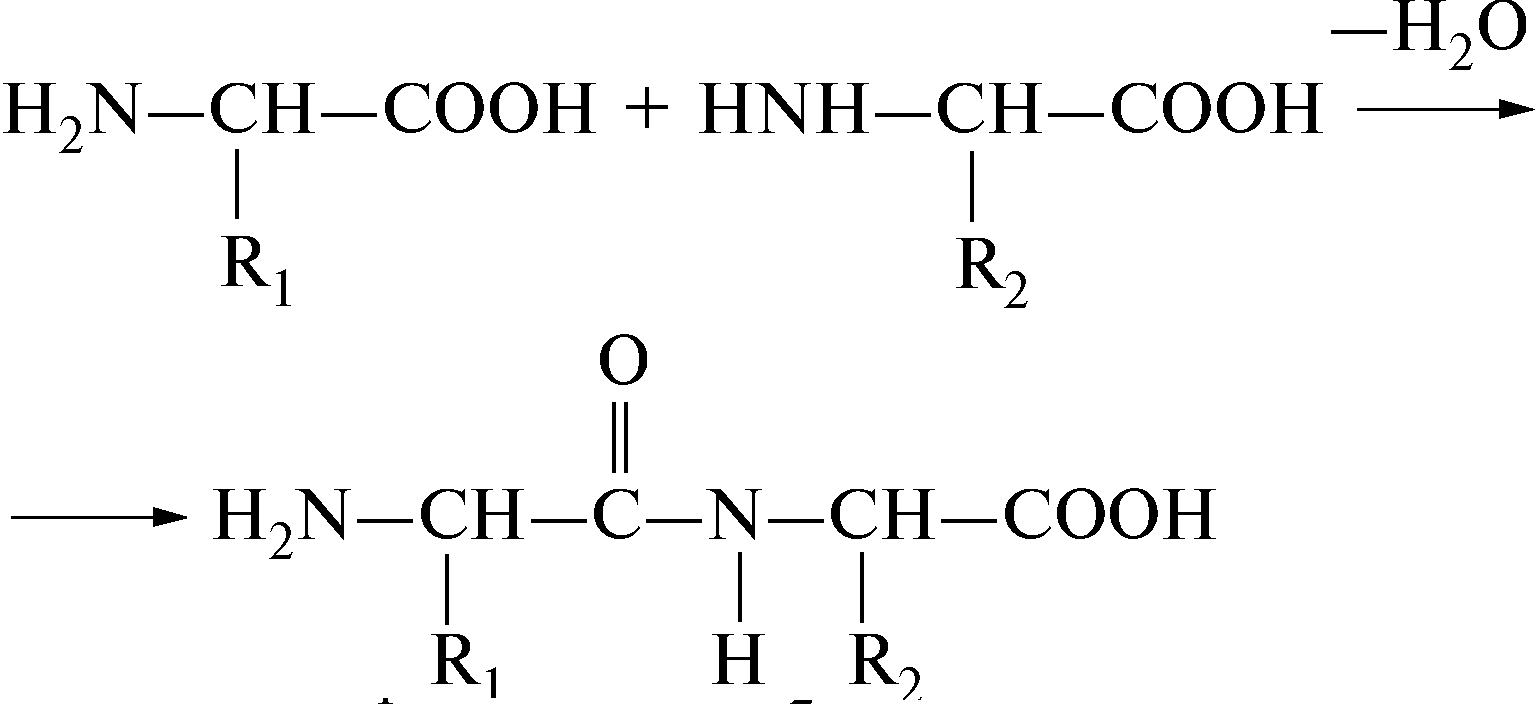
O 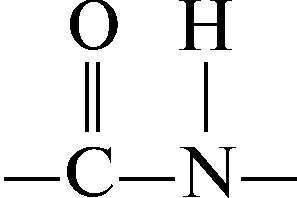 tekkivat ühendit, mis on kahe aminohappe molekuli vastasmõju tulemus, nimetatakse dipeptiidiks ja sidet peptiidiks.
tekkivat ühendit, mis on kahe aminohappe molekuli vastasmõju tulemus, nimetatakse dipeptiidiks ja sidet peptiidiks.
Dipeptiidi vaba karboksüülrühm võib ühineda mis tahes aminohappe teise molekuli amiinrühmaga, mille tulemusena moodustub tripeptiid. Kui neli aminohappejääki on ühendatud peptiidsidemetega, tetrapeptiid, viis - pentapeptiid jne. Mitmest aminohappest koosnevate ühendite üldnimetus on polüpeptiidid- just need on valgud.
Paljusid polüpeptiide leidub vabas vormis taimedes, loomsetes kudedes ja mikroorganismides suur tähtsus ainevahetuse vaheühenditena ja füsioloogiliselt väga aktiivsed ühendid. Näitena võib tuua väljapaistva inglise biokeemiku F. Hopkinsi avastatud tripeptiid glutatioon, mis koosneb glükokooli, tsüsteiini ja glutamiinhappe jääkidest:
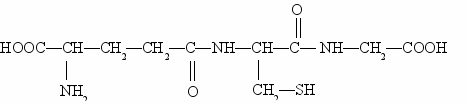
Glutatiooni leidub kõigis elusrakkudes. Selle sisaldus on eriti kõrge nisuidudes ja pärmis. Glutatiooni ülimalt oluline roll ainevahetuses seisneb selles, et ta on tugev redutseerija ja väga kergesti oksüdeerub.
Polüpeptiidide hulka kuuluvad mitmed antibiootikumid, mikroorganismide poolt moodustatud ained, mis tapavad teisi mikroorganisme või pärsivad nende kasvu: gramitsidiin, türotsidiin, lihheniformiin. Mõnda neist antibiootikumidest kasutatakse meditsiinis laialdaselt patogeensete mikroobide vastu võitlemiseks.
Aminohapped on valgumolekuli tähestik: kombineerides neid erinevas järjekorras, saad lõpmatu hulga erinevaid valke.
^
6.2 Täiendavad vaated keemiline side
Kogu bioloogiline mitmekesisus keemilised omadused looduslikud valgud, mis on tingitud aminohapete järjestusest erinevate kõrvalradikaalidega - R-rühmad nende polüpeptiidahelas.
Skemaatiliselt võib polüpeptiidide külgahelaid kujutada järgmiselt:
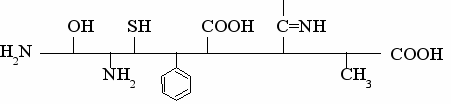
Aminohapete R-rühmade keemiliste omaduste erinevus põhjustab valgu molekuli struktuuris erineva tugevusega keemilisi sidemeid - disulfiid-, vesinik-, ioonsidemeid ja hüdrofoobseid interaktsioone.
^
6.2.1 Disulfiidside
Aminohapete peptiidahelad (valgus võib olla üks, kaks või enam) võivad olla ristseotud nii enda sees kui ka omavahel, kuna polüpeptiidis paiknevate sulfhüdrüülrühmade -SH vahel moodustub kovalentne disulfiidside -S-S- tsüsteiinide ahel:
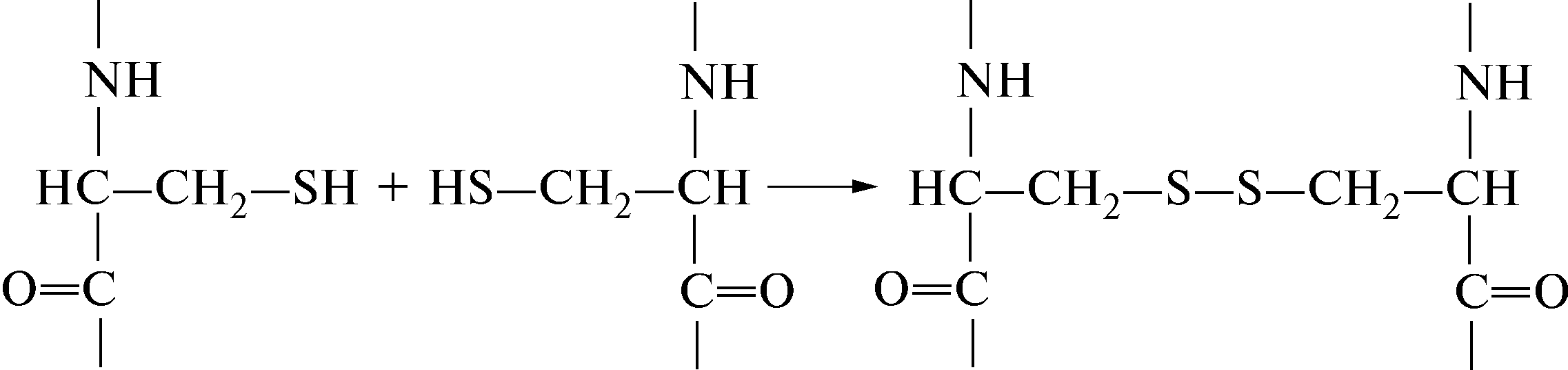
^
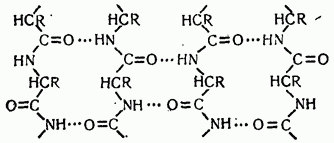
6.2.2 Vesinikside
Vesiniksidemed tekivad kovalentselt seotud positiivse laenguga vesinikuaatomi ja negatiivse laenguga kovalentse sidemega aatomi – aktseptori – vahelise dipoolinteraktsiooni tulemusena. Järgnevalt on toodud näited erinevatest valkudes moodustunud vesiniksidemetest (tähistatud punktiirjoonega).
Vesinikside peptiidrühmade vahel:
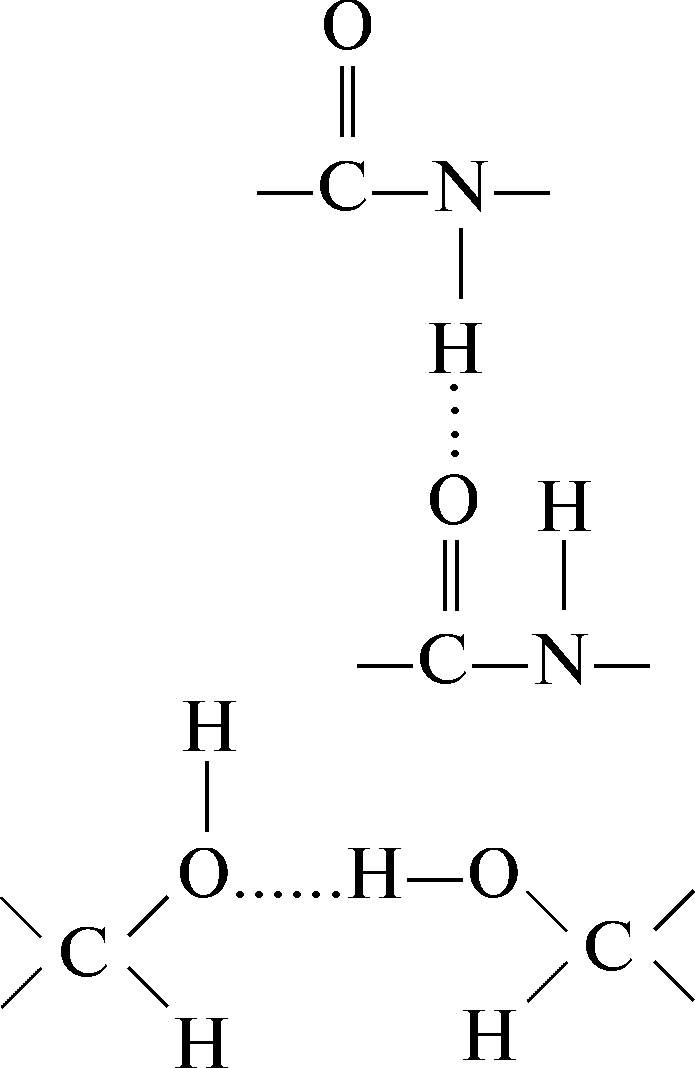
Vesinikside kahe hüdroksüülrühma vahel:
Vesinikside laetud karboksüülrühma ja türosiini hüdroksüülrühma vahel:
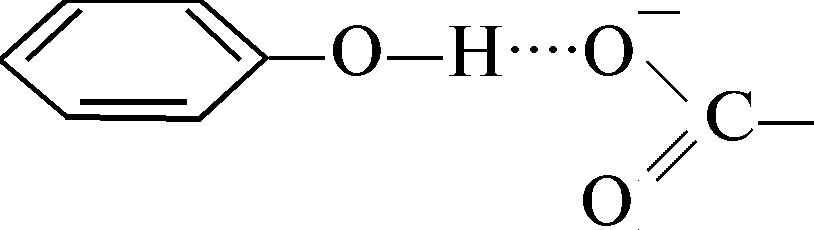
Vesinikside laetud amiinrühma ja laetud karboksüülrühma vahel:
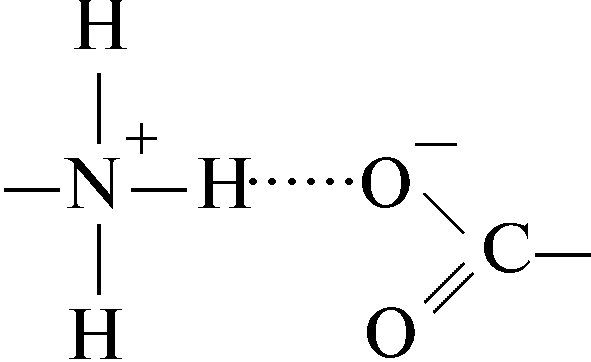
Vesinikside seriini hüdroksüülrühma ja karbonüülpeptiidsideme vahel:
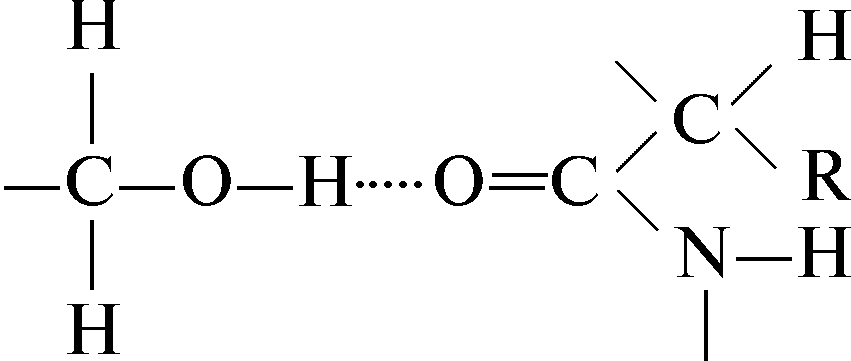
^
6.2.3 Soolaside
Happed, nagu lüsiin ja asparagiin, võivad moodustada soola- või ioonsidemeid:
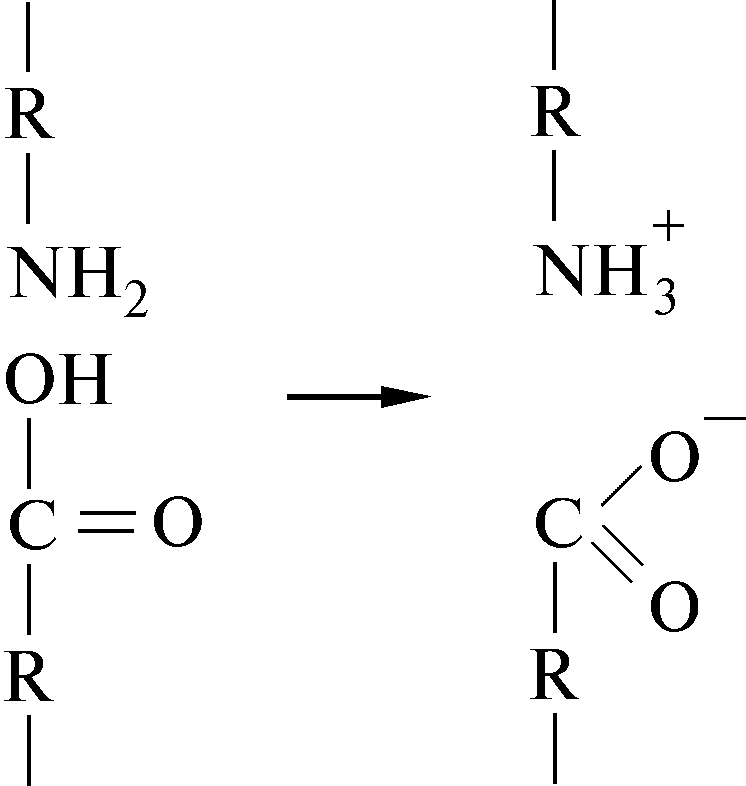
^
6.2.4 Hüdrofoobne koostoime
Kui ioon- ja vesiniksidemed tekivad polaarsete aatomite või kahe või enama polaarse molekuli laetud rühmade dipoolinteraktsiooni tulemusena, siis hüdrofoobsed interaktsioonid seovad vesilahustes ühe või mitme molekuli mittepolaarseid (hüdrofoobseid) osi. Iga sellise interaktsiooni energia on väike, kuid selliste vastastikmõjude suure arvu tõttu suudavad nad luua stabiilseid struktuure.
Hüdrofoobsete interaktsioonide mõjul lähenevad polüpeptiidahela mittepolaarsed piirkonnad üksteisele veemolekulide nihkumise ja nende interaktsiooni nõrgenemise tõttu. veekeskkond.
Valiini, leutsiini, isoleutsiini, fenüülalaniini, proliini, trüptofaani, metioniini ja tsüsteiini külgahelad (R-rühmad) omavad hüdrofoobset interaktsiooni.
Ioonsed, vesiniksidemed ja hüdrofoobsed vastasmõjud määravad ja stabiliseerivad iga valgu molekuli spetsiifilise ruumilise struktuuri.
^
7. Valgu molekuli ehitus
7.1 Valgu molekuli kuju
Molekuli kuju ja ruumilise struktuuri tunnuste järgi jagunevad valgud kerajas, mille molekulaarne kuju on lähedane sfäärilisele või elliptilisele kujule (lühikese ja pika telje suhe on kuni 1:50) ja fibrillaarne, mille molekul on piklikuma kujuga ja võib moodustada multimolekulaarseid filamentseid struktuure – fibrillid.
Globulaarsed valgud koosnevad ühest või mitmest polüpeptiidahelast, mis on mittekovalentsete ja kovalentsete sidemete tõttu tihedalt volditud kompaktseks osakeseks – gloobuliks. Need valgud, mis on aminohappejääkide koostise ja bioloogiliste funktsioonide poolest mitmekesised, lahustuvad tavaliselt vees hästi. Paljud globulaarsed valgud on ensüümid. Peaaegu kõik nende polaarsed R-rühmad asuvad molekuli pinnal ja on hüdraatunud, hüdrofoobsed R-rühmad asuvad molekuli sees.
Fibrillaarsed valgud koosnevad piklikest või keerdunud polüpeptiidahelatest, mis on paigutatud paralleelselt ja on ühendatud arvukate mittekovalentsete ja kovalentsete sidemetega. Reeglina on tegemist tugevate jäikade struktuuride moodustavate valkudega, need on vees lahustumatud ja polüpeptiidahelates aminohappejääkide, peamiselt hüdrofoobsete, koostiselt homogeensemad.
^
7.2 Valgu struktuur
Eristama:
7.2.1 Esmane;
7.2.2 Teisene;
7.2.3 Kolmanda tasemega;
7.2.4 Valgumolekulide kvaternaarne struktuur.
7.2.1 Valgu esmane struktuur on valgu polüpeptiidahelas kovalentsete peptiidsidemetega ühendatud aminohappejääkide vaheldumise järjekord (järjestus).
Valgu R-rühmade ahelasisese interaktsiooni tõttu voldib valgu polüpeptiid ahel spontaanselt "natiivseks" (looduslikuks) ruumiliseks struktuuriks.
7.2.2 Valgu sekundaarne struktuur on polüpeptiidahelas ühendatud aminohappejääkide ruumiline orientatsioon. Moodustamisel sekundaarne struktuur kaasatud on vesiniksidemed. Polüpeptiidahelate sekundaarset struktuuri on kolm peamist tüüpi: α-heeliks, β-struktuur (volditud kiht) ja juhuslik mähis.
Kui moodustub α-heeliks, keerdub polüpeptiidahel ümber telje. Õige α-heeliks on kõige stabiilsem.
β-struktuuris (volditud kiht) asetsevad peptiidahelad üksteisega paralleelselt, moodustades ruumilise kujundi, mis sarnaneb akordionina volditud volditud lehele. Reeglina moodustavad sellise struktuuri piklikud polüpeptiidahelad.
β-struktuuri stabiliseerimine saavutatakse ahelatevaheliste vesiniksidemete moodustumisega, milles osalevad kõik peptiidsidemed.
Valgu molekuli sekundaarstruktuuri määrab selle esmane struktuur. Seetõttu on polüpeptiidahelas aminohappejärjestuse väljaselgitamisel võimalik ennustada selle sekundaarset struktuuri, kuna aminohapped erinevad oluliselt nende võime poolest moodustada α-heeliksit või β-struktuuri.
Erinevate tehnoloogiliste protsesside käigus võivad valkude α-heeliksid või β-struktuurid üksteisesse üle minna. See seletab eelkõige villaste esemete suuruse vähenemist, kui neid pestakse kuumas vees.
7.2.3 Valgu tertsiaarne struktuur määrab valgu molekuli ruumilise korralduse. See tekib spontaanselt ja sõltub aminohappejääkide suurusest, kujust ja polaarsusest, nende järjestusest polüpeptiidahelas, s.o. valgu primaarstruktuuril, samuti selle sekundaarstruktuuri tüübil, määrates valgu molekuli ruumilise korralduse. See tekib polüpeptiidiahelate interaktsiooni tulemusena ja seda toetavad disulfiid- ja ioonsidemed, hüdrofoobsed ja elektrostaatilised interaktsioonid.
Tertsiaarne struktuur, nagu ka sekundaarne, määratakse polüpeptiidahela aminohappejärjestuse järgi, kuid kui sekundaarstruktuuri määrab aminohapete interaktsioon ahela lähedal asuvates osades, siis tertsiaarne struktuur sõltub aminohappest. üksteisest kaugel olevate ahelaosade järjestus.
Paljude suhteliselt nõrkade sidemete tulemusena on valgu peptiidahela kõik osad üksteise suhtes fikseeritud, moodustades kompaktse struktuuri.
7.2.4 Kvaternaarne struktuur on mitme polüpeptiidahela ühendus, mis moodustub mittekovalentsete sidemete kaudu (vesinik, ioonne, hüdrofoobne interaktsioon, elektrostaatiline külgetõmme). Iga polüpeptiidahelat, mis on seotud kvaternaarse struktuuri moodustamisega, nimetatakse subühikuks või protomeeriks. Kvaternaarse struktuuriga valgumolekulid võivad teatud tingimustel dissotsieeruda allüksused – protomeerid ja muudel tingimustel uuesti assotsieeruda, moodustades dimeerid ja seejärel algse oligomeerse molekuli.
Protomeeride ekslik ühendamine oligomeerses valgus või seos teiste valkudega on võimatu (komplementaarsus).
Täiendavad interaktsioonid on peaaegu kõigi elusorganismide biokeemiliste protsesside aluseks, sealhulgas ensümaatilised ühendite ülekandeprotsessid läbi membraanide, valkude kaitsereaktsioonid ja paljud teised valgumolekulidega seotud protsessid.
See. valgud koosnevad peptiidsidemetega seotud ja polüpeptiidahelaid moodustavatest aminohappejääkidest, mis paiknevad ruumis teatud viisil tänu disulfiid-, vesinik-, ioonsidemetele, aga ka hüdrofoobsetele interaktsioonidele, s.t. neil on teatud tingimustel teatud konformatsioon. Looduslik konformatsioon toimub normaalsetes füsioloogilistes tingimustes.
^
8. Valkude füüsikalis-keemilised omadused
8.1 Füüsikalised omadused
1. Elusorganismides on valgud tahkes ja lahustunud olekus. Paljud valgud on kristallid, kuid need ei anna tõeseid lahendusi, sest. nende molekul on väga suur. Valkude vesilahused on hüdrofiilsed kolloidid, mida leidub rakkude protoplasmas ja need on aktiivsed valgud. Kristallilised tahked valgud on säilitusühendid. Denatureeritud valgud (juuste keratiin, lihaste müosiin) on tugivalgud.
2. Kõik valgud on reeglina suure molekulmassiga. See sõltub keskkonnatingimustest (t°, pH) ja isoleerimismeetoditest ning ulatub kümnetest tuhandetest miljoniteni.
3. Optilised omadused. Valgulahused murravad valgusvoogu ja mida suurem on valgu kontsentratsioon, seda tugevam on murdumine. Seda omadust kasutades saate määrata valgusisalduse lahuses.
Kuivate kilede kujul neelavad valgud infrapunakiiri. Neid võtavad peptiidrühmad.
^
8.2 Valkude denatureerimine
Globulaarse valgu natiivne konformatsioon on erakordselt labiilne ja allub muutustele keemiliste mõjurite või energia- ja mehaaniliste koormuste mõjul. Mõju all välised tegurid võib puruneda suur hulk sidemeid, stabiliseerides valgu molekuli ruumilist struktuuri, katkeb iga valgu jaoks ainulaadne peptiidahela järjestatud konformatsioon ja kogu valgumolekul või suurem osa sellest saab korrastamata spiraali kuju - see on denatureeritud.
^ Valkude denatureerimine - see on selle molekuli molekulisisene ümberkorraldamine, natiivse konformatsiooni rikkumine, millega ei kaasne peptiidsideme lõhustumist. Valgu aminohapete järjestus ei muutu.
Denatureerimise tulemusena rikutakse mittekovalentsete sidemetega moodustunud valgu sekundaarset, tertsiaarset ja kvaternaarset struktuuri ning valgu bioloogiline aktiivsus kaob täielikult või osaliselt, pöörduvalt või pöördumatult, olenevalt denatureerivatest ainetest, intensiivsusest. ja nende toime kestus.
^
8.2.1 Denaturatsiooni põhjustavad tegurid
Tegevuse ajal toimub denaturatsioon erinevaid tegureid mille võib jagada järgmisteks osadeks:
1. Füüsiline.
Denaturatsiooni põhjustavad kõrged temperatuurid - valgulahuse kuumutamine temperatuurini 60 ... 80 ° C. 100°C juures denatureeritakse kõik valgud. Välja arvatud kõrge temperatuur, füüsikalistest teguritest, erineva sagedusega ja looduse kiirgus mõjub valgu molekulile denatureerivalt: α-, β-, γ-kiirgus, kõrgsageduslikud voolud, ultraheli, ultraviolettkiirgus jne.
2. Keemiline.
Keemilistest teguritest põhjustavad valkude denaturatsiooni kontsentreeritud happed ja leelised, raskmetallide soolad - tina, vask, elavhõbe, arseen, kaadmium, plii, mangaan jne, samuti pindaktiivsete ainete toime polaarsete molekulidega - uurea, guanidiinkloriid. Need ained häirivad valgu molekuli stabiliseerivate sidemete loomulikku jaotumist.
3. Mehaaniline - hõõrumine, vahustamine, valgulahuste intensiivne segamine või loksutamine jne.
Denatureerimisel tekivad lisaks bioloogilise aktiivsuse kadumisele kaod või väheneb valgu lahustuvus ja veeimavus, muutub valgulahuste viskoossus, aga ka valku sisaldavate toodete mehaanilised omadused.
^ Denatureerimine võib olla:
1. Pööratav - juhul, kui valk-inhibiitori kompleks võib laguneda ja valk naaseb algsesse olekusse (väljasoolamine).
2. Pöördumatu – valgu loomulikke omadusi ei taastata. Tavaliselt toimub see spetsiifiliste denaturatsioonifaktorite toimel, kui aktiivsed rühmad seonduvad.
^ 8.2.2 Denatureerimise tähtsus toiduainete tehnoloogias
Valkude denatureerimisel on suur tähtsus paljudes toiduainetööstuse tehnoloogilistes protsessides - leiva küpsetamisel, pasta, köögiviljade, teravilja ja seemnete kuivatamisel, pressimisel taimeõli pressidel, konserveerimisel, toiduvalmistamisel toiduained ja mitmed teised.
Denatureerimise mõjul muutuvad toiduvalgud proteolüütiliste ensüümide toimele paremini ligipääsetavaks, valgu molekuli moodustavate keemiliste rühmade reaktsioonivõime suureneb, valgumolekuli kuju muutub - see “vaatab üles” või muutub sõltuvalt sellest kompaktsemaks. denaturatsiooni tingimustes suureneb valkude hüdrofoobsus.
^
8.3 Isoelektriline punkt
Valgud, nagu aminohapped, on amfoteersed elektrolüüdid, mis migreeruvad elektriväljas kiirusega, mis sõltub nende kogulaengust ja keskkonna pH-st. Iga valgu teatud pH väärtuse korral on selle molekulid elektriliselt neutraalsed. Seda pH väärtust nimetatakse valgu isoelektriliseks punktiks. Valgu isoelektriline punkt sõltub molekulis olevate laetud rühmade arvust ja olemusest. Valgu molekul on positiivselt laetud, kui söötme pH on alla selle isoelektripunkti, ja negatiivselt, kui söötme pH on kõrgem kui antud valgu isoelektriline punkt. Isoelektrilises punktis on valgul kõige väiksem lahustuvus ja kõrgeim viskoossus, mille tulemuseks on valgu kõige lihtsam sadestumine lahusest – valgu koagulatsioon. Isoelektriline punkt on üks valkude iseloomulikke konstante. Kui aga valgulahus viia isoelektrilisse punkti, siis valk ise ikkagi ei sadestu. See on tingitud valgu molekuli hüdrofiilsusest.
^
8.4 Valkude hüdrofiilsus
Valkude pinnal on erinevad hüdrofiilsed rühmad, mis tõmbavad ligi dipoolvee molekule. hüdrofiilsus erinevad rühmad erinev.
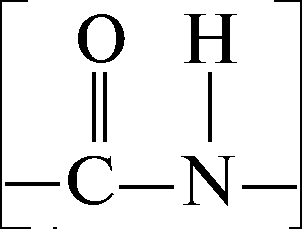
Peptiidside seob ühte veemolekuli
karboksüülrühm -COO - - 4 veemolekuli, - NH 3 -amiinrühm - 1 jne. Seetõttu on valgumolekuli ümber nn hüdratatsioonikest, mis annab valgulahustele stabiilsuse ja takistab valgumolekuli sadenemist.
^
8.5 Valkude väljasoolamine
Kui see vesikest eemaldada valgukuulikult, s.o. vähendage selle hüdratatsiooni, siis hakkavad valgumolekulid agregeeruma, moodustades suuremaid osakesi ja hakkavad oma gravitatsiooni mõjul lahusest sademe kujul välja settima.
Veekesta saab eemaldada orgaaniliste lahustite (alkohol, atsetoon) või leelis- või leelismuldmetallisoolade abil. Kuna soolade, alkoholi või atsetooni molekulid on valgugloobulitest hüdrofiilsemad, eemaldavad need valgult vesikesta, mille tulemusena see kergesti sadestub.
Kuna valgu sadestumine lahusest saavutatakse valgulahusele lisamisega piisav sooladeks nimetatakse valgu eraldamise protsessi lahusest soolade mõjul väljasoolamine. Soola sadestusvõime sõltub nii katiooni kui ka aniooni keemilisest olemusest. Katioonid ja anioonid liidetakse vastavalt nende sadestamisvõimele nn lüotroopsesse seeriasse, kuhu need paigutatakse vastavalt sadestamisvõime vähenemisele vasakult paremale.
Lüotroopne seeria:
Katioonid: C S, Rb, K, Na, Li, Ba 2, Sr 2, Ca 2, Mg 2;
Anioonid: SO 2- 4 , Сl - , Br - , NO - 3 , J - , KNS - .
Väljasoolamist kasutatakse laialdaselt valkude eraldamiseks ilma denatureerimiseta.
^
8.6 Valkude turse
Teatud tingimustel valgulahused paisuvad, muutuvad kolloidsüsteemideks - geelideks. Geelides moodustavad lahusti ja valk ühe väliselt homogeense massi, mis sarnaneb tarretisega. Kuivatatud geel, asetatuna vette, imab seda väga suurtes kogustes. Seda vee neeldumist nimetatakse geeli turse. Mängivad valkude turse protsessid oluline roll toiduainetööstuses. Tera paisumine selle töötlemisel - lukustumine, konditsioneerimine ja idanemine, jahu paisumine taigna valmistamisel, tarretiste moodustumine želatiini lisamisel erinevatele maiustused- kõik need protsessid on seotud valkude tursega. Tursele vastandnähtus, s.o. nimetatakse vee vabanemist geelist sünerees.
9 Kvalitatiivsed reaktsioonid valkudele
9.1. Miloni reaktsioon - lämmastikhappes lahustunud metallilise elavhõbeda mõju valgule ja kirsipunase värvuse saamine. Reaktsioon fenoolrühmadele.
9.2. Biureti reaktsioon - valgu leeliselisele lahusele lisatakse tilk vasksulfaati ja saadakse punakasvioletne värvus. Peptiidsideme reaktsioon.
9.3. Adamkevitši reaktsioon. Glüoksüülhappe ja tugeva väävelhappe lisamine valgule, mille tulemuseks on violetne värvus. Reaktsioon indoolirühmadele.
9.4. Ksantoproteiini reaktsioon - lämmastikhappe kollane värvumine. Reaktsioon benseenirõngastele.
9.5. Ninhüdriini reaktsioon – värvimine ninhüdriini lisamisel.
9.6. Reaktsioon väävlile - pliatsetaadi lisamisel ja kuumutamisel tekib tume värvus (väävlit sisaldavad aminohapped).
10 Valkude klassifikatsioon
Kõik looduslikud valgud(valgud) jagunevad kahte suurde klassi:
10.1 Lihtne;
10.2 Keeruline.
10.1 Lihtvalgud hüdrolüüsitakse hapete või leeliste toimel aminohapeteks ja ei anna hüdrolüüsil muid orgaanilisi ja anorgaanilisi ühendeid. Need koosnevad ainult α-aminohappe jääkidest.
Klassifikatsioon lihtsad valgud lahustuvuse alusel.
10.1.1 Albumiinid on vees lahustuvad valgud. Nende valkude hulka kuuluvad kanamuna valk, teravilja (üheiduleheliste) taimede iduvalgud ja kaheiduleheliste seemnete valgud. Vesilahustest soolatakse need valgud hästi välja ja keetes denatureerivad. Valkude nimetus on tavaliselt seotud selle taime botaanilise nimetusega, milles need paiknevad. Nisus ja riisis leiduvaid albumiine nimetatakse leukosiinideks, hernes kaunviljadeks ja riitsinusubades ritsiinideks.
10.1.2 Globuliinid- soolades lahustuvad valgud. Tavaliselt kasutatakse nende ekstraheerimiseks 10% NaCl lahust. Globuliinid moodustavad suurema osa õliseemne valkudest. Paljudel albumiinidel ja globuliinidel on ensümaatilised omadused. Maisi globuliine nimetatakse maisiiniks, ube - faseoliiniks, herneid - leguleiiniks, kanepit - edestiiniks, maapähkleid - arahhiiniks, kõrvitsaid - cucurbitiiniks.
10.1.3 Prolamiinid - valgud, mis lahustuvad 60-80% etüülalkoholi lahuses. Nime "prolamiinid" nad said tänu sellele, et need sisaldavad suur hulk proliini aminohapped. Proliine sünteesitakse ainult teraviljataimede seemnetes. Nisu prolamiini nimetatakse gliadiinideks, maisi prolamiini nimetatakse zeiinideks ja sorgot koferiinideks.
10.1.4 Gluteliinid- valgud, mis ekstraheeritakse taime kudedest lahjendatud leeliselahustega (0,2% NaOH). Nisugluteliinid on gluteniin; riisi gluteliinid on oryzeniin.
Prolamiinid ja gluteliinid moodustavad suurema osa nisugluteenist. Gluteeni ja seega ka jahu kvaliteet sõltub gliadiini ja gluteniini kogusest ja suhtest.
Lisaks nendele neljale valgurühmale nimetatakse lihtsateks ka järgmisi spetsiifiliste omadustega valke:
10.1.5 Protamiinid on väikese molekulmassiga valgud, mis koosnevad 80% aluselistest aminohapetest ja ei sisalda väävlit.
Neid valke leidub ainult kalade spermas (piimas). Molekulaarse suuruse poolest on protamiinid väikseimad valgud. Mõned neist koosnevad isegi seitsmest aminohappest, mille hulgas arginiin, proliin ja seriin moodustavad enam kui poole molekulist.
10.1.6 Histoonid- madala molekulmassiga valgud on samuti põhilise iseloomuga, sisalduvad raku tuumade kromosoomides ja mängivad olulist rolli kromatiini struktuuri kujunemisel. Histoonid on tõelised valgud, need sisaldavad peaaegu kõike valkude aminohapped. Neid iseloomustab suur asendamatute aminohapete sisaldus: umbes iga neljas aminohape on arginiin või lüsiin. Need paiknevad taimedes raku tuumas, ribosoomides ja mitokondrites, kus nad täidavad nende organellide struktuurielementide rolli.
10.2. Komplekssed valgud lisaks molekuli valguosa aminohappejääkidele sisaldavad need ka mittevalgulist ehk proteesirühma. Proteesirühma võivad esindada erineva iseloomuga kemikaalid (tabel 1). Komplekssed valgud klassifitseeritakse nende mittevalgukomponendi järgi.
Sidemed valgu polüpeptiidahelate ja proteesrühma vahel võivad olla kovalentsed või mittekovalentsed.
Tabel 1
Mõnede komplekssete valkude proteesrühmad
Kompleksvalk ehk holoproteiin võib olenevalt oma keemilisest olemusest dissotsieeruda valguosaks ehk apoproteiiniks ja proteesrühmaks:
Holoproteiin Apoproteiin Proteesirühm
Komplekssetest valkudest eristuvad lipoproteiinid ja nukleoproteiinid väga suure struktuurse keerukusega, moodustades elusrakus supramolekulaarseid struktuure, mille spetsiifilise korralduse määrab biokeemilised protsessid mis toimub nende valkude osalusel.
Valgu molekulil on nelja tüüpi struktuurne korraldus - primaarne, sekundaarne, tertsiaarne ja kvaternaarne.
Esmane struktuur
Lineaarne struktuur, mis on rangelt määratletud geneetiliselt määratud aminohappejääkide järjestus polüpeptiidahelas. Peamine suhtlusviis peptiid (peptiidsideme moodustumise mehhanismi ja omadusi käsitletakse eespool).
Polüpeptiidahelal on märkimisväärne paindlikkus ja see omandab ahelasisese interaktsiooni tulemusena teatud ruumilise struktuuri (konformatsiooni).
Valkudes eristatakse kahte peptiidahelate konformatsiooni taset - sekundaarset ja tertsiaarset struktuuri.
Valgu sekundaarne struktuur
See on polüpeptiidahela paigutamine järjestatud struktuuri, mis on tingitud vesiniksidemete moodustumisest ühe polüpeptiidahela või külgnevate ahelate peptiidrühmade aatomite vahel.
Sekundaarse struktuuri moodustumisel tekivad peptiidrühmade hapniku- ja vesinikuaatomite vahel vesiniksidemed:
Konfiguratsiooni järgi on sekundaarne struktuur jagatud kahte tüüpi:
spiraal (α-heeliks)
kihiline (β-struktuur ja rist-β-vorm).
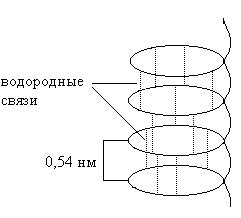
α-heeliks näeb välja nagu tavaline spiraal. See moodustub peptiidsete vesiniksidemete tõttu ühes polüpeptiidahelas (joonis 1).
Riis. 1. α-heeliksi moodustumise skeem
α-heeliksi peamised omadused:
– iga esimese ja neljanda aminohappejäägi peptiidrühmade vahel moodustuvad vesiniksidemed;
- heeliksi pöörded on korrapärased, ühes pöördes on 3,6 aminohappejääki;
– aminohapete kõrvalradikaalid ei osale α-heeliksi moodustamises;
– kõik peptiidrühmad osalevad vesiniksideme moodustumisel, mis määrab α-heeliksi maksimaalse stabiilsuse;
– kuna kõik peptiidrühmade hapniku- ja vesinikuaatomid osalevad vesiniksidemete moodustamises, viib see α-spiraalsete piirkondade hüdrofiilsuse vähenemiseni;
– α-heeliks tekib spontaanselt ja on polüpeptiidahela kõige stabiilsem konformatsioon, mis vastab minimaalsele vabaenergiale;
- vältida α-heeliksi proliini ja hüdroksüproliini moodustumist - nende asukohtades α-heeliksi korrapärasus katkeb ja polüpeptiidahel paindub (katkeneb) kergesti, kuna seda ei hoia teine vesinikside (joon. . 2).
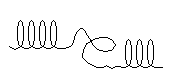
Riis. 2. α-heeliksi regulaarsuse rikkumised
Proliini α-iminorühma lämmastikuaatom jääb peptiidsideme tekkimisel ilma vesinikuaatomita, mistõttu ta ei saa osaleda vesiniksideme tekkes. Kollageeni polüpeptiidahelas on palju proliini ja hüdroksüproliini (vt lihtsate valkude klassifikatsiooni – kollageen).
α-heeliksi kõrge sagedus on iseloomulik müoglobiinile ja globiinile (valk, mis on hemoglobiini osa). Keskmine kerajas(ümmargused või elliptilised) valgud on spiraliseerumisaste 60–70%. Spiraalsed lõigud vahelduvad kaootiliste mähistega. Valkude denaturatsiooni tulemusena suurenevad heeliksi → spiraali üleminekud. Spiraliseerimiseks(α-heeliksi moodustumine) mõjutada aminohappe radikaalid, mis moodustavad polüpeptiidahela, näiteks üksteise lähedal asuvad negatiivselt laetud glutamiinhappe radikaalide rühmad, need tõrjuvad ja takistavad α-heeliksi teket (tekib spiraal). Samal põhjusel takistavad tihedalt asetsevad arginiin ja lüsiin, mille radikaalides on positiivselt laetud funktsionaalrühmad, α-heeliksi moodustumist (vt protamiinide ja histoonide näidet).
Aminohapperadikaalide suured suurused (näiteks seriini, treoniini, leutsiini radikaalid) takistavad ka α-heeliksi teket.
Seega on α-heeliksite sisaldus valkudes erinev.
β-struktuur (kihiliselt volditud) - on polüpeptiidahela kergelt kõvera konfiguratsiooniga ja moodustatakse peptiidsete vesiniksidemete abil ühe polüpeptiidahela või külgnevate polüpeptiidahelate üksikutes osades. β-struktuuri on kahte tüüpi:
– juurdeross-β-vorm(lühike β-struktuur) - on valgu ühest polüpeptiidahelast moodustatud piiratud kihilised alad (joonis 3).
Riis. 3. Valgu molekuli rist-β-vorm
Enamik globulaarseid valke sisaldavad lühikesi β-struktuure (kihilisi piirkondi). Nende koostist saab esitada järgmiselt: (αα), (αβ), (βα), (αβα), (βαβ).
– täielik β-struktuur. See tüüp on iseloomulik kogu polüpeptiidahelale, millel on piklik kuju ja mida hoiavad omavahel peptiidsed vesiniksidemed. seotud paralleelselt või antiparalleelne polüpeptiidahelad (joonis 4).
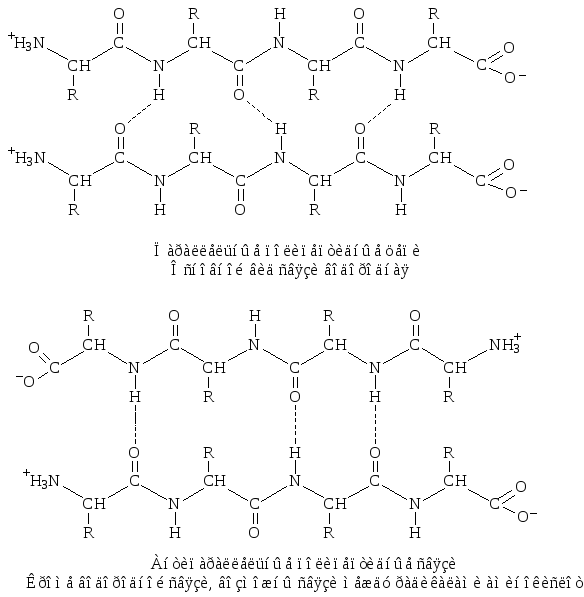
Riis. 4. Täielik β-struktuur
Antiparalleelsetes struktuurides on sidemed stabiilsemad kui paralleelsetes.
Regulaarse β-struktuuriga valgud on seedetraktis vastupidavamad, halvasti või üldse mitte seeduvad.
Sekundaarse struktuuri (α-heeliks või β-struktuur) moodustumise määrab polüpeptiidahela aminohappejääkide järjestus (st valgu primaarstruktuur) ja seetõttu on see geneetiliselt ette määratud. Aminohapped nagu metioniin, valiin, isoleutsiin ja asparagiinhape soodustavad β-struktuuri moodustumist.
Täieliku β-struktuuriga valkudel on fibrillaarne(filamentne) vorm. Täielik β-struktuur leidub tugikudede (kõõluste, naha, luude, kõhre jne) valkudes, keratiinis (juukse- ja villavalk) (üksikute valkude omaduste kohta vt jaotist "Toortoidu valgud materjalid").
Kuid mitte kõigil fibrillaarsetel valkudel pole ainult β-struktuur. Näiteks α-keratiin ja paramüosiin (mollusk obturator lihasvalk), tropomüosiin (skeletilihase valk) kuuluvad fibrillaarsete valkude hulka ja nende sekundaarne struktuur on α-heeliks.
Valgumolekulide biosüntees toimub rakkude ribosoomides aminohappejääkide järjestikuse ühendamise teel peptiidsidemega. Nende asukoha järjestuse määravad DNA molekulid, M-RNA ja teised, mis kannavad pärilikku teavet. Sünteesi edenedes hiilib polüpeptiidahel väikesest ribosoomist välja tsütoplasmasse. Tsütoplasmas on painduv valgu molekul ühel või teisel kujul - konformatsiooni või sekundaarse struktuuriga, säilitades samal ajal kõik kovalentsed sidemed tänu oma esmasele struktuurile.
Suurte valgumolekulide võrdlev paindlikkus avaldub paljude võimalike konformatsioonide olemasolus, mis välistingimuste muutumisel muutuvad üksteiseks. Selles suhtes erinevad valgu molekulid oluliselt klassikalise orgaanilise keemia väikestest orgaanilistest molekulidest.
Valgumolekulide üks olulisemaid ja huvitavamaid sekundaarstruktuure on a-spiraalne struktuur, mille määrasid esmakordselt Pauling ja Corey 1953. aastal. See tekib valgu molekuli peptiidrühmade vaheliste molekulisiseste vesiniksidemete toimel.
Pauling ja Corey näitasid, et a-spiraalne struktuur, st peptiidahela voltimine spiraaliks, on tingitud kolmest vesiniksidemete ahelast (joonis 14) peptiidrühmade vahel. Esimene ahel seob esimese peptiidrühma vesiniku neljanda hapnikuga, neljanda vesiniku - seitsmenda hapnikuga jne. Teine vesiniksidemete ahel viiakse läbi teise peptiidrühma vesiniku vahel. viienda hapnikuga, viienda vesinikuga - kaheksanda hapnikuga jne. Kolmas vesiniksidemete ahel toimub sidemed kolmanda pentiidrühma vesiniku ja kuuenda rühma vesiniku vahel, vesiniku vesiniku vahel. kuues üheksanda hapnikuga jne. Selle tulemusena moodustub parempoolne spiraal sammuga 5,6 A ja läbimõõduga 4,56 A. 18 aminohappejääki. Kõik radikaalid asuvad spiraali välisküljel.
Riis. 14. Kolm vesiniksidemete ahelat a-spiraalses valgumolekulis; O - hapnik; - vesinik; - lämmastik; peptiidirühmad saavad sissetulevate ja nende süsinikuaatomite arvud.
Peptiidrühmade vahelise ühe vesiniksideme moodustumise energia on umbes 0,21 eV. Seetõttu on see vesinikside nõrk tüüpi. Väike nihe peptiidirühma aatomite iseloomulikes infrapunavibratsioonides viitab ka madalale sidumisenergiale. Vesiniksideme moodustumisel muutuvad vastavalt võnkesagedus ja võnkesagedus võrdseks (amiid I).
Amiid I vibratsioonil on energia, mis on võrdne ja suur elektriline dipoolmoment. Mõõtmiste kohaselt töötasid Yu. N. Chirgadze ja E. P. Raševskaja välja meetodi valkude sekundaarstruktuuri kvantitatiivseks analüüsimiseks vesilahustes ja kristallides, mis põhinevad Amiidi vibratsioonist põhjustatud neeldumisriba polarisatsiooni ja intensiivsuse mõõtmisel. I.
Valgud ja polüpeptiidid, mille radikaalid ei sisalda aromaatseid rühmi, neelavad valgust spektri kaugemas ultraviolettpiirkonnas. See neeldumine on tingitud peptiidrühma -elektronide kvantüleminekutest, mis osalevad täiendava sideme moodustumisel C- ja N-aatomite vahel.Neeldumisribad vastavad sagedustele 52600, 60600 ja
pikema lainepikkusega ergastusenergia on ligikaudu 6,52 eV. Kvantüleminekut iseloomustab suur ülemineku dipoolmoment
A-spiraalses valgumolekulis jaguneb see neeldumisriba kaheks ribaks, mille maksimumid on lainepikkuste vahemikus 1980 A ja 1890 A. Need on polariseeritud vastavalt piki ja risti molekuli. Moffitt (J. Chem. Phys., 1956, 25, 467) näitas, et see niinimetatud Davõdovi lõhenemine on tingitud molekulis perioodiliselt paiknevate peptiidirühmade resonantsinteraktsioonist. Tellimuse jagamise summa
Kui valgu primaarstruktuuris on iminohappejääk - proliin (8.2), siis vastavas peptiidirühmas vesinikku ei ole, kuna proliinis on lämmastikuaatomis ainult üks vesinikuaatom, mis peptiidi moodustumise käigus eraldub. side veemolekuli vabanemisega. Sellise peptiidrühma lämmastikuaatom ei saa moodustada vesiniksidet naaberrühma hapnikuaatomiga. Seetõttu on proliini asukohas a-heeliksi struktuur katki - tekib spiraali "katkestus".
Spiraalse struktuuri painutused tekivad sageli ka kõige lihtsama aminohappe - glütsiini (Gly) jäägi kohtades, mille radikaal sisaldab ainult vesinikuaatomit. Sellist valgumolekuli spiraalse struktuuri rikkumist täheldatakse kõige sagedamini Gly jäägi läheduses, kui selle kõrval on Ser jäägid,
Struktuuri stabiliseerimine spiraalse struktuuri katkiste osadega (kohalike painutustega spiraal) toimub molekuli naaberosade külgmiste radikaalide vahel tekkivate keemiliste ja vesiniksidemete tõttu. Keemilistest sidemetest on kõige olulisem disulfiidside (S-S), mis tekib kahe radikaali väävliaatomite vahel. Selline side võib tekkida SH-rühmi sisaldavate tsüsteiinijääkide lähenemise ja oksüdatsiooni (vesinikuaatomi kadumise) ajal. Võimalikud on ka sidemed karboksüülrühmi sisaldavate radikaalide ja teiste OH- ja NH-rühmi sisaldavate radikaalide vahel.
Valgu sekundaarstruktuuri kujunemisel mängib olulist rolli ka elektrostaatiline interaktsioon elektrilaenguid kandvate radikaalide vahel. Negatiivsed laengud saadakse asparagiinhappe ja glutamiini aminohappejääkide radikaalide poolt vees dissotsiatsiooni käigus. Aluseliste aminohapete jäägid on positiivselt laetud! histidüül, lüsüül, arginüül. Dissotsiatsiooniprotsess sõltub söötme pH-st.
Elektrilised vastasmõjud kauglaengute vahel suurel määral veega varjestatud. Lähenedes aga
Valgumolekulide beeta struktuur, mis koosneb neljast antiparalleelsest ahelast.
vastupidiselt laetud radikaalid, nende hüdraatunud kestad hävivad ja tekivad nn soolasidemed. Gibbsi vaba energia suurenemine soolasildade moodustumisel on tingitud nii Coulombi interaktsioonist kui ka veestruktuuri imputatsioonist hüdraadi kestade hävitamise ajal.
Enamikul valkudel on füsioloogilise pH juures negatiivne laeng. Mõned kromosoomide valgud sisaldavad palju lüsiini ja asparginüüli, mistõttu on need füsioloogilistes tingimustes positiivselt laetud.
Polüpeptiidahela painutuste ja selle üksikute sektsioonide järgneva lähenemisega on peptiidrühmade vahel võimalik pigem põikisuunaliste vesiniksidemete moodustumine, mitte pikisuunalised sidemed, mis viivad a-spiraalse struktuurini. Sel juhul asetsevad polümeerahela mõlemad osad üksteisega paralleelselt või antiparalleelselt (joonis 15). Seda tüüpi vesiniksidemeid peptiidrühmade vahel nimetatakse -vormiks. See on tüüpiline paralleelsete ja antiparalleelsete virnastatud polüpeptiidstruktuuride jaoks valgugloobulites ja kunstlikult moodustatud polümeerides: nailon, nailon jne.
Hüdrofoobsed ja hüdrofiilsed interaktsioonid veega mängivad olulist rolli a-spiraalse struktuuri häiritud piirkondadega valgumolekuli stabiilse vormi moodustamisel. Need interaktsioonid viivad selleni, et molekul voldib palliks - kerakeseks, mille pinnal on peamiselt hüdrofiilsete radikaalidega (glutamiin, türosiin jne) alad ja sees hüdrofoobsete radikaalidega (leutsiin, alaniin, fenüülalaniin) jne) .
Mõned autorid viitavad valgumolekuli sekundaarstruktuurile kui struktuurile, mis on tingitud ainult peptiidahelas olevate aatomirühmade vastastikmõjudest (vesinik-, keemilised, ioonsidemed, disulfiidsillad jne). Kogu valgumolekuli konformatsioon, mis on tingitud selle interaktsioonist vesikeskkonnaga, viitab tertsiaarsele struktuurile. Meile tundub, et selline jaotus on üsna meelevaldne.
Üldjuhul määrab valgu molekuli sekundaar- ja tertsiaarstruktuurid selle esmane struktuur, st koostis.
ja aminohappejääkide paigutus piki selle polüpeptiidahelat. Selline struktuur luuakse pärast kogu valgu molekuli sünteesi lõppu ribosoomil. Teisisõnu, samas välised tingimused erineva primaarstruktuuriga valkudel on ka erinevad sekundaarsed ja tertsiaarsed struktuurid – konfiguratsioon ehk konformatsioon x. See konformatsioon vastab valgu molekulist ja selle keskkonnast koosneva süsteemi minimaalsele vaba Gibbsi energiale. Kuna valgu molekuli kuju oleneb sisuliselt tema vastasmõjust väliskeskkonnaga (vesi, teised molekulid), siis võib sama valk olla erinevates välistingimustes erineva konformatsiooniga.
O. B. Ptitsyni ja mitmete teiste autorite töödes pakuti välja meetod valgu sekundaarstruktuuri ennustamiseks selle primaarstruktuurist. Samale probleemile on pühendatud ka V. Limi uurimused. Nende uuringute tulemusena leiti, et hüdrofoobseid rühmi sisaldavatest piirkondadest on gloobuli sees võimalik pikkade spiraalide moodustumine. Gloobuli pinnal asuvad molekuli lõigud on samuti spiraalsed, kui nende hüdrofoobsed radikaalid on suunatud kera sisse ja hüdrofiilsed on kokkupuutes veega.
Mõnel juhul kombineeritakse mitu peptiidahelat disulfiidsildade, vesinik- ja ioonsidemete ning van der Waalsi interaktsioonide kaudu üheks molekuliks. Sellised on näiteks hemoglobiini molekulid, mis on osa vere punalibledest (erütrotsüütidest). Need koosnevad neljast peptiidahelast (vt punkt 9.1). Sel juhul räägitakse valgumolekuli kvaternaarsest struktuurist.
Kvaternaarse struktuuriga molekulid sisaldavad palju ensüüme, mis katalüüsivad rakkudes toimuvaid bioloogilisi reaktsioone (vt § 9). Näiteks ensüüm fosforülaas vastutab
glükogeeni sisenemiseks ja lagundamiseks rakkudesse, koosneb kahest peptiidahelast molekulmassiga 96 000 daltonit. Ja ensüüm aspartüültranskarbomülaas, mis on osa tsütidiintrifosfaati (CTP) sünteesivast süsteemist, koosneb 12 polümeerist. Neist kuue molekulmass on 35 000 daltonit ja ülejäänud kuue molekulmass on 17 000 daltonit. Kvaternaarse struktuuriga valkude olemasolu on nende füsioloogilise aktiivsuse seisukohalt äärmiselt oluline (vt lõik 9.3).
Valgu molekulid ühendatakse mõnikord keerukamateks struktuurideks. Näiteks a-spiraalsed valgumolekulid on sageli keerdunud paarikaupa sekundaarseteks heeliksiteks. Globulaarsed valgumolekulid võivad ise moodustada spiraalseid struktuure. Selline on näiteks aktiini filamentide struktuur lihaskiud(vt p 19.2).
Sekundaarne ja palju muud kõrge tase struktuurid on tingitud nõrkadest vesiniksidemetest, hüdrofoobsetest, hüdrofiilsetest ja van der Waalsi vastasmõjudest. Seetõttu hävivad need struktuurid kuumutamisel temperatuurini 60-70 ° C. Esmase struktuuri hävitamiseks ilma ensüümide osaluseta on vaja kõrgemaid temperatuure.
Struktuuride sekundaarse ja kõrgema taseme hävitamise protsessi, säilitades samal ajal molekuli esmase struktuuri, nimetatakse valgu denaturatsiooniks. Keedetud ja praetud toidud sisaldavad denatureeritud valke. Valgumolekulide denatureerimine võib toimuda ka ultraviolettkiirguse, raskmetallide soolade ja mõnede orgaaniliste ühendite kokkupuutel. Denatureerimise käigus kaotab valk oma bioloogilised funktsioonid.
Võimalik ka oluline muutus valgumolekuli struktuurid ("osaline denaturatsioon") veepinnal ning vesi- ja mittevesikeskkonna vahelisel kokkupuutel. Veepinnale sattudes muudab kerakujuline molekul oma kuju. See "rullub lahti" kahemõõtmeliseks struktuuriks, nii et mittepolaarsed rühmad tulevad veest välja, polaarsed ja laetud rühmad aga jäävad vette. Selle "pinna denaturatsiooni" tulemusena muutub globulaarne valgumolekul reaktiivsemaks, kuna paljastatakse varem vees peidetud rühmad. Üldiselt muutub valgu molekuli kuju ka vee ja mõne muu suure molekulaarstruktuuri, näiteks ensüümi, vahelisel liidesel.
Hüdrofoobse ja hüdrofiilse interaktsiooni tõttu toimub valgu molekulide joondamine bioloogilistes membraanides vesikeskkonna ja topeltlipiidi (rasva) kihi piiril (vt § 12).