Основні характеристики амінокислот білків, що входять до складу. Амінокислоти, що входять до складу білків, їх будова, властивості
Білки – полімерні молекули, в яких мономерами служать амінокислоти. У складі білків в організмі людини зустрічають лише 20 альфа-амінокислот. Одні й ті ж амінокислоти присутні в різних за структурою та функціями білків. Індивідуальність білкових молекул визначається порядком чергування амінокислот у білку.
Амінокислотами називаються органічні кислоти, що містять одну або декілька аміногруп.
Всі α-амінокислоти, крім амінооцтової (гліцину), мають асиметричний α-вуглецевий атом і існують у вигляді двох енантіомерів. Практично всі білки побудовані з 20 α-амінокислот, що належать за винятком гліцину до L-ряду.
||По фізичним та ряду хімічних властивостей амінокислоти різко відрізняються від відповідних кислот та основ. Вони
· краще розчиняються у воді, ніж в органічних розчинниках;
· добре кристалізуються;
· мають високу щільність
· високі температуриплавлення.
Ці властивості вказують на взаємодію амінних та кислотних груп, внаслідок чого амінокислоти у твердому стані та в розчині (у широкому інтервалі рН) знаходяться у цвіттер-іонній формі (тобто як внутрішні солі).
Усі амінокислоти відрізняються характером радикала, який може бути ациклічним або циклічним. До складу радикала може входити додатково друга карбоксильна група (такі амінокислоти називаються моноамінодикарбонові МАДК) або дві амінні групи (діаміномонокарбонові ДАМК). У складі окремих амінокислот можуть бути гідроксильні групи (серин, треонін), сульфгідрильна (цистеїн), метильна (метіонін).
Таблиця 1. Найважливіші амінокислоти.
Більшість амінокислот, що беруть участь в обмінних процесах і входять до складу білків, можуть надходити з їжею або синтезуватися в організмі в процесі обміну (з інших амінокислот, що надлишають). Вони називаються замінними. Деякі амінокислоти не можуть синтезуватися в організмі і повинні надходити з їжею. незамінніамінокислоти. Таких амінокислот дев'ять (гістидин, триптофан, фенілаланін, лізин, метіонін, треонін, ізолейцин, лейцин, валін).
4.Молекулярна маса білків. Розміри та форма білкових молекул.
Первинна структурабілків у значною міроювизначає вторинну, третинну структури та особливості четвертинної структури. У свою чергу, первинна та просторова структури білків, їх молекулярна маса, форма та розміри зумовлюють їх фізико-хімічні властивості.
Розмір білка може вимірюватися в числі амінокислотних залишків або в дальтонах (молекулярна маса), але із-за відносно великої величини молекули маса білка виражається у похідних одиницях - кілодальтонах (кДа). Молекулярна маса білків досить велика, тому вони відносяться до високомолекулярних сполук. Молекулярна маса білків коливається від 6 000 до 1 000 000 Дальтон і вище, вона залежить від кількості амінокислотних залишків у поліпептидному ланцюгу, а для олігомерних білків, що мають четвертинну структуру – від кількості протомерів (субодиниць), що входять до них.
Молекулярна маса деяких білків становить:
· Інсулін - 5700Д,
· Пепсин-35 000Д,
· Гемоглобін - 65 000Д.
Молекулярну масу білка можна визначити за швидкістю седиментації при ультрацентрифугуванні, тобто. при прискоренні 100 000-500 000 G . На підставі цього визначають коефіцієнт седиментації, який позначають S (на честь шведського вченого СВЕДБЕРГА). Молекулярна маса більшості білків коливається в межах 1-20S.
![]()
Іншим методом визначення молекулярної маси є метод гельфільтрації (молекулярне просіювання). Використовується штучно створені гранули, що мають пори (гранули СЕФАДЕКСУ). Всередину гранули можуть проникати лише сполуки певного розміру: молекули невеликого розміру входять у гранули, а більші швидше вимиваються. Молекулярна маса розраховується орієнтовно. Буфер не затримується, а білок рухається тим повільніше, що менше молекулярна маса.
Білки мають різну форму, але виділяють дві основні групи:
· глобулярні (кулясті). Більш компактні, в цих білках гідрофільні групи розташовані переважно зовні, а гідрофобні - всередині, утворюючи ядро, водорозчинні згортаються при нагріванні, нейтральні, порівняно важко осаджуються розчинами солей. (Глобулін, Альбумін)
· Фібрилярні (веретеноподібні). Утворюють полімери, їх структура зазвичай високорегулярна і підтримується переважно взаємодіями між різними ланцюгами. Вони утворюють мікрофіламенти, мікротрубочки, фібрили, підтримують структуру клітин та тканин. (Актін, Міозін)
На основі відмінностей білків у молекулярній масі, розмірів та формі їх можна розділити за допомогою ультрацентрифугування (за швидкістю седиментації), методом гель – фільтрації (молекулярного просіювання в сефадексі).
Вітаю вас, друзі мої! Сьогодні я хотіла б поговорити з вами ось на тему, скільки всього амінокислот існує. І які потрібні нашому організму? Справа в тому, що багато моїх подруг стали прихильницями монодієт. Я хотіла б довести, що не можна від усього відмовитися. Виняток певної частини продуктів негативно впливає нашу красу.
Білки є незамінними поживними речовинами в будь-якій здорової дієти. Усі білки складаються з будівельних блоків, які називаються амінокислотами. Це начебто цеглинок для будівництва будинку. Але не всі білки у своєму раціоні містять амінокислоти, які нам потрібні.
Якщо ви подивитеся на білок під мікроскопом, він виглядатиме у вигляді ланцюжка з амінокислот, з'єднаних пептидним зв'язком. В організмі людини органічні кислоти грають роль цеглинок, з яких створюється та ремонтується м'язова тканина, волосся та шкіра.
Ще десятки років тому вчені знали лише три-чотири речовини. Наразі відомо, що існує понад 200 органічних кислот. У останні рокизнаходять ще більше застосуваннядля амінокислотних функцій Наприклад, кератин, що міститься в нашому волоссі і нігтях допомагає розробити з'єднання, що використовується у вигляді пластика, що біорозкладається.
Однак для стабільної життєдіяльності організму потрібно 22 протеїногенні амінокислоти, які поділяються за категоріями:
- замінні – самостійно синтезуються у нашому організмі;
- незамінні - надходять ззовні (продукти, харчові добавки).
Ця класифікація не позбавлена недоліків. Наприклад, аргінін може створюватися у нашому організмі, вважаючись замінною кислотою. Тільки з деякими особливостями метаболізму та в деяких фізіологічних станахприрівнюється до незамінних.
Також і гістидин, який синтезується, тільки в великих кількостях. Тому його потрібно вживати з їжею.
Незамінні
Цей вид речовин не може синтезуватись у тілі людини самостійно. Тому необхідно отримувати їх із їжі. Найбільше їх утримують білки тваринного походження. Якщо організм відчуває нестачу якогось елемента, то починає споживати з інших джерел. Наприклад, з м'язової тканини. Основний наголос робиться на функціонування двох органів – мозку та серця. Найчастіше - на шкоду іншим. Докладніше ви можете прочитати в моїй статті про . Зараз я зроблю побіжний огляд.

Лише три амінокислоти (ізолейцин + лейцин + валін) становлять майже 70% усіх органічних кислот в організмі. Тому їхнє значення в організмі людини настільки високо. У спортивному харчуванні є навіть спеціальний BCAA комплекс, що містить ці три компоненти.
Лейцинбере участь у захисті та відновленні м'язів, кісток, шкірних покривів. Завдяки йому виділяється гормон зростання. Керує рівнем цукру та допомагає спалюванню жиру. Міститься у бобових, м'ясі, горіхах, рисі (нешліфованому) та зернах пшениці. Завдяки своїй здатності стимулювати синтез білка, лейцин допомагає стимулювати нарощування м'язової масита сприяє жироспаленню. Найкращі харчові джерела лейцину, включають будь-який білок із тварин, які, природно, містять усі незамінні амінокислоти.
Ізолейциніснує у білках і прискорює вироблення енергії. Його дуже "люблять" спортсмени. Після виснажливих тренуваньдопомагає швидкій регенерації м'язової тканини. Знімає неприємний больовий синдром. Бере участь у освіті гемоглобіну, регулює кількість глюкози. Джерела: м'ясні та рибні продукти, яйця, горіхи, горох, соя. У спортивне харчуванняміститься у BCAA концентратах.
PS: думаю, вам буде цікаво, в яких продуктах харчування містяться амінокислоти і скільки?
Білки- то високомолекулярні азотовмісні органічні сполуки, що складаються із залишків амінокислот, з'єднаних пептидними зв'язками. Іншими словами, білки – це полімери, мономерами яких є амінокислоти.
Білки побудовані із сотень або тисяч амінокислотних залишків, з'єднаних пептидними зв'язками. Різноманітність білків, що існують у природі, залежить від особливостей амінокислотного складу, кількості амінокислотних залишків та порядку їх поєднання
Загальна характеристика амінокислот.
Загалом у природі виявлено близько 300 амінокислот. За здатністю входити до складу білків амінокислоти бувають:
1) Протеїногенні(Протеїн - білок; генезис - дає, що народжує). Кількість білкових або протеїногенних амінокислот становить відносно невелика: в живих організмах є 20 основних протеїногенних амінокислот. Крім стандартних 20 амінокислот, у білках зустрічаються і модифіковані амінокислоти, які є похідними звичайних амінокислот.
2)Непротеїногенні(До складу білків не входять); бувають α, β та γ.
Усі білкові амінокислотиє α-амінокислотами з характерною загальною структурною особливістю: наявністю карбоксильної та амінної груп, пов'язаних з атомом вуглецю в α-положенні.
Крім карбоксильної та аміногруп, кожна амінокислота має радикал, який у різних амінокислот неоднаковий за структурою, електричним зарядом та розчинністю.
Класифікація протеїногенних амінокислот.
Існує кілька класифікацій протеїногенних амінокислот, в основі яких покладені різні критерії. Розглянемо лише деякі з них:
1) Класифікація за електрохімічною природою радикала (R):
а) не полярні амінокислоти(їх 8) - гідрофобні (нерозчинні у воді): аланін (ала); валін (вал); лейцин (лей); ізолейцин (мулі); пролін (про); фенілала-нін (фен); триптофан (три); метіонін (мет);
б) полярні амінокислоти (їх 12) – розчиняються у воді; у свою чергу вони поділяються на:
- незаряджені (їх 7): гліцин (глі); серин (сір); треонін (три); цис-теїн (цис); тирозин (тир); аспарагін (асп); глутамін (глн);
– заряджені негативно (їх 2): аспарагінова кислота (асп); глутамінова кислота (глу);
- заряджені позитивно (їх 3): лізин (ліз); гістидин (гіс); аргінін (арг).
2) Класифікація за здатністю синтезуватися в організмі людини та тварин:
а) незамінні (не синтезуються в організмі, тому повинні надходити з їжею, їх 8): валін, лейцин, ізолейцин, триптофан, фенілаланін, метіонін, треонін, лізин);
б) замінні (синтезуються у організмі) – їх 12.
Біологічна роль амінокислот.
Крім того, що амінокислоти є структурними блоками білків, вони використовуються в живих організмах для синтезу різноманітних речовин. Різні амінокислоти(як протеїногенні, так і непротеїногенні) є попередниками пептидів, азотистих основ, гормонів, вітамінів, ней-ромедіаторів, алкалоїдів та інших найважливіших сполук. Так, наприклад, із триптофану синтезуються вітамін РР (нікотинова кислота) та серотонін, з тирозину – такі важливі гормони, як адреналін, норадреналін, тироксин. З амінокислоти валін утворюється вітамін В3 (пантотенова кислота). Амінокислота пролін є сполукою, що захищає живі клітини від багатьох стресів (у тому числі окислювального).
рівні організації білкових молекул (структура білків).
Існує 4 основні рівні організації білкових молекул:
- Первинна структура
Первинна структура білка є поліпептидним ланцюгом, що складається з амінокислотних залишків, з'єднаних пептидними зв'язками:
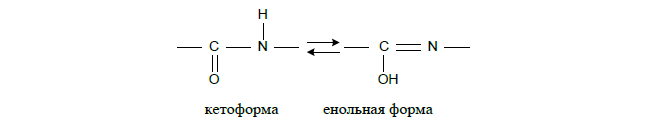
Пептидна зв'язок характеризується такими властивостями:
1) атоми Про і Н пептидного зв'язку мають трансорієнтацію;
2) чотири атоми пептидного зв'язку лежать у одній площині, тобто. для пептидного зв'язку характерна компланарність;
3) пептидна зв'язок у молекулі білка виявляє кето-єнольну таутомеризацію;
4) довжина C-N-зв'язку, рівна 0,13 нм, має проміжне значення між довжиною подвійного ковалентного зв'язку (0,12 нм) і одинарного ковалентного зв'язку (0,15 нм), з чого випливає, що обертання навколо осі C-Nутруднено;
5) пептидна зв'язок міцніше звичайної ковалентної, т.к. вона є полуторною (через перерозподіл електронної щільності).
Для кожного індивідуального білка послідовність амінокислот поліпептидного ланцюга є унікальною. Вона визначається генетично і у свою чергу визначає більш високі рівніорганізації даного білка.
- Вторинна структура
Вторинна структура білка є способом укладання поліпептидного ланцюга в упорядковану форму за рахунок системи водневих зв'язків. Поліпептидна ланцюг мимоволі скручується і набуває більш енергетично вигідної форми. Вторинна структура білків має два основні різновиди:
1) α-спіраль (як правило, правозакручена); стабілізується між киснем карбонільною групою та воднем аміногрупи.
Між Н та О утворюється водневий зв'язок. Вона слабка, але оскільки цих зв'язків багато, ця структура стійка. Кожна пептидна група бере участь у освіті двох водневих зв'язків.
Гідрофільні радикали R виявляються назовні, а гідрофобні радикали R1 знаходяться всередині спіралі (ховаються від розчинника).
2) β – складчастий шар. При утворенні цієї структури кілька поліпептидних ланцюгів, не згортаючись в α-спіраль, зв'язуються міжланцюжковими водневими зв'язками. Наприклад, така структура має β-кератини (входять до складу шовку). β-складчаста структура виникає між суміжними поліпептидними ланцюгами. При взаємодії між собою вторинних структурможе утворюватися надвторинна структура (суперспіраль). Наприклад, суперспіралізована α-спіраль зустрічається у фібрилярних білках.
- Третинна структура
Третинна структура білків є глобулу і характерна для глобулярних білків. На третинному рівні організації виникає активний центр і білок набуває функціональної активності.
Зв'язки, що стабілізують третинну структуру:
1) дисульфідна (виникає між радикалами цистеїну; цей зв'язок міцний, але здатний легко відновлюватися);
2) іонна (утворюється між зарядженими радикалами амінокислот);
3) воднева (виникає між радикалами полярних амінокислот);
4) ізопептидна (утворюється між карбоксильною та аміногрупою радикала);
5) гідрофобна взаємодія (між гідрофобними амінокислотами).
У глобули полярні радикали у гідратованому стані знаходяться зовні, гідрофобні радикали всередині.
У межах глобули часто виділяють домени – ділянки поліпептидного ланцюга, які самостійно від інших ділянок того ж ланцюга утворюють структуру, яка багато в чому нагадує глобулярний білок.
- Четвертична структура
Четвертична структура характерна лише для олігомерних білків (олігомерні білки – білки, що складаються з кількох поліпептидних ланцюгів).
Протомір - поліпептидний ланцюгу складі олігомерного білка. Четвертична структура - характерний спосіб розташування протомерів олігомерного білка. Активний центр виникає при поєднанні протомірів. Наприклад, четвертинну структуру має гемоглобін – білок крові, що міститься в еритроцитах (переносить кисень).
амінокислоти.
Амінокислоти– мономери білків. Назви амінокислот виробляють від назв відповідних карбонових кислот з приставкою аміно-. -. Усі амінокислоти, що входять до складу білків, мають тривіальну назву. Усі a – амінокислоти мають загальну формулу: Загальна формула амінокислотЗалежно від будови радикалу амінокислоти розбивають на групи, наприклад: амінокислоти, що містять сірки (цистеїн, метіонін), ароматичні амінокислоти (триптофан, тирозин) і т.д. Для амінокислот характерна ізомерія: вуглецевий скелет, положення функціональної групи, оптична ізомерія.Амінокислоти, що входять до складу білків.
| амінокислота. | - R |
| Гліцин | - H |
| Аланін | - СH 3 |
| Валін | - CH(CH 3) 2 |
| Лейцин | - CH 2 – CH(CH 3) 2 |
| Ізолейцин | - CH 2 – CH(CH 3) – З 2 H 5 |
| Цистеїн | - CH 2 - SH |
| Метіонін | - CH 2 - CH 2 - S - СH 3 |
| Серін | - CH 2 - OH |
| Треонін | - CH(OH) – CH 3 |
| Фенілаланін | - CH 2 – C 6 H 5 |
| Тирозін | 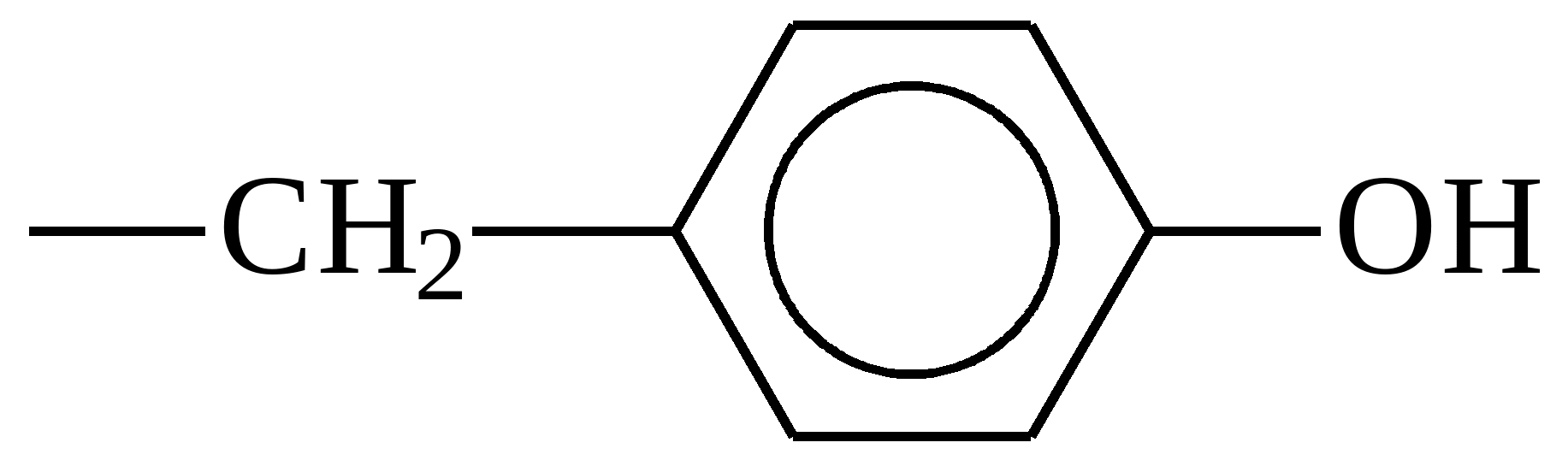 |
| Триптофан | 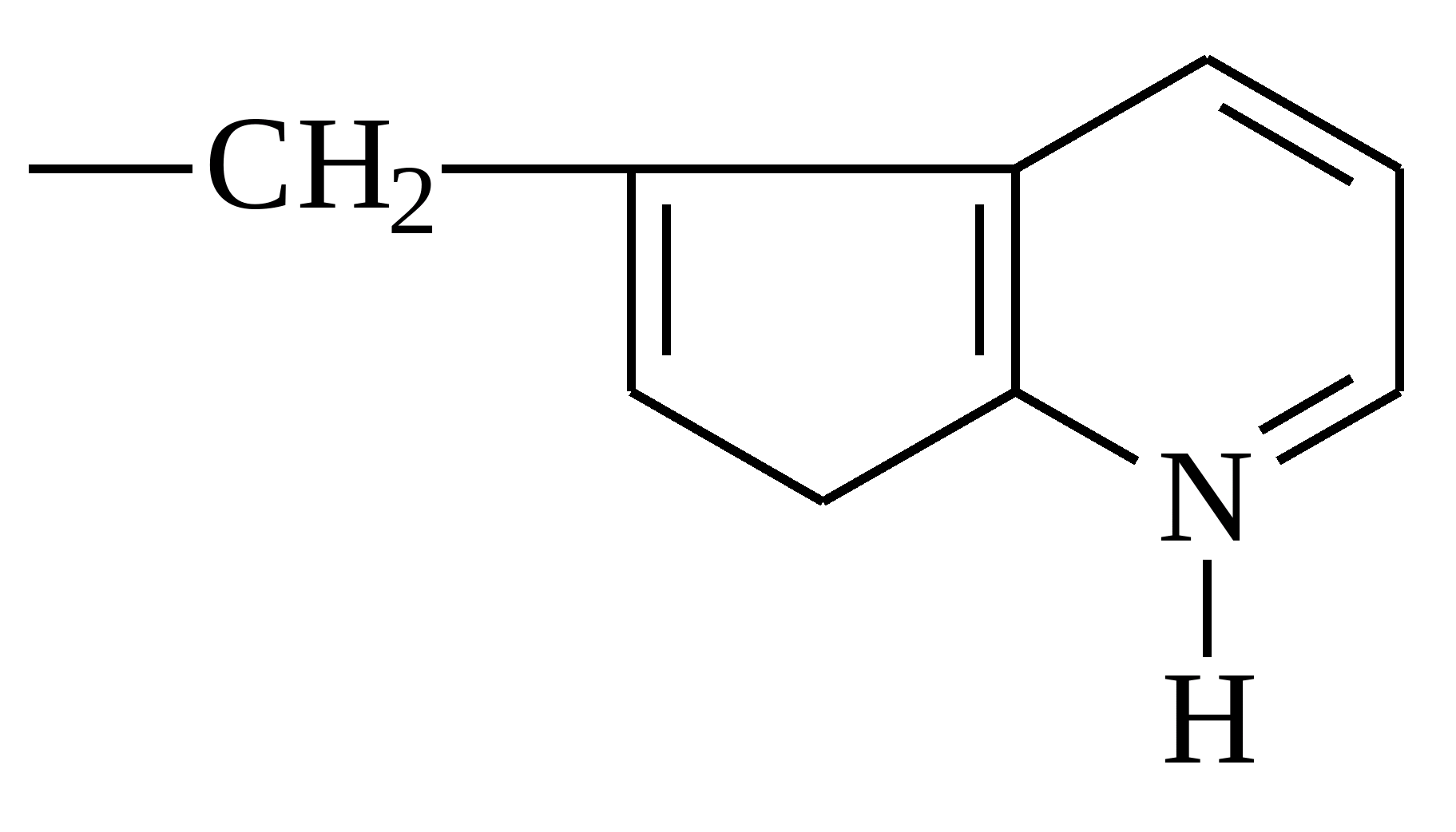 |
| Аспарагінова кислота | - CH 2 - COOH |
| Глутамінова кислота | - CH 2 - CH 2 - COOH |
| Аспарагін | - CH 2 – CO-NH 2 |
| Глутамін | - CH 2 - CH 2 - CO -NH 2 |
| Гістідін | 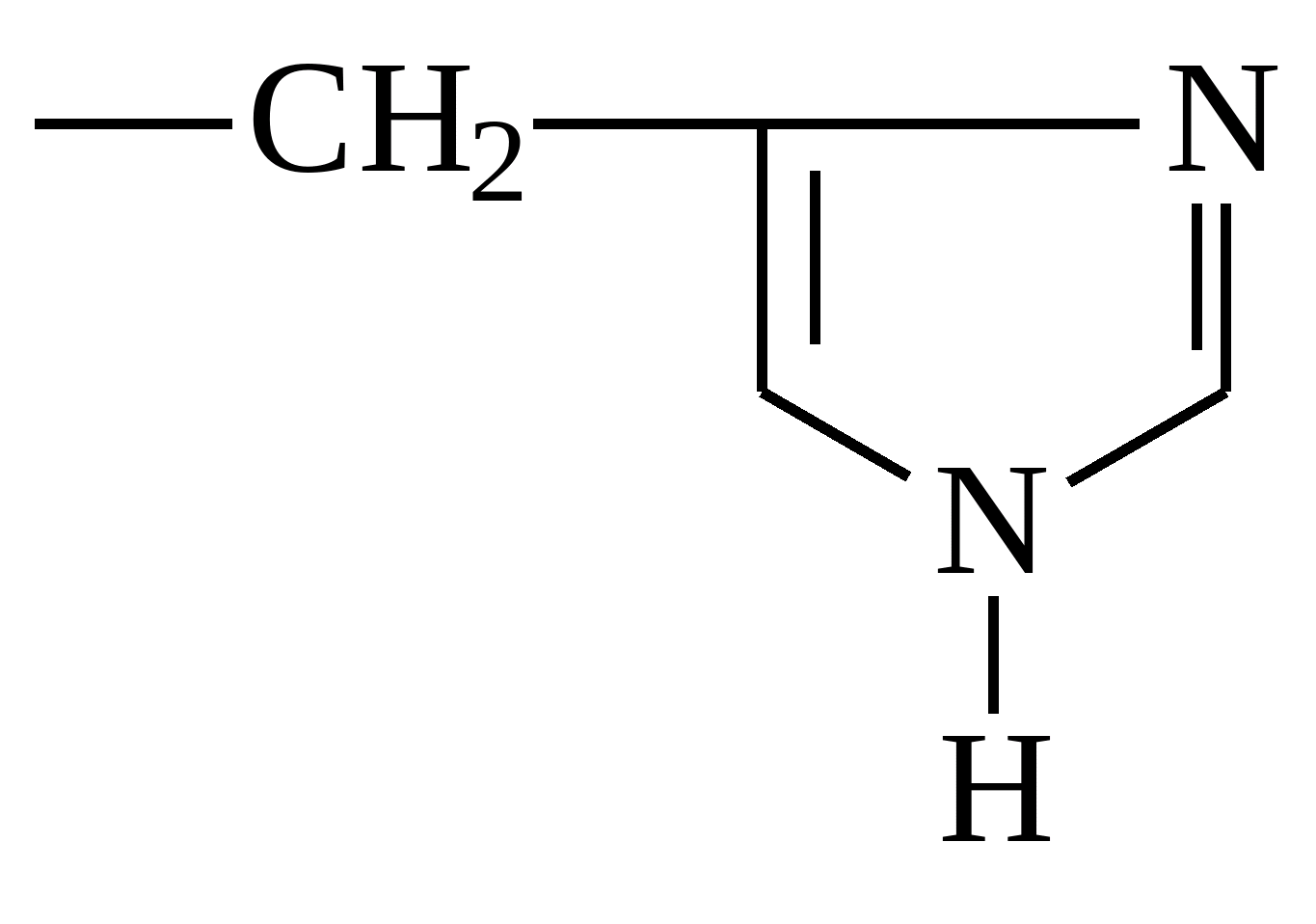 |
| Лізін | - (CH 2) 4 - NH 2 |
| Аргінін |  |
| Пролін | 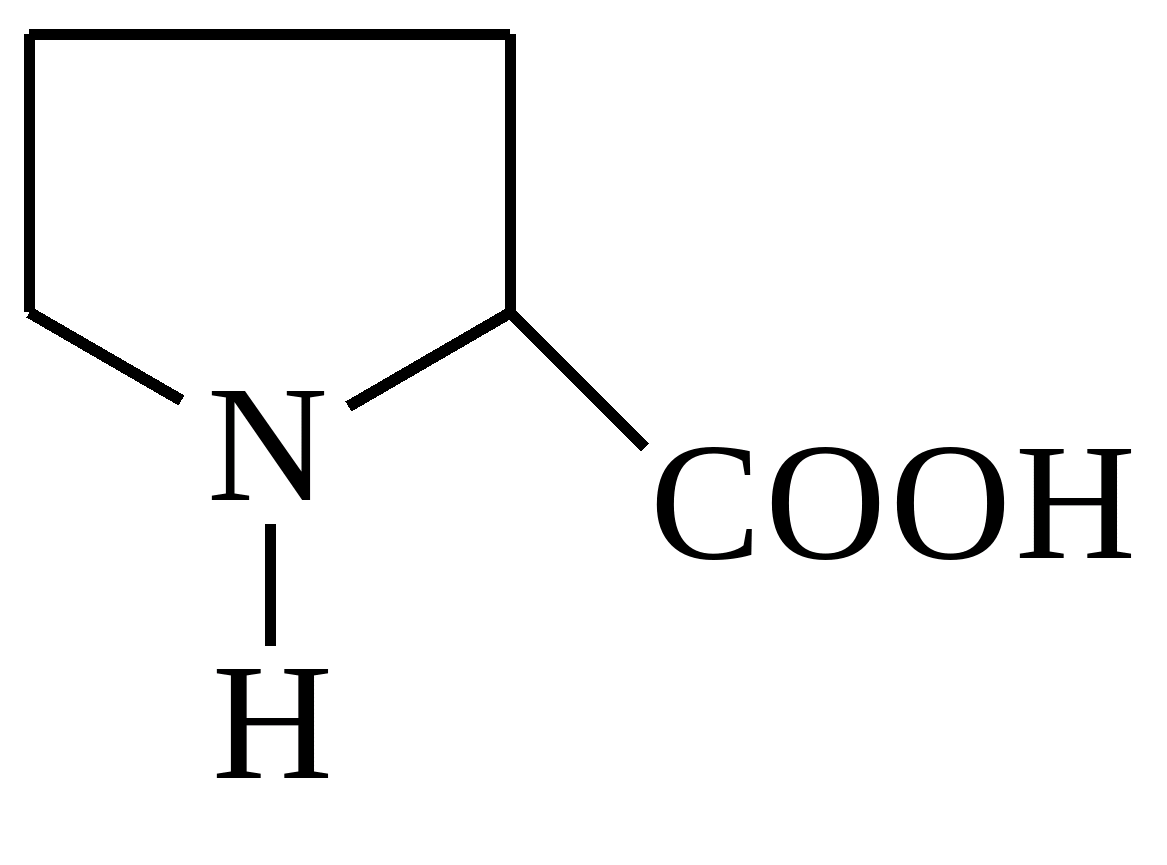 |
Одержання амінокислот.
Амінокислоти отримують як синтезом, і з природних об'єктів. Цей методзаснований на заміщенні галогену в молекулі галогензаміщеної карбонової кислоти на аміногрупу під дією аміаку:
Хімічні характеристики.
Хімічні властивостіамінокислот визначаються наявністю в їх структурі кількох функціональних груп, у загальному випадку аміногрупи (властивості основ), та карбоксильної групи (властивість кислот). Тому в реакціях амінокислоти здатні виявляти як основні, так і кислотні властивості – це амфотерні сполуки, що реагують і з кислотами, і з основами. В результаті утворюються відповідні солі: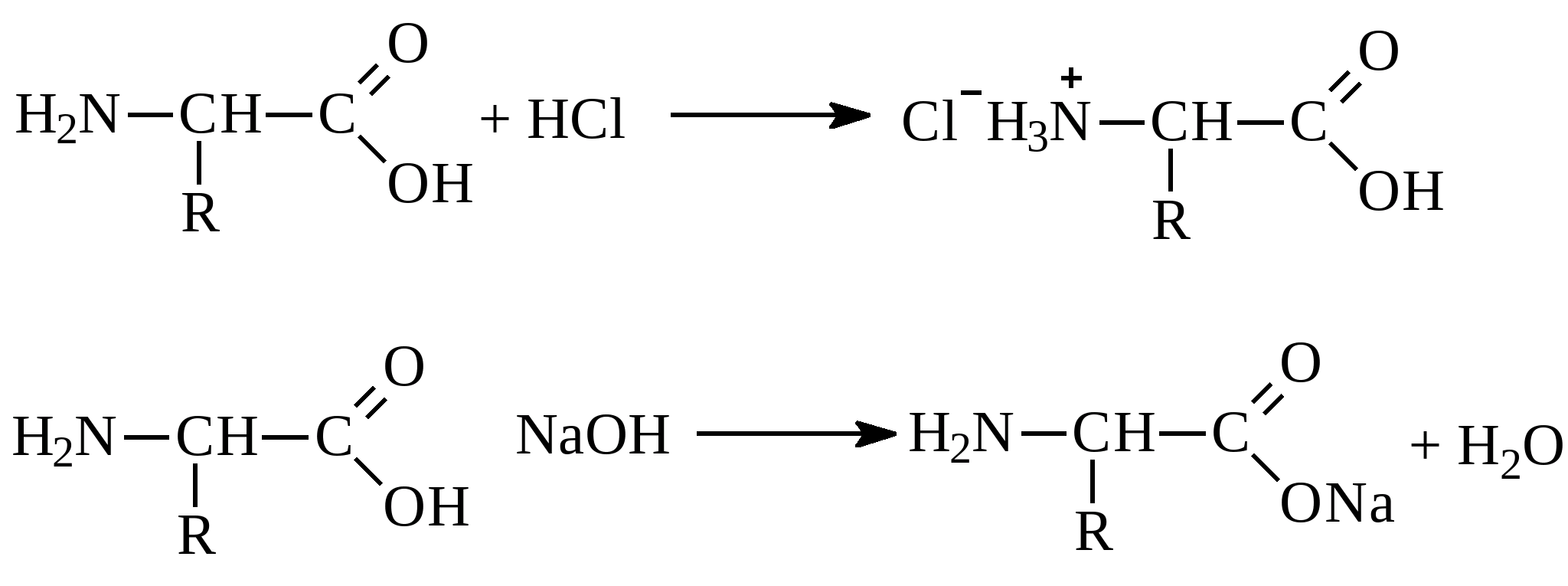 Залежно від кислотності середовища амінокислоти в розчині існують в одній із форм: у лужному середовищі
в нейтральному середовищі в кислому середовищіЯкщо амінокислоті переважають кислотні групи, то розчин амінокислоти має кислу реакцію. Розчини кислот із основними радикалами мають лужну реакцію. Амінокислоти здатні вступати в реакції як за участю аміногрупи, так і за участю карбоксильної групи, характерні для відповідних класів сполук. Реакція по аміногрупі ( взаємодія з азотистою кислотою):
Залежно від кислотності середовища амінокислоти в розчині існують в одній із форм: у лужному середовищі
в нейтральному середовищі в кислому середовищіЯкщо амінокислоті переважають кислотні групи, то розчин амінокислоти має кислу реакцію. Розчини кислот із основними радикалами мають лужну реакцію. Амінокислоти здатні вступати в реакції як за участю аміногрупи, так і за участю карбоксильної групи, характерні для відповідних класів сполук. Реакція по аміногрупі ( взаємодія з азотистою кислотою): 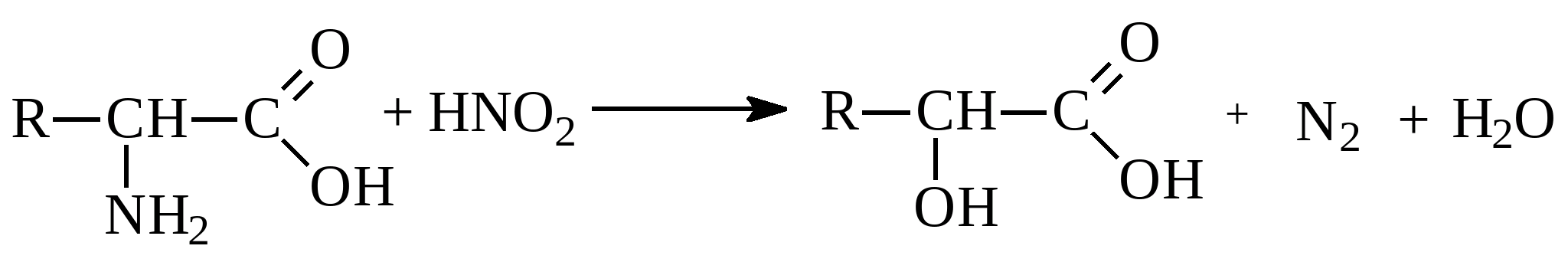 ОксикислотаВзаємодія зі спиртами ( реакція по карбоксильній групі) призводить до утворення складних ефірів:
ОксикислотаВзаємодія зі спиртами ( реакція по карбоксильній групі) призводить до утворення складних ефірів: 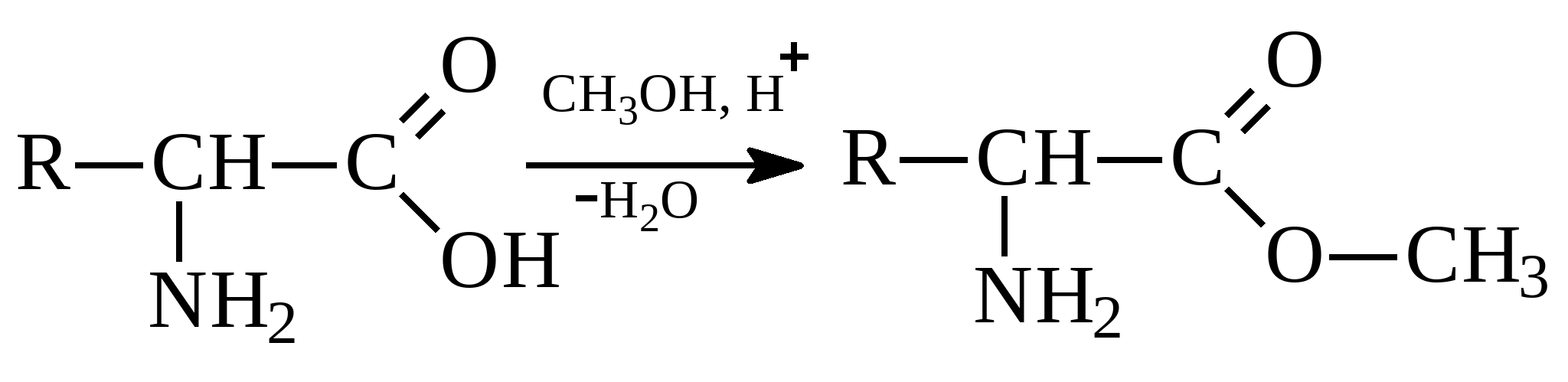 Взаємодія амінокислот один з одним із відщепленням води та утворенням продукту, в якому фрагменти пов'язані пептидним зв'язком: Пептидна зв'язокПодібні сполуки – продукти конденсації двох і більше продуктів амінокислот називають пептидами. Вони належать до класу амідів. Якісною реакцією на амінокислоти є утворення пофарбованих у синьо-фіолетовий колір продуктів з нінгідрином(амінокислоти їм окислюються):
Взаємодія амінокислот один з одним із відщепленням води та утворенням продукту, в якому фрагменти пов'язані пептидним зв'язком: Пептидна зв'язокПодібні сполуки – продукти конденсації двох і більше продуктів амінокислот називають пептидами. Вони належать до класу амідів. Якісною реакцією на амінокислоти є утворення пофарбованих у синьо-фіолетовий колір продуктів з нінгідрином(амінокислоти їм окислюються): 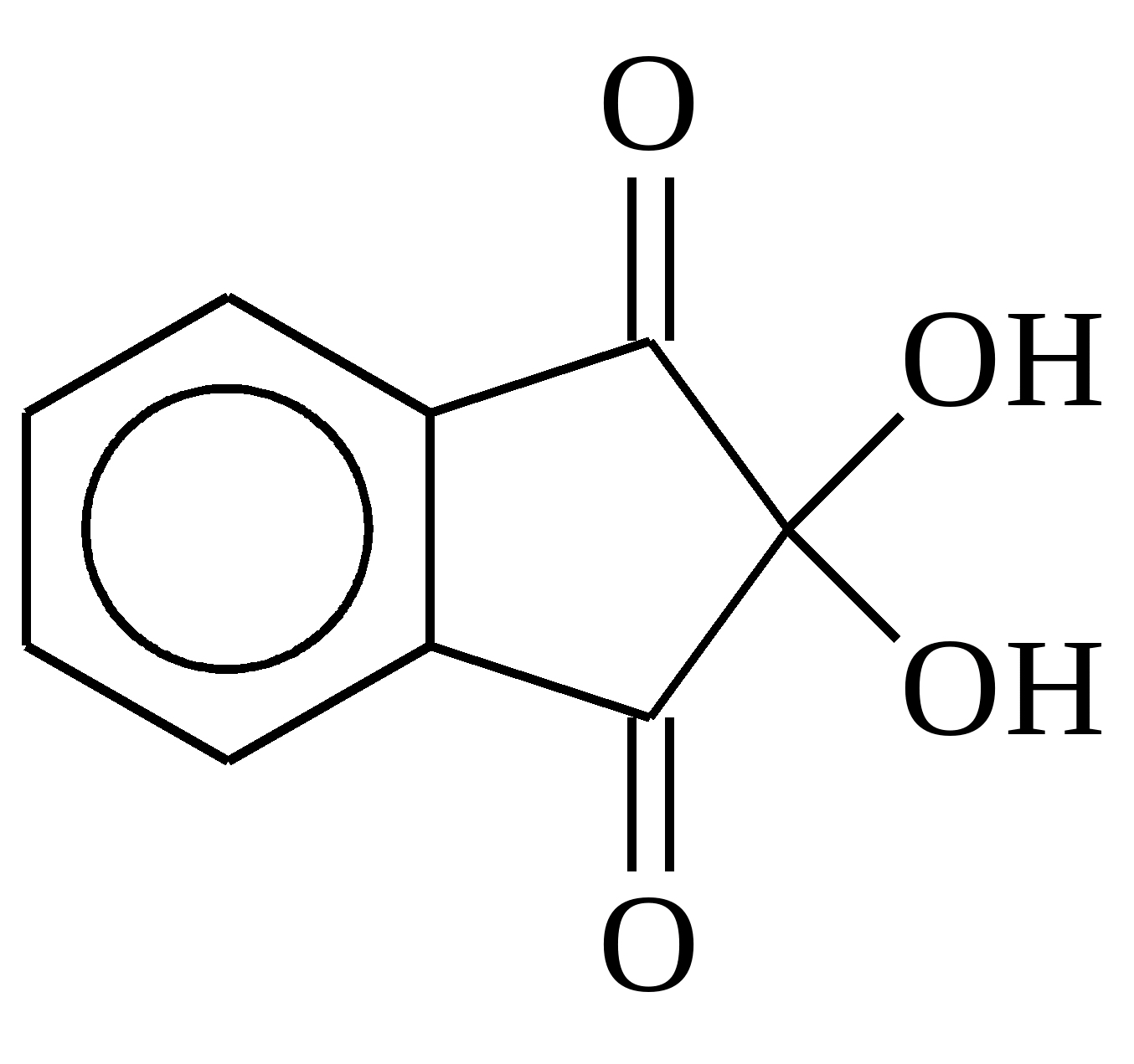 Нінгідрин
НінгідринАроматичні амінокислоти при нагріванні взаємодіють з концентрованою HNO 3 (нітрується бензольне кільце), продукти пофарбовані в жовтий колір(ксантопротеїнова реакція).
Нінгідрин
НінгідринАроматичні амінокислоти при нагріванні взаємодіють з концентрованою HNO 3 (нітрується бензольне кільце), продукти пофарбовані в жовтий колір(ксантопротеїнова реакція). Ліпіди. 5
Під терміном ліпіди поєднують жири та жироподібні речовини. Ліпіди – органічні сполуки із різною структурою, але загальними властивостями. Вони нерозчинні у воді, але добре розчиняються в органічних розчинниках, таких як; бензин, ефіри та ін. За хімічною структурою жири являють собою складні сполуки триатомного спирту гліцерину та високомолекулярних жирних кислот. Наприклад, стеарин виходить в результаті реакції між гліцерином та стеариновою кислотою: жирна кислота Гліцерин стеаринова кислота СтеарінСтеаринова і пальмітинова (З 15 H 31 COOH) кислоти є насиченими (граничними), а олеїнова (З 17 H 33 COOH) та деякі інші кислоти – ненасиченими. У насичених жирних кислот температура плавлення вище, ніж у ненасичених, тому жири, утворені цими кислотами в природних умовжиттєдіяльності, знаходиться у твердому стані. Такі жири характерні для клітин тварин. Рідкі ненасичені жири називають маслами. Вони можуть зустрічатися у тварин (наприклад у складі молока), але типові для рослин. Особливо біологічно важливими жироподібними речовинамиє фосфоліпіди.Це також складні сполуки гліцерину і жирних кислот. Від реальних жирів вони відрізняються тим, що містять залишок фосфорної кислоти. Вони є основними компонентами мембран клітин.
жирна кислота Гліцерин стеаринова кислота СтеарінСтеаринова і пальмітинова (З 15 H 31 COOH) кислоти є насиченими (граничними), а олеїнова (З 17 H 33 COOH) та деякі інші кислоти – ненасиченими. У насичених жирних кислот температура плавлення вище, ніж у ненасичених, тому жири, утворені цими кислотами в природних умовжиттєдіяльності, знаходиться у твердому стані. Такі жири характерні для клітин тварин. Рідкі ненасичені жири називають маслами. Вони можуть зустрічатися у тварин (наприклад у складі молока), але типові для рослин. Особливо біологічно важливими жироподібними речовинамиє фосфоліпіди.Це також складні сполуки гліцерину і жирних кислот. Від реальних жирів вони відрізняються тим, що містять залишок фосфорної кислоти. Вони є основними компонентами мембран клітин.  R 1
,
R 2
- залишки жирних кислот,R 3
- азотистий основа Гліколіпідискладаються з вуглеводів та ліпідів. Особливо їх багато у складі тканини мозку та нервових волокон.
R 1
,
R 2
- залишки жирних кислот,R 3
- азотистий основа Гліколіпідискладаються з вуглеводів та ліпідів. Особливо їх багато у складі тканини мозку та нервових волокон.  R- Залишок ліпіду (Жирна кислота) Ліпопротеїдиє комплексними сполуками різних білків з жирами. Стероїди- клас органічних сполук тварини або рослинного походження, що мають високу біологічну активність.
R- Залишок ліпіду (Жирна кислота) Ліпопротеїдиє комплексними сполуками різних білків з жирами. Стероїди- клас органічних сполук тварини або рослинного походження, що мають високу біологічну активність.  Тестостерон – гормон. За хімічною природою – стероїд. Жири –це суміші складних ефірів та вищих карбонових кислот та гліцерину (трехатомного спирту). Загальна формула жирів:
Тестостерон – гормон. За хімічною природою – стероїд. Жири –це суміші складних ефірів та вищих карбонових кислот та гліцерину (трехатомного спирту). Загальна формула жирів: 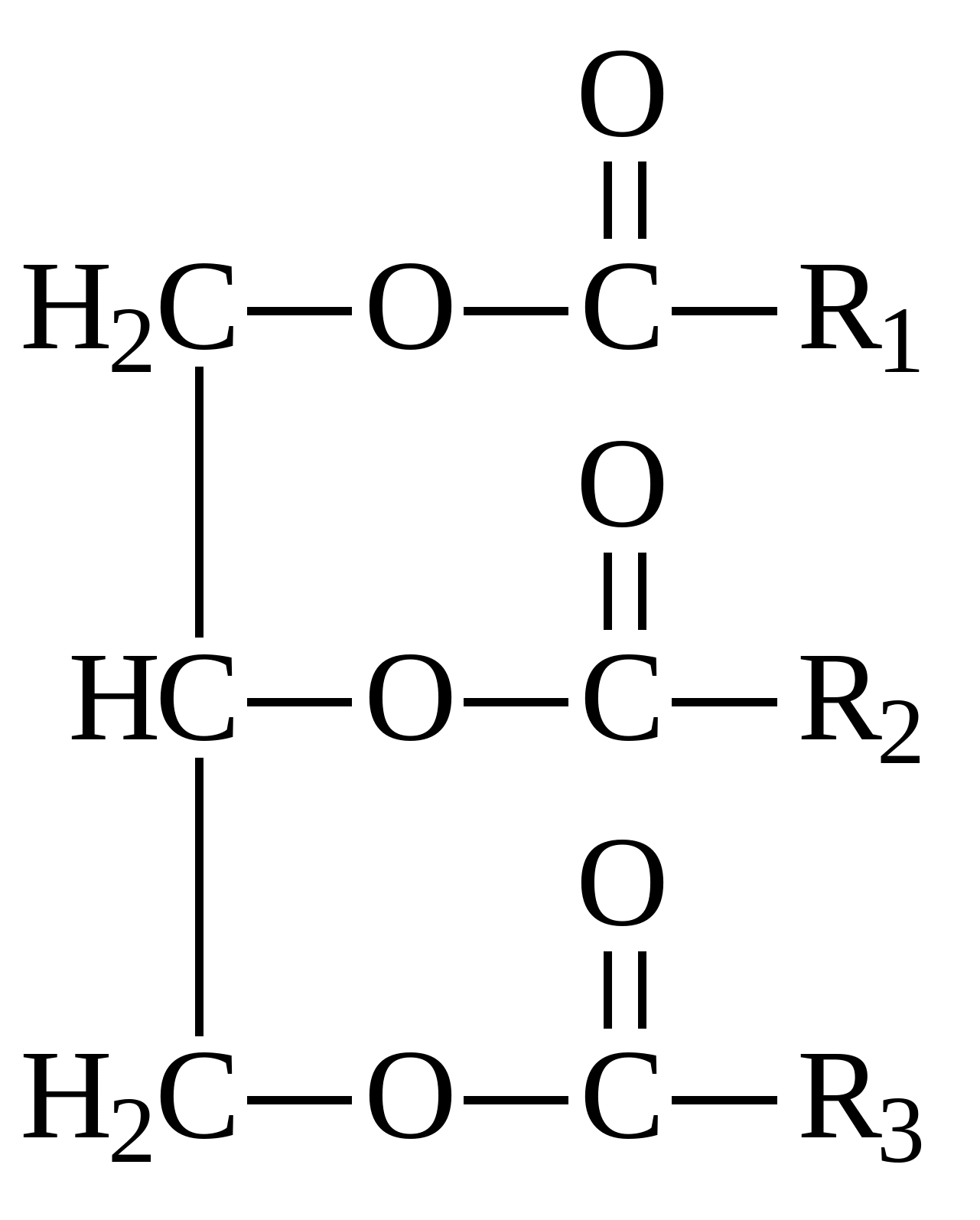 Загальна формула жирів.Якщо до складу жиру входять залишки однієї кислоти, такий жир називають простим. До складу змішаних жирів входять залишки різних жирних кислот. Загальна назва карбонових кислот із гліцерином – тригліцериди. Найчастіше до складу жирів входять залишки наступних кислот:
Загальна формула жирів.Якщо до складу жиру входять залишки однієї кислоти, такий жир називають простим. До складу змішаних жирів входять залишки різних жирних кислот. Загальна назва карбонових кислот із гліцерином – тригліцериди. Найчастіше до складу жирів входять залишки наступних кислот:
| Граничні: | |
| Міристинова | З 13 Н 27 COOH |
| Пальмітінова | CH 3 (CH 2) 14 COOH |
| Стеаринова | C 1 7 H 3 5 СOOH |
| Ненасичені: | |
| Олеїнова | СН 3 (СН 2) 7 СН = СН (СН 2) 7 СООН |
| Лінолева | CH 3 (CH 2) 3 -(CH 2 CH=CH) 2 (CH 2) 7 COOH. |
Функції ліпідів. 6
| ФУНКЦІЯ | РІВЕНЬ ОРГАНІЗАЦІЇ | ПРИКЛАДИ |
| Захисна | Тканинний | Гліколіпіди беруть участь у розпізнаванні та зв'язуванні токсинів збудників небезпечних хвороб – правця, холери, дифтерії. |
| Організмовий | 1. Підшкірний жирссавців виконує функцію термоізоляції та амортизації (захист від механічних пошкоджень). 2. Віски є водовідштовхувальними покриттями. | |
| Регуляторна | Організмовий | 1. Похідними холестерину є багато гормонів. 2. Жиророзчинні вітаміни необхідні зростання і розвитку організму. 3. Серцевими глікозидами є простими ліпідами (стероїдами). 4. Терпенами є такі речовини: запашні речовини рослин, які залучають комах – запилювачів. Гібберелліни – регулятори росту рослин. |
| Енергетична | Клітинний | Жири - найкраще джерело енергії, при окисленні 1г глікогену утворюється 17кДж енергії. У хребетних приблизно половина всієї енергії, що споживається у стані спокою, утворюється за рахунок окислення жирних кислот, що входять до складу жирів. |
| Резервна | Організмовий | 1. джерело енергії синтезу АТФ. Жири - основна запасна речовина у тварин, олії у рослин. 2. Джерело метаболічної води (вода, що утворюється внаслідок обміну речовин). |
| Структурна | Клітинний | 1. подвійний сій фосфоліпідів є основою клітинної мембрани. 2. Стероїд холестерин входить до складу клітинних мембран тварин клітин. 3. До складу мембран клітин деяких тканин входять так само ліпопротеїди та глікопротеїди. |
| Тканинний та органний | 1. Гліколіпіди беруть участь у міжклітинних контактах у тканинах тварин, будучи молекулярними рецепторами. 2. Різні фосфоліпіди необхідні нормального функціонування нервової тканинита містяться там у значних кількостях. 3. Жовчні кислоти та їх похідні є похідними холестирину. 4. Ліпопротеїни є транспортною формою ліпідів в організмі ссавців. 5. Зоровий пурпур очі є ліпопротеїдом. | |
| Організмовий | 1. Велика кількість жиру зменшує питому вагу морських тварин (тюленів, моржів) та птахів. 2. У ссавців, що впадають у сплячку, і у немовлят існує спеціальна жирова тканина - бурий жир, що грає роль біологічного підігрівача. Енергія, що виділяється при окисленні жиру, не йде на синтез АТФ, а є тільки джерелом тепла. Бурий жир або оточує життєво важливі органи, або лежить на шляху крові, що припливає до них, таким чином, тепло утворюються в бурому жирі, прямує до найважливішим органам. 3. З воску бджоли будують стільники. |
Фізичні властивості жирів.
Жири, утворені граничними кислотами, нормальних умовах- Тверді речовини, тому тваринні жири зазвичай тверді - до їх складу входять насичені кислоти. Наприклад, в коров'яче масло входять гліцериди олеїнової, пальмітинової та стеаринової кислот. Рідкі жири ( олії), як правило, утворені ненасиченими кислотами. Найчастіше рідкі жири рослинного походження. Температура плавлення жиру визначається його природою, температура кипіння жиру тим вища, чим вищий у ньому вміст граничних кислот і чим довше вуглеводневий радикал жирної кислоти. Всі жири легші за воду і не розчиняються в ній, жири добре розчиняються в неполярних органічних розчинниках, таких як: вуглеводні, бензин, дихлоретан та інших.Хімічні властивості жирів.
Нагрівання жиру призводить до утворення карбонових кислот та гліцерину, отже, жири можна синтезувати з гліцерину та карбонових кислот: Реакція омилення жирів (гідроліз жирів).Милами називають натрієві солі вищих карбонових кислот, т.к. їх розчини мають миючу дію. Для отримання мила жири піддають лужному гідролізу:
Реакція омилення жирів (гідроліз жирів).Милами називають натрієві солі вищих карбонових кислот, т.к. їх розчини мають миючу дію. Для отримання мила жири піддають лужному гідролізу:  Жир гліцерин милоЗвичайні мила – це суміші пальмітинової, стеаринової та олеїнової кислот, причому натрієві солі утворюють тверді мила, а калієві – рідкі мила.
Жир гліцерин милоЗвичайні мила – це суміші пальмітинової, стеаринової та олеїнової кислот, причому натрієві солі утворюють тверді мила, а калієві – рідкі мила. Гідрогенізація жирів.
Гідрогенізація жирів– так називають процес, приєднання водню до залишків ненасичених кислот, що входять до складу жирів. У результаті рідких жирів, молекули яких містять ненасичені вуглеводневі радикали, отримують тверді жири, що містять залишки придільних (насичених) жирних кислот. Гідрування проводять під тиском у присутності каталізатора: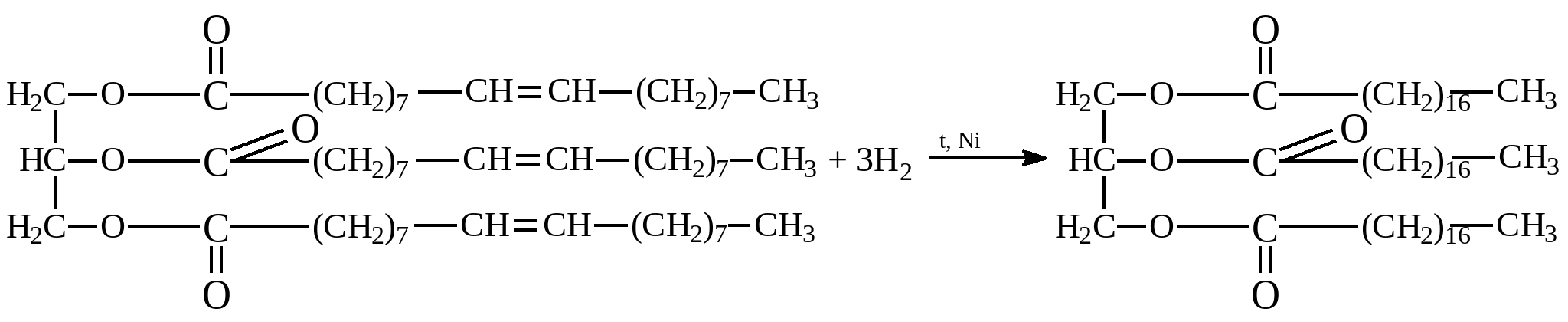 Саме так із рослинної олії (рідкий жир) отримують тверді гідрогенізовані жири, які потім використовують у технічних цілях і для виробництва маргарину (емульсії гідрогенізованої рослинної олії в молоці з харчовими добавками). Під дією кисню повітря (при зберіганні) і при нагріванні залишки карбонових кислот рідких жирів можуть «зшиватися» між собою по місцях подвійних зв'язків з утворенням «зшитих полімерів» - твердих плівок. Тривале зберіганняна повітрі (дія світла, вологи, кисню, тепла) призводить до «прогоркання» жирів – появи продуктів з розкладання (альдегіди, кетони, карбонові кислоти, гідроксикислоти). Процес супроводжується появою характерного запаху «згірклої» олії.
Саме так із рослинної олії (рідкий жир) отримують тверді гідрогенізовані жири, які потім використовують у технічних цілях і для виробництва маргарину (емульсії гідрогенізованої рослинної олії в молоці з харчовими добавками). Під дією кисню повітря (при зберіганні) і при нагріванні залишки карбонових кислот рідких жирів можуть «зшиватися» між собою по місцях подвійних зв'язків з утворенням «зшитих полімерів» - твердих плівок. Тривале зберіганняна повітрі (дія світла, вологи, кисню, тепла) призводить до «прогоркання» жирів – появи продуктів з розкладання (альдегіди, кетони, карбонові кислоти, гідроксикислоти). Процес супроводжується появою характерного запаху «згірклої» олії. Опис задач практикуму.
У цій частині роботи представлені експерименти, які можуть показати основні властивості речовин, представлених у роботі. У процесі проведення робіт варто звернути увагу на такі пункти:- З реактивами потрібно поводитися дуже обережно і використовувати їх строго у певних кількостях. Результати якісних реакцій найкраще дивитись на білому тлі.
Тема вуглеводів.
1. Відновлюючі властивості моно-і дисахаридів. 7
Цей експеримент ознайомить васз методикоюпостановки якісних реакцій на вуглеводиБагато хто з нас знає, що білки необхідні організму, тому що в них містяться амінокислоти. Але далеко не всі розуміють, що являють собою ці елементи і чому їх наявність у раціоні така важлива. Сьогодні ми з'ясуємо, скільки амінокислот входить у які вони класифікуються і яку функцію виконують.
Що таке амінокислоти?
Отже, амінокислоти (амінокарбонові кислоти) - це органічні сполуки, які є основним елементом, що утворює структуру білка. Білки, у свою чергу, беруть участь у всіх фізіологічних процесах людського організму. Вони формують кістки, сухожилля, зв'язки, внутрішні органи, м'язи, нігті та волосся. Білки стають частиною організму у процесі синтезу амінокислот, що прийшли з їжею. Отже, не білок є важливим поживною речовиною, А саме амінокислоти. І не всі білки однаково корисні, адже у кожного з них свій унікальний склад цих кислот.
Досить складна, розглянемо її на базовому рівні. Ми знаємо, що амінокарбонові кислоти є своєрідними будівельними блокамиу будівлі під назвою білок та у мегаполісі під назвою людина. Однак не у всіх білках є саме ті елементи, які нам потрібні. Якщо подивитись білок під мікроскопом, можна побачити ланцюжок з амінокислот, які з'єднуються пептидними зв'язками. Грубо кажучи, ланки цього ланцюжка служать у нашому організмі ремонтним та будівельним матеріалом.
Дивно, але був час, коли вчені не знали, скільки різних амінокислот входить до складу білків. Більшість із них були відкриті в 19, а решта у 20-му столітті. Вченим знадобилося 119 років, щоб остаточно відповісти на запитання: Скільки амінокислот входить до складу білка? Будова кожної з них вивчалася ще довше.
На сьогоднішній день відомо, що для нормальної життєдіяльності організму людини необхідно 20 протеїногенних амінокарбонових кислот. Цю двадцятку часто називають мажорними кислотами. З точки зору хімії їх класифікують за безліччю ознак. Але найпростішим обивателям найближча класифікація за здатністю кислот синтезуватися в нашому організмі. За цією ознакою амінокислоти бувають замінними та незамінними.

У цій класифікації є деякі недоліки. Наприклад, аргінін у деяких фізіологічних станах вважається незамінним, але може синтезуватися організмом. А гістидин поповнюється в таких малих кількостях, що його все-таки необхідно приймати з їжею.
Тепер, коли ми знаємо, скільки видів амінокислот входить до складу білків, розглянемо докладніше обидва види.
Незамінні (есенційні)
Як ви вже зрозуміли, ці речовини не можуть самостійно синтезуватись організмом, тому їх необхідно вживати з їжею. Основна кількість незамінних органічних кислот міститься у тваринних білках. Коли в організмі немає того чи іншого елемента, він починає забирати його з м'язової тканини. Цей клас складається із 8 кислот. Познайомимось із кожною з них.
Лейцин
Ця кислота відповідає за відновлення та захист м'язових тканин, шкірних покривів та кісток. Саме завдяки лейцину виділяється гормон зростання. Крім того, ця органічна кислота регулює рівень цукру в крові та сприяє спалюванню жирів. Вона міститься в м'ясі, горіхах, бобових, нешліфованому рисі та зернах пшениці. Лецитин стимулює, отже, сприяє нарощуванню м'язової маси.
Ізолейцин
Ця кислота прискорює вироблення енергії, тому її люблять спортсмени. Після виснажливих занять вона допомагає швидкому відновленню м'язових волокон. Ізолейцин знімає так звану крепатуру, бере участь в утворенні гемоглобіну та регулює кількість цукру. Найбільше ізолейцину міститься в м'ясі, рибі, яйцях, горіхах, гороху та сої.

Лізін
Ця амінокислота грає важливу рольу роботі імунної системи. Її головне завдання- синтез антитіл, які захищають наш організм від впливу вірусів та алергенів. Крім того, лізин регулює процес оновлення кісткової тканинита колагену, а також гормони росту. Цю органічну кислоту можна знайти в таких продуктах харчування, як: яйця, картопля, червоне м'ясо, риба та кисломолочні продукти.
Фенілаланін
Ця альфа-амінокислота відповідає за нормальну роботу центральної нервової системи. Її недолік в організмі призводить до нападів депресії та хронічним хворобам. Фенілаланін допомагає нам концентруватися та запам'ятовувати потрібну інформацію. Входить до складу препаратів, що використовуються при лікуванні психічних розладів, зокрема хвороби Паркінсона. Позитивно позначається на роботі печінки та підшлункової залози. Амінокислота міститься в: горіхах, грибах, курці, молочних продуктах, бананах, абрикосах та топінамбурі.
Метіонін
Мало хто знає, скільки амінокислот входить до складу білка, зате багатьом відомо, що метіонін активно спалює жирові тканини. Але це далеко не все корисні властивостіцієї кислоти. Вона впливає на витривалість та працездатність людини. Якщо її в організмі недостатньо, це відразу можна зрозуміти по шкірі та нігтям. Метіонін зустрічається в таких продуктах харчування, як: м'ясо, риба, насіння соняшнику, бобові, цибуля, часник та кисломолочні продукти.
Треонін
Прагнучи дізнатися, скільки амінокислот входить до складу білка, вчені відкрили таку речовину, як треонін, однією з останніх. Адже воно дуже корисне для людини. Треонін відповідає за все найважливіші системилюдського організму, а саме за нервову, імунну та серцево-судинну. Перша ознака його нестачі - проблеми із зубами та кістками. Найбільше треоніну людина отримує з молочних продуктів, м'яса, грибів, овочів та злаків.
Триптофан
Ще одне найважливіша речовина. Воно відповідає за синтез серотоніну, який часто називають гормоном гарного настрою. Нестачу триптофану можна виявити порушення сну, апетиту. Дана кислота також регулює функцію дихання та артеріальний тиск. Вона міститься переважно в: морепродуктах, червоному м'ясі, птиці, кисломолочних продуктахта пшениці.
Валін
Виконує функцію відновлення пошкоджених волокон та стежить за обмінними процесамиу м'язах. При сильних навантаженьможе надавати стимулюючу дію. Також грає роль у розумової діяльностілюдини. Допомагає при лікуванні печінки та головного мозку від негативних впливівалкоголю та наркотиків. Людина може отримати валін з м'яса, грибів, сої, молочних продуктів та арахісу.
Примітно, що 70% усіх органічних кислот у нашому організмі займають лише три амінокислоти: лейцин, ізолейцин та валін. Тому вони вважаються найважливішими у забезпеченні нормальної життєдіяльності організму. У спортивному харчуванні навіть виділили спеціальний комплексВСАА, які містять саме ці три кислоти.
Продовжуємо відповідати на запитання про те, скільки мажорних амінокислот входить до складу білка, та переходимо до замінних представників класу.

Замінні
Головна відмінність цієї групи полягає в тому, що її представники можуть утворюватися в організмі шляхом ендогенного синтезу. Слово «замінні» вводить багатьох в оману. Тому часто непоінформовані люди кажуть, що ці амінокислоти необов'язково вживати з їжею. Звісно ж, це не так! Замінні кислоти, як і есенціальні, обов'язково мають бути у складі щоденного раціону. Вони справді можуть утворюватися з інших речовин. Але це відбувається лише у разі, коли раціон складено неправильно. Тоді частина корисних речовинта есенціальних кислот витрачається на відтворення замінних кислот. Отже, це дуже сприятливо для організму. Розберемо незамінні кислоти, що входять до «мажорної двадцятки».
Аланін
Сприяє прискоренню метаболізму вуглеводів та виведенню з печінки токсинів. Зустрічається у таких продуктах харчування, як: м'ясо, птиця, яйця, риба та молочні продукти.
Аспарагінова кислота
Вважається універсальним паливом для нашого організму, оскільки значно покращує обмін речовин. Зустрічається в молоці, тростинному цукрі, птиці та яловичині.
Аспарагін
Намагаючись відповісти на запитання: "Скільки амінокислот входить до складу білка?", Вчені в першу чергу відкрили саме аспарагін. Було це далекого 1806 року. Ця кислота бере участь у покращенні роботи нервової системи. Вона міститься у всіх тваринних білках, а також горіхах, картоплі та злаках.
Гістідін
Є важливим будівельним елементом усіх внутрішніх органів. Відіграє чи не ключову роль у освіті червоних та білих кров'яних тілець. Позитивно впливає на імунну системуі статеву функцію. Через широкий спектр застосування запаси гістидину в організмі швидко виснажуються. Тому важливо приймати його з їжею. Міститься у м'ясних, молочних та злакових продуктах.
Серін
Стимулює роботу головного мозку та центральної нервової системи. Зустрічається у таких продуктах, як: м'ясо, соя, злаки, арахіс.
Цистеїн
Ця амінокислота в організмі відповідає за синтез кератину. Без неї не було б здорових нігтів, волосся та шкіри. Знаходиться в таких продуктах, як: м'ясо, яйця, червоний перець, часник, цибуля та броколі.
Аргінін
Говорячи про те, скільки протеїногенних амінокислот входить до складу білків і які функції вони виконують, ми переконалися, що кожна з них важлива для організму. Однак, є кислоти, які, на думку експертів, вважаються найбільш значущими. До них належить аргінін. Він відповідає за здорову роботу м'язів, суглобів, шкірного покривута печінки, а також зміцнює імунітет та спалює жири. Аргінін часто використовують бодібілдери та ті, хто бажає схуднути, у складі добавок. У природному виглядівін зустрічається в м'ясі, горіхах, молоці, злаках та желатині.

Глютамінова кислота
Є важливим елементомдля здорової роботиголовного та спинного мозку. Часто продається як добавки «Глутамат натрію». Зустрічається в яйцях, м'ясі, молочних продуктах, рибі, моркві, кукурудзі, помідорах та шпинаті.
Глутамін
Потрібен у білках для зростання та підтримки м'язів. Також є "паливом" головного мозку. Крім того, глутамін виводить із печінки все те, що надходить туди з нездоровою їжею. При термічній обробці кислота денатурує, тому щоб її заповнити, потрібно вживати петрушку і шпинат у сирому вигляді.
Гліцин
Допомагає крові згортатися, а глюкозі – перероблятися на енергію. Зустрічається у м'ясі, рибі, бобових та молоці.
Пролін
Відповідає за синтез колагену. При нестачі в організмі проліну починаються проблеми із суглобами. Зустрічається в основному в тваринних білках, тому є чи не єдиною речовиною, з якою стикаються люди, які не вживають м'ясо.
Тирозін
Відповідає за регулювання артеріального тискута апетит. При нестачі цієї кислоти людина страждає на швидку стомлюваність. Щоб таких проблем не було, потрібно їсти банани, насіння, горіхи та авокадо.

Продукти, багаті на амінокислоти
Тепер ви знаєте скільки амінокислот входить до складу білка. Функції та місце знаходження кожної з них вам також відомі. Зазначимо основні продукти, вживаючи які, можна не перейматися збалансованістю харчування щодо амінокислот.
Яйця. Відмінно засвоюються організмом, дають йому велика кількістьамінокислот і забезпечують білкове підживлення.
Молочні продукти. Здатні забезпечити людину безліччю корисних речовин, спектр яких, до речі, не обмежується органічними кислотами.
М'ясо. Мабуть, перше джерело білка і речовин, що входять до нього.
Риба. Багата на білок і добре засвоювана організмом.
Багато хто абсолютно впевнений, що без продуктів тваринного походження не можна забезпечити організм належною кількістю білка. Це зовсім не так. І доказом тому є величезна кількість вегетаріанців із прекрасною фізичною формою. Серед рослинних продуктівОсновними джерелами амінокислот є: бобові, горіхи, крупи, насіння.

Висновок
Сьогодні ми довідалися, скільки амінокислот входить до складу білка. Групи речовин та докладний описїхні представники допоможуть вам зорієнтуватися у складанні раціону здорового харчування.






