Valgu molekuli omadused. Valkude struktuur ja omadused
Oravad- kõrgmolekulaarsed orgaanilised ühendid, mis koosnevad aminohappejääkidest, mis on pika ahelana ühendatud peptiidsidemega.
Elusorganismide valkude koostis sisaldab ainult 20 tüüpi aminohappeid, mis kõik on alfa-aminohapped ja aminohapete koostis valgud ja nende omavaheliste seoste järjekorra määrab elusorganismi individuaalne geneetiline kood.
Valkude üheks tunnuseks on nende võime spontaanselt moodustada ainult sellele konkreetsele valgule iseloomulikke ruumilisi struktuure.
Oma struktuuri spetsiifilisuse tõttu võivad valgud omada mitmesuguseid omadusi. Näiteks globulaarse kvaternaarse struktuuriga valgud, eriti valk kana muna, lahustatakse vees, moodustades kolloidseid lahuseid. Fibrillaarse kvaternaarse struktuuriga valgud ei lahustu vees. Fibrillaarsed valgud moodustavad eelkõige küüsi, juukseid, kõhre.
Valkude keemilised omadused
Hüdrolüüs
Kõik valgud on võimelised hüdrolüüsima. Valkude täieliku hüdrolüüsi korral moodustub α-aminohapete segu:
Valk + nH 2 O => α-aminohapete segu
Denaturatsioon
Sekundaarsete, tertsiaarsete ja kvaternaarsete valgustruktuuride hävitamine ilma seda hävitamata esmane struktuur nimetatakse denaturatsiooniks. Valkude denatureerimine võib toimuda naatriumi-, kaaliumi- või ammooniumisoolade lahuste toimel – selline denatureerimine on pöörduv:
Kiirguse (näiteks kuumutamise) või valgu töötlemisel raskmetallide sooladega toimuv denaturatsioon on pöördumatu:
Nii näiteks täheldatakse munade kuumtöötlemisel nende valmistamise ajal pöördumatut valgu denaturatsiooni. Munavalge denatureerimise tulemusena kaob selle võime vees lahustuda koos kolloidse lahuse moodustumisega.
Kvalitatiivsed reaktsioonid valkudele
Biureti reaktsioon
Kui valku sisaldavale lahusele lisatakse 10% naatriumhüdroksiidi lahust ja siis suur hulk 1% vasksulfaadi lahusega ilmub lilla värv.
valgulahus + NaOH (10% lahus) + СuSO 4 = violetne värvus
ksantoproteiini reaktsioon
valgulahused muutuvad kontsentreeritud lämmastikhappega keetmisel kollane:
valgulahus + HNO 3 (konts.) => kollane värvus
Valkude bioloogilised funktsioonid
| katalüütiline | kiirendada elusorganismides erinevaid keemilisi reaktsioone | ensüümid |
| struktuurne | ehitusmaterjal rakud | kollageen, rakumembraani valgud |
| kaitsev | kaitsta keha infektsioonide eest | immunoglobuliinid, interferoon |
| regulatiivsed | valitseda metaboolsed protsessid | hormoonid |
| transport | elutähtsate ainete ülekandumine ühest kehaosast teise | hemoglobiin kannab hapnikku |
| energiat | varustada keha energiaga | 1 gramm valku võib anda kehale 17,6 J energiat |
| mootor (mootor) | ükskõik milline motoorsed funktsioonid organism | müosiin (lihaste valk) |
19. sajandi esimesel poolel paljud keemikud, nende hulgas eelkõige J. von Liebig, jõudsid järk-järgult järeldusele, et valgud on lämmastikuühendite eriklass. Nimi "valgud" (kreeka keelest.
protod esimene) pakkus 1840. aastal välja Hollandi keemik G. Mulder. FÜÜSIKALISED OMADUSED Valgud tahkes olekus valge värv, ja on lahuses värvitud, välja arvatud juhul, kui need kannavad mõnda kromofoori (värvilist) rühma, näiteks hemoglobiini. Lahustuvus vees erinevad valgud varieerub suuresti. See varieerub ka sõltuvalt pH-st ja soolade kontsentratsioonist lahuses, nii et saab valida tingimused, mille korral üks valk sadestub selektiivselt teiste valkude juuresolekul. Seda "väljasoolamise" meetodit kasutatakse laialdaselt valkude eraldamiseks ja puhastamiseks. Puhastatud valk sadestub sageli lahusest välja kristallidena.Võrreldes teiste ühenditega on valkude molekulmass väga suur - mitmest tuhandest mitme miljoni daltonini. Seetõttu sadestuvad ultratsentrifuugimise ajal valgud ja pealegi erineva kiirusega. Positiivse ja negatiivse laenguga rühmade esinemise tõttu valgumolekulides liiguvad need elektriväljas erineva kiirusega. See on elektroforeesi alus, meetod, mida kasutatakse üksikute valkude eraldamiseks keerukatest segudest. Valkude puhastamine toimub ka kromatograafiaga.
KEEMILISED OMADUSED Struktuur. Valgud on polümeerid, st. molekulid, mis on ehitatud nagu ahelad korduvatest monomeersetest üksustest või subühikutest, mille rolli nad mängivad a -aminohapped. Aminohapete üldvalem kus R vesinikuaatom või mõni orgaaniline rühm.Valgu molekul (polüpeptiidahel) võib koosneda ainult suhteliselt väikesest arvust aminohapetest või mitmest tuhandest monomeerühikust. Aminohapete ühendamine ahelas on võimalik, kuna igaühel neist on kaks erinevat keemilist rühma: aluseliste omadustega aminorühm,
NH2 ja happeline karboksüülrühm COOH. Mõlemad rühmad on seotud a - süsinikuaatom. Ühe aminohappe karboksüülrühm võib moodustada amiid- (peptiid-) sideme teise aminohappe aminorühmaga: Pärast seda, kui kaks aminohapet on sel viisil ühendatud, saab ahelat pikendada, lisades teisele aminohappele kolmanda jne. Nagu ülaltoodud võrrandist näha, moodustamisel peptiidside vabaneb vee molekul. Hapete, leeliste või proteolüütiliste ensüümide juuresolekul kulgeb reaktsioon vastupidises suunas: polüpeptiidahel lõhustatakse vee lisamisega aminohapeteks. Seda reaktsiooni nimetatakse hüdrolüüsiks. Hüdrolüüs toimub spontaanselt ja aminohapete ühendamiseks polüpeptiidahel energiat on vaja.
Pärast seda, kui kaks aminohapet on sel viisil ühendatud, saab ahelat pikendada, lisades teisele aminohappele kolmanda jne. Nagu ülaltoodud võrrandist näha, moodustamisel peptiidside vabaneb vee molekul. Hapete, leeliste või proteolüütiliste ensüümide juuresolekul kulgeb reaktsioon vastupidises suunas: polüpeptiidahel lõhustatakse vee lisamisega aminohapeteks. Seda reaktsiooni nimetatakse hüdrolüüsiks. Hüdrolüüs toimub spontaanselt ja aminohapete ühendamiseks polüpeptiidahel energiat on vaja. Karboksüülrühm ja amiidrühm (või sarnane imiidrühm aminohappe proliini puhul) esinevad kõigis aminohapetes, samas kui aminohapete vahelised erinevused on määratud selle rühma ehk "külgahela" olemusega. mis on ülalpool kirjaga tähistatud
R . Külgahela rolli võib täita üks vesinikuaatom, nagu aminohappes glütsiin, või mõni mahukas rühm, nagu histidiinis ja trüptofaanis. Mõned külgahelad on keemiliselt inertsed, teised aga väga reaktiivsed.Sünteesida saab palju tuhandeid erinevaid aminohappeid ja looduses leidub palju erinevaid aminohappeid, kuid valgusünteesiks kasutatakse ainult 20 erinevat aminohapet: alaniin, arginiin, asparagiin, asparagiinhape, valiin, histidiin, glütsiin, glutamiin, glutamiinhape, isoleutsiin, leutsiin, lüsiin, metioniin, proliin, seriin, türosiin, treoniin, trüptofaan, fenüülalaniin ja tsüsteiin (valkudes võib tsüsteiin esineda dimeerina
tsüstiin). Tõsi, mõnedes valkudes on lisaks regulaarselt esinevale kahekümnele ka teisi aminohappeid, kuid need tekivad mõne kahekümne loetletud modifitseerimise tulemusena pärast selle lisamist valgu hulka.optiline aktiivsus. Kõik aminohapped, välja arvatud glütsiin, a neli süsinikku kinnituvad erinevad rühmad. Geomeetriliselt saab nelja erinevat rühma kinnitada kahel viisil ja vastavalt sellele on kaks võimalikku konfiguratsiooni ehk kaks isomeeri, mis on omavahel seotud objektina oma peegelpildiga, s.t. kuidas vasak käsi paremale. Ühte konfiguratsiooni nimetatakse vasakpoolseks või vasakukäeliseks ( L ) ja teine parempoolne või paremale pöörav ( D ), kuna kaks sellist isomeeri erinevad polariseeritud valguse tasandi pöörlemissuuna poolest. Leidub ainult valkudes L -aminohapped (erandiks on glütsiin; seda saab esitada ainult ühel kujul, kuna selle neljast rühmast kaks on samad) ja neil kõigil on optiline aktiivsus (kuna seal on ainult üks isomeer). D -aminohapped on looduses haruldased; neid leidub mõnes antibiootikumis ja bakterite rakuseinas.Aminohapete järjestus. Aminohapped polüpeptiidahelas ei paikne juhuslikult, vaid kindlas kindlas järjekorras ning just see järjestus määrab valgu funktsioonid ja omadused. Varieerides 20 tüüpi aminohapete järjestust, saate tohutul hulgal erinevaid valke, nagu ka tähestiku tähtedest palju erinevaid tekste.Varem kestis valgu aminohappejärjestuse määramine sageli mitu aastat. Otsene määramine on endiselt üsna töömahukas ülesanne, kuigi on loodud seadmed, mis võimaldavad seda automaatselt teostada. Tavaliselt on lihtsam määrata vastava geeni nukleotiidjärjestus ja tuletada sellest valgu aminohappejärjestus. Tänaseks on paljude sadade valkude aminohappejärjestused juba kindlaks määratud. Dekodeeritud valkude funktsioonid on tavaliselt teada ja see aitab ette kujutada sarnaste valkude võimalikke funktsioone, mis moodustuvad näiteks pahaloomulistes kasvajates.
Komplekssed valgud. Ainult aminohapetest koosnevaid valke nimetatakse lihtsateks. Sageli on aga polüpeptiidahela külge kinnitatud metalliaatom või mõni muu element. keemiline ühend, mis ei ole aminohape. Selliseid valke nimetatakse kompleksseteks. Näiteks hemoglobiin: see sisaldab raudporfüriini, mis annab sellele punase värvuse ja võimaldab tal toimida hapnikukandjana.Enamike keerukamate valkude nimetused sisaldavad viidet seotud rühmade olemusele: glükoproteiinides on suhkrud, lipoproteiinides rasvad. Kui ensüümi katalüütiline aktiivsus sõltub seotud rühmast, siis nimetatakse seda proteesrühmaks. Sageli mängib mõni vitamiin proteesirühma rolli või on selle osa. Näiteks A-vitamiin, mis on kinnitunud ühe võrkkesta valgu külge, määrab selle valgustundlikkuse.
Tertsiaarne struktuur. Tähtis pole mitte niivõrd valgu aminohappejärjestus (esmasstruktuur), vaid viis, kuidas see ruumis paikneb. Kogu polüpeptiidahela pikkuses moodustuvad vesinikuioonid korrapäraselt vesiniksidemed, mis annavad sellele spiraali või kihi kuju (sekundaarne struktuur). Selliste spiraalide ja kihtide kombinatsioonist tekib järgmise järjestuse kompaktne vorm - valgu tertsiaarne struktuur. Ahela monomeerseid lülisid hoidvate sidemete ümber on võimalik pöörata läbi väikeste nurkade. Seetõttu on puhtalt geomeetrilisest vaatenurgast mis tahes polüpeptiidahela võimalike konfiguratsioonide arv lõpmatult suur. Tegelikkuses eksisteerib iga valk tavaliselt ainult ühes konfiguratsioonis, mille määrab tema aminohappejärjestus. See struktuur ei ole jäik, see on justkui « hingab” kõigub teatud keskmise konfiguratsiooni ümber. Kett on volditud konfiguratsiooni, milles vaba energia (töövõime) on minimaalne, nii nagu vabastatud vedru surutakse kokku ainult vaba energia miinimumile vastavasse olekusse. Sageli on üks ahela osa jäigalt seotud teise disulfiidiga ( SS) sidemed kahe tsüsteiinijäägi vahel. See on osaliselt põhjus, miks tsüsteiin mängib aminohapete hulgas erilist rolli. oluline roll.Valkude struktuuri keerukus on nii suur, et valgu tertsiaarset struktuuri pole veel võimalik välja arvutada, isegi kui selle aminohappejärjestus on teada. Kuid kui on võimalik saada valgukristalle, saab selle tertsiaarset struktuuri määrata röntgendifraktsiooniga.
Struktuursetes, kontraktiilsetes ja mõnedes teistes valkudes on ahelad piklikud ja mitmed kõrvuti asetsevad kergelt volditud ahelad moodustavad fibrillid; fibrillid omakorda volditakse suuremateks kiududeks. Enamik lahuses olevaid valke on aga kerakujulised: ahelad on kerinud kerasse, nagu lõng keras. Selles konfiguratsioonis on vaba energia minimaalne, kuna hüdrofoobsed ("vett tõrjuvad") aminohapped on peidetud kera sees, hüdrofiilsed ("vett tõmbavad") aminohapped aga selle pinnal.
Paljud valgud on mitme polüpeptiidahela kompleksid. Seda struktuuri nimetatakse valgu kvaternaarseks struktuuriks. Näiteks hemoglobiini molekul koosneb neljast alaühikust, millest igaüks on globulaarne valk.
Struktuurvalgud moodustavad oma lineaarse konfiguratsiooni tõttu kiude, mille tõmbetugevus on väga kõrge, samas kui globulaarne konfiguratsioon võimaldab valkudel astuda spetsiifilistesse interaktsioonidesse teiste ühenditega. Gloobuli pinnale ilmub kettide õige paigaldamise korral teatud õõnsus, milles asuvad reaktiivsed keemilised rühmad. Kui antud valk on ensüüm, siis sellisesse õõnsusse siseneb mingi aine teine, tavaliselt väiksem molekul, täpselt nagu võti lukku; sel juhul muutub õõnsuses paiknevate keemiliste rühmade mõjul molekuli elektronpilve konfiguratsioon ja see sunnib seda teatud viisil reageerima. Sel viisil katalüüsib ensüüm reaktsiooni. Antikeha molekulidel on ka õõnsused, milles seonduvad mitmesugused võõrained ja muutuvad seeläbi kahjutuks. "Võti ja lukk" mudel, mis selgitab valkude vastasmõju teiste ühenditega, võimaldab mõista ensüümide ja antikehade spetsiifilisust, s.t. nende võime reageerida ainult teatud ühenditega.
Valgud erinevat tüüpi organismides. Valgud, mis täidavad sama funktsiooni erinevad tüübid taimed ja loomad ning seetõttu kannavad sama nime, on sarnase konfiguratsiooniga. Kuid need erinevad mõnevõrra oma aminohappejärjestuse poolest. Kuna liigid lahknevad ühisest esivanemast, asendatakse mõned aminohapped teatud positsioonides mutatsioonidega teistega. Pärilikke haigusi põhjustavad kahjulikud mutatsioonid jäetakse kõrvale looduslik valik, kuid kasulikud või vähemalt neutraalsed võivad püsida. Mida lähemal on kaks bioloogilist liiki teineteisele, seda vähem on nende valkudes erinevusi.Mõned valgud muutuvad suhteliselt kiiresti, teised on üsna konservatiivsed. Viimaste hulka kuulub näiteks tsütokroom Koos hingamisteede ensüüm, mida leidub enamikus elusorganismides. Inimestel ja šimpansitel on selle aminohappejärjestused identsed ja tsütokroomis Koos nisu, vaid 38% aminohapetest osutus erinevateks. Isegi kui võrrelda inimesi ja baktereid, siis tsütokroomide sarnasus Koos(erinevused mõjutavad siin 65% aminohapetest) on siiani näha, kuigi bakterite ja inimeste ühine esivanem elas Maal umbes kaks miljardit aastat tagasi. Tänapäeval kasutatakse aminohapete järjestuste võrdlemist sageli filogeneetilise (genealoogilise) puu koostamiseks, mis peegeldab erinevate organismide vahelisi evolutsioonilisi suhteid.
Denatureerimine. Sünteesitud valgu molekul, voltimine, omandab oma konfiguratsiooni. Seda konfiguratsiooni saab aga hävitada kuumutamisel, pH muutmisel, orgaaniliste lahustite toimel ja isegi lihtsalt lahuse segamisel, kuni selle pinnale ilmuvad mullid. Sel viisil muudetud valku nimetatakse denatureeritud; see kaotab oma bioloogilise aktiivsuse ja muutub tavaliselt lahustumatuks. Tuntud näited denatureeritud valkudest keedetud munad või vahukoort. Väikesed valgud, mis sisaldavad vaid umbes sada aminohapet, on võimelised renatureerima, s.t. hankige uuesti algne konfiguratsioon. Kuid enamik valke muudetakse lihtsalt sassis polüpeptiidahelate massiks ega taasta oma eelmist konfiguratsiooni.Üks peamisi raskusi aktiivsete valkude eraldamisel on nende äärmine tundlikkus denaturatsiooni suhtes. Kasulik rakendus see valkude omadus leitakse konserveerimisel toiduained: kõrge temperatuur denatureerib pöördumatult mikroorganismide ensüüme ja mikroorganismid surevad.
VALGU SÜNTEES Valgu sünteesiks peab elusorganismis olema ensüümide süsteem, mis on võimeline siduma ühe aminohappe teisega. Vaja on ka infoallikat, mis määraks, millised aminohapped tuleks ühendada. Kuna kehas on tuhandeid valke ja igaüks neist koosneb keskmiselt mitmesajast aminohappest, vajalikku teavet peab olema tõesti tohutu. See on salvestatud (sarnaselt sellele, kuidas salvestatakse kirjet magnetlindile) nukleiinhappemolekulides, mis moodustavad geenid. cm . ka PÄRILIKKUS; NUKLEIINHAPPED.Ensüümide aktiveerimine. Aminohapetest sünteesitud polüpeptiidahel ei ole alati lõplikul kujul valk. Paljud ensüümid sünteesitakse esmalt mitteaktiivsete lähteainetena ja need muutuvad aktiivseks alles pärast seda, kui teine ensüüm eemaldab ahela ühest otsast mõne aminohappe. Sellises aktiivne vorm osa seedeensüüme sünteesitakse, näiteks trüpsiin; Need ensüümid aktiveeritakse seedetrakt ahela otsafragmendi eemaldamise tulemusena. Hormooninsuliin, mille molekul aktiivsel kujul koosneb kahest lühikesest ahelast, sünteesitakse ühe ahela kujul, nn. proinsuliin. Siis keskosa see ahel eemaldatakse ja ülejäänud fragmendid seostuvad üksteisega, moodustades aktiivse hormooni molekuli. Komplekssed valgud tekivad alles pärast teatud keemilise rühma kinnitumist valgu külge ja see kinnitumine nõuab sageli ka ensüümi.Metaboolne vereringe. Pärast looma toitmist süsiniku, lämmastiku või vesiniku radioaktiivsete isotoopidega märgistatud aminohapetega liidetakse märgis kiiresti tema valkudesse. Kui märgistatud aminohapped lakkavad kehasse sisenemast, hakkab märgise hulk valkudes vähenema. Need katsed näitavad, et saadud valke ei säilitata kehas kuni eluea lõpuni. Kõik need, välja arvatud mõned erandid, on dünaamilises olekus, lagunedes pidevalt aminohapeteks ja seejärel uuesti sünteesitud.Mõned valgud lagunevad, kui rakud surevad ja hävivad. See juhtub pidevalt, näiteks erütrotsüütide ja epiteeli voodri rakkudega sisepind sooled. Lisaks toimub elusrakkudes ka valkude lagunemine ja taassüntees. Kummalisel kombel teatakse valkude lagunemisest vähem kui nende sünteesist. Selge on aga see, et lagundamisel osalevad proteolüütilised ensüümid, mis on sarnased nendele, mis lagundavad seedetraktis valgud aminohapeteks.
Erinevate valkude poolväärtusaeg varieerub mitmest tunnist mitme kuuni. Ainus erand on kollageeni molekul. Kui need on moodustatud, jäävad need stabiilseks ja neid ei uuendata ega asendata. Aja jooksul aga muutuvad mõned nende omadused, eelkõige elastsus, ja kuna need ei uuene, siis teatud vanusega seotud muutused nagu kortsude ilmumine nahale.
sünteetilised valgud. Keemikud on juba ammu õppinud aminohappeid polümeriseerima, kuid aminohapped ühinevad juhuslikult, nii et sellise polümerisatsiooni saadused on looduslike omadega vähe sarnased. Tõsi, aminohappeid on võimalik teatud järjekorras kombineerida, mis võimaldab saada mõningaid bioloogiliselt aktiivseid valke, eriti insuliini. Protsess on üsna keeruline ja nii on võimalik saada ainult neid valke, mille molekulid sisaldavad sadakond aminohapet. Selle asemel on eelistatav sünteesida või isoleerida soovitud aminohappejärjestusele vastava geeni nukleotiidjärjestus ja viia see geen seejärel bakterisse, mis toodab replikatsiooni teel palju soovitud toode. Sellel meetodil on aga ka omad miinused. cm . Vaata ka GEENIINSENERING. VALGUD JA TOITUMINE Kui organismis olevad valgud lagunevad aminohapeteks, saab neid aminohappeid valgusünteesiks uuesti kasutada. Samal ajal lagunevad aminohapped ise, nii et neid ei kasutata täielikult ära. Samuti on selge, et kasvu, raseduse ja haavade paranemise ajal peab valkude süntees ületama lagunemise. Keha kaotab pidevalt mõningaid valke; need on juuste, küünte ja naha pinnakihi valgud. Seetõttu peab iga organism valkude sünteesiks saama aminohappeid toidust. Rohelised taimed sünteesitakse CO-st 2 , vesi ja ammoniaak või nitraadid on kõik 20 aminohapet, mida leidub valkudes. Paljud bakterid on võimelised sünteesima aminohappeid ka suhkru (või mõne samaväärse) ja fikseeritud lämmastiku juuresolekul, kuid lõpuks tarnivad suhkrut rohelised taimed. Loomadel on aminohapete sünteesimise võime piiratud; nad saavad aminohappeid rohelisi taimi või muid loomi süües. Seedekulglas lagundatakse imendunud valgud aminohapeteks, viimased imenduvad ning organismile iseloomulikud valgud. antud organism. Ükski imendunud valk ei ole sellisena kehastruktuuridesse lülitatud. Ainus erand on see, et paljudel imetajatel võib osa emasloomade antikehadest läbi platsenta sattuda tervena loote vereringesse ja emapiima kaudu (eriti mäletsejalistel) kanduda vastsündinule kohe pärast sündi.Vajadus valkude järele. Selge on see, et elu säilitamiseks peab organism toidust saama teatud koguse valku. Selle vajaduse suurus sõltub aga mitmest tegurist. Organism vajab toitu nii energia (kalorite) allikana kui ka materjalina oma struktuuride ülesehitamiseks. Esiteks on vajadus energia järele. See tähendab, et kui toidus on vähe süsivesikuid ja rasvu, toiduvalgud kasutatakse mitte nende enda valkude sünteesiks, vaid kaloriallikana. Pikaajalise paastumise korral kulutatakse energiavajaduse rahuldamiseks isegi teie enda valgud. Kui toidus on piisavalt süsivesikuid, võib valgu tarbimist vähendada.lämmastiku tasakaal. Keskmiselt u. 16% valgu kogumassist moodustab lämmastik. Valke moodustavate aminohapete lagundamisel eritub neis sisalduv lämmastik organismist uriiniga ja (vähemal määral) väljaheitega erinevate lämmastikuühendite kujul. Seetõttu on see mugav kvaliteedi hindamiseks valgu toitumine kasutada sellist indikaatorit lämmastiku tasakaaluna, st. kehasse viidud lämmastiku koguse ja ööpäevas väljutatava lämmastiku koguse vahe (grammides). Kell normaalne toitumine täiskasvanul on need arvud võrdsed. Kasvavas organismis eritunud lämmastiku hulk vähem kogust saanud, s.t. saldo on positiivne. Valgu puudumisega toidus on tasakaal negatiivne. Kui toidus on piisavalt kaloreid, aga valgud puuduvad selles täielikult, säästab organism valke. Samal ajal aeglustub valkude ainevahetus ja aminohapete taaskasutamine valgusünteesis toimub võimalikult tõhusalt. Kaod on aga vältimatud ning lämmastikuühendid erituvad endiselt uriiniga ja osaliselt ka väljaheitega. Valgunälja ajal kehast päevas eritunud lämmastiku kogus võib olla igapäevase valgupuuduse mõõt. Loomulik on eeldada, et selle defitsiidiga võrdväärse valgukoguse lisamisega dieeti on võimalik taastada lämmastiku tasakaal. Siiski ei ole. Sellise valgukoguse saamisel hakkab organism aminohappeid vähem tõhusalt kasutama, seega kulub lämmastiku tasakaalu taastamiseks veidi aega. lisakogus orav.Kui valgu kogus toidus ületab lämmastiku tasakaalu säilitamiseks vajaliku, siis näib, et sellest pole kahju. Üleliigseid aminohappeid kasutatakse lihtsalt energiaallikana. Eriti markantse näitena võib viidata eskimotele, kes tarbivad vähe süsivesikuid ja umbes kümme korda rohkem valku kui vaja lämmastiku tasakaalu säilitamiseks. Enamasti on aga valgu kasutamine energiaallikana ebasoodne, kuna teatud kogusest süsivesikutest saad palju rohkem kaloreid kui samast valgukogusest. Vaestes riikides saavad inimesed vajalikke kaloreid süsivesikute arvelt ja tarbib minimaalselt valku.
Kui a vajalik number kaloreid, mida organism saab valguvabade toodetena, minimaalne lämmastiku tasakaalu säilitav valgu kogus on u. 30 g päevas. Ligikaudu sama palju valku sisaldab neli viilu saia või 0,5 liitrit piima. Tavaliselt peetakse optimaalseks mitut. suur kogus; soovitatav 50-70 g.
Asendamatud aminohapped. Seni on valku käsitletud tervikuna. Samal ajal peavad valkude sünteesi toimumiseks kehas olema kõik vajalikud aminohapped. Mõnda aminohapet on looma keha ise võimeline sünteesima. Neid nimetatakse asendatavateks, kuna neid ei pea toidus olema, oluline on vaid see, et üldiselt oleks valgu kui lämmastikuallika tarbimine piisav; siis puuduse korral mitteasendatavad aminohapped keha saab neid sünteesida nende arvelt, mida esineb liigselt. Ülejäänud "asendamatuid" aminohappeid ei saa sünteesida ja need tuleb sisse võtta koos toiduga. Inimestele hädavajalikud on valiin, leutsiin, isoleutsiin, treoniin, metioniin, fenüülalaniin, trüptofaan, histidiin, lüsiin ja arginiin. (Kuigi arginiini saab organismis sünteesida, peetakse seda asendamatuks aminohappeks, kuna see moodustub vastsündinutel ja kasvavatel lastel mitte piisavalt. Teisalt inimese jaoks keskiga Mõnede nende aminohapete tarbimine toiduga võib muutuda valikuliseks.)See nimekiri asendamatud aminohapped ligikaudu sama ka teistel selgroogsetel ja isegi putukatel. Valkude toiteväärtus määratakse tavaliselt kasvavatele rottidele söötmise ja loomade kaalutõusu jälgimise teel.
Valkude toiteväärtus. Valgu toiteväärtuse määrab asendamatu aminohape, millest on kõige rohkem puudus. Illustreerime seda näitega. Meie keha valgud sisaldavad keskmiselt u. 2% trüptofaani (massi järgi). Oletame, et dieet sisaldab 10 g valku, mis sisaldab 1% trüptofaani ja selles on piisavalt muid asendamatuid aminohappeid. Meie puhul võrdub 10 g seda defektset valku sisuliselt 5 g täieliku valguga; ülejäänud 5 g saab olla ainult energiaallikas. Pange tähele, et kuna aminohappeid kehas praktiliselt ei säilitata ja valkude sünteesi toimumiseks peavad kõik aminohapped olema samaaegselt olemas, saab asendamatute aminohapete tarbimise mõju tuvastada ainult siis, kui need kõik sisenevad kehasse. keha samal ajal.. Enamiku loomsete valkude keskmine koostis on lähedane valkude keskmisele koostisele Inimkeha, seega ei ohusta aminohapete puudus meid tõenäoliselt, kui meie toidus on rikkalikult selliseid toiduaineid nagu liha, munad, piim ja juust. Siiski on valke, nagu želatiin (kollageeni denaturatsiooni produkt), mis sisaldavad väga vähe asendamatuid aminohappeid. Taimsed valgud, kuigi nad on selles mõttes paremad kui želatiin, on ka asendamatute aminohapete poolest vaesed; eriti vähe neis lüsiini ja trüptofaani. Ikka ja puhas taimetoitlane dieet ei saa üldse kahjulikuks pidada, välja arvatud juhul, kui tarbitakse veidi suuremas koguses taimseid valke, mis on piisav keha varundamiseks asendamatute aminohapetega. Enamik valke leidub taimedes seemnetes, eriti nisu ja erinevate kaunviljade seemnetes. Valgurikkad on ka noored võrsed, näiteks spargel.Sünteetilised valgud toidus. Lisades väikeses koguses sünteetilisi asendamatuid aminohappeid või nende poolest rikkaid valke mittetäielikele valkudele, näiteks maisivalkudele, on võimalik oluliselt suurendada toiteväärtus viimane, s.o. suurendades seeläbi tarbitava valgu hulka. Teine võimalus on kasvatada baktereid või pärme naftasüsivesinikel, lisades lämmastikuallikana nitraate või ammoniaaki. Sel viisil saadud mikroobne valk võib olla kodulindude või kariloomade söödaks või inimestele otse tarbitav. Kolmas, laialdaselt kasutatav meetod kasutab mäletsejaliste füsioloogiat. Mäletsejalistel mao alglõigus nn. arm, kus elavad erivormid bakterid ja algloomad, mis muunduvad halvemaks taimsed valgud terviklikumateks mikroobseteks valkudeks ning need omakorda pärast seedimist ja imendumist loomseteks valkudeks. Karbamiidi, odavat sünteetilist lämmastikku sisaldavat ühendit, võib lisada loomasöödale. Vatsas elavad mikroorganismid kasutavad uurea lämmastikku, et muuta süsivesikud (mida on söödas palju rohkem) valkudeks. Umbes kolmandik kogu loomasöödas leiduvast lämmastikust võib tulla karbamiidi kujul, mis sisuliselt tähendab teatud määral keemilist valgusünteesi. USA-s on sellel meetodil oluline roll ühe valgu hankimise viisina.KIRJANDUS Murray R, Grenner D, Meyes P, Rodwell W. inimese biokeemia, tt. 12. M., 1993Alberts B., Bray D., Lewis J. et al. Raku molekulaarbioloogia, tt. 13. M., 1994
Oravad - Need on biopolümeerid, mis koosnevad peptiidsidemetega (-CO-NH-) omavahel ühendatud α-aminohappe jääkidest. Valgud on osa kõigi elusorganismide rakkudest ja kudedest. Valgu molekulid sisaldavad 20 erinevat aminohappejääki.
valgu struktuur
Valkudel on ammendamatult palju erinevaid struktuure.
Valgu esmane struktuur on aminohappeühikute järjestus lineaarses polüpeptiidahelas.
sekundaarne struktuur- see on heeliksit meenutava valgusmolekuli ruumiline konfiguratsioon, mis moodustub polüpeptiidahela keerdumisel rühmade vaheliste vesiniksidemete tõttu: CO ja NH.
Tertsiaarne struktuur- see on spiraaliks keerdunud polüpeptiidahela ruumiline konfiguratsioon.
Kvaternaarne struktuur on mitme valgu makromolekuli polümeersed moodustised.
Füüsikalised omadused
Valkude omadused on väga mitmekesised, mida nad täidavad. Mõned valgud lahustuvad vees, moodustades reeglina kolloidseid lahuseid (näiteks munavalge); teised lahustuvad lahjendatud soolalahustes; teised on lahustumatud (näiteks sisekudede valgud).
Keemilised omadused
Denaturatsioon- valgu sekundaarse, tertsiaarse struktuuri hävitamine toimel erinevaid tegureid: temperatuur, hapete toime, raskmetallide soolad, alkoholid jne.
Mõju all oleva denatureerimise ajal välised tegurid(temperatuur, mehaaniline mõju, keemiliste ainete toime ja muud tegurid) toimub muutus valgu makromolekuli sekundaarses, tertsiaarses ja kvaternaarses struktuuris, see tähendab selle natiivses ruumilises struktuuris. Esmane struktuur ja seega keemiline koostis valgud ei muutu. muutuvad füüsikalised omadused: vähenenud lahustuvus, hüdratatsioonivõime, bioloogilise aktiivsuse kaotus. Valgu makromolekuli kuju muutub, toimub agregatsioon. Samal ajal suureneb mõnede rühmade aktiivsus, proteolüütiliste ensüümide mõju valkudele hõlbustatakse ja sellest tulenevalt on see kergemini hüdrolüüsitav.
Toidutehnoloogias on eriti praktilise tähtsusega valkude termiline denatureerimine, mille aste sõltub temperatuurist, kuumutamisajast ja õhuniiskusest. Seda tuleb meeles pidada toidutoorme, pooltoodete ja mõnikord kuumtöötlemise režiimide väljatöötamisel valmistooted. eriline roll termilise denatureerimise protsessid mängivad taimsete materjalide blanšeerimisel, teravilja kuivatamisel, leiva küpsetamisel, pasta. Valkude denaturatsiooni võib põhjustada mehaaniline toime(surve, hõõrumine, raputamine, ultraheli). Keemiliste reaktiivide (happed, leelised, alkohol, atsetoon) toime põhjustab valkude denatureerumist. Kõiki neid tehnikaid kasutatakse laialdaselt toidu- ja biotehnoloogias.
Kvalitatiivsed reaktsioonid valkudele:
a) Valkude põletamisel - põlenud sulgede lõhn.
b) Valk + HNO 3 → kollane värvus
c) Valgulahus + NaOH + CuSO 4 → violetne värvus
Hüdrolüüs
Valk + H 2 O → aminohapete segu
Valkude funktsioonid looduses:
katalüütiline (ensüümid);
Reguleeriv (hormoonid);
Struktuurne (villane keratiin, siidfibroiin, kollageen);
motoorne (aktiin, müosiin);
transport (hemoglobiin);
Varu (kaseiin, munaalbumiin);
kaitsev (immunoglobuliinid) jne.
Niisutus
Hüdratsiooniprotsess tähendab vee sidumist valkudega, samal ajal kui neil on hüdrofiilsed omadused: nad paisuvad, nende mass ja maht suurenevad. Valgu tursega kaasneb selle osaline lahustumine. Üksikute valkude hüdrofiilsus sõltub nende struktuurist. Valgu makromolekuli pinnal asuvad hüdrofiilsed amiid- (–CO–NH–, peptiidside), amiini (NH 2) ja karboksüülrühma (COOH) rühmad tõmbavad ligi veemolekule, orienteerides need rangelt valgu pinnale. molekul. Valguglobuleid ümbritsev hüdraat (vesi) takistab valgulahuste stabiilsust. Isoelektrilises punktis on valkudel vähim võime vett siduda, valgumolekule ümbritsev hüdratatsioonikiht hävib, mistõttu need ühinevad, moodustades suuri agregaate. Valgumolekulide agregatsioon toimub ka siis, kui need dehüdreeritakse mõne orgaanilise lahustiga, näiteks etüülalkoholiga. See viib valkude sadenemiseni. Kui söötme pH muutub, valgu makromolekul laetakse ja selle hüdratatsioonivõime muutub.
Piiratud turse korral moodustavad kontsentreeritud valgulahused keerukaid süsteeme, mida nimetatakse tarretisteks. Tarretised ei ole vedelad, elastsed, neil on plastilisus, teatud mehaaniline tugevus ja nad suudavad säilitada oma kuju. Kerakujulisi valke saab täielikult hüdraatida, lahustades need vees (näiteks piimavalgud), moodustades madala kontsentratsiooniga lahuseid. Valkude hüdrofiilsed omadused on suur tähtsus bioloogias ja toiduainetööstuses. Väga liikuv tarretis, mis on ehitatud peamiselt valgu molekulidest, on tsütoplasma - raku poolvedel sisu. Väga hüdreeritud tarretis on nisutainast eraldatud toorgluteen, mis sisaldab kuni 65% vett. Hüdrofiilsus, nisu terade, teraviljaproteiinide ja jahu peamine kvaliteet, mängib olulist rolli teravilja säilitamisel ja töötlemisel, küpsetamisel. Tainas, mida saadakse pagaritööstuses, on vees paisunud valk, tärkliseterasid sisaldav kontsentreeritud tarretis.
Vahutamine
Vahustamisprotsess on valkude võime moodustada väga kontsentreeritud vedelgaasisüsteeme, mida nimetatakse vahtudeks. Vahu, milles valk on vahuaine, stabiilsus ei sõltu ainult selle olemusest ja kontsentratsioonist, vaid ka temperatuurist. Valke kasutatakse laialdaselt vahuainetena kondiitritööstuses (vahukomm, vahukomm, suflee) Leival on vahu struktuur ja see mõjutab selle maitseomadusi.
Põlemine
Valgud põlevad, moodustades lämmastiku süsinikdioksiid ja vesi, aga ka mõned muud ained. Põlemisega kaasneb põlenud sulgedele iseloomulik lõhn.
värvireaktsioonid.
- Ksantoproteiin - toimub aromaatsete ja heteroaatomiliste tsüklite interaktsioon valgu molekulis kontsentreeritud lämmastikhappega, millega kaasneb kollase värvuse ilmumine;
- Biureet - valkude nõrgalt leeliseliste lahuste ja vask(II) sulfaadi lahusega interaktsioon toimub komplekssete ühendite moodustumisega Cu 2+ ioonide ja polüpeptiidide vahel. Reaktsiooniga kaasneb violetse-sinise värvuse ilmumine;
- kui valke kuumutatakse leelisega pliisoolade juuresolekul, tekib must sade, mis sisaldab väävlit.
§ 9. VALKUDE FÜÜSIKALIS-KEEMILISED OMADUSED
Valgud on väga suured molekulid, suuruselt võivad need olla madalamad kui nukleiinhapete ja polüsahhariidide üksikud esindajad. Tabelis 4 on esitatud mõnede valkude molekulaarsed omadused.
Tabel 4
Mõnede valkude molekulaarsed omadused
|
Suhteline molekulmass |
Vooluahelate arv |
Aminohappejääkide arv |
|
|
Ribonukleaas |
|||
|
müoglobiin |
|||
|
Kümotrüpsiin |
|||
|
Hemoglobiin |
|||
|
Glutamaadi dehüdrogenaas |
Valgu molekulid võivad sisaldada kõige rohkem erinev summa aminohappejäägid - 50 kuni mitu tuhat; ka valkude suhtelised molekulmassid on väga erinevad – mitmest tuhandest (insuliin, ribonukleaas) miljonini (glutamaatdehüdrogenaas) või rohkemgi. Polüpeptiidahelate arv valkudes võib ulatuda ühest mitme kümne või isegi tuhandeni. Seega sisaldab tubaka mosaiikviiruse valk 2120 protomeeri.
Teades valgu suhtelist molekulmassi, saab ligikaudselt hinnata, kui palju aminohappejääke selle koostis sisaldab. Polüpeptiidahelat moodustavate aminohapete keskmine suhteline molekulmass on 128. Peptiidsideme moodustumisel lõhustatakse veemolekul, mistõttu on aminohappejäägi keskmine suhteline mass 128 - 18 = 110. Neid andmeid kasutades saame arvutada, et 100 000 suhtelise molekulmassiga valk koosneb ligikaudu 909 aminohappejäägist.
Valgu molekulide elektrilised omadused
Valkude elektrilised omadused on määratud positiivse ja negatiivse laenguga aminohappejääkide olemasoluga nende pinnal. Laetud valgurühmade olemasolu määrab valgu molekuli kogulaengu. Kui valkudes domineerivad negatiivselt laetud aminohapped, siis selle molekul neutraalses lahuses on negatiivse laenguga, kui ülekaalus on positiivselt laetud aminohapped, on molekul positiivse laenguga. Valgu molekuli kogulaeng sõltub ka söötme happesusest (pH). Vesinikuioonide kontsentratsiooni suurenemisega (happesuse suurenemine) pärsitakse karboksüülrühmade dissotsiatsiooni:
ja samal ajal suureneb protoneeritud aminorühmade arv;
Seega söötme happesuse suurenemisega väheneb negatiivselt laetud rühmade arv valgu molekuli pinnal ja suureneb positiivselt laetud rühmade arv. Täiesti teistsugust pilti täheldatakse vesinikioonide kontsentratsiooni vähenemise ja hüdroksiidioonide kontsentratsiooni suurenemisega. Dissotsieerunud karboksüülrühmade arv suureneb
ja protoneeritud aminorühmade arv väheneb
Seega saab söötme happesust muutes muuta ka valgumolekuli laengut. Valgumolekulis oleva söötme happesuse suurenemisega väheneb negatiivselt laetud rühmade arv ja suureneb positiivselt laetud rühmade arv, molekul kaotab järk-järgult negatiivse ja omandab positiivse laengu. Lahuse happesuse vähenemisega täheldatakse vastupidist pilti. Ilmselt on teatud pH väärtuste korral molekul elektriliselt neutraalne; positiivselt laetud rühmade arv võrdub negatiivselt laetud rühmade arvuga ja molekuli kogulaeng on null (joonis 14).
pH väärtust, mille juures valgu kogulaeng on null, nimetatakse isoelektriliseks punktiks ja seda tähistataksepi.

Riis. 14. Isoelektrilise punkti olekus on valgumolekuli kogulaeng null
Enamiku valkude isoelektriline punkt on pH vahemikus 4,5–6,5. Siiski on erandeid. Allpool on mõnede valkude isoelektrilised punktid:
pH väärtustel alla isoelektrilise punkti kannab valk positiivset kogulaengut ja sellest kõrgemal negatiivset kogulaengut.
Isoelektrilises punktis on valgu lahustuvus minimaalne, kuna selle molekulid on selles olekus elektriliselt neutraalsed ja nende vahel ei ole vastastikust tõukejõudu, mistõttu võivad nad vesinik- ja ioonsidemete, hüdrofoobsete interaktsioonide, van. der Waalsi väed. PI-st erinevate pH väärtuste korral kannavad valgumolekulid sama laengut - kas positiivset või negatiivset. Selle tulemusena tekivad molekulide vahel elektrostaatilised tõukejõud, mis takistavad nende "kokkukleepumist", lahustuvus on suurem.
Valkude lahustuvus
Valgud on vees lahustuvad ja lahustumatud. Valkude lahustuvus sõltub nende struktuurist, pH väärtusest, lahuse soola koostisest, temperatuurist ja muudest teguritest ning selle määrab nende rühmade olemus, mis on valgu molekuli pinnal. Lahustumatute valkude hulka kuuluvad keratiin (juuksed, küüned, suled), kollageen (kõõlused), fibroiin (leelis, ämblikuvõrk). Paljud teised valgud on vees lahustuvad. Lahustuvuse määrab laetud ja polaarsete rühmade olemasolu nende pinnal (-COO -, -NH 3 +, -OH jne). Valkude laetud ja polaarsed rühmitused meelitavad veemolekule enda poole ning nende ümber moodustub hüdratatsioonikest (joon. 15), mille olemasolu määrab nende lahustuvuse vees.

Riis. 15. Valgu molekuli ümber hüdratatsioonikihi moodustumine.
Valkude lahustuvust mõjutab neutraalsete soolade (Na 2 SO 4, (NH 4) 2 SO 4 jne) olemasolu lahuses. Madalatel soolade kontsentratsioonidel suureneb valkude lahustuvus (joonis 16), kuna sellistes tingimustes suureneb polaarsete rühmade dissotsiatsiooni aste ja valgumolekulide laetud rühmad on varjestatud, vähendades seeläbi valgu-valgu interaktsiooni, mis aitab kaasa valkude moodustumisele. agregaadid ja valkude sadestumine. Suure soolakontsentratsiooni korral väheneb valkude lahustuvus (joonis 16) hüdratatsioonikihi hävimise tõttu, mis põhjustab valgumolekulide agregatsiooni.
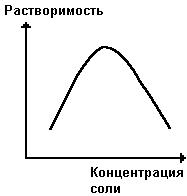
Riis. 16. Valkude lahustuvuse sõltuvus soola kontsentratsioonist
On valke, mis lahustuvad ainult soolalahustes ja ei lahustu puhas vesi, nimetatakse selliseid valke globuliinid. On ka teisi valke albumiinid, erinevalt globuliinidest lahustuvad nad puhtas vees hästi.
Valkude lahustuvus sõltub ka lahuste pH-st. Nagu me juba märkisime, on valkude lahustuvus isoelektrilises punktis minimaalne, mis on seletatav valgu molekulide vahelise elektrostaatilise tõuke puudumisega.
Teatud tingimustel võivad valgud moodustada geeli. Geeli moodustumisel moodustavad valgumolekulid tiheda võrgustiku, mille sisemus on täidetud lahustiga. Geelidest moodustub jogurti valmistamisel näiteks želatiin (sellest proteiinist valmistatakse tarretis) ja piimavalke.
Temperatuur mõjutab ka valgu lahustuvust. Kõrge temperatuuri mõjul sadestuvad paljud valgud nende struktuuri katkemise tõttu, kuid sellest tuleb täpsemalt juttu järgmises osas.
Valkude denatureerimine
Vaatleme hästi tuntud nähtust. Munavalge kuumutamisel muutub see järk-järgult häguseks ja seejärel moodustub tahke tromb. keerduv munavalge- munaalbumiin - pärast jahutamist osutub see lahustumatuks, samas kui enne kuumutamist oli munavalge vees hästi lahustuv. Samad nähtused ilmnevad ka siis, kui kuumutatakse peaaegu kõiki keravalke. Kuumutamisel toimuvaid muutusi nimetatakse denatureerimine. Valke nende loomulikus olekus nimetatakse emakeelena valgud ja pärast denatureerimist - denatureeritud.
Denatureerimisel häirub valkude natiivne konformatsioon nõrkade sidemete katkemise tagajärjel (ioonsed, vesinikud, hüdrofoobsed interaktsioonid). Selle protsessi tulemusena võivad valgu kvaternaarsed, tertsiaarsed ja sekundaarsed struktuurid hävida. Esmane struktuur on säilinud (joon. 17).

Riis. 17. Valkude denatureerimine
Denatureerimise käigus tekivad pinnale hüdrofoobsed aminohapperadikaalid, mida leidub natiivsetes valkudes molekuli sügavuses, mille tulemusena tekivad tingimused agregatsiooniks. Valgumolekulide agregaadid sadestuvad. Denaturatsiooniga kaasneb valgu bioloogilise funktsiooni kadumine.
Valkude denaturatsiooni võivad põhjustada mitte ainult kõrgenenud temperatuur, vaid ka muud tegurid. Happed ja leelised võivad põhjustada valkude denaturatsiooni: nende toime tulemusena ionogeensed rühmad laetakse uuesti, mis viib ioon- ja vesiniksidemete katkemiseni. Karbamiid hävitab vesiniksidemeid, mille tulemuseks on nende loomuliku struktuuri kadumine valkude poolt. Denatureerivad ained on orgaanilised lahustid ja raskmetalliioonid: orgaanilised lahustid hävitavad hüdrofoobseid sidemeid ja raskmetalliioonid moodustavad valkudega lahustumatuid komplekse.
Koos denatureerimisega on olemas ka vastupidine protsess – renaturatsioon. Denatureeriva faktori eemaldamisega on võimalik taastada algne loomulik struktuur. Näiteks aeglasel jahutamisel kuni toatemperatuuril lahus taastab trüpsiini loomuliku struktuuri ja bioloogilise funktsiooni.
Valgud võivad rakus denatureerida ka normaalsete eluprotsesside käigus. On üsna ilmne, et valkude loomuliku struktuuri ja funktsiooni kadumine on äärmiselt ebasoovitav sündmus. Sellega seoses tuleks mainida spetsiaalseid valke - saatjad. Need valgud suudavad ära tunda osaliselt denatureeritud valke ja nendega seondudes taastada nende natiivse konformatsiooni. Chaperonid tunnevad ära ka valgud, mis pole kaugeltki denatureerivad, ja transpordivad need lüsosoomidesse, kus need lagunevad. Tšaperoonid mängivad olulist rolli ka tertsiaarsete ja kvaternaarsete struktuuride moodustamisel valgusünteesi käigus.
Huvitav teada! Praegu mainitakse sageli sellist haigust nagu hullu lehma tõbi. Seda haigust põhjustavad prioonid. Need võivad loomadel ja inimestel põhjustada ka muid neurodegeneratiivseid haigusi. Prioonid on valgulised nakkusetekitajad. Kui prioon siseneb rakku, põhjustab see muutuse oma rakulise vaste konformatsioonis, mis ise muutub priooniks. Nii tekib haigus. Prioonvalk erineb raku omast sekundaarne struktuur. Valgu prioonvorm on peamiseltb-volditud struktuur ja rakuline -a- spiraal.
Valgud looduses
Valgud on elu molekulid. Iga elusorganism sisaldab suurt hulka erinevaid valgumolekule, samas kui igal liigil on oma ainulaadsed valgud. Isegi valgud, mis toimivad mitmesugused samad funktsioonid erinevad üksteisest. Näiteks kõikidel selgroogsetel – kaladel, lindudel, imetajatel – sisaldavad punased verelibled valku hemoglobiini, mis kannab hapnikku. Kuid iga loomaliigi hemoglobiin on oma, eriline. Hobuse hemoglobiini molekul erineb vastavast inimese valgust 26 kohas, sigadel 10, gorilladel aga vaid ühe aminohappe poolest.
Valkude funktsioonid kehas on väga mitmekesised. Seal on valgud - ainete (molekulid, ioonid) ja elektronide kandjad; on biokatalüsaatoreid, mis kiirendavad reaktsioone miljard korda ja eristuvad hämmastava spetsiifilisusega; kehas on erinevate bioloogiliste protsesside regulaatorid - hormoonid, näiteks insuliin, vasopressiin, oksütotsiin. Valgud kaitsevad organismi nakkuse eest, nad suudavad ära tunda ja hävitada võõrkehi: viirused, bakterid, rakud. Raku kontakte väliskeskkonnaga teostavad ka erinevad valgud, mis suudavad eristada molekulide kuju, registreerida temperatuurimuutusi, ainete ebaolulisi lisandeid ja eristada üht värvi teisest.
Valgu omadused
Valkude omadused on väga mitmekesised ja selle määrab nende struktuur.
1. Vees lahustuvuse järgi valgud jagunevad kahte klassi:
kerajas valgud - lahustuvad vees või moodustavad kolloidseid lahuseid; fibrillaarne valgud on vees lahustumatud.
2. Denatureerimine. Kuumutamisel, muutes söötme happesust, toimub valgu sekundaarse ja tertsiaarse struktuuri hävimine koos primaarse säilimisega. Seda nähtust nimetatakse denatureerimine .
Denatureerimise näide- voltimine munavalged munade keetmisel. Toimub denaturatsioon pööratav (alkoholi, soolase toidu joomisel) ja pöördumatu. pöördumatu võib põhjustada denaturatsiooni kõrged temperatuurid, kiiritus, keha mürgistuse korral raskmetallide soolade, alkoholide, hapetega.
VIDEO:
3. Valkude hüdrolüüs- see on primaarstruktuuri pöördumatu hävitamine happelises või leeliselises lahuses koos aminohapete moodustumisega. Hüdrolüüsi saadusi analüüsides on võimalik kindlaks teha valkude kvantitatiivne koostis.
4. Valkude puhul on teada mitmeid kvalitatiivseid reaktsioone.
1. Kõik peptiidsidet sisaldavad ühendid annavad leeliselises lahuses kokkupuutel vase (II) sooladega violetse värvuse. See reaktsioon helistas biureet.
VIDEO:
2. Aromaatseid aminohappejääke (fenüülalaniin, türosiin) sisaldavad valgud annavad kontsentreeritud lämmastikhappega kokkupuutel kollase värvuse - ksantoproteiini reaktsioon.
VIDEO:
5. Valkude amfoteersed omadused
Väga oluline elusorganismide eluks on valkude puhveromadus, s.o. võime siduda nii happeid kui aluseid ning hoida elusorganismi erinevate süsteemide pH-väärtust püsivana.
Valkude muundumine kehas
Loomorganismid ehitavad oma valke toidust saadavate valkude aminohapetest. Seetõttu on valgud koos rasvade ja süsivesikutega meie toidu oluline komponent.
Loomsed ja taimsed valgud lagunevad inimese seedetraktis aminohapeteks. Toidu seedimise käigus hüdrolüüsitakse valgud ensüümide mõjul. Maos lagunevad need enam-vähem suurteks "fragmentideks" – peptiidideks, mis soolestikus edasi hüdrolüüsitakse aminohapeteks. Viimased imenduvad soolestiku villide poolt verre ja sisenevad kõikidesse keha kudedesse ja rakkudesse. Siin sünteesitakse ensüümide toimel aminohapetest inimkeha kudedele iseloomulikud valgud. Valkude süntees nõuab teatud aminohapete olemasolu. Kuid osades toiduga kaasas olevates valkudes on kõik inimesele vajalikud aminohapped, teistes aga mitte kõik. Inimkeha suudab ise sünteesida mõnda aminohapet või asendada need teistega. Kuid ta ei suuda moodustada 10 aminohapet. Neid tuleb hankida koos toiduga. Neid happeid nimetatakse asendamatuteks (vt Rakendused).
Valke, mis sisaldavad kõiki asendamatuid aminohappeid, nimetatakse täisväärtuslikeks valkudeks. Ülejäänud valgud on mittetäielikud. Täisvalgud on piim, juust, liha, kala, munad, kaunviljad. Valkude sünteesi rakkudes kontrollib DNA. See viiakse läbi ribosoomide pinnal RNA abil. Valke ei säilitata inimkehas peaaegu kunagi. Liigsed aminohapped maksarakkudes muudetakse süsivesikuteks – glükoosiks ja glükogeeniks või reservrasvaks. Seetõttu peaksid balletitantsijad vältima oma toidus liigset valku. Väga kahjulik on aga tahtlik nälgimine, kui suurte energiakulutuste tõttu hakkab organism oma süsivesikute ja rasvade varud ära kulutama. See on kulutatud rakkude tsütoplasma valgud.
Aminohapete saatus organismis on erinev
1. Suurem osa neist kulub valkude sünteesile, mida kasutatakse keha valgumassi suurendamiseks selle kasvu ajal ja elu jooksul lagunevate valkude uuendamiseks.
2. Valkude süntees kaasneb energia neeldumisega.
3. Aminohappeid kasutatakse organismis ka mittevalguliste lämmastikku sisaldavate ühendite, näiteks nukleiinhapete sünteesiks.
4. Osa aminohapetest laguneb ja oksüdeerub järk-järgult.
Edusammud valkude uurimisel ja sünteesil
Põhiteave valkude koostise ja struktuuri kohta saadi nende hüdrolüüsi uurimisel (valkude hüdrolüüs on primaarstruktuuri pöördumatu hävitamine happelises või aluselises lahuses koos aminohapete moodustumisega). On kindlaks tehtud, et mistahes valgu hüdrolüüsi tulemusena saadakse α-aminohapete segu ja kõige sagedamini leidub valkudes 20 α-aminohapet.
Kuidas aminohapped moodustavad valgu molekuli? Veel eelmise sajandi 80ndatel vene biokeemik JA MINA. Danilevski oma katsete põhjal esitas ta esimesena hüpoteesi valgu molekuli aminohappejääkide vahelisest peptiidsidemest. 1899. aastal asusid Saksa orgaanilised keemikud valkude uurimisele. Emil Fischer ja Franz Chamberlain. Nad väitsid, et valkude aminohapped on seotud ühe happe aminorühma ja teise karboksüülrühmaga. Sellise sideme tekkimisel eraldub veemolekul. See hüpotees leidis hiilgavalt kinnitust eksperimentaalselt aastal 1907 ja seda nimetati "polüpeptiiditeooriaks".
Fisheril õnnestus sünteetiliselt saada polüpeptiide, mille molekulid sisaldasid erinevaid peptiidsidemetega ühendatud aminohappejääke.
Peptiidide saamiseks kasutatakse laialdaselt keemilist sünteesi, sh. bioloogiliselt aktiivsed hormoonid ja nende erinevad analoogid, mida kasutatakse struktuuri ja bioloogilise funktsiooni vahelise seose uurimiseks, samuti peptiidid, mis kannavad erinevate valkude antigeenseid determinante ja mida kasutatakse sobivate vaktsiinide valmistamiseks. Esimene keemiline valgusüntees 60ndatel. (lambainsuliin ja ribonukleaas S), mis viidi läbi lahuses, kasutades samu meetodeid, mida kasutatakse peptiidide sünteesil, olid seotud äärmiselt suurte raskustega. Igal juhul oli vaja läbida sadu keemilisi reaktsioone ja lõplik valgu saagis oli väga madal (alla 0,1%), mille tulemusena saadi preparaate, mida ei saanud puhastada. Hiljem sünteesiti mõned keemiliselt puhtad valgud, eelkõige iniminsuliin (P. Sieber et al.) ja Kesk-Aasia kobra (V.T. Ivanov) tuumast pärit neurotoksiin II. Valkude keemiline süntees on aga endiselt väga keeruline probleem ja sellel on rohkem teoreetiline kui praktiline tähendus. Paljutõotavamad on geenitehnoloogia meetodid, mis võimaldavad praktiliselt luua tööstusliku tootmise olulised valgud ja peptiidid.
Polüpeptiidide lihtsustatud sünteesi võib kujutada järgmiselt:
Pidage meeles: sidet aminohappejääkide vahel, nimelt: ühe happe C \u003d O rühmade ja teise happe N-H vahel, nimetatakse peptiidiks (amiidiks), aatomite rühma -CO─NH ─ nimetatakse peptiidiks ( amiid) rühm.
Peptiid või valgu ahel on aminohapete polükondensatsiooniprodukt. Ahela ühte otstest, kus asub vaba aminorühmaga aminohappejääk, nimetatakse N-otsaks, aminohapet ennast nimetatakse N-otsaks; ahela teist otsa aminohappejäägiga, millel on karboksüülrühm, nimetatakse C-otsaks, hapet C-otsaks.
Peptiidahel kirjutatakse alati alates N-otsast. Peptiidi nimes on aluseks võetud C-otsa hape, ülejäänud aminohapped on tähistatud asendajatena sufiksiga –üül-, loetledes need järjestikku, alustades N-otsast. Saadud dipeptiidi nimi: GLIC IL ALAN IN
KOOLITAJAD:
VIDEO:






