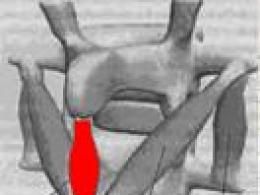
Перетравлення білків у шлунок. Перетравлення білків у шлунково-кишковому тракті
ВСТУП
Білковому обміну належить особливе місце серед інших видів обміну речовин. Це специфічними функціями білків (пластичної, каталітичної, імунної), які можуть виконувати ні вуглеводи, ні ліпіди.
В організмі людини щодня розпадається до амінокислот (АМК) близько 400 г білків і стільки ж синтезується. Основним джерелом АМК в людини є харчові білки. Добова нормаспоживання білків становить близько 100 г. Усі 20 АМК, які входять до складу білків організму, можна розділити на замінні (що синтезуються самим організмом) та незамінні (не синтезуються і повинні надходити з їжею). Присутність у харчових білках усіх незамінних АМК визначає повноцінність білкового харчуваннялюдини.
Оскільки білки всіх організмів відрізняються суворою видовою та тканинною специфічністю, організм людини використовує білки їжі тільки після їх повного гідролізу до АМК у шлунково-кишковому трактіпід впливом низки протеолітичних ферментів - пептидаз. Всі пептидази в залежності від місця розташування пептидного зв'язку, що гідролізується, поділяють на (1) ендопептидази,гідролізуючі пептидні зв'язки, віддалені від кінців пептидного ланцюга(пепсин, трипсин, хімотрипсин, еластаза) та (2) екзопептидази,гідролізуючі пептиді зв'язки, утворені N-та С-кінцевими амінокислотами (амінопептидаза, карбоксипептидаза, дипептидаза).
Шлункові та панкреатичні пептидази виробляються у неактивній формі, секретуються у місці дії, де активуються шляхом часткового протеолізу. Такий механізм утворення активних ферментів необхідний захисту секреторних клітин шлунка і підшлункової залози від самоперетравлення.
Перетравлення білків у шлунку відбувається під дією пепсину. Профермент пепсиноген виробляється головними клітинами шлункових залоз і при надходженні їжі секретується в порожнину шлунка. Пепсиноген активується двома способами:
1) соляною кислотою (повільно);
2) аутокаталітично (швидко) вже наявним пепсином.
Шлунковий сік містить соляну кислоту, яка виробляється клітинами обкладання шлунка і виконує наступні функції:
1) має бактерицидну дію;
2) денатурує білки їжі;
3) створює оптимум рН для пепсину;
4) активує пепсиноген шляхом часткового протеолізу. Перетравлення білків у кишечнику відбувається під дією:
1) ферментів підшлункової залози (трипсину, хімотрипсину, еластази, карбоксипептидаз);
2) ферментів тонкої кишки (амінопептідаз, дипептідаз, трипептідаз).
Активна форма трипсину утворюється в кишечнику за участю ентеропептидази, яка відщеплює від N-кінця трипсиногену гексапептид, що призводить до зміни конформації молекули та формування активного центру трипсину. Інші протеази панкреатичного соку (хімотрипсиноген, прокарбоксипептидаза, проеластазу) активуються трипсином.
Активація панкреатичних пептидаз відбувається за каскадним механізмом. Кишкові пептидази синтезуються в ентероцитах одночасно в активній формі.
Кінцевим результатом перетравлення білків є утворення вільних АМК, що надходять до клітин слизової оболонки кишечника шляхом активного транспорту. Більшість вільних АМК, що утворилися, використовується для синтезу власних білків організму; АМК, що залишилися, використовуються для синтезу біологічно активних молекул: гормонів, біогенних амінів, а також нуклеотидів, гему, креатинфосфату та багатьох інших сполук, у тому числі для синтезу глюкози в процесі глюконеогенезу.
Найважливіший шлях перетворень АМК в організмі - це реакції трансамінування з α-кетокислотами з утворенням нових (замінних) АМК.
Ще один шлях метаболізму АМК – декарбоксилювання з утворенням біологічно активних молекул – біогенних амінів. Основним коферментом обміну АМК є піридоксальфосфат (ПФ).
Деградація АМК відбувається шляхом їх дезамінування: безазотисті залишки можуть використовуватися для синтезу глюкози (глюконеогенез) або, перетворюючись на ацетил-КоА, окислюватися до вуглекислого газу та води з утворенням енергії (розрізняють глікогенні та кетогенніАМК).
У цьому розділі наводиться лабораторна робота з кількісного аналізу кислотності шлункового соку, що дозволяє оцінити вміст вільної, пов'язаної загальної соляної кислоти, а також загальної кислотності шлункового соку.
Процес трансамінування представлений двома роботами:
1) кількісне визначення аспартатамінотрансферази (АсАТ) та аланінамінотрансферази (АлАТ) у сироватці крові, що має діагностичне значення при ураженнях серця та для диференціальної діагностики хвороб печінки;
2) хроматографічне підтвердження активності АлАТ. Ранній діагностиці спадкового захворювання- фенілпіро-
виноградної олігофренії (фенілкетонурії) - присвячена робота з кількісного визначення фенілаланіну в сироватці крові.
Кількісне визначення кінцевих продуктів обміну білків представлено двома лабораторними роботами:
1) кількісне визначення сечовини у сечі ферментативним (уреазним) методом;
2) колориметричний метод кількісного визначення креатиніну у сечі.
6.1. Кількісний аналіз шлункового соку. ВИЗНАЧЕННЯ ВІЛЬНОЇ, ЗВ'ЯЗАНОЇ, ЗАГАЛЬНОЇ СОЛЯНОЇ КИСЛОТИ І ЗАГАЛЬНОЇ КИСЛОТНОСТІ ШЛУНКОВОГО СОКУ
Шлунковий сік є безбарвною рідиною з сильнокислою реакцією (рН 1,5-2,0). За добу у людини виділяється близько 15 л шлункового соку; до його складу входять вода, неферментативні білки, ферменти (пепсин, гастриксин), муцин, фактор Касла, соляна кислота, гідрофосфати та інші сполуки.
Кисла реакція шлункового соку обумовлена присутністю соляної кислоти, гідрофосфатів, а при патологічних процесах- молочної кислоти та жирних кислот. Сукупність всіх речовин шлункового соку, здатних бути донорами протонів, становлять загальну кислотність.Соляну кислоту, пов'язану з білками та продуктами їх перетравлення, називають пов'язаною соляною кислотою,а що знаходиться в незв'язаному вигляді - вільною соляною кислотою.Зміст останньої схильний до значних коливань, тоді як кількість пов'язаної соляної кислоти досить постійно.
У характері секреції шлункового соку розрізняють такі патологічні зміни: 1) гіперхлоргідрію – збільшення вмісту вільної соляної кислоти та загальної кислотності. Такий стан переважно спостерігається при виразкової хворобишлунка; 2) гіпохлоргідрію - зменшення кількості вільної соляної кислоти та загальної кислотності; 3) ахлоргідрію – повна відсутність соляної кислоти, загальна кислотність при цьому значно знижена; 4) ахілію – відсутність секреції шлункового соку.
Зменшення або відсутність соляної кислоти в шлунку може спостерігатися при хронічному гастриті, раку шлунка, злоякісному недокрів'ї.
У клініці використовують рН-метрію шлункового соку, проте корисну інформаціюможна отримати простим, витонченим способом, запропонованим нижче.
Мета роботи
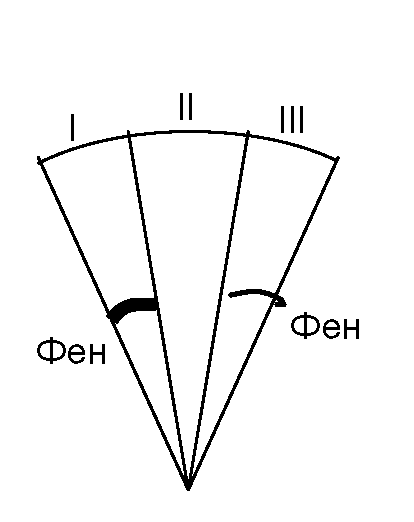
Послідовно відтитрувати один із трьох зразків шлункового соку розчином NaOH у присутності двох індикаторів і на підставі розрахунків зробити висновок про кислотність шлункового соку: нормальну, підвищену або знижену. Порівняти з іншими зразками та відзначити характер зміни загальної кислотності, а також загальної, вільної та пов'язаної соляної кислоти.
Принцип методу
Користуючись різними індикаторами (диметиламіноазобензол та фенолфталеїн), в одній і тій же пробі шлункового соку визначають як загальну кислотність, так і вміст загальної, вільної та зв'язаної соляної кислоти.
Загальну кислотність шлункового соку виражають кількістю мл 0,1 М розчину NaOH, що пішли на титрування 100 мл шлункового соку в присутності індикатора фенолфталеїну (інтервал переходу забарвлення pH 8,2-10). У нормі загальна кислотність становить 40-60 титраційних одиниць (од.).
Вільну соляну кислоту виражають кількістю мл 0,1 М розчину NaOH, що пішли на титрування 100 мл шлункового соку в присутності індикатора диметиламіноазобензолу (інтервал переходу забарвлення рН 1,0-3,0). У нормі вміст вільної соляної кислоти становить 20-40 од.
Загальна соляна кислота - це сума вільної та пов'язаної з білками соляної кислоти (останню знаходять по різниці між загальною та вільною соляною кислотою).
Виконання роботи
У колбу для титрування вносять із бюретки 5 мл досліджуваного шлункового соку. Додають 1 краплю розчину диметиламіноазобензолу і 2 краплі розчину фенолфталеїну. З'являється рожево-малинове фарбування. Пробу титрують 0,1 М розчином NaOH до помаранчевого фарбування та відзначають кількість мілілітрів лугу, що пішли на титрування вільної соляної кислоти (І пункт титрування).
Далі титрування продовжують до появи лимонно-жовтого забарвлення та відзначають загальну кількість мілілітрів NaOH, що пішли на титрування від початку загального титрування (II пункт титрування). Потім титрування продовжують до появи малинового фарбування і відзначають кількість мілілітрів лугу, що пішли на титрування з початку загального титрування (III пункт титрування).
Розрахунки
Припустимо, що на титрування 5 мл шлункового соку до пункту I пішло від 0 до 1,5 мл 0,1 М розчину NaOH, до пункту II – від 0 до 2 мл та до пункту III – від 0 до 3 мл. Тоді загальна кислотність складе 3? 100/5 = 60 од., кількість вільної соляної кислоти - 1,5*100/5 = 30 од., кількість загальної соляної кислоти (середня арифметична між пунктами титрування II та III) - (2+3)/2? 100/5 = 50 од., а кількість пов'язаної соляної кислоти знаходять по різниці між вмістом загальної та вільної соляної кислоти: 50 - 30 = 20 од.
Дані титрування та розрахунку вносять до таблиці (див. нижче).
Тестові завданняна тему «Перетворення білків та дезамінування амінокислот»
1. Протеїнази, амілази та ліпази відносять до класу гідролаз.
2. Таурін є продуктом перетворення цистеїну.
3. Скатол та індол утворюються в кишечнику з амінокислоти тирозину.
4. Соляна кислота у шлунку сприяє активації пепсиногену.
5. При дезамінуванні амінокислот у організмі утворюються біогенні аміни.
6. Пепсин відносять до ендопептидаз.
7. Як кофермент глутаматдегідрогенази НАД+ можна замінити на ФАД.
8. У людини відбувається неокислювальне дезамінування цистеїну.
9. Трипсин бере участь у активації хімотрипсиногену.
10. Можливе самоперетравлення пепсину у шлунку.
11. Карбокси- та амінопептидази відносять до ендопептидазів.
12. Уридиндифосфоглюкуронова кислота бере участь у знешкодженні індолу.
Коферментом дезамінування Замінною амінокислотою
амінокислот не можебути для людини є
1) НАД+ 1) фенілаланін
2) ФАД 2) тирозин
3) ФМН 3) триптофан
4) ТПФ 4) треонін
5) ПФ 5) метіонін
3. Встановіть відповідність між проферментом та відповідним каталізатором.
6.2. КІЛЬКІЗНЕ ВИЗНАЧЕННЯ АСПАРТАТАМІНОТРАНСФЕРАЗИ І АЛАНІНАМІНОТРАНСФЕРАЗИ
У СИВОРОТКУ КРОВІ
Аспартатамінотрансфераза (АсАТ, КФ: 2.6.1.1) та аланінамінотрансфераза (АлАТ, КФ: 2.6.1.2) - піридоксальфосфатсодержащіе ферменти.
АсАТ каталізує оборотне перенесення аміногрупи від аспартату на α-кетоглутарат з утворенням глутамату та оксалоацетату.
АлАТ каталізує оборотну реакцію перенесення аміногрупи від аланіну на α-кетоглутарат з утворенням глутамату та пірувату (ПВК).
АлАТ міститься в цитозолі, тоді як для АсАТ відомі дві форми: цитоплазматична та мітохондріальна.
При ураженні тканин амінотрансферази «вимиваються» з пошкоджених клітин у кровотік, тому визначення активності амінотрансфераз у сироватці крові має важливе значення, особливо для діагностики уражень серця та диференціальної діагностикихвороб печінки. Так, при неускладненому інфаркті міокарда рівень АсАТ у сироватці крові починає підвищуватися вже через 4-6 год після настання інфаркту, максимум активності посідає другу добу і лише на 5-8-й день активність ферменту знижується до норми. Зміна активності сироваткової АлАТ при цьому незначна.
При інфекційному гепатиті (хвороби Боткіна) та загостренні хронічного гепатиту активності обох амінотрансфераз у сироватці
крові підвищуються (активність АлАТ підвищується сильніше). Цироз печінки не супроводжується значною гіперферментемією.
Мета роботи
Визначити активність обох амінотрансфераз у сироватці крові колориметричним методом та порівняти отримані результати з нормою.
Принцип методу
Визначення активності обох амінотрансфераз засноване на колориметричному виявленні пірувату, що утворюється за 1 год інкубації, за кольоровою реакцією з 2,4-динітрофенілгідразином у лужному середовищі (див. роботу 4.3Б). У разі АлАТ піруват утворюється безпосередньо з аланіну, а у випадку АсАТ піруват утворюється з оксалоацетату після декарбоксилювання останнього в лужному середовищі:
Активність обох ферментів визначають за калібрувальним графіком.
Виконання роботи* (Див. Додаток 9.2)
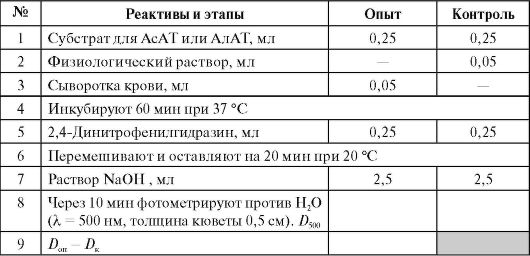
* Одна половина студентської групи визначає активність АлАТ, інша – активність АсАТ, потім групи обмінюються результатами.
Розрахунки
Розрахунок активності проводять у мккат/л за калібрувальним графіком (дані щодо його побудови наведені у таблиці).

Норма:АлАТ = 0,05-0,12 мккат/л; АсАТ = 0,06-0,14 мккат/л. Верхня межа – 0,42 мккат/л.
Самостійне формулювання висновків
Тестові завдання на тему
«Переварювання білків та обмін амінокислот»
1. Визначте, чи правильне твердження.
1. Тирозин є незамінною амінокислотою для людини.
2. В окисному дезамінуванні амінокислот можуть брати участь різні коферменти.
3. Реакції трансамінування амінокислот необоротні.
4. У процесах трансдезамінування та трансреамінування амінокислот бере участь α-кетоглутарова кислота.
5. Коферентом амінотрансферазу служить ФАД.
6. У процесі трансамінування виділяється аміак.
7. В організмі людини можливе перетворення піровиноградної кислоти на аланін.
8. Фенілаланін є попередником серотоніну.
9. Для діагностики інфаркту міокарда використовують визначення активності аспартатамінотрансферази у сироватці крові людини.
10. Вітамін В 1 необхідний реакцій трансамінування.
11. Глюконеогенез посилюється при цукровому діабеті.
12. Лізин та треонін беруть участь у реакціях трансамінування.
2. Виберіть правильну відповідь.
Метаболіт ЦТК, який бере участь у Глікогенній амінокислоті
реакціях трансамінування, - це не є 1) цитрат 1) аргінін
2) ізоцитрат 2) глутамін
3) сукцинат; 3) гістидин
4) фумарат 4) лейцин
5) оксалоацетат 5) метіонін
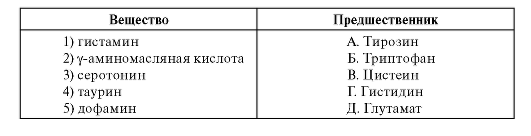
3. Встановіть відповідність між речовиною та її попередником.
6.3. Виявлення активності АЛАНІНАМІНОТРАНСФЕРАЗИ МЕТОДОМ ПАПЕРОВОЇ ХРОМАТОГРАФІЇ
Аланінамінотрансфераза (АлАТ), як і інші амінотрансферази, бере участь у взаємному перетворенні α-амінокислот і α-кетокислот у цитозолі клітини:
Аланін + α-Кетоглутарат ↔ Піруват + Глутамат.
Тому активність АлАТ можна визначити якісно за появою в реакційній суміші нової амінокислоти, що утворилася в результаті перенесення аміногрупи від аланіну або глутамату на -кетоглутарат або піруват відповідно (залежно від того, в якому напрямку проводиться реакція).
Мета роботи
Методом паперової хроматографії показати наявність активності АлАТ та визначити, яка амінокислота (аланін або глутамат) була присутня у вихідній субстратній суміші, тобто в якому напрямку проводилася ферментативна реакція.
Принцип методу
Оскільки в результаті ферментативної реакції утворюється нова амінокислота, здійснюють ідентифікацію вихідної та амінокислоти, що утворюється під дією АлАТ, методом радіальної
паперової хроматографії (див. роботу 1.4Б «Паперова хроматографія амінокислот»). Ідентифікацію проводять після фарбування нінгідрином порівняно величин R f досліджуваних АМК зі стандартними, які поділяють одночасно в тих самих умовах. Для вирішення завдання необхідно провести три незалежні хроматографічні поділи: 1) субстратної суміші (одна амінокислота); 2) субстратної суміші + АлАТ (утворюється друга амінокислота); 3) стандартного розчину «свідків» аланіну та глутамату для ідентифікації.
Виконання роботи
Беруть три диски хроматографічного паперу діаметром 12 см. Простим олівцемзверху позначають прізвище студента та номер диска. У центрі кожного диска обводять коло діаметром 0,3-0,4 см. Мікропіпеткою в центр дисків завдають реактиви, як зазначено в таблиці.
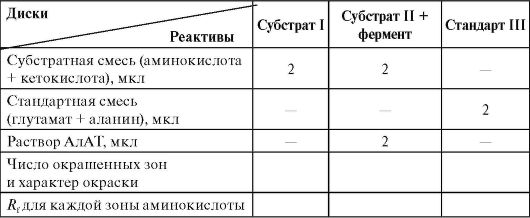
Через 10 хв. після нанесення останнього реагенту (час інкубації) всі три диски підсушують на повітрі. На кожному диску від краю до центру роблять ножицями два паралельні розрізи (ширина розрізу дорівнює діаметру кружечка в центрі диска). Вирізану смужку перпендикулярно відгинають диску так, щоб лінія згину проходила через середину зони нанесення розчинів. «Ніжку» вкорочують до 2-3 см і поміщають диск між нижньою та верхньою половинками чашки Петрі, що містить суміш бутанол + оцтова кислота+ Н 2 Про співвідношення 5:1:4. Проводять хроматографічне поділ під тягою приблизно протягом 1 год. Диски вилучають із хроматографічної камери і обводять фронт розчинника простим олівцем.
Висушують в сушильній шафі при 100 °С, змочують розчином нінгідрину і знову висушують.
Розраховують величину R f для кожної пофарбованої зони та проводять ідентифікацію амінокислот. Роблять висновок про те, яка амінокислота перебувала у субстратній суміші. Потім вирізують сегменти з кожного диска і складають разом поруч, поєднуючи центральні зони нанесення речовини.
![]()
Самостійне формулювання висновків
6.4. ЕКСПРЕС-МЕТОД ВИЗНАЧЕННЯ ПІДВИЩЕНОГО ЗМІСТ ФЕНІЛАЛАНІНУ У ПЛАЗМІ КРОВІ
Перетворення незамінної амінокислотифенілаланіну в замінну - тирозин в організмі людини здійснюється реакцією гідроксилювання, яку каталізує фермент фенілаланін-4-монооксигеназа (косубстратом служить тетрагідробіоптерин).
Клініко-діагностичне значення
Вроджена відсутність фенілаланін-4-монооксигенази призводить до розвитку тяжкого спадкового захворювання – фенілпіровиноградної олігофренії (фенілкетонурії). При цьому внаслідок зменшення споживання фенілаланіну тканинами його концентрація у плазмі різко зростає (в нормі вміст 0,1 ммоль/л, що відповідає 0,015 г/л). Одночасно, внаслідок посилення
* Операції, відмічені зірочкою, виконуються під тягою лаборантами.
реакції трансамінування фенілаланіну, у тканинах підвищується концентрація фенілпірувату - конкурентного інгібітора ферментів, що беруть участь у метаболізмі пірувату. У дитини спостерігається уповільнення розумового розвиткута розвивається фенілпіровиноградна олігофренія. У зв'язку з цим надзвичайно важливо провести якомога раніше діагностику даної патології (на 1-3-й день народження дитини) і ввести строгу дієту, що виключає фенілаланін із харчування. Для раннього виявлення відсутності фенілаланін-4-монооксигенази проводять визначення підвищеного вмісту фенілаланіну в плазмі, яке досить просто здійснити методом паперової хроматографії.
Мета роботи
Оцінити методом паперової хроматографії вміст фенілаланіну в плазмі крові обстежуваної дитини в порівнянні з її вмістом у свідомо здорової дитини.
Принцип методу
Хроматографічне поділ зразків плазми крові обстежуваної дитини та свідомо здорової в порівнянні зі стандартом, що містить гранично допустиму кількість фенілаланіну (напівкількісне визначення).
Виконання роботи
Беруть три диски хроматографічного паперу діаметром 12 см. На диск I наносять 2 мкл плазми обстежуваної дитини, на диск II - 2 мкл плазми крові свідомо здорової дитини (концентрація фенілаланіну 0,015 г/л). На диск III наносять 2 мкл стандартного розчину фенілаланіну (концентрація 0,06 г/л) та 2 мкл плазми крові здорової дитини. Загальна концентрація фенілаланіну 0,075 г/л.
Нанесення розчинів на хроматографічні диски, проведення хроматографії та прояв хроматограм здійснюють так само, як у попередній роботі.
Порівнюють отримані хроматограми за інтенсивністю забарвлення фенілаланіну на всіх трьох дисках і роблять висновок про вміст фенілаланіну в плазмі обстежуваної дитини.
Самостійне формулювання висновків
Тестові завдання на тему «Обмін амінокислот»
I. Визначте, чи правильне твердження.
1. Гістидин у печінці здатний дезамінуватися за внутрішньомолекулярним типом.
2. Відновлені коферменти оксидаз амінокислот можуть безпосередньо окислюватися молекулярним киснем.
3. Дезамінування глутамінової кислоти супроводжується проміжним утворенням імінокислоти.
4. Коферментом моноаміноксидаз (МАО) служить ФАД.
6. Аміак утворюється за будь-якого типу дезамінування амінокислот.
7. Гістамін має судинозвужувальну дію.
8. Дофамін є попередником норадреналіну.
9. В організмі людини можливе декарбоксилювання 5-окситриптофана.
10. Усі природні амінокислоти можуть «згоряти» у ЦТК.
ІІ. В організмі людини з аланіну може утворитися глюкоза. 12. Лейцин відносять до кетогенних амінокислот.
2. Виберіть правильну відповідь.
Коферментом більшості Декарбоксилювання
декарбоксилаз амінокислот амінокислот наводить
є до освіти
1) ФАД 1) спирту
2) ФМН 2) альдегіду
3) ПФ 3) аміна
4) ТПФ 4) аміда
5) НАДФ + 5) кетону
3. Встановіть відповідність між ферментом, що бере участь в обміні АМК, та його коферментом.

6.5. Кількісне визначення сечовини в сечі ФЕРМЕНТАТИВНИМ УРЕАЗНИМ/ФЕНОЛ-ГІПОХЛОРИТНИМ МЕТОДОМ
Сечовина – основний кінцевий продукт обміну білків в організмі людини. На частку сечовини припадає 80-90% азоту, що виділяється з сечею.
Біологічна роль синтезу сечовини в печінці (орнітиновий цикл сечовиноутворення) полягає у зв'язуванні аміакислот, що утворюється при дезамінуванні амінокислот, у відносно малотоксичну молекулу сечовини, яка потім екскретується з сечею.
Знаючи кількість екскретованої за добу сечовини та кількість азоту, що надходить з їжею, можна обчислити азотистий баланс, який є важливим показникомстану білкового та амінокислотного обміну. Азотистий баланс може бути:
1) позитивним - у дітей, які одужують після тяжкої хвороби;
2) негативним - при тяжких захворюваннях, у тому числі онкологічних, при голодуванні та у старечому віці;
3) рівним нулю (азотиста рівновага) – у здорових дорослих людей (при нормальному харчуванні).
Будь-яке підвищення білкового обміну, процеси інтенсивного розпаду білка (пухлини, гіпертиреоз, діабет) супроводжуються посиленням сечовиноутворення та збільшенням кількості сечовини, що виділяється із сечею за стуки. Патологічні зміни печінки, що призводять до її функціональної недостатності, а отже, порушення синтезу сечовини, супроводжуються зниженням кількості сечовини у крові та сечі. Функціональна недостатність нирок веде до зниження кількості сечовини в сечі та одночасного підвищення її вмісту в крові (уремія). Деякі форми діабету, що характеризуються підвищеним апетитомі прогресуючим схудненням хворого, що супроводжуються підвищенням виділення сечовини з сечею за рахунок посиленого розпаду білків.
Мета роботи
Визначити вміст сечовини в сечі і порівняти отриманий результат з нормою.
Принцип методу
Даний метод – ферментативний, він заснований на реакції розщеплення молекули сечовини під дією високоспецифічного ферменту (уреази) до аміаку та вуглекислого газу, які у водному розчині утворюють карбонат амонію:
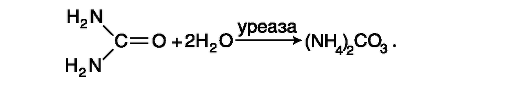
Іони амонію у присутності нітропрусиду натрію реагують з фенолом та гіпохлоритом натрію. В результаті реакції утворюється індофенол ( синього кольору), інтенсивність фарбування якого пропорційна концентрації іонів амонію (і відповідно сечовини).
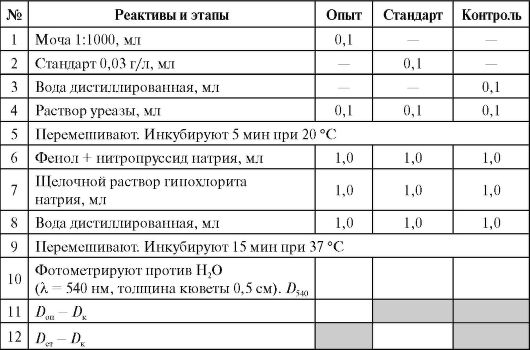
Виконання роботи (Див. Додаток 9.2)
Для дослідження беруть такі проби (три марковані пробірки): досвід (розведена сеча), стандарт (стандартний розчин сечовини 0,03 г/л) та контроль (вода). Усі реактиви вносять згідно з описом у таблиці.
На студентську групу ставлять два контролю та два стандарти. Інші студенти роблять досвідчені проби.
Розрахунки
Масу сечовини розраховують за стандартом сечовини*:

Самостійне формулювання висновків.
Тестові завдання на тему «Шляхи знешкодження аміаку в організмі людини та тварин»
1. Визначте, чи правильне твердження.
1. Глутамінсинтетазу відносять до лігазу.
2. Виведення сечовини із сечею у кількості 20-35 мг на добу є нормою.
3. Утворення карбамоілфосфату у синтезі сечовини потребує витрати двох молекул АТФ.
4. Креатин у нормі виводиться із сечею.
5. Аргіназа каталізує утворення оксиду азоту (11).
6. Аміногрупа аспартату служить одним із джерел азоту в молекулі сечовини.
7. Амінокислоти – єдине джерело аміаку в організмі.
8. Азот амідної групи глутаміну може включатися до молекули сечовини.
9. У глутамінсинтетазної реакції витрачається АТФ. * Вважаючи добову кількість сечі рівним 1,5 л.
10. Для людини виділення 1 г креатиніну за добу є нормою.
11. Метіонін бере участь у синтезі креатину.
12. Іон амонію виводиться із сечею.
2. Виберіть правильну відповідь.
Аміак у клітинах мозку Цикл сечовиноутворення
знешкоджується шляхом відбувається
1) синтезу сечовини 1) у нирках
2) утворення солей амонію 2) у печінці
3) перетворення глутамату на глутамін 3) у надниркових залозах
4) синтезу креатину 4) у сечовому міхурі
5) усіма перерахованими способами; 5) у підшлунковій залозі.
3. Встановіть відповідність між Х та Y у реакції:

6.6. КІЛЬКІСНЕ ВИЗНАЧЕННЯ
Креатиніна в сечі
Креатинін є одним із кінцевих продуктів азотистого обміну (5% від загального азоту сечі). Він утворюється в м'язової тканиниз креатинфосфату:
Креатінфосфат → Креатінін + Ф н.
У свою чергу креатинфосфат синтезується з креатину в реакції, що каталізується креатинкіназою (креатинфосфокіназою, КФК) за участю АТФ:
Креатин+АТФ ↔ Креатин~Ф+АДФ.
Ця реакція є оборотною, і утворення АТФ у зворотній реакції є екстреним механізмом забезпечення енергією м'язового скорочення.
У нормі із сечею виділяється лише креатинін. Поява креатину в сечі (креатинурія) свідчить про захворювання печінки, нирок, цукровий діабет, ендокринні розлади (гіпертиреоз, аддісонова хвороба, акромегалія та ін.), інфекційних захворюваннях. Винятком є поява креатину в сечі у підлітків та вагітних жінок.
Гіперкреатинурія з одночасною креатинурією має місце при патології поперечно-смугастих м'язів: міозит, міастенія, дистрофія Гіпокреатинінурія спостерігається при хронічному нефриті, м'язової атрофіїпісля перенесених інфекцій, у старечому віці.
Мета роботи
Визначити вміст креатиніну в сечі і порівняти отриманий результат з нормою.
Принцип методу
Метод кількісного визначення креатиніну в сечі (за Фоліном) заснований на кольоровій реакції з пікриновою кислотою. Інтенсивність помаранчевого забарвлення пікрата креатиніну, що вимірюється на фотоелектроколориметр з зеленим світлофільтром (540 нм), прямо пропорційна концентрації креатиніну, яку визначають за калібрувальним графіком.
Виконання роботи
У 2 мірні колби на 50 мл поміщають реактиви, як зазначено в таблиці

Для побудови калібрувального графіка використовують стандартний розчин дихромату калію (K2Cr2O7).
Досвідченим шляхом знайдено, що оптична щільність 0,17 М розчину K 2 Cr 2 O 7 відповідає оптичної щільності продукту, що утворюється внаслідок реакції взаємодії креатиніну (концентрація 2 мг/мл) з пікринової кислоти в лужному середовищі. Тому калібрувальну криву легко можна побудувати, використовуючи дешевий та доступний дихромат калію.
З вихідного розчину 0,17 М дихромату калію готують ряд розведень: 4 мірні пробірки відбирають відповідно 1, 2, 3 і 5 мл вихідного розчину і всі проби доводять водою до кінцевого об'єму 5 мл. Визначають оптичну густину отриманих розчинів при 540 нм у кюветі товщиною 1 см проти води. З отриманих значень оптичної густини калібрувальних розчинників віднімають Д до, визначену в роботі раніше, і на підставі отриманих результатів будують графік залежності оптичної густини від концентрації креатиніну. Для цього на осі абсцис відкладають кількість мілілітрів дихромату калію, що відповідає концентрації креатиніну (0,4; 0,8; 1,2 та 2 мг/мл відповідно), на осі ординат - величину оптичної щільності (D 540 - Д к). Отриману в роботі величину (Д оп - Д к) відкладають на графіку і знаходять концентрацію креатиніну в сечі (мг/мл). Потім розраховують масу креатиніну в сечі:
Норма:чоловіки: 1-2 г/добу (8,8-17,6 ммоль/добу);
жінки: 0,6-1,5 г/добу (5,3-13,2 ммоль/добу).
Самостійне формулювання висновків Тестові завдання на тему
«Особливості обміну окремих амінокислот»
1. Визначте, чи правильне твердження.
1. Гліцин бере участь у синтезі пуринових основ.
2. До складу КоА входить β-аланін.
3. Азот гуанідинової групи аргініну є джерелом утворення оксиду азоту.
4. Монооксигенази беруть участь в утворенні катехоламінів.
5. Триптофан може бути попередником утворення рибонуклеотиду нікотинової кислоти (вітаміну РР).
6. Серотонін утворюється із серину.
7. Глутамінова кислота входить до складу глутатіону.
8. Гомогентизиновая кислота є проміжним продуктом перетворення фенілаланіну.
9. Можливе перетворення гістидину на глутамінову кислоту.
10. Креатинфосфат є макроергічною сполукою.
11. Цистеїн піддається процесу декарбоксилювання.
12. Можливі перетворення гліцину на серин та треонін.
2. Виберіть правильну відповідь.
Молекула гліцину не бере участіЗ'єднання, яке
у синтезі не утворюєтьсяз тирозину, - це
1) гема 1) гомогентизинова
2) пуринових основ кислота
3) піримідинових основ 2) адреналін
4) парних жовчних кислот; 3) норадреналін.
5) креатину 4) дофамін
5) фенілаланін
3. Встановіть відповідність між Х та Yв реакції

Тестові завдання на тему
«Регуляція та патологія амінокислотного обміну»
1. Визначте, чи правильне твердження.
1. Фенілкетонурія виникає в результаті вродженого порушення синтезу фенілаланін-4-монооксигенази.
2. Сеча із запахом кленового сиропуз'являється у разі порушення обміну розгалужених амінокислот.
3. Квашіоркор спостерігається у дітей при нестачі їжі білків.
4. Алкаптонурія – вроджений дефект обміну триптофану.
5. Фенілкетонурію можна виявити за підвищеним вмістом фенілаланіну в сироватці крові.
6. Квашіоркор супроводжується зниженням опірності організму до інфекцій.
7. Підвищення концентрації амінокислот у крові супроводжується ацидемією.
8. При фенілкетонурії виняток з їжі тирозину призводить до позитивного ефекту.
9. Інгібітори моноаміноксидаз використовують при лікуванні депресивних станів.
10. Хвороба Хартнупа пов'язана з порушенням всмоктування триптофану.
11. Нестача вітаміну В6 викликає порушення обміну окремих амінокислот.
12. Нестача метіоніну може призвести до жирового переродження печінки.
2. Виберіть правильну відповідь.
Фенілпіровіноградна олігофренія Альбінізм пов'язаний
розвивається внаслідок вродженого з порушенням обміну
відсутності ферменту класу 1) метіоніну
1) оксидоредуктаз 2) серину
2) трансфераз 3) цистеїну
3) гідролаз 4) тирозину
4) ліаз 5) триптофану
5) ізомераз
3. Встановіть відповідність між патологією та АМК, порушення обміну або всмоктування якої у кишечнику має місце при даній патології.

6.7. КОЛОКВІУМ ЗА ТЕМОЮ «ПЕРЕВАРЮВАННЯ БІЛКІВ І ОБМІН АМІНОКИСЛОТ»
Запитання для самостійної підготовки
1. Поняття про біологічну цінність білків. Роль білків у харчуванні. Замінні та незамінні амінокислоти.
2. Загальні шляхи перетворення амінокислот у тканинах.
3. Дезамінування амінокислот. Механізми окисного дезамінування.
4. Шляхи перетворення безазотистого залишку амінокислот. Глікогенні та кетогенні амінокислоти.
5. Трансамінування амінокислот. Ферменти та коферменти трансамінування. Трансдезамінування та трансреамінування. Діагностичне значення визначення амінотрансферазу у сироватці крові.
6. Реакції гідроксилювання та декарбоксилювання ароматичних амінокислот.
7. Декарбоксилювання амінокислот. Утворення біогенних амінів та їх біологічна роль. Розпад біогенних амінів. Моноаміноксидази.
8. Шляхи утворення аміаку в організмі. Біосинтез сечовини.
9. Утворення отруйних продуктів гниття білків у кишечнику та механізм їх знешкодження у печінці.
10. Особливості обміну гліцину та серину.
11. Особливості обміну сірковмісних амінокислот.
12. Особливості обміну аргініну.
13. Особливості обміну дикарбонових амінокислот.
14. Особливості обміну фенілаланіну та тирозину. Фенілпіровіноградна олігофренія. Алкаптонурія. Експрес-метод визначення підвищеного вмісту фенілаланіну у сироватці крові.
15. Синтез креатину. Креатинфосфат. Кількісне визначення креатиніну у сечі.
16. Зв'язок обміну білків, жирів та вуглеводів.
Варіанти письмової частини колоквіуму
1. Вкажіть механізм активації
1) пепсиногену
2) трипсиногену
3) хімотрипсиногену
4) проеластази
2. Напишіть реакції знешкодження у печінці
1) фенолів
2) індолу
3) бензойної кислоти
4) аміаку
3. Розгляньте механізм реакцій та участь коферментів у процесах
1) гідроксилювання
2) трансдезамінування
3) трансреамінування
4) метилювання
4. Найповніше вкажіть фармакологічні ефекти
1) дофаміну
2) гістаміну
3) серотоніну
4) норадреналіну
5. Розберіть випадки порушення обміну
1) триптофану
2) тирозину
3) сірковмісних амінокислот
4) амінокислот з розгалуженим ланцюгом
6. Вкажіть, у біосинтезі яких сполук бере участь
1) метіонін
2) аргінін
3) глутамін
4) гліцин
Варіанти завдань комп'ютерного тестування
1. У знешкодженні аміаку беруть участь амінокислоти
1) гістидин
2) аспарагінова кислота
3) аланін
4) глутамінова кислота
5) триптофан
2. Кофермент глутаматдегідрогенази у реакції освіти α- кетоглутарової кислоти
1) НАД+
2) ПФ
3) ФАД
4) ФМН
5) КоQ(убіхінон)
3. Хворим із стійким збільшенням вмісту аміаку в крові може допомогти прийом амінокислоти
1) гістидину
2) аспарагіну
3) глутаміну
4) глутамінової кислоти
5) лізину
4. Вроджений дефект синтезу ферменту гомогентизинат-1,2-діоксігенази викликає
1) фенілкетонурію
2) хвороба Паркінсона
3) алкаптонурію
4) альбінізм
5) гомоцистинурію
5. У синтезі креатину беруть участь
1) аргінін
2) лейцин
3) метіонін
4) серин
5) гліцин
6. Добове виділення креатиніну із сечею становить
1) 0,1-0,2 г/добу
2) 1,0-2,0 г/добу
3) 10-20 г/добу
4) 1,0-2,0 мг/добу
5) 10-20 мг/добу
7. Процес трансамінування амінокислот
1) забезпечує синтез біогенних амінів
2) відбувається за участю піридоксальфосфату
3) забезпечує утворення замінних амінокислот
4) супроводжується утворенням аміаку
5) призводить до збільшення загальної кількості амінокислот
8. В орнітиновому циклі беруть участь
1) цитрулін
2) лізин
3) аланін
4) аргінін
5) аспарагін
9. До змішаних (глікогенних та кетогенних) амінокислот відносять
1) триптофан
2) тирозин
3) фенілаланін
4) серин
5) лейцин
10. ТГФК бере участь у синтезі
1) серина з гліцину
2) цистеїну з метіоніну
3) тирозину з фенілаланіну
4) глутамінової кислоти з гістидину
5) глутаміну з глутамату
11. Процесу трансамінування не піддаються
1) глутамін та аспарагін
2) лізин та треонін
3) ізолейцин та аспартат
4) фенілаланін та тирозин
5) аланін та валін
12. Аміак у клітинах мозку знешкоджується шляхом
1) синтез сечовини
2) утворення солей амонію
3) перетворення глутамату на глутамін
4) утворення аланіну
5) синтезу креатину
13. Кофермент більшості декарбоксилаз амінокислот – це
1) ФАД
2) ФМН
3) ПФ
4) ТПФ
5) біотин
14. Гістидазу відносять до класу
1) оксидоредуктаз
2) трансфераз
3) гідролаз
4) ліаз
5) ізомераз
15. Скатол та індол знешкоджуються у печінці за допомогою
1) гліцину
2) глутамату
3) α-кетоглутарату
4) уридиндифосфоглюкуронової кислоти
5) проліну
16. Піридоксальфосфат (ПФ) - кофермент
1) аланінамінотрансферази
2) амілази
3) аспартатамінотрансферази
4) моноаміноксидази
5) глутаматдегідрогенази
17. Метаболіт ЦТК, який бере участь у реакціях трансамінування, - це
1) цитрат
2) α-кетоглутарат
3) сукцинат
4) фумарат
5) малат
18. γ-аміномасляна кислота утворюється
1) із гістидину
2) з аспарагінової кислоти
3) із глутамінової кислоти
4) із глутаміну
5) з аспарагіну
19. Добове виведення сечовини із сечею в нормі складає
1) 25-35 мг
2) 0,25-0,35 г
3) 2,5-3,5 г
4) 25-35 г
5) 250-350 г
20. Гліцин може утворитися
1) з метіоніну
2) із лізину
3) із валіну
4) з тирозину
5) із серину
21. Альбінізм пов'язаний із порушенням обміну
1) метіоніну
2) серина
3) цистеїну
4) тирозину
5) триптофану
22. Оксид азоту(11) NO утворюється з азоту
1) аргініну
2) цистеїну
3) валіна
4) гістидину
5) серина
23. Коферментом оксидаз L-амінокислот може бути
1) ФМН
2) ПФ
3) НАД +
4) НАДФ+
5) КоА
24. Активність аспартатамінотрансферази у сироватці крові різко підвищується
1) при захворюваннях нирок
2) при панкреатитах
3) при простатитах
4) при нефритах
5) при інфаркті міокарда
25. Соляна кислота у шлунку
1) денатурує білки
2) має бактерицидну дію
3) активує пепсиноген
4) створює оптимум рН для пепсину
5) інгібує пепсиноген
26. Кофермент моноаміноксидази (МАО) - це
1) НАД+
2) ФАД
3) НАДН(Н+)
4) ТПФ
5) ПФ
27. Квашіоркор спостерігається у дітей при нестачі їжі
1) вуглеводів
2) ліпідів
3) білків
4) вітамінів
5) мінеральних речовин
28. Джерелом освіти таурину є
1) метіонін
2) цистеїн
3) гліцин
4) серин
5) треонін
29.
1) лейцин
2) аланін
3) серін
4) глутамін
5) лізин
30. При гнильному розпаді фенілаланіну в кишечнику утворюються
1) фенол
2) скатол
3) індол
4) крезол
5) лейцин
31. Алкаптонурія – вроджений дефект обміну
1) триптофану
2) гістидину
3) метіоніну
4) тирозину
5) гліцину
32. Біосинтез сечовини відбувається
1) у мозку
2) у сечовому міхурі
3) у підшлунковій залозі
4) у надниркових залозах
5) у печінці
33. Добова потребау білках у людини становить приблизно
1) 100 г
2) 100 мг
3) 10 г
4) 1000 мг
5) 1000 г
34. Коферментами дезамінування амінокислот можуть бути
1) НАД+
2) ФАД
3) ФМН
4) ТПФ
5) КоА
35. У процесі відновного амінування α-кетоглутарової кислоти бере участь
1) НАДФ+
2) НАДФН(Н+)
3) ФАДН 2
4) ФМНН 2
5) НАД+
36. Серотонін - продукт декарбоксилювання
1) гістидину
2) тирозину
3) проліну
4) фенілаланіну
5) 5-окситриптофану
37. Суворо кетогенна амінокислота - це
1) аланін
2) валін
3) триптофан
4) лейцин
5) метіонін
38. Аргіназа бере участь у синтезі
1) оксиду азоту(11)
2) креатину
3) сечовини
4) серина
5) білка
39. Монооксигенази беруть участь в освіті
1) тирозину
2) діоксифенілаланіну
3) норадреналіну
4) аспарагіну
5) глутаміну
40. Внутрішньомолекулярному дезамінуванню в організмі людини піддається
1) гліцин
2) глутамін
3) гістидин
4) тирозин
5) триптофан
41. З'єднання, що утворюються з тирозину, - це
1) γ-аміномасляна кислота
2) адреналін
3) норадреналін
4) дофамін
5) фенілаланін
42. Основний кофермент обміну амінокислот – це
1) КоА
2) ТПФ
3) НАД +
4) біоцитин
5) ПФ
43. Фенілпіровіноградна олігофренія розвивається внаслідок вродженої відсутності ферменту класу
1) ліаз
2) лігаз
3) гідролаз
4) ізомераз
5) оксидоредуктаз
44. З амінокислоти тирозину утворюються
1) серотонін
2) діоксифенілаланін
3) дофамін
4) норадреналін
5) індол
45. Активація пепсиногену в пепсин здійснюється
1) трипсином
2) хімотрипсином
3) пепсином
4) ентерокіназою
5) амілазою
46. Скатол та індол утворюються при гнильному розпаді в кишечнику.
1) тирозину
2) фенілаланіну
3) триптофану
4) гістидину
5) проліну
47. Вроджений недолік ферменту фенілаланін-4-монооксигенази (фенілаланінгідроксилази) викликає
1) фенілпіровиноградну олігофренію
2) хвороба Паркінсона
3) алкаптонурію
4) альбінізм
5) гомоцистинурію
48. Фермент секрету підшлункової залози не виявляєпротеолітичної активності, - це
1) трипсин
2) хімотрипсин
3) амілаза
4) карбоксипептидазу
5) амінопептидаза
49. Діоксифенілетиламін (дофамін) є
1) біогенним аміном
2) попередником синтезу норадреналіну
3) судинорозширювальним агентом
4) похідним триптофану
5) попередником γ-аміномасляної кислоти (ГАМК)
50. Біологічна цінністьбілка визначається
1) амінокислотним складом
2) наявністю заряду
3) можливістю розщеплення у шлунково-кишковому тракті
5) молекулярною масою
51. Ферменти, що беруть участь у циклі сечовиноутворення, – це
1) аргіназа
2) креатинкіназа
3) карбамоїлфосфатсинтетаза
4) уреаза
5) фумараза
52. У сечі пацієнта виявлено значну кількість гомогентизинової кислоти. Можлива патологія- це
1) альбінізм
2) хвороба Паркінсона
3) цистинурія
4) алкаптонурія
5) фенілкетонурія
53. Найбільш інтенсивному дезамінуванню у печінці піддається
1) сір
2) гіс
3) цис
4) асп
5) глу
54. Загальний метаболіт процесів синтезу сечовини та ЦТК – це
1) сукциніл-КоА
2) сукцинат
3) аспартат
4) фумарат
5) малат
55. Гістидаза (гістидинаміакліаза) каталізує реакцію
2) окисного дезамінування
3) карбоксилювання
4) внутрішньомолекулярне дезамінування
5) метилювання
56. Метіонін бере участь у синтезі
1) адреналіну
2) цистеїну
3) сечовини
4) фосфатидилхоліну
5) норадреналіну
Правильні відповіді
1. 2, 4
2. 1
3. 4
4. 3
5. 1, 3, 5
6. 2
7. 2, 3
8. 1, 4
9. 1, 2, 3
10. 1
11. 2
12. 3
13. 3
14. 4
15. 4
16. 1, 3
17. 2
18. 3
19. 4
20. 5
21. 4
22. 1
23. 1
24. 5
25. 1, 2, 3, 4
26. 2
27. 3
28. 2
29. 1
30. 1, 4
31. 4
32. 5
33. 1
34. 1, 2, 3
35. 2
36. 5
37. 4
38. 3
39. 1, 2, 3
40. 3
41. 2, 3, 4
42. 5
43. 5
44. 2, 3, 4
45. 3
46. 3
47. 1
48. 3
49. 1, 2
50. 1, 3, 4
51. 1, 3
52. 4
53. 5
54. 4
55. 4
56. 1, 2, 4
Харчування є складним процесом, в результаті якого надходять, перетравлюються та всмоктуються необхідні організмуречовини. Останні десять років активно розвивається спеціальна наука, присвячена харчуванню – нутріціологія. У цій статті ми розглянемо процес травлення в організмі людини, скільки часу він триває і як обходиться без жовчного міхура.
Будова травної системи
Травна система представлена сукупністю органів, які забезпечують засвоюваність поживних речовинорганізмом, що є для нього джерелом енергії, необхідної при оновленні клітин і для зростання.
Травна система складається з: порожнини рота, глотки, тонкої, товстої та прямої кишки.
Травлення в ротовій порожнині людини
Процес травлення в ротовій порожнині полягає в подрібненні їжі. У цьому процесі відбувається енергійна обробка їжі слиною, взаємодія між мікроорганізмами та ферментами. Після обробки слиною частина речовин розчиняється та проявляється їх смак. Фізіологічний процестравлення в ротовій порожнині полягає в розщепленні крохмалю до цукрів ферментом амілаза, що міститься в слині.
Простежимо дію амілази з прикладу: під час хвилинного жування хліба можна відчути солодкий смак. Розщеплення білків та жирів у роті не відбувається. У середньому процес травлення в організмі людини за часом займає приблизно 15-20 с.
Відділ травлення – шлунок
Шлунок є найширшою частиною травного тракту, Що має здатність до збільшення у розмірах, і вміщує величезну кількість їжі. В результаті ритмічного скорочення м'язів його стінок процес травлення в організмі людини починається з ретельного змішування їжі зі шлунковим соком, що має кисле середовище. 
Комок їжі, що потрапив у шлунок, знаходиться в ньому протягом 3-5 год, піддаючись за цей час механічній і хімічній обробці. Травлення у шлунку починається з піддавання їжі впливу шлункового соку та соляної кислоти, яка присутня в ньому, а також пепсину.
В результаті травлення у шлунку людини білки за допомогою ферментів перетравлюються до низькомолекулярних пептидів та амінокислот. Перетравлення вуглеводів у шлунку, що почалося в роті, зупиняється, що пояснюється втратою амілазам своєї активності в кислому середовищі.
Травлення в порожнині шлунка
Процес травлення в організмі людини відбувається під дією шлункового соку, що містить ліпазу, здатну розщеплювати жири. При цьому велике значеннявіддається соляній кислоті шлункового соку. Під впливом соляної кислоти підвищується активність ферментів, викликається денатурація та набухання білків, виявляється бактерицидна дія.
Фізіологія травлення в шлунку полягає в тому, що збагачена вуглеводами їжа, що знаходиться в шлунку приблизно дві години, процес евакуації проходить швидше, ніж їжа, що містить білки або жири, що затримується в шлунку на 8-10 год.
У тонкий кишечник їжа, яка перемішана із шлунковим соком і частково переварена, перебуваючи в рідкій або напіврідкій консистенції, переходить через одночасні проміжки невеликими порціями. У якому відділі проходить процес травлення в організмі людини? 
Відділ травлення – тонкий кишечник
Травленню в тонкому кишечнику, в який зі шлунка потрапляє харчова грудка, відводиться найбільш важливе, з погляду біохімії засвоєння речовин, місце.
У цьому відділі кишковий сік складається з лужного середовища через прибуття в тонкий кишечник жовчі, соку підшлункової залози та виділення стінок кишечника. Травний процес у тонкому кишечнику не у всіх проходить швидко. Цьому сприяє наявність недостатньої кількостіферменту лактази, який гідролізує молочний цукор, пов'язаний із невсвоєнням цілісного молока. У процесі травлення у даному відділілюдини витрачається більше 20 ферментів, наприклад пептидази, нуклеази, амілаза, лактаза, сахароза та ін.
Діяльність даного процесу в тонкому кишечнику залежить від трьох переходять один в одного відділів, з яких він складається -дванадцятипала, худа і клубова кишки. У дванадцятипалу кишку надходить жовч, що утворилася в печінці. Тут їжа перетравлюється завдяки підшлунковому соку та жовчі, які впливають на неї. У підшлунковому соку, що є рідиною, що не має кольору, містяться ферменти, які сприяють розщепленню білків і поліпептидів: трипсину, хімотрипсину, еластазу, карбоксипептидазу і амінопептидазу. 
Роль печінки
Важлива роль процесі травлення організмі людини (коротко згадаємо звідси) відводиться печінки, у якій утворюється жовч. Особливість травного процесу в тонкому кишечнику обумовлена сприянням жовчі в емульгуванні жирів, всмоктуванні тригліцеридів, активуванні ліпази, також сприяє стимулюванню перистальтики, інактивуванню пепсину в дванадцятипалій кишці, має бактерицидну і бактеріостатичну дію, збільшує гідро.
Жовч не складається з ферментів травлення, але важлива при розчиненні та всмоктуванні жирів та жиророзчинних вітамінів. Якщо жовч виробляється недостатньо або виділяється в кишечник, відбувається порушення процесів перетравлення і всмоктування жирів, а також збільшення їх виділення у первісному вигляді з калом.
Що відбувається у відсутності жовчного міхура?
Людина залишається без так званого невеликого мішечка, в який раніше відкладалася жовч «про запас».
Жовч необхідна у дванадцятипалій кишці лише за наявності у ній їжі. А це не є постійним процесом, тільки в період після прийому їжі. Через деякий час дванадцятипала кишка спустошується. Відповідно, зникає потреба у жовчі.
Тим не менш, робота печінки не зупиняється на цьому, вона продовжує вироблення жовчі. Саме для цього природою було створено жовчний міхурщоб виділена в проміжках між прийомом їжі жовч не зіпсувалася і зберігалася до появи потреби в ній. 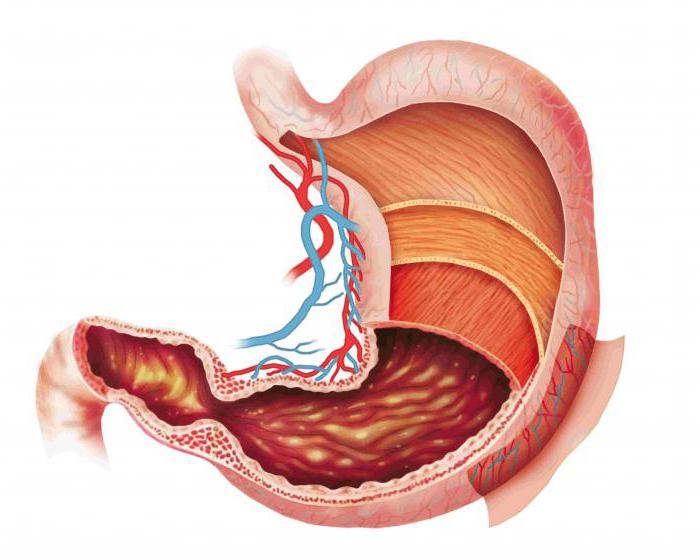
І тут постає питання про відсутність цього «сховища жовчі». Як виявляється, людина може обходитися без жовчного міхура. Якщо вчасно зробити операцію і не спровокувати інші хвороби, пов'язані з органами травлення, відсутність в організмі жовчного міхура переноситься легко. Час процесу травлення в організмі людини цікавить багатьох.
Після операції жовч може зберігатися лише у жовчних протоках. Після вироблення жовчі клітинами печінки вона викидається в протоки, звідки легко і безперервно прямує до дванадцятипалої кишки. Причому це залежить від того, прийнята чи їжа чи ні. Звідси випливає, що після віддаленого жовчного міхура їжу спочатку необхідно вживати часто і маленькими порціями. Це тим, що з обробки великих порцій жовчі не вистачить. Адже місця її накопичення більше немає, а потрапляє вона в кишку безперервно, хоч і в невеликих кількостях.
Найчастіше організм вимагає час, щоб навчитися функціонувати без жовчного міхура. необхідне місцедля зберігання жовчі. Ось як відбувається процес травлення в організмі людини без жовчного міхура.
Відділ травлення – товстий кишечник
Залишки неперетравленої їжі просуваються в товстий кишечник і знаходяться в ньому приблизно від 10 до 15 годин. Тут відбуваються такі процеси травлення в кишечнику: всмоктування води та мікробна метаболізація поживних речовин. 
У травленні, що у відділі товстого кишечника, велику роль відіграють баластные речовини їжі, яких відносять неперетравні біохімічні компоненти: клітковина, геміцелюлоза, лігнін, камеді, смоли, воски.
Структура їжі впливає на швидкість всмоктування в тонкій кишці та час пересування через ШКТ.
Частина харчових волокон, які не розщеплюються ферментами, що належать шлунково-кишковому тракту, руйнується мікрофлорою
Товста кишка є місцем формування калових мас, в які входять: неперетравлені залишки їжі, слизу, відмерлі клітини слизової оболонки та мікроби, які безперервно розмножуються в кишечнику, і які викликають процеси бродіння та газоутворення. Скільки процес травлення в організмі людини триває? Це найчастіше питання.
Розщеплення та всмоктування речовин
Процес всмоктування поживних речовин здійснюється протягом усього шлунково-кишкового тракту, покритого волосками. На 1 квадратному міліметрі слизової оболонки знаходиться близько 30-40 ворсинок. 
Щоб відбувався процес всмоктування речовин, які розчиняються жирами, а точніше жиророзчинних вітамінів, у кишечнику мають бути присутні жири та жовч.
Всмоктування водорозчинних продуктів, таких як амінокислоти, моносахариди, мінеральні іони, відбувається за участю кровоносних капілярів.
У здорової людинивесь процес травлення займає від 24 до 36 год.
Ось скільки часу процес травлення в організмі людини триває.
Які не здатні до всмоктування в кров та лімфу через великих розмірівсвоїх молекул. Хімічна переробка їжі в шлунково-кишковому тракті є послідовним ступінчастим ферментативним гідролітичним розщепленням великомолекулярних білків, вуглеводів і ліпідів до простих речовин, здатних до всмоктування. Ферменти, що каталізують ці реакції гідролізу називають гідролазами. Усі травні ферменти синтезуються, резервуються і виділяються у неактивній формі, у вигляді проферментів та активуються безпосередньо перед початком гідролізу.
Перетравлення білків їжі призначене для їх денатурації, позбавлення видової та тканинної специфічності та розщеплення на прості компоненти, здатні всмоктуватися в тонкій кишці в кров. Майже всі білки їжі (~95 ÷ 97%) всмоктуються у вигляді вільних амінокислот. Розщеплення білків їжі є гідролізом за участю каталізаторів - протеолітичних ферментів (протеази, протеїнази, пептидази). Кожен фермент із протеїназ розриває цілком певні пептидні зв'язки білків. Специфічність дії залежить від розміру поліпептиду, його структури, різновиду амінокислот, що беруть участь в утворенні пептидних зв'язків. Головні протеїнази, що каталізують гідроліз білків та пептидів їжі, показані в таблиці.
Таблиця 1. Протеолітичні ферменти шлунково-кишкового тракту. Модифікація: Березов Т. Т., Коровкін Б. Ф. Біологічна хімія. 3-тє вид., |
||
| Секрет | Ферменти | Особливості дії |
| Шлунковий сік | Пепсин | Протеїназа |
| Реннін | Створення молока | |
| Гастріксін | Подібний до пепсину | |
| Сік підшлункової залози | Трипсин | Протеїназа |
| Хімотрипсин | Протеїназа | |
| Колагеназа | Протеїназа | |
| Карбоксипептидаза | Пептидаза | |
| Еластаза | Пептидаза | |
| Кишковий сік | Амінопептидаза | Пептидаза |
| Лейцинамінопептидаза | Пептидаза | |
| Аланінамінопептидаза | Пептидаза | |
| Ентеропептидаза | Глікопротеїн | |
| Трипептидази | Пептидази | |
| Дипептидази | Пептидази | |
| Пролив-дипептидазу | Пептидаза | |
| Пролін-дипептидаза | Пептидаза | |
|
|
Процес перетравлення тваринної білкової їжі зовсім відрізняється від перетравлення їжі крохмалистою. Якщо ви подивіться, як поїдають їжу хижі тварини, то помітите – вони виривають із туші шматки м'яса і, не пережовуючи, ковтають їх. Зуби їм потрібні тільки для того, щоб відірвати шматок плоті, але не жувати. Таким чином, ніякого травлення в ротової порожниниу них немає, а перетравлення тварин білків починається у шлунку. Для цього в порожнину шлунка виділяється соляна кислота та фермент пепсин, і там створюється різко кисле середовище – найкраще для травлення тваринних білків.
Знаєте, що робить соляна кислота з м'ясом і навіщо потрібне різко кисле середовище? Це з'ясував досвідченим шляхом академік О. М. Уголєв. Виявляється, соляна кислота шлункового соку проникає в клітини шматка м'яса і спричиняє руйнування лізосом (особливі клітинні органи). У лізосомах клітини знаходяться ферменти - гідролази, які при створеній в ній рН-середовища від 3,5 до 5,5 (дуже кислої) руйнують всі клітинні структури. Отже, шлунковий сік індукує (активує) самоперетравлення тваринної їжіїї ж ферментами. Цей механізм існує як у хижих, так і у рослиноїдних тварин. В принципі, він може відбуватися і в людини, але для цього треба їсти сирем'ясо.
Індукований автоліз посилюється за нормальної температури 37-40 °З. Під впливом кислого шлункового соку відбувається, по-перше, підвищення проникності мембран; по-друге, зміна активності протеолітичних та інших ферментів; по-третє, змінюється стан білкових клітин та тканин, зокрема їхня чутливість до дії ферментів.
На відміну від поверхневої дії травних соків на харчовий об'єкт, у разі індукованого автолізу має місце «травний вибух» тканин шматка з'їденого м'яса зсередини, оскільки автоліз індукується по всій товщині харчового об'єкта. І тут відбувається гідролітичне розщеплення всіх клітинних структур.
Індуктор, тобто соляна кислота шлункового соку, проникає всередину клітин сирої їжі та руйнує її лізосоми-органели, що містять безліч гідролітичних ферментів. ферменти, що вийшли в цитоплазму (порожнину клітини), розщеплюють (гідролізують) структури клітини та її оболонку. Отже, сира їжа (тварина і рослинна) перетравлюється власними ферментами і потім засвоюється організмом.
Виявилося, що близько 50% гідролізу (розщеплення) визначається ферментами не шлункового соку, а самої автолізованої тканини!
Всі тварини використовують аутоличне травлення, споживаючи живі об'єкти (тварини чи рослини), і лише людина піддає їжу термічній обробці, «покращуючи» її.
Власні ферменти травних соків особливо важливі для утилізації структур, позбавлених лізосом (наприклад, білка сполучної тканини), з високою швидкістю. Для цього і потрібен пепсин.
Біохімік А. Паргетті виявив, що при приготуванні їжі на вогні понад 54 ° С протягом будь-якої кількості часу активність ферментів пропадає і автоліз стає неможливим.
Вищеописаний процес стосується лише перетравлення білків. Опрацьована білкова масапорціями надходить у дванадцятипалу кишку і далі в тонкий кишечник, де йдуть укласти ельні процеси травлення та всмоктування білкових продуктів у кров.
Виявляється, кислий вміст має нейтралізуватися та придбати нейтральну або слаболужну реакцію. Це необхідно для того, щоб ферменти підшлункової залози розпочали остаточне розщеплення підготовлених у шлунку білкових структур.
Таким чином, виходить, що якщо тварина білкова їжавбита термічною обробкою, то процеси автолізу стають неможливими ні в шлунку, ні в тонкому кишечнику, і все кишкове навантаження падає на організм (шлунок і підшлункову залозу, що виробляє ферменти, які розщеплюють тваринний білок).
Павлов своїми експериментами показав, що різні білкові продуктитваринного походження (м'ясо і сир, яйця і м'ясо, молоко і риба і т. п.) активність шлунка у виробленні соляної кислоти, пепсину та їх активності зовсім різна (на одні продукти вона починається раніше, на інші пізніше, різна і міцність соків) . Звідси виникають незручності арімі поєднання білка з білком.
Ще сильніше розрізняються умови для нормального перетравлення при одночасному прийоміпродуктів, багатих білком (м'яса, риби), продуктів, багатих крохмалями (наприклад, картопля, каші, хліб). Травлення не може проходити нормально. Обидва ферменти (амілаза і пепсин) заважають один одному, оскільки їм потрібна різне середовище: амілазі - слаболужна, а пепсину - різко кисла. Таким чином, для організму надмірно утруднена робота з перетравлення одночасно крохмалистої та білкової їжі (це дає і зовнішній ефект – відчуття втоми). І до того ж обидва вказані продукти не можуть нормально перетравитися і, замість харчування організму, завдають йому шкоди, готуючи ґрунт для розвитку багатьох хронічних захворюваньнайрізноманітнішої природи. Ось чому роздільне вживання білкової та крохмалистої їжі покладено в основу лікувального харчування.
Крім вищевикладених причин, білкова їжа є вкрай обтяжливою для організму. А в основі рідкісної дії лежить поняття «специфічної динамічної дії їжі».
Під специфічним динамічним дією їжі (СДДП) мається на увазі посилення обміну речовин після їди порівняно з рівнем основного обміну. Приблизно через 15-30 хв після їди відбувається підвищення обміну енергії, досягаючи максимуму через 3-6 годин, і зберігається протягом 10-12 годин. Причому різні видиїжі по-різному впливають це підвищення. Жири трохи підвищують обмін, а іноді й гальмують його. Вуглеводна їжа підвищує на 10-20%, а білкова ще більше - до 40%.
Чим викликано таке сильне підвищення обміну енергії після їди? Для цього необхідно знати, скільки у дорослої людини витрачається харчового білкана побудову та заміну зношених тканин організму та скільки – на споживання енергії.
Давним-давно Рубнер досвідченим шляхом показав, що лише 4% загального обміну енергії йдена побудову чи приріст білка. У середньому це 30 г білка на день на особу (а в 100 г м'яса його 20 г). Перш ніж відповісти на запитання, куди йде зайвий білок, дамо відповідь на інший: що у нас використовується як основне «паливо»?
Основний постачальник енергії у нас є вуглевод. При окисленні киснем ми отримуємо вільну енергію, яку використовуємо, а також вуглекислий газта воду, які легко виводяться з організму.
Якщо білок використовувати як енергетичний матеріал, то від нього спочатку треба відщепити азот, а потім використовувати вуглевод як паливо.
На відміну від вуглеводів та жирів, азот в організмі не може відкладатися про запас і посилено виводиться з організму (а для цього потрібна вільна вода та енергія). Так, після білкового сніданкувиводиться до 50% азоту, що надійшов з їжею, а разом з ним і вода, в якій він знаходиться! В цьому випадку енерговитрати досягають таких розмірів, що до 30-40% калорійності їжі йде на розщеплення азоту та виведення його з організму. Як нам відомо, основний орган, що виводить азот з організму, - це нирки. Тому «надпланова» робота швидко зношує їх.
В результаті реакцій СДДП відбувається не тільки інтенсифікація енергообміну та розпаду амінокислот (білка), а й зміна рівня глюкози в крові, зрушення водно-сольового балансу, Зміна тонусу судин, залучаються гормональні системи.
Біохімік А. Є. Браунштейн звернув увагу, що засвоєння та обмін амінокислот (білка) потребує значної кількості вільної енергії. На шляху проходження через організм кожен атом азоту викликає розпад багатьох молекул АТФ та неорганічного фосфату.
При зіставленні швидкостей синтезу та розпаду білка, а також кругообігу азоту при дієтах з низьким та високим змістомбілка, встановлено, що з низькобілкової дієті інтенсивність кругообігу азоту знижується на 18%. Звідси видно роль СДДП для побудови раціональних дієту випадках лікування, самооздоровлення, а заразом дана відповідь любителям м'ясної їжі, Який вважає її основним постачальником енергії.
Важливо розуміти, що зекономлена організмом енергія при переході на малобілковий раціон піде на зміцнення та лікування вашого організму.
Постійна підтримка в організмі кислотно-лужної рівноваги.
Життєві процеси, зовнішнім проявом яких є здоров'я чи хвороба, протікають як біологічних реакцій. Біологічні реакції найкраще протікають у тому чи іншому водному середовищі і за певної температури. Оптимальна водне середовищехарактеризується співвідношенням кислотних та лужних елементів, що становить величину рН.
Організм людини на підтримку у себе найкращої величини рН витрачає великі зусилля, маючи певні механізми, що його регулюють та підтримують. Відхилення внутрішнього середовища організму від оптимальних значень рН призводить до нездужань, а потім і до хвороб. З цієї причини для здійснення процесу одужання, а надалі підтримки міцного здоров'яважливо відрегулювати та відновити цей показник.
В організмі людини кислоти та луги утворюються самі, шляхом обміну речовин, а також вносяться з їжею, яка може мати переважний вміст кислот або лугів або бути нейтральною (те й інше міститься в ній у рівних кількостях). Таким чином, при перетравленні одних продуктів в організмі переважно утворюються кислоти, і тому їх називають кислотоутворюючими продуктами, при перетравленні інших - луги, і тому їх називають лугоутворюючими продуктами.
На кислотні та лужні властивості продуктів великий впливнадає термічний обробіток. Більшість свіжих продуктів при споживанні викликають зсув рН внутрішнього середовища організму в лужну сторону. Але ті ж продукти, що пройшли термічну обробку (варіння, запікання тощо), вже насичують внутрішнє середовище кислотами, зрушуючи їх у кислу сторону. Причому одні продукти можуть суттєво впливати на внутрішнє середовище, інші не дуже. Звідси пішло розподіл продуктів харчування на сильнокислотообразующие і слабокислотообразующие, і навіть слабо– і сильнощелочеобразующие.
До сильнокислотоутворюючихпродуктам відносяться: м'ясо та продукти з нього (ковбаса, шинка, буженина тощо), риба, яйця, сир, солодощі, продукти з білого борошна, алкоголь та кава.
До слабокислотоутворюючихпродуктам відносяться: сир, сметана, горіхи, цілісні крупи та продукти з борошна грубого помелу.
До слаболужноутворюючихпродуктам відносяться: різного роду сухофрукти, не пастеризоване молоко та гриби.
До сильнолужноутворюючихПродуктам відносяться: овочі (коренеплоди і особливо листові овочі), свіжі фрукти, картопля та зелений салат.
У цілому нині продукти тваринного походження викликають зрушення внутрішнього середовища організму в кислу бік, а рослинного – в лужну.
Лугоутворюючий вплив свіжої рослинної їжі пояснюється високим вмістом у ній мінеральних речовин: калію, кальцію, магнію та натрію.
Важливо зрозуміти, що відбувається з кислотами, що утворюються в організмі і як вони можуть впливати на здоров'я.
У процесі перетравлення продуктів, багатих на вуглеводи, накопичується багато вугільної кислоти (Н2СОЗ). Сама по собі вугільна кислота є нестійкою і існує лише у розчинах, легко розпадаючись на воду та вуглекислий газ. Звідси виходить, що з вуглеводистої їжі усередині клітин утворюється вода (середовище життя), а вугільна кислота та вуглекислий газ є регуляторами pH середовища, від якого залежить активність ферментів усередині клітини. Природно, вуглеводна їжа дає організму та енергію.
Що стосується особливостей вуглеводистої їжі, то слід звернути особливу увагу на мінеральні речовини, що входять до її складу. Так, калій, що у вуглеводистої їжі, сприяє виведенню води з організму, а натрій, навпаки, – затримці. Фрукти та овочі відносяться в основному до калієвої їжі, а крупи – до натрієвої. Тому при вживанні вищезгаданих продуктів повинна зберігатися рівновага: по 50% на овочі з фруктами та зернові з бобовими.
Щодо перетравлення багатою білкомїжі треба знати, що білок є сполукою вуглеводу з азотом. У процесі травлення відбувається поділ білка на вуглеводну та азотну частину. Вуглеводна частина далі перетравлюється як вуглевод, а азотиста використовується для побудови тканин. Однак організм здатний засвоювати для своїх потреб лише невелику частину азоту, що надходить з їжі, і виводити обмежену кількість азотистих речовин у вигляді сечовини та сечової кислоти. Звідси, сечовина та сечова кислота, що залишаються в організмі до моменту їх виділення через нирки, зсувають кислотно-лужну рівновагу у бік кислоти. Якщо людина споживає багато білкової їжі, то сечовина та сечова кислота накопичуються в організмі, викликаючи закислення.
У білкових продуктах тваринного походження також міститься багато сірки та фосфору, які утворюють іншу групу кислот, що підлягають виділенню.
Через війну виходить, що з споживанні переважно кислотообразующих продуктів організм надмірно закисляется. Внутрішнє середовище організму, його рН зміщуються з нормальних, правильних показників і не можуть нормально здійснювати біологічні реакції – життєві процеси порушуються. На думку лікарів-натуропатів, це є основною причиною виникнення численних хвороб.
Отже, ми з вами розібрали, у чому лікувальна цінність роздільного харчування.
1. Поділ продуктів в одному прийомі їжі дозволяє їм легше і краще перетравлюватися та засвоюватися. Це заощаджує життєві силиорганізму та спрямовує їх на самовідновлення. А саму хворобу позбавляє підживлення шляхом усунення передумов для її виникнення і течії.
2. Зменшення кількісного прийому білкової їжі до фізіологічно потрібних нормзнімає непотрібне навантаження на організм як реакцій СДДП, зменшує навантаження на органи виділення, особливо нирки.
3. Переважна більшість продуктів з лужними властивостями дозволяє вирівняти і нормалізувати внутрішнє середовище організму і цим створити правильні умовидля лікування та стабільного здоров'я.
4. Вживання в їжу продуктів з високим енергетичним потенціалом (рекомендованих Бірхером-Беннером як акумулятори 1-го порядку) та скорочення загальної кількості споживаної їжі створює хороші передумови для збільшення енергії в організмі та успішного позбавлення від хвороб, пов'язаних з її нестачею.
Клінічні підтвердження ефективності системи роздільного харчування.
Після того як основоположники правильного харчування М. Бірхер-Беннер, Г. Хей, М. Герзон та Н. Уокер з'ясували досвідченим шляхом, як можна лікувати та зміцнювати здоров'я людей за допомогою харчування, з'явилася маса послідовників, які успішно продовжили їхню справу. Доктор Герберт Шелтон поширив роздільне харчування в Америці та успішно лікував, спираючись на нього та інші способи натуропатії. У Європі це зробив доктор Людвіг Вальб. Їм та багатьма іншими лікарями були проведені клінічні дослідження, що підтвердили ефективність лікувального роздільного харчування
1935 року до доктора Вальба надійшла на лікування 11-річна дитина з діагнозом «зморщена нирка». До цього його лікував дуже відомий тоді фахівець із захворювань нирок професор Вольгард. Всі спроби лікування, включаючи кліматичне лікування в Єгипті, були безуспішними, і професор відмовився від пацієнта, вважаючи даний випадокбезнадійним.
Лікар Вальб перевів хлопчика на роздільне харчування, від якого він повністю одужав і згодом став спортивним льотчиком!
Загалом до Вальба звернулося 120 осіб із «невиліковними» захворюваннями нирок. Після лікування правильним харчуванням 80% із них покращили свій стан, а деякі вилікувалися повністю.
Чим можна пояснити ефективність методу роздільного харчування під час лікування нирок? Застосування певних продуктівхарчування призводить до того, що з організму виділяються непотрібна вода та сіль. Ці два фактори сильно впливають на працездатність серця та нирок. Зменшення навантаження дозволяє їм розпочати процес самовідновлення. Тому для осіб із хронічною нирковою недостатністюсистему роздільного харчування змінюють так, щоб вони в основному вживали їжу, бідну солями та білками. Додатково для виведення надлишку води та солі на першому етапі лікувального харчування призначають продукти, що мають природну сечогінну дію (багаті калієм).
У результаті такого харчування у крові зменшується кількість речовин, які мають виділятися у сечі. Сечовиділення збільшується. Виділення білка в сечі протікає у зворотному напрямку; підвищений кров'яний тиск, обумовлене нирковою хворобою, знижується Полегшується робота серця і відновлюються нирки. Важливо не запустити захворювання, коли організм втрачає здатність до самовідновлення.
Роздільне харчування є основним лікуванням для пацієнтів з хворим серцем. Було встановлено, що всі тяжкі захворювання серця, у тому числі інфаркт та інсульт, супроводжуються прихованим закисленням організму. Застосування роздільного харчування зменшує згортання крові, що вимірюється значенням «ртутної величини».
Доктор Вальб з'ясував, що при всіх хворобах кровообігу та серця слід віддавати перевагу невеликим прийомамїжі, уникати денатурованих харчових продуктів, оскільки вони менше і повільніше насичують людину і тому поїдаються в занадто велику кількість, що шкідливо для кровообігу та серця.
Застосування роздільного харчування більш ніж у 90% пацієнтів з підвищеним рівнемхолестерину в крові призводить до зниження його рівня та подальшої нормалізації. Таким чином, суттєво зменшується ризик виникнення атеросклерозу та такого його ускладнення, як звапніння вінцевих судин серця.
54-річний чоловік, хворий на діабет, змушений був припинити роботу. Через хворобу він осліп на одне око, друге око бачив на 50%. Як основне лікування використовували роздільне харчування. Через 6 тижнів зір покращав. Доза інсуліну знизилася наполовину. Через деякий час він зміг почати працювати.
Доктор Вальб розповів про 55-річного чоловіка, який 6 років страждав цукровим діабетом. Під час лабораторного дослідження виявили різко підвищена кількістьцукру в сечі, рівень цукру в крові цього пацієнта становив близько 350 мг (норма становить 110 мг). Щоденна кількість сечі в нього становила понад 6 л, і він мав щодня колоти 50 од. інсуліну. Після переходу на роздільне харчування потреба в інсуліні протягом чотирьох місяців скоротилася до нуля, а кількість сечі склала 1,6 л на день (норму). Рівень цукру у крові становив загалом 150 мг, а сечі не виявлявся.
Хворі на цукровий діабет повинні користуватися системою роздільного харчування в модифікованій формі. Тим, кому потрібен інсулін, слід вживати їжу, багату на вуглеводи(каші, картопля), після ранкового та вечірнього інсулінового уколу. У проміжку рекомендується приймати невеликі порціїїжі, що складаються зі свіжих овочів, фруктів, зелені. Подібна їжа лужить організм.
Лікар Вальб показав, що у 200 діабетиків, які лікувалися в його клініці роздільним харчуванням, приблизно через 4-6 тижнів рівень цукру в сечі знизився на 98%, а рівень цукру в крові – на 90%. Споживання інсуліну скоротилося в середньому на 37%. Крім того, відступили недуги, пов'язані з порушенням кровообігу. При цьому зазначалося, що діабетики, що впорскують вищі стандартні одиниціінсуліну, можуть досягти більш відчутних результатів, ніж інші хворі на діабет.
Застосування роздільного харчування хворим на цукровий діабет дозволяє вилікувати діабетичне ураження кровоносних судин. Для цього усувають закислення організму вживанням лужної їжі (свіжої, рослинної). Потім слідує зниження рівня цукру в крові до нормальної величини. Достаток при роздільному харчуванні баластових речовин веде до того, що деякі складові вуглеводів (глюкоза) повільніше потрапляють у кров. Рівень цукру в крові менший і змінюється плавно, замість того, щоб коливатися вгору і вниз, як це відбувається при вживанні рафінованих вуглеводистих продуктів (очищених круп, картоплі, хлібобулочних виробів, не кажучи вже про цукор).
У 1978 році доктор Вальб обстежив 82 жінки і 51 чоловік, середній вік яких становив 53 роки. Пацієнти страждали від різних хвороб: пухлин, алергій, хвороб нирок, ревматизму, діабету, захворювань системи кровообігу та травних органів. Дослідження крові за чотири тижні застосування роздільного харчування показало, що її дані нормалізувалися загалом на 80%! І це лише за чотири тижні!
Практика роздільного харчування.
Коли організм звільнився від шлаків, якими раніше був сповнений, піднімається настрій і людині відкривається новий, щасливий світ.
Говард Хей
При роздільному харчуванні необхідно дотримуватися трьох важливих умов.
1. Правильний вибірпродуктів харчування.
Тут треба дотримуватися рекомендацій доктора Бірхера-Беннера - більше використовувати продукти, що є акумуляторами 1-го порядку. Це в основному свіжа рослинна їжа: овочі (листові та коренеплоди), фрукти, горіхи. Особливу увагутреба приділяти вживанню свіжих соків, особливо першому етапі, щоб швидше вимити шлаки і токсини з організму.
2. Олужнення організму протягом дня.
Лугоутворювачами є продукти, в яких переважають такі мінерали, як натрій, калій, кальцій та магній. Це в основному свіжі овочі та фрукти, а також свіжі соки з них.
Кислотоутворювачами є продукти, в яких переважають фосфор, хлор та сірка. Це в основному крупи, мясні продукти, а також продукти, що пройшли термічну обробку (навіть ті ж овочі, термічно оброблені, стають кислотоутворюючими).
Для того, щоб надійно вилужувати організм, що особливо цінно при ряді захворювань, потрібно близько 80% денного раціонувживати у сирому вигляді (свіжі соки, овочі, фрукти, салати, злегка тушковані овочі). І лише 20% відводиться на білкові продукти тваринного походження (м'ясо, риба, сир) та зернові (каші, хліб). Практика показала, що співвідношення 70:30 є дуже добрим показником.
Які продукти харчування є більш «лужними» і які «кислими», видно з таблиці нижче.
Щоб зберегти лужний надлишок в організмі, а значить створити лікувальні передумови, слід вживати в їжу більша кількістьпродуктів, зазначених у лівій частині таблиці. Для кислотного надлишку годяться продукти, зазначені у правій частині таблиці.
Таблиця 1
3. Дотримання принципу роздільного споживання продуктів.
Раніше вже вказувалося, чому деякі продукти слід приймати окремо від інших. Коротко повторю, що це правило сприяє кращій течіїтравного процесу, засвоєння перевареного, економії життєвої енергіїорганізму, який використовується на лікувальні процеси або зміцнення організму.
Головний секрет роздільного харчування полягає в тому, щоб знати, які харчові продуктиможна поєднувати в одному прийомі їжі і які не можна.
Забороняється в одному прийомі змішувати лужно надлишкові продукти з надлишковими кислотами.
Ява-скрипт вимкнено – пошук недоступний…
Перетравлення білків у шлунково-кишковому тракті
Перетравлення білків починається у шлунку під дією ферментів шлункового соку. За добу його виділяється до 2,5 літрів і він відрізняється від інших травних соків сильно кислою реакцією, завдяки присутності вільної соляної кислоти, що секретується клітинами обкладки слизової шлунка.
Секреція соляної кислоти є активним транспортом, здійснюваним протонною АТФ-азою з витратою АТФ.
Роль соляної кислоти:
1. денатурує білки;
2. стерилізує їжу;
3. викликає набухання важкорозчинних білків;
4. активує пепсиноген;
5. створює рН-оптимум для дії пепсину;
6. сприяє всмоктуванню заліза;
7. викликає секрецію секретину в дванадцятипалій кишці.
У шлунковому соку містяться протеолітичні ферменти пепсин, гастриксин та ренін. Головним із них є пепсин. Він виробляється головними клітинами слизової оболонки шлунка у вигляді проферменту пепсиногену. Активація його здійснюється соляною кислотою (повільна) та аутокаталітично пепсином (швидка) шляхом відщеплення фрагмента поліпептидного ланцюга з N-кінця (частковий протеоліз). При цьому відбувається зміна конформації молекули та формування активного центру. Пепсин діє при значеннях рН 1,5-2,5 і є ендопептидазою з відносною специфічністю дії, що розщеплює пептидні зв'язки всередині білкової молекули.
Крім пепсину в шлунковому соку міститься фермент гастриксин, який проявляє протеолітичну активність при рН 3,0-4,0. Очевидно, саме він починає перетравлення білків.
У шлунковому соку немовлят міститься фермент реннин, який має значення для перетравлення білків у немовлят, т.к. каталізує створення молока (перетворення розчинного казеїногену в нерозчинний казеїн), внаслідок чого сповільнюється просування нерозчинного казеїну в дванадцятипалу кишку і він довше піддається дії протеаз.
Поліпептиди, що утворилися в результаті дії пепсину в шлунку, надходять у дванадцятипалу кишку, куди виділяється сік підшлункової залози. Панкреатичний сік має лужну реакцію (рН 75-82), що обумовлено високим вмістом бікарбонатів. Кислий вміст, що надходить зі шлунка нейтралізується, і пепсин втрачає свою активність.
У панкреатичному соку містяться протеолітичні ферменти трипсин, хімотрипсин, карбоксипептидаза та еластазу, які виробляються також у вигляді проферментів. Трипсиноген активується ентерокіназою (виробляється клітинами слизової оболонки. дванадцятипалої кишки), переходить в активний трипсин, який активує решту ферментів підшлункового і кишкового соку. Клітини підшлункової залози захищені від дії протеаз тим, що ферменти шлункового соку утворюються як неактивних попередників, а панкреас синтезується особливий білок-інгібітор трипсину. У порожнині ШКТ протеази не контактують з білками клітин, оскільки слизова оболонка покрита шаром слизу, а кожна клітина містить зовнішньої поверхніплазматичної мембрани полісахариди, які не розщеплюються протеазами Руйнування клітинних білків ферментами шлункового чи кишкового соку відбувається при виразковій хворобі.
Перетравлення продуктів протеолізу харчових білків у тонкому кишечнику здійснюється за допомогою аміно-, ді-, та трипептидаз, які функціонують переважно пристінково.
Таким чином, кінцевими продуктами перетравлення білків у шлунково-кишковому тракті є вільні амінокислоти, які всмоктуються.